Биология моря, 2019, T. 45, № 2, стр. 97-107
Распределение видов-доминантов макрофитов по глубине в северо-западной части Татарского пролива
А. А. Дуленин *
Хабаровский филиал Тихоокеанского научно-исследовательского рыбохозяйственного центра (ХфТИНРО)
680028 Хабаровск, Россия
* E-mail: dulenin@mail.ru
Поступила в редакцию 14.03.2018
После доработки 30.07.2018
Принята к публикации 18.10.2018
Аннотация
Изучены закономерности распределения по глубине доминантов донной растительности в западной части Татарского пролива в пределах Хабаровского края (на основе материалов водолазных съемок ХфТИНРО). Установлено, что при наличии подходящих грунтов растительный покров формируется до глубины 18–22 м, а ниже сменяется разреженными поселениями. Большинство видов-доминантов сохраняют относительную стабильность показателей обилия на глубине от 2 до 20 м. Их экологические оптимумы, как правило, приходятся на глубину 2–6 м, что обусловлено повышенной гидродинамикой. На основе ранее выполненного зонирования фитали и выявленных закономерностей предложена схема вертикального распределения растительного покрова в районе исследований. Показано, что расположение горизонтов и этажей растительности не отличается от описанного ранее, однако их границы размыты и соответствуют континуальной картине распределения растительного покрова.
Имеющиеся сведения о глубине распространения макрофитов в дальневосточных морях умеренной зоны, приведенные во флористических сводках (см., например: Перестенко, 1994; Клочкова, 1996), далеко не полные. Опубликованные данные об изменении донной растительности с глубиной (Гусарова и др., 1993; Петров, Поздеев, 1992; Дуленин, 2008; и др.) носят описательный характер. Закономерности распределения донной растительности по глубине анализируются лишь в небольшом количестве работ (Перестенко, 1969, 1980; Гусарова, 1975; Дуленин, 2015).
Татарский пролив – самая северная часть Японского моря. Систематические альгологические исследования у материковых берегов пролива начаты лишь в текущем столетии (Дуленин, 2007). Фиталь западной части Татарского пролива по видовому составу была разделена на горизонты и этажи (Дуленин, 2008), но количественные закономерности изменения пояса растительности с глубиной для этого района не были изучены. Цель настоящей работы – дополнить ранее выполненные исследования общей картиной изменения растительного покрова с глубиной на основании анализа распределения его доминантов. Основные задачи: показать изменение удельной биомассы и проективного покрытия в зависимости от глубины, определить диапазоны глубинных оптимумов доминантов, выполнить вертикальное зонирование донной растительности и обсудить факторы, влияющие на ее распределение.
МАТЕРИАЛ И МЕТОДИКА
Основной объем материала получен в экспедиции Хабаровского филиала ТИНРО-Центра (ХфТИНРО) в июле 2010 г. на НИС “Потанино” (База исследовательского флота ТИНРО-Центра). Выполнено 710 водолазных гидробиологических станций. Дополнительно использованы сведения, полученные ХфТИНРО в период гидрологического лета в июле–сентябре 1999–2016 гг. более чем на 800 станциях. Не менее 350 водолазных станций с отбором проб выполнено непосредственно автором. Материал собирали по общепринятым методикам (Блинова и др., 2005) вдоль западного побережья Татарского пролива от мыса Туманный на юге (47°24′ N, 139°03′ E) до мыса Южный на севере (51°40′N, 141°06′ E), т.е. в пределах Хабаровского края (рис. 1). Систематический отбор проб выполнен на глубинах 2–20 м. Дополнительно приведены сведения по глубинам, на которых регулярный отбор проб в условиях подвижных экспедиций был затруднен: 0–2 м – для Alaria esculenta (Linnaeus) Greville и Zostera marina Linnaeus, а также по общему составу и обилию макрофитов на глубине 20–26 м.
Виды идентифицировали по определителям Перестенко (1980, 1994) и Клочковой (1996). Названия таксонов приведены, как предложено ранее (AlgaeBase, 2018). Данные по корковым представителям порядка Corallinales P.C. Silva & H.W. Johansen, 1986 представлены без разделения по видам в связи с трудностью их отбора и определения в экспедиционных условиях. Данные для Saccharina japonica f. longipes (Miyabe) Selivanova, Zhigadlova & G.I. Hansen Aresch и S. japonica (Areschoug) C.E. Lane, C. Mayes, Druehl & G.W. Saunders приведены отдельно, поскольку типовая и удлиненная формы этого вида по экологическим и морфологическим характеристикам значительно различаются (Гусарова, Иванова, 2006) и формируют топически изолированные сообщества (Дуленин, 2008).
Доминанты выделяли по двум взаимодополняющим показателям обилия – удельной биомассе (кг/м2) и проективному покрытию (доля). Удельную биомассу определяли путем тотального сбора водорослей с площади 1 м2 для относительно редко расположенных растений и 0.25 м2 для плотно расположенных. Проективное покрытие оценивали визуально. Для характеристики выраженности растительного покрова проективное покрытие всех учтенных на каждой станции видов складывали (Дуленин, 2015) и получали суммарное проективное покрытие. В качестве доминантов выделены виды, показатели обилия которых систематически превышали граничные значения: 1 кг/м2 для удельной биомассы и 0.2 для проективного покрытия. Уровень доминирования видов в разных диапазонах глубины показан при помощи коэффициента Броцкой–Зенкевича (Броцкая, Зенкевич, 1939) $\sqrt {BN} ,$ где В – удельная биомасса, а N – частота встречаемости. Для выявления доминирования по проективному покрытию этот коэффициент был модифицирован как $\sqrt {CN} ,$ где С – доля покрытия. По распределению показателей обилия вычислены медианные глубины обитания видов (Gattuso et al., 2006).
Закономерности изменения количественного обилия доминантов с глубиной устанавливали, используя процедуру регрессионного анализа. Чтобы получить сравнимые результаты, зависимости сводили к линейной регрессии. Для нормализации распределений и линеаризации зависимостей данные подвергали преобразованию Бокса–Кокса. Статистическую значимость отличий углового коэффициента регрессии от нуля проверяли при помощи t-критерия. Чтобы показать действительный характер распределения обилия доминантов по глубине, на графиках они приведены в непреобразованном виде. Кластерный анализ распределения доминантов по глубине выполнен методом средней связи с использованием коэффициента Брея–Кeртиса (Bray, Curtis, 1957) в качестве меры сходства: IBC = (2∑min(yij, yik))/(∑(yij + yik)) × 100%, где yij – присутствие вида i в районе или диапазоне j; yik – присутствие вида i в районе или диапазоне k. Количественная обработка выполнена с использованием статистического пакета Past 3.20 (Hammer, 2018).
РЕЗУЛЬТАТЫ
Из 190 видов морских макрофитов исследованного района (Гусарова и др., 2002; Дуленин, 2008) в сублиторали выделено 25 доминантов; проанализированы данные по 23 из них (табл. 1, 2). Исключительно на мелководьях (0–2 м, иногда до 4 м) были распространены поселения не включенных в анализ (см. выше) Alaria esculenta (удельная биомасса 0.5–2.0 кг/м2, проективное покрытие 0.1–0.6) и Zostera marina (удельная биомасса 2–4 кг/м2, проективное покрытие 0.5–1.0). Распределение включенных в анализ доминантов (рис. 2) показало, что 2/3 из них наиболее часто произрастали на глубине менее 6 м. На эту глубину приходилось от 65 ± 4% (N = 0.44) находок Saccharina japonica до 90 ± 7% (N = 0.21) находок S. cichorioides (рис. 2г, е). Однако Saccharina japonica f. longipes, Agarum clathratum, S. sculpera, Neorhodomela larix, Odonthalia corymbifera и Zostera asiatica (рис. 2д, и, ж, р, с, у) распределялись по глубине относительно равномерно. При этом указанные сахарины на мелководьях не встречались. Что касается общей картины (рис. 2ф), то 42 ± 2% (N = 0.88) станций с учтенными удельными биомассами располагались на глубине менее 6 м, 28 ± 2% (N = 0.83) станций – на глубине 6–10 м, 17 ± 2% (N = 0.51) станций – на глубине 11–15 м и 13 ± 2% (N = 0.44) станций – на глубине 16–20 м. С увеличением глубины частота встречаемости растительности плавно снижалась, в наиболее глубоководном диапазоне она была в 2 раза ниже, чем в самом мелководном. Для 2/3 видов не выявлено статистически значимого снижения удельной биомассы с глубиной. У Ulva lactuca, S. japonica f. longipes, A. clathratum, O. corymbifera и Z. asiatica их удельная биомасса независимо от глубины произрастания не изменялась. Статистически значимое снижение удельной биомассы с глубиной отмечено лишь для шести из 19 проанализированных доминантов (табл. 1). Изменение проективного покрытия с глубиной было выражено более существенно; статистически значимое уменьшение обилия выявлено для 11 доминантов (табл. 1). Для 12 из 23 видов изменение покрытия с глубиной было незначимо, а для пяти из них (U. lactuca, Bossiella cretacea, Corallina pilulifera, Neorhodomela teres, Z. asiatica) данный показатель независимо от глубины оставался стабильным. Кроме этого с глубиной статистически значимо снижались суммарные показатели удельных биомасс и проективного покрытия растительного покрова.
Таблица 1.
Показатели обилия доминантов донной растительности и параметры их линейных регрессий для зависимости от глубины в северо-западной части Татарского пролива
| Вид | По удельной биомассе | По проективному покрытию | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| N | m ± SE | α ± SE | R2 | p | N | m ± SE | α ± SE | R2 | p | |
| Codium fragile (Suringar) Hariot | 20 | 1.6 ± 0.4 | –0.06 ± 0.09 | 0.03 | 0.5 | 10 | 0.1 ± 0.02 | 0.17 ± 0.18 | 0.1 | 0.37 |
| Ulva lactuca Linnaeus | 34 | 0.4 ± 0.1 | –0.001 ± 0.004 | <0.01 | 0.99 | 40 | 0.2 ± 0.04 | 0.007 ± 0.05 | <0.01 | 0.89 |
| Desmarestia viridis (O.F. Müller) J.V. Lamouroux | 54 | 0.6 ± 0.1 | –0.05 ± 0.04 | 0.03 | 0.19 | 50 | 0.2 ± 0.03 | –0.09 ± 0.04 | 0.12 | <0.01 |
| Saccharina japonica | 152 | 2.9 ± 0.3 | –0.08 ± 0.03 | 0.06 | <0.01 | 154 | 0.2 ± 0.02 | –0.08 ± 0.01 | 0.15 | <0.01 |
| S. japonica f. longipes | 15 | 7.9 ± 1.1 | 0.03 ± 0.14 | <0.01 | 0.85 | 15 | 0.7 ± 0.08 | –0.01 ± 0.09 | <0.01 | 0.9 |
| S. cichorioides (Miyabe) C.E. Lane, C. Mayes, Druehl et G.W. Saunders | 57 | 2.4 ± 0.4 | –0.08 ± 0.06 | 0.03 | 0.17 | 38 | 0.3 ± 0.04 | –0.05 ± 0.04 | 0.04 | 0.21 |
| S. sculpera C.E. Lane, C. Mayes, Druehl & G.W. Saunders | 22 | 0.6 ± 0.1 | –0.14 ± 0.04 | 0.32 | <0.01 | 28 | 0.2 ± 0.04 | –0.05 ± 0.03 | 0.08 | 0.14 |
| Costaria costata (C. Agardh) De A. Saunders | 42 | 1.2 ± 0.2 | –0.18 ± 0.06 | 0.17 | 0.07 | 44 | 0.1 ± 0.02 | –0.12 ± 0.03 | 0.27 | <0.01 |
| Agarum clathratum Dumortier | 140 | 1.2 ± 0.1 | –0.01 ± 0.02 | <0.01 | 0.53 | 150 | 0.3 ± 0.02 | –0.03 ± 0.01 | 0.05 | <0.01 |
| Sargassum pallidum (Turner) C. Agardh | 51 | 4.8 ± 0.9 | –0.1 ± 0.06 | 0.06 | 0.08 | 33 | 0.4 ± 0.05 | –0.05 ± 0.03 | 0.14 | 0.03 |
| S. miyabei Yendo | 37 | 2.6 ± 0.4 | –0.23 ± 0.05 | 0.35 | <0.01 | 33 | 0.3 ± 0.05 | –0.14 ± 0.03 | 0.38 | <0.01 |
| Stephanocystis crassipes (Mertens ex Turner) Draisma, Ballesteros, F. Rousseau Thibant | 107 | 2 ± 0.2 | –0.09 ± 0.03 | 0.07 | <0.01 | 95 | 0.2 ± 0.02 | –0.04 ± 0.02 | 0.08 | <0.01 |
| Tichocarpus crinitus (S.G. Gmelin) Ruprecht | 38 | 1.4 ± 0.3 | –0.05 ± 0.06 | 0.02 | 0.36 | 21 | 0.2 ± 0.06 | 0.09 ± 0.04 | 0.18 | 0.05 |
| Corallina officinalis Linnaeus | нд | нд | нд | нд | нд | 46 | 0.4 ± 0.04 | 0.009 ± 0.07 | <0.01 | 0.89 |
| C. pilulifera Postels & Ruprecht | нд | нд | нд | нд | нд | 19 | 0.4 ± 0.03 | 0.003 ± 0.02 | 0.015 | 0.95 |
| Bossiella compressa Kloczcova | нд | нд | нд | нд | нд | 143 | 0.3 ± 0.02 | –0.04 ± 0.009 | 0.12 | <0.01 |
| Корковые кораллиновые | нд | нд | нд | нд | нд | 242 | 0.3 ± 0.02 | –0.03 ± 0.008 | 0.06 | <0.01 |
| Ptilota filicina J. Agardh | 33 | 1.3 ± 0.3 | –0.13 ± 0.03 | 0.3 | <0.01 | 20 | 0.3 ± 0.09 | –0.14 ± 0.06 | 0.23 | 0.03 |
| Neoptilota asplenioides (Esper) Kylin ex Scagel, Garbary, Golden & Hawkes | 33 | 1 ± 0.2 | –0.04 ± 0.04 | 0.03 | 0.35 | 16 | 0.2 ± 0.05 | 0.07 ± 0.05 | 0.15 | 0.16 |
| Neorhodomela larix (Turner) Masuda | 36 | 0.7 ± 0.1 | –0.006 ± 0.04 | <0.01 | 0.88 | 30 | 0.2 ± 0.02 | 0.002 ± 0.01 | <0.01 | 0.88 |
| Odonthalia corymbifera (S.G. Gmelin) Greville | 50 | 0.6 ± 0.1 | 0.006 ± 0.03 | <0.01 | 0.86 | 35 | 0.2 ± 0.03 | –0.05 ± 0.02 | 0.14 | 0.02 |
| Phyllospadix iwatensis Makino | 93 | 2.6 ± 0.3 | –0.26 ± 0.07 | 0.15 | <0.01 | 91 | 0.3 ± 0.02 | –0.11 ± 0.004 | 0.09 | 0.09 |
| Zostera asiatica Miki | 54 | 1.5 ± 0.2 | 0.02 ± 0.05 | 0.03 | 0.7 | 60 | 0.4 ± 0.04 | 0.0001 ± 0.03 | <0.01 | 1 |
| Суммарно по станциям | 482 | 4.8 ± 0.2 | -0.17 ± 0.01 | 0.35 | <0.01 | 449 | 0.9 ± 0.03 | -0.05 ± 0.005 | 0.17 | <0.01 |
Примечание. Угловые коэффициенты значимы при p < 0.05 (выделено жирным шрифтом); нд – нет данных; N – количество проб; m ± SE – среднее арифметическое и его стандартная ошибка; α ± SE – угол наклона линии регрессии и его стандартная ошибка; R2 – коэффициент детерминации; p – вероятность ошибочного отклонения нулевой гипотезы.
Таблица 2.
Показатели доминирования макрофитов в сублиторали северо-западной части Татарского пролива
| Вид | Глубина, м | ||||
|---|---|---|---|---|---|
| МГ, м | 2–5 | 6–10 | 11–15 | 16–20 | |
| Codium fragile | 5/6 | 0.48/0.05 | 0.17/0.06 | 0.03/0.02 | –/– |
| Ulva lactuca | 5/5 | 0.25/0.16 | 0.12/0.08 | 0.01/– | –/– |
| Desmarestia viridis | 5/6 | 0.32/0.13 | 0.12/0.06 | 0.03/0.02 | 0.01/0.02 |
| Saccharina japonica | 5/5 | 0.71/0.2 | 0.30/0.09 | 0.11/0.03 | 0.02/0.01 |
| S. japonica f. longipes | 17/16 | –/– | 0.6/0.25 | 0.73/0.28 | 0.97/0.33 |
| S. cichorioides | 4/4 | 0.7/0.23 | 0.11/0.03 | 0.12/0.05 | –/– |
| S. sculpera | 15/16 | 0.07/0.04 | 0.11/0.07 | 0.16/0.07 | 0.07/0.06 |
| Costaria costata | 4/5 | 0.49/0.14 | 0.13/0.05 | 0.01/0.01 | –/0.01 |
| Agarum clathratum | 10/10 | 0.17/0.07 | 0.29/0.15 | 0.21/0.1 | 0.10/0.05 |
| Sargassum pallidum | 5/5 | 0.87/0.24 | 0.20/0.06 | –/– | 0.05/0.01 |
| S. miyabei | 5/5 | 0.80/0.24 | 0.26/0.06 | 0.02/0.01 | –/– |
| Stephanocystis crassipes | 5/5 | 0.61/0.2 | 0.20/0.08 | 0.1/0.02 | –/– |
| Tichocarpus crinitus | 5/5 | 0.44/0.18 | 0.14/0.03 | 0.04/0.02 | 0.01/0.01 |
| Corallina officinalis | нд/5 | нд/0.29 | нд/0.03 | нд/– | нд/– |
| C. pilulifera | нд/3 | нд/0.28 | нд/– | нд/– | нд/– |
| Bossiella compressa | нд/10 | нд/0.12 | нд/0.12 | нд/0.07 | нд/0.06 |
| Корковые известковые | нд/10 | нд/0.15 | нд/0.1 | нд/0.07 | нд/0.08 |
| Ptilota filicina | 5/5 | 0.5/0.2 | 0.11/0.07 | 0.03/0.01 | 0.04/0.02 |
| Neoptilota asplenioides | 5/5 | 0.39/0.19 | 0.14/0.04 | 0.08/0.06 | 0.01/– |
| Neorhodomela larix | 10/10 | 0.19/0.07 | 0.12/0.06 | 0.07/0.03 | 0.04/0.02 |
| Odonthalia corymbifera | 5/10 | 0.24/0.13 | 0.15/0.05 | 0.08/0.03 | 0.03/0.01 |
| Phyllospadix iwatensis | 3/3 | 0.76/0.24 | 0.10/0.04 | –/– | –/– |
| Zostera asiatica | 10/10 | 0.33/0.17 | 0.19/0.11 | 0.18/0.08 | –/– |
| m ± SE | 0.46 ± 0.06/ 0.17 ± 0.02 | 0.19 ± 0.03/ 0.08 ± 0.01 | 0.12 ± 0.04/ 0.05 ± 0.01 | 0.12 ± 0.09/ 0.05 ± 0.02 | |
Примечание. Диапазоны глубин с наибольшими значениями индексов доминирования выделены жирным шрифтом; медианные глубины (МГ), не совпадающие с глубинами экологических оптимумов, подчеркнуты. В первом столбце перед косой чертой медианная глубина (МГ), вычисленная по удельной биомассе, за чертой – по проективному покрытию; в остальных столбцах – значения коэффициентов $\sqrt {В N} $ и $\sqrt {CN} $ соответственно; нд – нет данных, “–” – вид не найден или коэффициент его доминирования меньше 0.01.
Рис. 2.
Изменение удельной биомассы (УБ) доминантов подводной растительности в северо-западной части Татарского пролива по глубине. Показаны линии тренда.
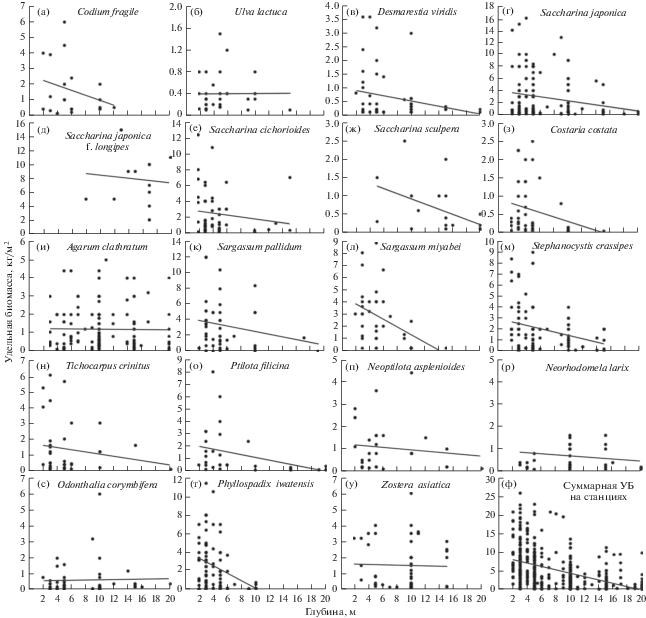
Медианные глубины распространения доминантных макрофитов приходились преимущественно на мелководье (табл. 2). Для большинства (11) видов по удельной биомассе и почти для половины (10) видов по проективному покрытию медианные глубины совпадали и составляли 5 м. Для 4 видов-доминантов медианные глубины составляли 3–4 м и для двух – 6 м. На глубину 10 м приходились медианные глубины шести доминантов, а на глубины, близкие к максимальным (16–17 м), – только двух. В большинстве случаев медианные глубины по удельной биомассе и проективному покрытию полностью совпадали или имели близкие значения, различавшиеся не более чем на 1 м. Медианная глубина для пояса растительности в целом составила 9.5 м по удельной биомассе и 9 м по проективному покрытию.
Анализ глубинных диапазонов с наибольшими уровнями доминирования (табл. 2) показал, что для 20 доминантов они также приходились на мелководье хотя бы по одному показателю. В глубоководных диапазонах максимальные уровни доминирования достигались гораздо реже – для четырех доминантов в диапазоне 6–10 м и по одному доминанту – в диапазонах 11–15 и 16–20 м. За некоторыми исключениями, диапазоны доминирования, вычисленные по разным показателям, совпадали и включали медианные глубины соответствующих доминантов. Несовпадения отмечены только для четырех видов. Однако они невелики – медианные глубины в некоторых случаях приходились на диапазоны, соседние с диапазонами максимального доминирования. Средний уровень доминирования от мелководья до максимальных глубин снижался более чем в 3 раза: от 0.46 до 0.12 для удельной биомассы и от 0.17 до 0.05 для проективного покрытия.
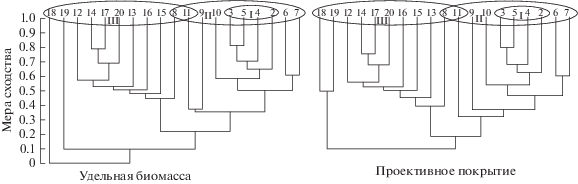
Дендрограммы сходства состава и обилия доминантов по глубине, построенные по удельной биомассе и проективному покрытию, близки между собой (рис. 3). Выделяются по две большие группы кластеров, охватывающих глубины 2–11 и 8–20 м соответственно, а глубины, относящиеся к ним, частично перекрываются. В центре кластеров, охватывающих глубины 2–11 м, выделяются группы, включающие глубины 2–5 м. Степень сходства растительности данных групп составляет 0.65–0.75. Растительность соседних глубин в пределах больших кластеров по степени сходства (от 0.33 до 0.8) может значительно различаться.
Рис. 3.
Сходство состава и обилия доминантов подводной растительности в северо-западной части Татарского пролива по глубине. Арабские цифры – глубина, м; римские цифры – номера этажей горизонта растительного покрова; овалы – границы этажей. Пояснения см. в тексте.
Глубже 18–22 м водорослевый пояс исчезал независимо от наличия подходящего грунта. Здесь на галечных и валунных равнинах растительность не формировала выраженного покрова и была представлена разреженными поселениями красных водорослей Turnerella mertensiana (Postels & Ruprecht) F. Schmitz; Sparlingia pertusa (Postels & Ruprecht) G.W. Saunders, I.M. Strachan & Kraft; Congregatocarpus pacificus (Yamada) Mikami; Callophyllis rhynchocarpa Ruprecht и Phycodrys riggii N.L. Gardner с минимальными суммарными значениями удельной биомассы (не более 0.1–0.5 кг/м2) и проективного покрытия (не более 0.05–0.2). Исключение составляла S. japonica f. longipes, поселения которой с удельной биомассой до 10 кг/м2 и с проективным покрытием не менее 0.5 достигали глубины не менее 22 м.
На мелководье произрастали доминанты из всех высших таксонов донной растительности, на глубинах более 12–15 м не встречались представители Chlorophyta и Magnoliophyta, на глубинах более 20–22 м – Phaeophycea, а максимальные глубины (более 22 м) были населены лишь Rhodophyta.
ОБСУЖДЕНИЕ
Ранее была зонирована фиталь района (Дуленин, 2008) и сопоставлены изменения видового состава и освещенности с глубиной по образцу прежних исследований (Гусарова, 1975; Перестенко, 1980). Однако известно, что распределение растительности по глубине определяется множеством факторов (Vadas, Steneck, 1988; Gattuso et al., 2006): температурой, гидродинамической нагрузкой и составом грунтов, а освещенность может его лимитировать только в водах с низкой прозрачностью (Камнев, 1989). Топические клины в современной науке о растительности рассматриваются в качестве комплексных градиентов (Миркин и др., 2001; Пузаченко, 2004). Для района исследований известны данные лишь по температуре (Пищальник, Бобков, 2000) и грунтам (собственные сведения), поэтому долю влияния каждого фактора на распределение растительности рассчитать невозможно, но можно попытаться оценить влияние отдельных факторов.
В ряде акваторий на распределение макрофитов влияет антропогенное загрязнение (Клочкова, Березовская, 2001; Okuda, 2008; и др.). Однако в районе исследования антропогенная деструкция донной растительности наблюдается только на ограниченных участках в портах Ванино и Советская Гавань (Дуленин и др., 2015). Растительный покров у остальных побережий (протяженностью около 600 км) находится в ненарушенном состоянии. Таким образом, для района исследований антропогенный фактор незначим и этот район можно рассматривать как полигон для выявления закономерностей нативного распределения донной растительности.
Камнев (1989) считает основным фактором развития растительности на мелководье движение воды, определяющее условия метаболизма донной растительности. Это согласуется с нашими наблюдениями: глубины до 6 м с наиболее развитым растительным покровом (рис. 1) отличались максимальной гидродинамикой (Дуленин, 2008). Ее влияние можно проследить и для отдельных видов. Например, Alaria esculenta с прочными срединной жилкой и органами прикрепления доминировала на прибойных участках открытых побережий в сублиторальной кайме. Saccharina japonica f. longipes из-за длинных и широких слоевищ (соответственно до 10 м и 40 см; собственные данные), обладающих большой парусностью, формировала поселения только на глубинах 8–22 м, где гидродинамическая нагрузка снижена и растения могут развиваться без риска быть выброшенными на берег. Обладающая мягкими стеблями Zostera marina обитала лишь на мелководье закрытых бухт со слабой гидродинамической нагрузкой. Более жесткие стебли и толстые корневища Zostera asiatica позволяли виду расселяться в биотопах с разным уровнем гидродинамической нагрузки от сублиторальной каймы до глубины 15 м.
Очевидна связь состава грунта с частотой встречаемости растительности, которая снижалась с глубиной (r = 0.88 ± 0.12), поскольку на малых глубинах преобладают жесткие грунты, пригодные для прикрепления водорослей (по собственным данным, от 89% жестких грунтов на 2–6-метровой глубине до 54% на глубине 16–20 м). Однако изменение обилия растительности по глубине на благоприятных грунтах требует объяснения. Снижение освещенности, вероятно, влияет на распределение основных таксономических групп доминантов. Часто наблюдавшееся относительное преобладание Chlorophyta на мелководьях и Rhodophyta на глубине (Biology of the red …, 1990; Spalding et al., 2003) не является общим правилом (Vadas, Steneck, 1988; Саутт, Уиттик, 1990). В нашем случае небольшая глубина распространения зеленых и бурых водорослей может быть связана с относительно низкой прозрачностью вод (4–8 м по нашим данным), что обусловлено большими массами взвеси, поставляемыми стоком из Амурского лимана и крупных рек (Тумнин, Коппи), и дополнительным снижением освещенности с глубиной.
Водоросли умеренного пояса способны жить при освещенности от 100–80 до 5–3% ФАР и даже до 0.1–0.05% (Titlyanov et al., 1992). Поэтому закономерно, что обилие большинства доминантов по глубине показывает признаки стабильности, хотя это не соответствует ни изменению комплексного абиотического градиента, ни, в частности, освещенности. Так, удельная биомасса большинства доминантов в пределах пояса растительности была относительно постоянной (рис. 2, табл. 1). Проективное покрытие демонстрировало бòльшую изменчивость, однако и в этом случае статистически значимые изменения с глубиной удалось проследить менее чем для половины доминантов. Например, относительная теневыносливость агарума позволяла ему успешно расти в условиях затенения крупными представителями Laminariales и Fucales, благодаря чему удельная биомасса вида на малых глубинах была стабильной. Вместе с тем с глубиной наблюдалось значимое уменьшение его проективного покрытия, что можно объяснить характером сложения растительности на глубине 10–20 м, где поселения агарума перемежались с пятнами корковых кораллиновых водорослей и c пустыми участками грунта. Такая картина была обычна и для других видов, проективное покрытие которых снижалось с глубиной при сохранении стабильности удельной биомассы. Очевидно, это результат действия естественных механизмов адаптации пространственной структуры поселений к условиям уменьшающегося количества света: ярусная структура зарослей на большой глубине не формируется, так как ювенильные особи при скудной освещенности не выживают в условиях дополнительного затенения талломами взрослых растений. Отдельные растения свободно осваивают становящееся избыточным пространство, более эффективно используя свет и сохраняя стабильность структуры поселений. Имеются и относительно теневыносливые доминанты, не встречающиеся на мелководье: S. japonica f. longipes и S. sculpera, однако глубины их распространения в районе исследования нельзя считать полностью благоприятными, так как поселения данных водорослей здесь нестабильны во времени (Дуленин, 2012).
Стабилизации количественных показателей, по-видимому, способствует и конкуренция за жизненное пространство. Действительно, на глубине 2–5 м отмечено наибольшее количество видов – до 85 (Дуленин, 2008), а значения индексов доминирования максимальны для большинства доминантов (табл. 3 ). Таким образом, на мелководье наиболее сильно выражена как межвидовая, так и внутривидовая конкуренция. Это существенно ограничивает возможности прироста биомассы, что связано с ограничением площади, пригодной для оседания спор и прикрепления взрослых растений, с затенением нижних ярусов и аллелопатией (Селиванова, 2003; Набивайло, Титлянов, 2006). Статистически значимых максимумов обилия здесь достигают немногочисленные виды-виоленты, прежде всего S. japonica и представители Sargassaceae. У них крупные талломы, причем первая отличается быстрым ростом, а вторые характеризуются значительной продолжительностью жизни (Камнев, 1989), что обеспечивает преимущества в конкурентной борьбе.
С глубиной растительность изреживается, конкуренция ослабевает и появляется возможность для развития относительно устойчивых эврибионтных видов. Именно этим можно объяснить то, что для большинства доминантов снижение обилия по глубине статистически незначимо. Ярко демонстрировали стабильность Agarum clathratum и Z. asiatica – наиболее эврибионтные максимально распространенные доминанты района (Дуленин, 2008). Они успешно осваивали любые глубины и резко, со ступенчатым падением обилия, исчезали при наступлении неблагоприятных условий. Z. asiatica, произрастающая на мягких грунтах, может испытывать конкуренцию лишь со стороны Z. marina на мелководье, местами образуя сообщества с комплексным сложением при совместном доминировании. Однако на глубине от 4 до 15 м Z. asiatica конкурентов не имеет и образует обширные монодоминантные поселения.
Разреженные поселения на больших глубинах (18–26 м) не формировали растительного покрова. Растения здесь располагались поодиночке, показатели обилия были минимальными (Дуленин, 2008), а доминирование было не выражено, вследствие чего конкуренция отсутствовала.
Относительно малозначимым фактором, влияющим на распределение растительности в районе исследований, следует считать температуру, что подтверждено ранее (Дуленин, Гусарова, 2016). Среднемноголетние значения температуры воды летом изменяются здесь от 16°С у поверхности до 12°С на изобате 20 м (по: Пищальник, Бобков, 2000). Однако летняя поверхностная температура колеблется от 5 до 22°С (Климат морей России…, 2007), а при хорошем перемешивании придонная температура часто не отличается от приповерхностной (собственные данные). Очевидно, что в таких условиях температурный градиент вряд ли значим для большинства доминантов – относительно эвритермных бореальных видов (Клочкова, 1996). Степень соответствия реального распределения водорослей термотропным характеристикам отдельных видов заметно различалась. Например, тепловодный низкобореально-тропическо-нотальный Codium fragile был ожидаемо распространен в наиболее прогреваемом диапазоне 2–12 м. В то же время холодноводная арктическо-бореальная Desmarestia viridis была приурочена преимущественно к прогреваемым мелководьям, что не соответствует ее термотропной характеристике, а относительно тепловодная широкобореально-субтропическая Odonthalia corymbifera имела стабильные показатели обилия на всех глубинах.
При наиболее благоприятных параметрах комплексного абиотического градиента и биотических взаимодействий формируются глубинные диапазоны с наибольшим уровнем доминирования отдельных видов, которые следует считать диапазонами экологических оптимумов. Медианные глубины в этом случае (в противоположность диапазонам) соответствуют некоторым точечным характеристикам оптимумов, что подтверждает их преимущественная принадлежность к диапазонам оптимумов. Смещение вниз медианных глубин пояса растительности по отношению к таковым для большинства доминантов (9–9.5 м против 4–6 м) показывает вклад в формирование растительности “глубоководных” доминантов. Распределение экологических оптимумов соответствует изменению комплексного градиента, коррелируя (r = 0.93 ± 0.07) и с уменьшением числа видов по глубине (Дуленин, 2008).
Результаты кластерного анализа состава и обилия доминантов по глубине (рис. 3) показывают более сложную картину. Растительность мелководий (2–5 м) не выделяется в отдельные кластеры, как можно было ожидать, но образует группы с максимальным сходством внутри больших кластеров, охватывающих глубины 2–11 м. Таким образом, на мелководьях складываются не отдельные ценотические общности с хорошо выраженными границами, как указывалось ранее (Дуленин, 2008), а формируется диапазон общего экологического оптимума растительности, содержащий наиболее типичные ее структурные элементы (табл. 2) и приуроченный к глубинам с наиболее благоприятными абиотическими условиями. Эколого-ценотический комплекс мелководий целесообразно обозначить как ядро растительности. Четкие границы у этого ядра отсутствуют, оно размывается с глубиной. На глубине 8–20 м (иногда до 22 м) складывается следующий глубоководный комплекс растительности, внутри которого невозможно выделить ядро. Это связано с тем, что условия здесь определяются конкретными биотопами (Симакова, 2011). Так, освещенность между гребнями скалистых склонов на 11–15-метровой глубине может быть существенно ниже, чем на открытой галечной равнине на глубине 16–20 м. В результате растительность на скалистых склонах будет представлена лишь разреженными пятнами агарума, а на галечной равнине – поселениями сахарин и красных водорослей, местами с высоким обилием. Границы глубоководного комплекса растительности также размыты: на 8–11-метровой глубине они перекрываются с комплексом мелководной растительности, образуя широкую переходную зону. Выделение в отдельную группу глубины 18–19 м отражает нечеткость нижних границ пояса макрофитов, где растительный покров постепенно сменяется разреженными поселениями.
Описанная картина соответствует континуальной концепции живого покрова (Миркин и др., 2001). Кафанов (2006) показал, что соотношение континуальности и дискретности в распределении биоты является вопросом масштаба. Однако, вопреки его мнению, элементы дискретной структуры присущи растительности района на топологическом уровне, тогда как на региональном уровне сочетается наличие континуумов и биотических границ (Дуленин, Гусарова, 2016). Дискретные границы могут присутствовать в масштабе отдельных фитоценозов и растительных поясов, их расположение значительно различается на разных участках. Кроме этого количественный анализ доминирования устраняет артефакты, возникшие при описании сообществ макрофитов района по физиономическому облику (Дуленин, 2008; Дуленин и др., 2010). Например, A. clathratum описывался ранее как исключительно глубоководный доминант, но показатели его обилия стабильны, начиная с мелководий (рис. 2). Stephanocystis crassipes, напротив, приведен как доминант мелководий, однако по нашим данным он образует ценотически самостоятельные группировки со значительной удельной биомассой на глубине 10 м и более (рис. 2).
Указанные обстоятельства затрудняют дискретное зонирование на основании вертикального распределения растительности. Расположение экологических оптимумов доминантов, разреженных поселений и результаты кластерного анализа позволяют выделить два горизонта растительности: верхний горизонт растительного покрова с тремя этажами растительности и нижний горизонт разреженных поселений. Расположение этих страт соответствует выделенным ранее (Дуленин, 2008), однако вместо дискретных границ они имеют широкие переходные зоны: между этажами – на глубинах 5–6 и 8–11 м, между горизонтами – на глубине 18–22 м соответственно.
ЗАКЛЮЧЕНИЕ
Анализ распределения доминантов донной растительности в северо-западной части Татарского пролива по глубине показал, что значения обилия большинства из них в пределах пояса растительности статистически значимо не изменяются. Сохранению стабильности количественных показателей способствует снижение конкуренции благодаря обеднению качественного состава растительности с глубиной. Общий экологический оптимум пояса растительности приурочен к глубине 2–6 м. Наиболее существенные абиотические факторы распределения подводной растительности – гидродинамика и состав грунтов. Распределение состава и обилия растительности имеет характер континуума. Горизонты и этажи фитали соответствуют выделенным ранее (Дуленин, 2008), однако имеют широкие переходные зоны.
Список литературы
Блинова Е.И., Вилкова О.Ю., Милютин Д.М. и др. Методические рекомендации по учету запасов промысловых гидробионтов в прибрежной зоне. М.: ВНИРО. 2005. 80 с.
Броцкая В.А., Зенкевич Л.А. Количественный учет фауны Белого моря // Тр. ВНИРО. 1939. Т. 4. С. 3–150.
Гусарова И.С. Макрофитобентос сублиторальной зоны островов Итуруп, Уруп и Симушир (Большая Курильская гряда): Автореф. … дис. канд. биол. наук. Л. 1975. 23 с.
Гусарова И.С., Иванова Н.В. Внутривидовая систематика Saccharina japonica Areschoug материкового побережья Японского моря // Изв. ТИНРО. 2006. Т. 147. С. 157–168.
Гусарова И.С., Суховеева М.В., Дуленин А.А. Аннотированный список водорослей-макрофитов северо-западной части Татарского пролива // Изв. ТИНРО. 2002. Т. 131. С. 327–339.
Гусарова И.С., Суховеева М.В., Жмакин А.Ф. Водоросли-макрофиты // Гидрометеорология и гидрохимия морей. Т. IX: Охотское море. Вып. 1. Гидрометеорологические условия. СПб.: Гидрометеоиздат. 1993. С. 145–154.
Дуленин А.А. Состояние изученности макрофитобентоса у берегов материковой части Татарского пролива // Изв. ТИНРО. 2007. Т. 148. С. 156–166.
Дуленин А.А. Распределение макрофитобентоса в условиях сублиторали северо-западной части Татарского пролива: Автореф. … дис. канд. биол. наук. Владивосток. 2008. 20 с.
Дуленин А.А. Ресурсы и распределение промысловых макрофитов западной части Татарского пролива (в пределах Хабаровского края) // Изв. ТИНРО. 2012. Т. 170. С. 17–29.
Дуленин А.А. Распределение сублиторальной растительности материкового побережья Охотского моря (в пределах Хабаровского края) // Изв. ТИНРО. 2015. Т. 180. С. 107–127.
Дуленин А.А., Гусарова И.С. Широтные изменения состава и структуры растительности в северо-западной части Татарского пролива // Биол. моря. 2016. Т. 42. № 4. С. 272–279.
Дуленин А.А., Дуленина П.А., Рижийс Е.А. Результаты гидробиологического водолазного обследования залива Советская Гавань // Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование: Материалы VI Всерос. научно-практ. конф. (24–26 марта 2015 г.). Петропавловск-Камчатский. 2015. Ч. 1. С. 55–59.
Дуленин А.А., Сидяков Ю.В., Черниенко И.С. Сообщества макробентоса сублиторали северо-западной части Татарского пролива и Охотского моря (в границах Хабаровского края) // Сб. науч. тр. Хабаровского филиала Тихоокеанского научно-исследовательского рыбохозяйственного центра. Владивосток: ТИНРО-центр. 2010. С. 115–137.
Камнев А.Н. Структура и функции бурых водорослей. М.: Изд-во МГУ. 1989. 200 с.
Кафанов А.И. Континуальность и дискретность живого покрова: проблема масштаба // Журн. общ. биол. 2006. Т. 67. № 4. С. 311–313.
Климат морей России и ключевых районов Мирового океана // Электронный атлас. ФЦП “Мировой океан”. Единая система информации об обстановке в Мировом океане (ЕСИМО). 2007. http://www.esimo.ru/atlas/Jap/2_watertemp_station_95049_1.html
Клочкова Н.Г. Флора водорослей-макрофитов Татарского пролива и особенности ее формирования. Владивосток: Дальнаука. 1996. 291 с.
Клочкова Н.Г., Березовская В.А. Макрофитобентос Авачинской губы и его антропогенная деструкция. Владивосток: Дальнаука. 2001. 220 с.
Миркин Б.М., Наумова Л.Г., Соломещ А.И. Современная наука о растительности. М.: Логос. 2001. 264 с.
Набивайло Ю.В., Титлянов Э.А. Конкурентные взаимоотношения водорослей в природе и в культуре // Биол. моря. 2006. Т. 32. № 5. С. 315–325.
Перестенко Л.П. К биономии литоральной и сублиторальной зон материкового побережья Японского моря // Ботан. журн. 1969. Т. 54. № 10. С. 545–557.
Перестенко Л.П. Водоросли залива Петра Великого. Л.: Наука. 1980. 232 с.
Перестенко Л.П. Красные водоросли дальневосточных морей России. СПб.: Ольга. 1994. 331 с.
Петров К.М., Поздеев В.Б. Подводные ландшафты и фитобентос у берегов южного Сахалина. Владивосток: ДВГУ. 1992. 128 с.
Пищальник В.М., Бобков А.О. Океанографический атлас шельфовой зоны острова Сахалин. Ч. 1. Южно-Сахалинск: Изд-во СахГУ. 2000. 174 с.
Пузаченко Ю.Г. Математические методы в экологических и географических исследованиях. М.: Academia. 2004. 409 с.
Саут Р., Уиттик А. Основы альгологии. М.: Мир. 1990. 597 с.
Селиванова О.Н. Конкуренция среди водорослей и проблема выбора видов, перспективных для санитарной марикультуры // Сб. тр. Камчат. института экологии и природопользования ДВО РАН. Петропавловск-Камчатский: Камчат. печат. двор. 2003. С. 152–171.
Симакова У.В. Структура и распределение сообществ макрофитобентоса в зависимости от рельефа дна: Северокавказское побережье Черного моря: Автореф. дис. … канд. биол. наук. М. 2011. 27 с.
AlgaeBase. World-wide electronic publication. National University of Ireland, Galway. http://www.algaebase.org; searched on 27 June 2018.
Biology of the red algae / Eds K.M. Cole, R.G. Sheath. Cambridge: Cambridge Univ. Press. 1990. P. 398–400.
Bray J.R., Curtis J.T. An ordination of the upland forest communities of Southern Wisconsin // Ecol. Monogr. 1957. V. 27. № 4. P. 325–349.
Gattuso J.-P., Gentili B., Duarte C.M. et al. Light availability in the coastal ocean: impact on the distribution of benthic photosynthetic organisms and contribution to primary production // Biogeosciences. 2006. V. 3. № 4. P. 489–513.
Hammer Ø. PAST: Paleontological statistics. Version 3.20. Reference manual. Oslo: Natural History Museum. Univ. of Oslo. 1999–2018. 262 p.
Spalding H., Foster M.S., Heine J.N. Composition, distribution, and abundance of deep-water (> 30 m) macroalgae in central California // J. Phycol. 2003. V. 39. P. 273–284.
Okuda K. Coastal environment and seaweed-bed ecology in Japan // Kuroshio Sci. 2008. V. 2. P. 15–20.
Titlyanov E.A., Bil K.Y., Kolmakov P.V. et al. Photosynthesis in common macrophyte species in the intertidal and upper subtidal zones of the Seychelles Islands // Atoll Res. Bull. 1992. V. 373. P. 1–36.
Vadas R.L., Steneck R.S. Zonation of deep water benthic algae in the Gulf of Maine // J. Phycol. 1988. V. 4. P. 338–346.
Дополнительные материалы отсутствуют.