Биология моря, 2019, T. 45, № 3, стр. 208-216
Кариологическая и молекулярно-генетическая дифференциация бахромчатых бычков рода Porocottus Gill, 1859 (Cottidae: Myoxocephalinae)
И. Н. Морева 1, *, О. А. Радченко 2, А. В. Петровская 2
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
2 Институт биологических проблем Севера ДВО РАН
685000 Магадан, Россия
* E-mail: irruz@yandex.ru
Поступила в редакцию 19.04.2018
После доработки 31.05.2018
Принята к публикации 31.05.2018
Аннотация
Впервые проведено кариологическое и молекулярно-генетическое исследование бахромчатых бычков рода Porocottus. Изучены кариотипы P. japonicus (2n = 42, NF = 42), P. allisi и P. minutus (2n = 40, NF = 42). В результате анализа митохондриальной ДНК установлены высокие уровни дифференциации видов, выявлены существенные отличия P. camtschaticus от P. minutus и P. japonicus. На основе комплексного исследования обнаружены признаки, позволяющие проводить надежную идентификацию P. japonicus, P. allisi, P. minutus и P. camtschaticus.
Род Porocottus – один из самых многочисленных в группе морских бычков–керчаков подсемейства Myoxocephalinae (Cottidae) (Fricke et al., 2018). Представители этого рода обитают на литорали и сублиторали Берингова, Охотского, Японского и Желтого морей, а также прилегающих вод северной части Тихого океана (Yabe, 1992; Muto et al., 2002; Парин и др., 2014, и др.).
Большинство видов рода Porocottus распространены в Японском, Охотском морях, у тихоокеанского побережья Камчатки, островов Курильского и Японского архипелагов. Ареал эндемичного вида охотоморского бахромчатого бычка P. minutus (Pallas, 1814) ограничен водами северной части Охотского моря (Черешнев и др., 2001; Парин и др., 2014). Камчатский бахромчатый бычок P. camtschaticus (Schmidt, 1916) встречается в Охотском море, у западного побережья Камчатки, у островов Парамушир и Симушир, а также в прибрежных водах Тихого океана, у юго-восточной Камчатки и о-ва Шикотан (Неелов, 1979; Шейко, Федоров, 2000; Федоров и др., 2003).
Японский P. japonicus (Schmidt, 1935) и южный P. tentaculatus (Kner, 1868) бахромчатые бычки распространены в северной части Японского моря и южной части Охотского моря, второй вид встречается и в северо-западной части Охотского моря – в Тауйской губе, у тихоокеанского побережья южных Курильских островов и Японии (Парин и др., 2014; Савельев, Колпаков, 2016). Бахромчатый бычок Эллиса P. allisi (Jordan, Starks, 1904) обитает в Японском море у берегов Приморья и в Татарском проливе, в Охотском море у островов Кунашир и Хоккайдо и в тихоокеанских водах у южных Курильских островов (Линдберг, Красюкова, 1987; Соколовский и др., 2007; Парин и др., 2014).
В Беринговом море встречаются чукотский P. quadrifilis (Gill, 1859) и белопятнистый P. mednius (Bean, 1898) бахромчатые бычки. В ареал P. mednius также входят прибрежные воды северных Курильских островов и южной части п-ва Камчатка (Парин и др., 2014).
По мнению некоторых авторов, род Porocottus нуждается в более детальной ревизии (Токранов, Шейко, 2009). На основании исследования морфологических признаков и особенностей строения сейсмосенсорной системы в роде Porocottus выделены два подрода. Чукотский бахромчатый бычок P. quadrifilis, американский бахромчатый бычок P. bradfordi (Rutter, 1898) и его подвид белопятнистый бахромчатый бычок P. bradfordi albomaculatus (Schmidt, 1916) относятся к подроду Porocottus. Подрод Crossias включает пять видов: P. allisi, P. minutus, P. tentaculatus, P. camtschaticus и P. japonicus (Неелов, 1976, 1979).
В современных каталогах содержатся данные о девяти видах рода Porocottus (Парин и др., 2014; Fricke et al., 2018). Валидным видом признан P. mednius, ранее описанный как Myoxocephalus mednius (Bean, 1898). Вид P. bradfordi и его подвид P. b. albomaculatus сведены в синонимию P. mednius (Fricke et al., 2018). В литературе имеется описание новых для рода Porocottus видов. В водах тихоокеанского побережья восточного Хоккайдо (Япония) был выловлен вид P. coronatus (Yabe, 1992). Еще один новый вид P. leptosomus описан из вод западного побережья Кореи, Желтое море (Muto et al., 2002).
После ревизии семейства Cottidae (Неелов, 1979) сравнительные морфологические исследования видов рода Porocottus не проводились. Молекулярно-генетические данные ограничены нуклеотидными последовательностями фрагмента гена COI единичных экземпляров P. allisi и P. leptosomus в GenBank (www.ncbi.nlm.nih.gov). Кариотипы видов неизвестны. В настоящей работе впервые проведен комплексный молекулярно-генетический и кариологический анализ видов P. japonicus, P. allisi, P. minutus и P. camtschaticus из Японского, Охотского морей и прибрежных вод о-ва Шикотан с целью определения уровня изменчивости, степени дифференциации и уточнения родственных отношений этих видов.
МАТЕРИАЛ И МЕТОДИКА
Сведения об объеме изученного материала и районах его сбора приведены в таблице 1. Виды рода Porocottus пойманы на литорали: P. japonicus и P. allisi – с помощью сачка, P. minutus – руками под камнями, а P. camtschaticus – мальковым неводом. Рыб идентифицировали по внешним морфологическим признакам.
Таблица 1.
Материал, использованный в работе
| Вид (номер образца) | Район сбора | Гены (№ в GenBank) | ||
|---|---|---|---|---|
| COI | 16S рРНК | Цитохром b | ||
| Porocottus camtschaticus (1750) | О-в Шикотан, б. Горобец | MH172265 | MH167461 | MH172283 |
| P. camtschaticus (1751) | Там же | MH172266 | MH167462 | MH172284 |
| P. camtschaticus (1752) | » | MH172267 | MH167463 | MH172285 |
| P. minutus (1930)* | Охотское море, Тауйская губа, о-в Недоразумения | MH172268 | MH167464 | MH172286 |
| P. minutus (1934)* | Там же | MH172269 | MH167465 | MH172287 |
| P. minutus (1936) | » | MH172270 | MH167466 | MH172288 |
| P. minutus (1938) | » | MH172271 | MH167467 | MH172289 |
| P. minutus (1939) | » | MH172272 | MH167468 | MH172290 |
| P. minutus (1996) | Охотское море, Тауйская губа, мыс Нюкля | MH172273 | MH167469 | MH172291 |
| P. minutus* | Охотское море, Тауйская губа, зал. Одян |
− | − | − |
| P. minutus* | Там же | − | − | − |
| P. japonicus (1993)* | Японское море, северное Приморье, б. Джигит | MH172274 | MH167470 | MH172292 |
| P. japonicus (1997)* | Татарский пролив, зал. Чихачева | MH172275 | MH167471 | MH172293 |
| P. japonicus (1998)* | Там же | MH172276 | MH167472 | MH172294 |
| P. japonicus (2011)* | » | MH172277 | MH167473 | MH172295 |
| P. japonicus (2012) | » | MH172278 | MH167474 | MH172296 |
| P. japonicus (2013) | » | MH172279 | MH167475 | MH172297 |
| P. allisi* | Японское море, северное Приморье, б. Джигит | − | − | − |
| P. allisi (KY305170) | Прибрежные воды Корейского полуострова | KY305170 | − | − |
| P. leptosomus (KY305169) | Там же | KY305169 | − | − |
| P. leptosomus (KY305156) | » | KY305156 | − | − |
| Megalocottus platycephalus | Охотское море, Тауйская губа | MH016197 | MH012123 | MH016217 |
| Enophrys diceraus | Там же | MH172280 | MH167476 | MH172298 |
| Gymnocanthus pistilliger | Японское море, Татарский пролив, зал. Ситуан | MH172281 | MH167477 | MH172299 |
| Alcichthys elongatus | Японское море, зал. Петра Великого, зал. Восток | MH172282 | MH167478 | MH172300 |
Молекулярно-генетический анализ
Проведен анализ изменчивости нуклеотидных последовательностей генов COI, цитохрома b и 16S рРНК митохондриальной ДНК (мтДНК). Для сравнительного молекулярно-генетического анализа привлечены данные из GenBank (www.ncbi.nlm.nih.gov) по нуклеотидным последовательностям участка гена COI видов P. allisi и P. leptosomus из прибрежных вод Корейского полуострова. Для укоренения филогенетических деревьев и тестирования монофилии Porocottus в качестве внешних групп использовали представителей семейства Cottidae: Megalocottus platycephalus, Enophrys diceraus, Gymnocanthus pistilliger и Alcichthys elongatus.
Геномную ДНК выделяли из мышечной ткани по стандартной методике, включающей лизис ткани 1% SDS в присутствии протеиназы К (0.2 мг/мл) и депротеинизацию фенолом (Maniatis et al., 1982). Для амплификации в полимеразной цепной реакции и секвенирования ДНК использовали универсальные олигонуклеотидные праймеры, описанные ранее (Радченко и др., 2009; Морева и др., 2017). Выравнивание нуклеотидных последовательностей и определение параметров изменчивости мтДНК (количество, тип, распределение замен) проводили в программе MEGA 6 (Tamura et al., 2013).
Для оценки генетических расстояний между участками мтДНК в программе PAUP 4.0b10 (Swofford, 2002) вычисляли значения p-дистанций. Для филогенетического анализа нуклеотидные последовательности были сформированы в набор данных, включающий отдельно первую, вторую и третью нуклеотидные позиции кодонов генов COI и цитохрома b, ген 16S рРНК. Для каждой части набора данных в программе Modeltest v3.7 (Posada, Crandall, 1998) с использованием критерия Akaike выбирали оптимальные модели нуклеотидных замещений (TrN+G, TIM+I, F81, GTR+I, TrNef+G, F81, TrN+G). Филогенетический анализ мтДНК выполнен с помощью метода байесовского анализа в программе MrBayes v.3.1.2 (Ronquist, Huelsenbeck, 2003). Из 10001 полученных деревьев первые 1001, характеризующиеся нестабильными параметрами моделей нуклеотидных замещений и правдоподобия, отброшены; на основе остальных получены консенсусные деревья и апостериорные вероятности их ветвления. Узлы ветвления с оценками апостериорной вероятности ≥0.95 приняты как достоверные (Leaché, Reeder, 2002).
Кариологический анализ
Материалом для кариологической работы послужили хромосомные препараты, приготовленные по методу воздушного высушивания (Kligerman, Bloom, 1977) с небольшими модификациями. Из-за небольших размеров изучаемых рыб (от 5 до 7 см) для приготовления суспензии клеток использовали всю почку. Гипотонический раствор подогревали до температуры 37°С. Время гипотонирования суспензии увеличили до 50 мин. Хромосомы окрашивали рутинно 4% раствором красителя Гимза (Giemsa), их качество анализировали под микроскопом, затем готовили серии препаратов для подробного анализа.
В метафазных пластинках выделяли хромосомы нескольких морфологических типов. Равноплечие метацентрические (М) хромосомы относили к двуплечим, субтелоцентрические (СТ) с очень коротким вторым плечом и акроцентрические (А) с невидимым вторым плечом – к одноплечим хромосомам.
РЕЗУЛЬТАТЫ
Молекулярно-генетический анализ
Полученные последовательности генов мтДНК депонированы в базе данных GenBank/NCBI под номерами, указанными в табл. 1. Секвенированные участки генов 16S рРНК, COI и цитохрома b длиной 613–614, 1009 и 841 пар нуклеотидов (пн) расположены в пределах 2009–2621, 5578–6586 и 14609–15350 пн согласно нумерации нуклеотидных позиций митохондриального генома Enophrys diceraus (GenBank KF039715).
В нуклеотидных последовательностях участка гена COI мтДНК изученных видов рода Porocottus (без учета внешних групп) обнаружено 130 филогенетически информативных сайтов (12.9%). Для гена цитохрома b установлено 113 информативных нуклеотидных позиций (13.4%). Фрагмент гена 16S рРНК характеризовался 19 информативными сайтами (3.1%).
В последовательностях мтДНК выявлены замены нуклеотидов, которые дифференцируют виды бахромчатых бычков. В последовательностях гена COI установлено 25, 24 и 50 таких специфических мутаций, гена цитохрома b – 15, 21 и 45, гена 16S рРНК – 2, 4 и 11 мутаций для P. minutus, P. japonicus и P. camtschaticus соответственно. В последовательности гена 16S рРНК P. japonicus обнаружена однонуклеотидная инсерция, отличающая этот вид не только от других бахромчатых бычков, но и от остальных представителей семейства Cottidae. Рассчитанные для объединенных последовательностей мтДНК р-дистанции приведены в табл. 2. Значения дивергенции между видами P. minutus и P. japonicus варьируют от 4.62 до 5.94 и в среднем составляют 5.25%. Виды P. minutus и P. camtschaticus различаются в среднем на 7.76% (с разбросом р-дистанций 7.32–8.27%). Представители P. japonicus и P. camtschaticus дифференцированы на 8.13% (с разбросом р-дистанций 7.47–8.99%).
Таблица 2.
Значения p-дистанций (%) по данным о нуклеотидных последовательностях генов COI, цитохрома b, 16S pРНК (ниже диагонали) и участка гена COI (выше диагонали)
| Вид (№ образца) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. Porocottus minutus (1930) | − | 1.20 | 1.00 | 1.00 | 1.20 | 0.20 | 7.37 | 7.37 | 7.37 | 7.37 | 7.41 | 7.41 | 9.78 | 9.58 | 9.62 | 9.16 | 11.35 | 11.75 | 13.75 | 11.16 | 14.20 | 13.15 |
| 2. P. minutus (1934) | 0.45 | − | 0.20 | 0.20 | 0.40 | 1.40 | 7.39 | 7.39 | 7.39 | 7.39 | 7.23 | 7.43 | 10.40 | 10.60 | 10.64 | 9.58 | 12.18 | 12.18 | 13.77 | 11.18 | 14.43 | 13.37 |
| 3. P. minutus (1936) | 0.65 | 0.45 | − | 0 | 0.20 | 1.20 | 7.17 | 7.17 | 7.17 | 7.17 | 7.01 | 7.21 | 10.18 | 10.38 | 10.42 | 9.36 | 11.95 | 12.35 | 13.55 | 10.96 | 14.20 | 13.15 |
| 4. P. minutus (1938) | 0.53 | 0.37 | 0.57 | − | 0.20 | 1.20 | 7.17 | 7.17 | 7.17 | 7.17 | 7.01 | 7.21 | 10.18 | 10.38 | 10.42 | 9.36 | 11.95 | 12.35 | 13.55 | 10.96 | 14.20 | 13.15 |
| 5. P. minutus (1939) | 0.49 | 0.29 | 0.41 | 0.37 | − | 1.39 | 6.97 | 6.97 | 6.97 | 6.97 | 6.81 | 7.01 | 9.98 | 10.58 | 10.62 | 9.16 | 11.75 | 12.15 | 13.35 | 10.76 | 14.40 | 12.95 |
| 6. P. minutus (1996) | 0.33 | 0.77 | 1.02 | 0.94 | 0.86 | − | 7.57 | 7.57 | 7.57 | 7.57 | 7.62 | 7.62 | 9.78 | 9.58 | 9.62 | 9.16 | 11.35 | 11.75 | 13.94 | 11.35 | 14.40 | 12.95 |
| 7. P. japonicus (1993) | 5.82 | 5.77 | 5.88 | 5.90 | 5.65 | 5.94 | − | 0 | 0 | 0 | 0 | 0 | 9.98 | 10.58 | 10.62 | 9.76 | 11.55 | 11.75 | 13.55 | 10.96 | 15.20 | 14.14 |
| 8. P. japonicus (1997) | 4.95 | 4.91 | 5.00 | 4.99 | 4.78 | 5.07 | 2.44 | − | 0 | 0 | 0 | 0 | 9.98 | 10.58 | 10.62 | 9.76 | 11.55 | 11.75 | 13.55 | 10.96 | 15.20 | 14.14 |
| 9. P. japonicus (1998) | 4.79 | 4.74 | 4.89 | 4.83 | 4.62 | 4.95 | 1.25 | 1.46 | − | 0 | 0 | 0 | 9.98 | 10.58 | 10.62 | 9.76 | 11.55 | 11.75 | 13.55 | 10.96 | 15.20 | 14.14 |
| 10. P. japonicus (2011) | 5.14 | 5.10 | 5.25 | 5.27 | 5.02 | 5.31 | 1.36 | 1.58 | 0.58 | − | 0 | 0 | 9.98 | 10.58 | 10.62 | 9.76 | 11.55 | 11.75 | 13.55 | 10.96 | 15.20 | 14.14 |
| 11. P. japonicus (2012) | 5.51 | 5.42 | 5.57 | 5.59 | 5.34 | 5.67 | 1.49 | 1.83 | 0.91 | 0.41 | − | 0 | 10.04 | 10.64 | 10.69 | 9.82 | 11.62 | 11.82 | 13.43 | 10.82 | 15.09 | 14.03 |
| 12. P. japonicus (2013) | 5.15 | 5.15 | 5.30 | 5.27 | 5.02 | 5.32 | 1.32 | 1.50 | 0.50 | 0.08 | 0.41 | − | 10.04 | 10.64 | 10.66 | 9.82 | 11.62 | 11.82 | 13.63 | 10.62 | 15.09 | 14.03 |
| 13. P. camtschaticus (1750) | 7.50 | 7.62 | 7.86 | 7.83 | 7.58 | 7.63 | 8.62 | 7.87 | 7.47 | 7.76 | 8.19 | 7.89 | − | 0.60 | 0.60 | 10.58 | 14.17 | 14.17 | 13.97 | 13.37 | 15.23 | 14.77 |
| 14. P. camtschaticus (1751) | 7.79 | 8.02 | 8.27 | 8.11 | 8.07 | 7.91 | 8.99 | 8.28 | 7.89 | 8.16 | 8.61 | 8.30 | 0.94 | − | 0 | 10.98 | 13.97 | 13.97 | 14.57 | 13.97 | 15.03 | 14.97 |
| 15. P. camtschaticus (1752) | 7.32 | 7.56 | 7.84 | 7.69 | 7.61 | 7.45 | 8.77 | 7.93 | 7.50 | 7.82 | 8.31 | 7.95 | 0.90 | 0.78 | − | 11.02 | 14.03 | 14.03 | 14.63 | 14.03 | 15.09 | 15.03 |
| 16. P. allisi (KY305170) | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | 11.16 | 11.55 | 12.55 | 12.75 | 16.00 | 14.94 |
| 17. P. leptosomus (KY305169) | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | 0.40 | 14.14 | 14.34 | 15.80 | 13.35 |
| 18. P. leptosomus (KY305156) | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | − | 14.34 | 14.54 | 16.20 | 13.55 |
| 19. Megalocottus platycephalus | 9.00 | 9.16 | 9.33 | 9.21 | 9.04 | 9.13 | 9.85 | 9.23 | 9.03 | 9.42 | 9.66 | 9.56 | 9.74 | 10.14 | 9.98 | − | − | − | − | 11.95 | 14.60 | 14.14 |
| 20. Enophrys diceraus | 9.98 | 10.06 | 10.15 | 10.18 | 9.93 | 10.03 | 10.55 | 10.39 | 9.98 | 10.44 | 10.72 | 10.50 | 10.55 | 11.25 | 10.96 | − | − | − | 9.20 | − | 13.00 | 14.34 |
| 21. Gymnocanthus pistilliger | 10.80 | 10.83 | 11.13 | 11.00 | 10.80 | 11.13 | 11.26 | 10.61 | 10.19 | 10.69 | 10.97 | 10.71 | 10.92 | 11.29 | 11.12 | − | − | − | 10.26 | 10.59 | − | 14.00 |
| 22. Alcichthys elongatus | 12.99 | 13.06 | 13.08 | 13.19 | 12.91 | 13.08 | 13.64 | 12.72 | 12.41 | 12.72 | 12.95 | 12.75 | 13.93 | 14.33 | 14.14 | − | − | − | 112.98 | 14.04 | 12.74 | − |
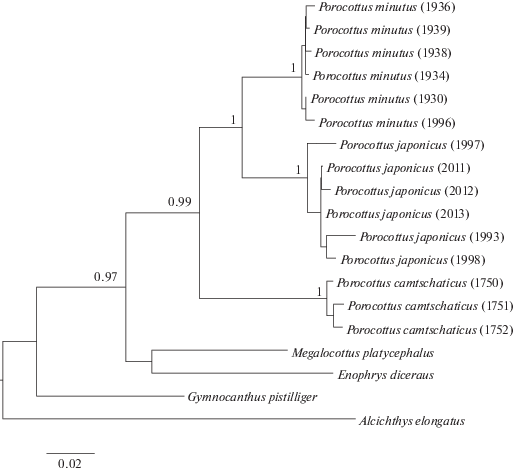
Построены два филогенетических дерева: по данным об объединенных последовательностях генов COI, цитохрома b, 16S рРНК мтДНК длиной 2463 пн (рис. 1) и по данным об участке гена COI длиной 582 пн с привлечением информации из GenBank (рис. 2). Положение в основании деревьев занимают ДНК-линии внешних групп: M. platycephalus, E. diceraus, G. pistilliger и A. elongatus. Типы мтДНК видов рода Porocottus формируют компактную группу, в которой P. camtschaticus, P. minutus и P. japonicus образуют собственные кластеры. В базальной части группы Porocottus находится ДНК-линия P. leptosomus (рис. 2). Основные оценки устойчивости основных узлов ветвления (РР ≥ 0.95) подтверждают достоверность ассоциаций типов ДНК видов рода Porocottus.
Кариологический анализ
Описание кариотипа P. japonicus (2 самки, 2 самца) составлено по результатам анализа 44 рутинно окрашенных метафазных пластинок. Кариотип рыб состоит из 42 хромосом (2n), число хромосомных плеч (NF) 42, включая 36 СТ и 6 А хромосом (рис. 3а). Изменчивость по числу хромосом не обнаружена, различия по 2n и NF между кариотипами самцов и самок не выявлены.
Рис. 3.
Кариограммы Porocottus japonicus: 2n = 42; NF = 42 (а); P. allisi и P. minutus: 2n = 40, NF = 42 (б, в). Условные обозначения: М – мета-, СТ – субтело-, А – акроцентрические хромосомы. Увеличение: 10 × 100.

Проанализированы 20 рутинно окрашенных метафазных пластинок самки P. allisi. Кариотип: 2n = 40, NF = 42, состоит из двух М, 32 СТ и шести А хромосом (рис. 3б).
Изучены 35 рутинно окрашенных метафазных пластинок P. minutus (2 самки, 1 самец и 1 неполовозрелая особь). Кариотип: 2n = 40, NF = 42, состоит из двух М, 32 СТ и шести А хромосом (рис. 3в). Изменчивость по числу хромосом не обнаружена, различия по 2n и NF между кариотипами самок и самца не выявлены.
В кариотипах видов установлены маркерные хромосомы, хорошо идентифицируемые во всех исследованных метафазных пластинках. У P. japonicus это три пары крупных СТ хромосом (рис. 3а: пары 1–3), у P. allisi – пары крупных М и СТ хромосом (рис. 3б: пары 1, 2), у P. minutus – одна пара мелких М и три пары крупных СТ хромосом (рис. 3в: пары 1–4).
ОБСУЖДЕНИЕ
Ареалы видов Porocottus japonicus, P. allisi, P. minutus и P. camtschaticus мозаичны и в сравнении с ареалом рода имеют небольшую протяженность (Неелов, 1979; Шейко, Федоров, 2000; Федоров и др., 2003; Соколовский и др., 2007). Биологические особенности бахромчатых бычков изучены крайне слабо. Имеющиеся в литературе данные свидетельствуют о различиях по глубине обитания, предпочитаемым биотопам и спектру питания (Соколовский и др., 2011; Парин и др., 2014; Савельев, Колпаков, 2016; Поезжалова-Чегодаева, 2017).
На основании морфологических признаков, строения сейсмосенсорной системы P. japonicus, P. allisi, P. camtschaticus и P. minutus включены в подрод Crossias (Неелов, 1976, 1979). Изученные виды имеют на голове одну или две пары мочек. Строение мочек специфично, что позволяет дифференцировать бахромчатых бычков (Неелов, 1979). Японский бахромчатый бычок имеет лишь одну пару заглазничных мочек, состоящих из небольшого мясистого кожного тела, от которого беспорядочно отходят небольшие и разные по длине усики. Затылочные мочки отсутствуют или представлены маленьким кожным придатком (Неелов, 1979; Савельев, Колпаков, 2016). Бахромчатый бычок Эллиса и охотоморский бахромчатый бычок имеют две пары хорошо развитых мочек. У P. allisi заглазничные мочки состоят из 5–6 длинных тонких усиков одинакового размера, затылочные – обычно из четырех усиков (Неелов, 1979; Линдберг, Красюкова, 1987). У P. minutus заглазничные мочки состоят из 2–8 усиков; меньшего размера затылочные – из 1–4 усиков (Неелов, 1979). Заглазничные мочки P. camtschaticus устроены иначе. Они состоят из 8–20 коротких усиков, сидящих на мясистом основании, и имеют вид петушиного гребня. Затылочные мочки образованы 1–4 короткими усиковидными придатками (Неелов, 1979).
Проведенный молекулярно-генетический анализ позволил обнаружить существенную изменчивость мтДНК и гетерогенность рода Porocottus. Установлено, что значения р-дистанций между видами изменяются в широких пределах – от 5.25% между P. minutus и P. japonicus до 8.13% между P. japonicus и P. camtschaticus. Полученные оценки дивергенции между P. camtschaticus и остальными видами высокие при сравнении в пределах одного рода; в некоторых случаях р-дистанции достигают почти 9%, приближаясь к уровню различий между близкими родами семейства Cottidae. Например, представители родов Porocottus и Megalocottus различаются в среднем на 9.43%, Porocottus и Enophrys – на 10.3%, Megalocottus и Enophrys – на 9.2% (табл. 2). Такая значительная генетическая дифференциация вида P. camtschaticus согласуется с его морфологическими отличиями – это единственный вид рода, имеющий на голове мощный гребень из многочисленных коротких усиков.
Несмотря на существенные различия, на филогенетическом дереве (рис. 1) кластеры изученных видов бахромчатых бычков образуют единую группу, в которой первым обособляется P. camtschaticus, а затем обособляется P. minutus вместе с P. japonicus. Достоверность полученных данных о монофилии этой группы, последовательности дифференциации мтДНК видов, более тесной филогенетической связи охотоморского и японского бахромчатых бычков подтверждается высокими оценками вероятности узлов ветвления.
У бахромчатых бычков выявлен внутривидовой полиморфизм мтДНК, который обусловлен различиями между экземплярами, добытыми в разных точках ареала видов. Самый низкий уровень различий обнаружен у P. minutus – 0.57% (варьирование – 0.29–1.02%). Внутривидовая дифференциация P. camtschaticus несколько выше и составляет 0.87 (0.87–0.94)%. Самая существенная изменчивость установлена для P. japonicus (среднее значение 1.14%); при этом максимально (на 1.6%) отличается экземпляр, пойманный в б. Джигит (северное Приморье), значительно удаленной от места вылова остальных представителей вида (зал. Чихачева, Татарский пролив). Этот вид, ранее известный только из северной части Татарского пролива и западного побережья о-ва Сахалин, недавно обнаружен в прибрежных водах северного Приморья (Савельев, Колпаков, 2016).
Для проведения сравнительного молекулярно-генетического анализа были использованы данные по нуклеотидным последовательностям участка гена COI мтДНК всех видов рода Porocottus, имеющиеся в GenBank (www.ncbi.nlm.nih.gov). Реконструированное филогенетическое дерево (рис. 2) свидетельствует, что P. allisi находится гораздо ближе к группе P. minutus – P. japonicus – P. camtschaticus (среднее значение р-дистанций составляет 9.78%, см. табл. 2), чем P. leptosomus (12.25%). Генетические отличия P. allisi и P. camtschaticus от P. minutus – P. japonicus имеют сходные значения – 9.54 и 10.27% соответственно.
Кариологический анализ P. minutus из двух точек ареала в Тауйской губе (зал. Одян и о-в Недоразумения), а также P. japonicus из б. Джигит (северное Приморье) и зал. Чихачева (Татарский пролив) показал, что их хромосомные наборы стабильны по числу хромосом.
На основании сравнительного анализа P. japonicus, P. allisi и P. minutus выявлены общие признаки, указывающие на их таксономическую близость. P. allisi и P. minutus сходны по числу (2n = 40) и морфологии хромосом (рис. 3б, 3в). Все изученные бахромчатые бычки имеют одинаковое число хромосомных плеч – 42. В кариотипах видов можно выделить сходные маркерные хромосомы. У P. allisi и P. minutus присутствует пара М хромосом (рис. 3б, 3в: пара 1). У японского и охотоморского бахромчатых бычков имеются крупные СТ хромосомы, размеры которых значительно превышают размеры всех остальных хромосом в их кариотипах (рис. 3а: пары 1–3; рис. 3в: пары 2–4). Крупные СТ хромосомы пары 3 у P. japonicus и пары 4 у P. minutus (рис. 3а, 3в) по размерам соответствуют крупным СТ хромосомам у P. allisi (рис. 3б: пара 2). У всех трех видов одинаковое количество А хромосом (рис. 3а: пары 19–21; рис. 3б, 3в: пары 18–20). Кариотипы P. japonicus, P. allisi и P. minutus содержат большое число одноплечих СТ и А хромосом (рис. 3).
Однако при общем сходстве в хромосомных наборах наблюдаются различия, которые, как и морфологические признаки, позволяют дифференцировать изученные виды бахромчатых бычков. М хромосомы P. allisi и P. minutus различаются по размерам (рис. 3б, 3в: пара 1). У бахромчатого бычка Эллиса они более крупные, чем все остальные хромосомы в его кариотипе. По сравнению с М хромосомами у P. allisi, у охотоморского бахромчатого бычка М хромосомы мелкие. У P. minutus М хромосомы по размерам соответствуют средним СТ хромосомам (рис. 3в: пара 1, пары 5–11).
Кариотип P. japonicus (2n = 42) отличается от такового у P. allisi и P. minutus (2n = 40) по числу и морфологии хромосом и представлен только одноплечими хромосомами (рис. 3). В хромосомном наборе P. japonicus содержится 18 пар СТ хромосом, у P. allisi и P. minutus на две пары СТ хромосом меньше – 16 пар (рис. 3а: пары 1–18; рис. 3б, 3в: пары 2–17). В кариотипе P. allisi отсутствуют две пары крупных СТ хромосом, маркерных для P. japonicus и P. minutus (рис. 3а: пары 1, 2; рис. 3в: пары 2, 3).
Общее сходство структуры хромосомных наборов и NF (42) у изученных бахромчатых бычков позволяет предположить, что М хромосомы у P. allisi и P. minutus образовались вследствие робертсоновских транслокаций, произошедших в ходе эволюции их кариотипов. Выявленные различия размеров маркерных М хромосом у P. allisi и P. minutus можно объяснить участием в их образовании разных одноплечих хромосом. Крупные М хромосомы P. allisi могли образоваться в результате центромерного слияния двух пар крупных СТ хромосом, а мелкие М хромосомы P. minutus – двух пар мелких или средних одноплечих хромосом. Проведенные кариологические исследования керчаковых рыб показали, что ведущее место среди структурных перестроек хромосом в этой группе занимают робертсоновские транслокации (Васильев, 1985; Морева и др., 2017). Они являются основным механизмом эволюционного изменения кариотипов у видов рода Myoxocephalus, приведшим к их существенным различиям (Морева, Борисенко, 2017).
Таким образом, в результате проведенного исследования установлены молекулярно-генетические и кариологические признаки, позволяющие проводить надежную идентификацию видов P. japonicus, P. allisi, P. minutus и P. camtschaticus. На основе молекулярно-генетического изучения обнаружена более тесная филогенетическая связь P. minutus с P. japonicus и выявлены существенные отличия P. camtschaticus от этих видов. Значительное сходство общей структуры кариотипов P. japonicus, P. allisi и P. minutus свидетельствует о их близком родстве. Обнаруженные различия видов соответствуют их дифференциации по морфологическим и биологическим признакам.
Работа выполнена при поддержке РФФИ (грант № 15-29-02416_офи_м) и Программы “Дальний Восток” (проект № 18-4-002).
Список литературы
Васильев В.П. Эволюционная кариология рыб. М.: Наука. 1985. 299 с.
Линдберг Г.У., Красюкова З.В. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Л.: Наука. 1987. Ч. 5. 522 с.
Морева И.Н., Борисенко С.А. Кариотип многоиглого керчака Myoxocephalus polyacanthocephalus (Pallas, 1814) (Pisces: Cottidae) из российской части ареала // Биол. моря. 2017. Т. 43. № 1. С. 64–69.
Морева И.Н., Радченко О.А., Петровская А.В. и др. Молекулярно-генетический и кариологический анализ двурогих бычков группы Enophrys diceraus (Cottidae) // Генетика. 2017. Т. 53. № 9. С. 1086–1097.
Неелов А.В. Обзор бахромчатых бычков рода Porocottus Gill и близких к нему родов (Cottidae, Myoxocephalinae). Л.: Зоогеография и систематика рыб. 1976. С. 78–112.
Неелов А.В. Сейсмосенсорная система и классификация керчаковых рыб (Cottidae: Myoxocephalinae, Artediellinae). Л.: Наука. 1979. 208 с.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. Рыбы морей России: аннотированный каталог. М.: Товарищество науч. изд. КМК. 2014. 733 с.
Поезжалова-Чегодаева Е.А. Морфологическая характеристика охотоморского бахромчатого бычка Porocottus minutus (Cottidae) из Тауйской губы Охотского моря // Чтения памяти академика К.В. Симакова: Материалы докл. Всероссийск. науч. конф. (Магадан, 22–24 ноября 2017 г.). Магадан: СВКНИИ ДВО РАН. 2017. 300 с.
Радченко О.А., Черешнев И.А., Петровская А.В. Родственные отношения и дивергенция некоторых таксонов рыб подсемейства Lycodinae (Zoarcidae, Pisces) по молекулярно-генетическим и морфологическим данным // Вопр. ихтиологии. 2009. Т. 49. № 5. С. 603–616.
Савельев П.А., Колпаков Е.В. Распространение и первые данные по биологии япономорского бахромчатого бычка Porocottus japonicus Schmidt, 1935 (Scorpaeniformes: Cottidae) в северо-западной части Японского моря // Биол. моря. 2016. Т. 42. № 1. С. 69–71.
Соколовский А.С., Дударев В.А., Соколовская Т.Г., Соломатов С.Ф. Рыбы российских вод Японского моря (аннотированный и иллюстрированный каталог). Владивосток: Дальнаука. 2007. 199 с.
Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. Рыбы залива Петра Великого. Владивосток: Дальнаука. 2011. 431 с.
Токранов А.М., Шейко Б.А. К познанию ихтиофауны прибрежных вод острова Старичков // Биота острова Старичков и прилегающей к нему акватории Авачинского залива / Тр. Камчат. фил. Тихоокеанского института географии ДВО РАН. Вып. VIII. Петропавловск-Камчатский: Камчатпресс. 2009. 350 с.
Федоров В.В., Черешнев И.А., Назаркин М.В. и др. Каталог морских и пресноводных рыб северной части Охотского моря. Владивосток: Дальнаука. 2003. 206 с.
Черешнев И.А., Волобуев В.В., Хованский И.Е. и др. Прибрежные рыбы северной части Охотского моря. Владивосток: Дальнаука. 2001. 197 с.
Шейко Б.А., Федоров В.В. Каталог позвоночных Камчатки и сопредельных морских акваторий. Петропавловск-Камчатский: Камчат. печат. двор. 2000. 166 с.
Fricke R., Eschmeyer W.N., R. van der Laan (eds). Catalog of fishes: genera, species, references. 2018. (http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp).
Kligerman A.D., Bloom S.E. Rapid chromosome preparations from solid tissues of fishes // J. Fish. Res. Board Can. 1977. V. 34. P. 266–269.
Leaché A.D., Reeder T.W. Molecular systematics of the eastern fence lizard (Sceloporus undulatus): a comparison of parsimony, likelihood, and Bayesian approaches // Syst. Biol. 2002. V. 51. № 1. P. 44–68.
Maniatis T., Fritsch E.F., Sambrook J. Molecular cloning: a laboratory manual. Cold Spring Harbor, N.Y.: Cold Spring Harbor Lab. 1982. 480 p.
Muto F., Choi Y., Yabe M. Porocottus leptosomus sp. nov., from the west coast of Korea, Yellow Sea (Scorpaeniformes: Cottidae) // Ichthyol. Res. 2002. V. 49. № 3. P. 229–233.
Posada D., Crandall K.A. Modeltest: testing the model of DNA substitution // Bioinformatics. 1998. V. 14. P. 817–818.
Ronquist F., Huelsenbeck J.P. MrBayes 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. P. 1572–1574.
Swofford D.L. PAUP*. Phylogenetic analysis using parsimony (*and other Methods). Version 4. Sunderland, Mass.: Sinauer Associates. 2002. 144 p.
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Yabe M. A New cottid species, Porocottus coronatus, from the Pacific coast of Hokkaido, Japan // Jpn. J. Ichthyol. 1992. V. 38. № 4. P. 361–365.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря