Биология моря, 2019, T. 45, № 3, стр. 197-207
Тканевый обмен и состояние антиоксидантного комплекса у черноморских моллюсков Mytilus galloprovincialis Lamarck, 1819 и Anadara kagoshimensis (Tokunaga, 1906) с разной устойчивостью к окислительному стрессу
О. Л. Гостюхина 1, *, Т. И. Андреенко 1, 2
1 Институт морских биологических исследований им. А.О. Ковалевского РАН
299011 Севастополь, Россия
2 Севастопольский государственный университет
299053 Севастополь, Россия
* E-mail: gostolga@yandex.ru
Поступила в редакцию 18.05.2018
После доработки 21.11.2018
Принята к публикации 29.11.2018
Аннотация
Определяли содержание аминокислот и глюкозы, активность аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), антиоксидантных ферментов супероксиддисмутазы (СОД), каталазы, глутатионпероксидазы (ГП) и глутатионредуктазы (ГР), а также уровень восстановленного глутатиона (GSH) и содержание продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-активных продуктов), в гепатопанкреасе, жабрах и ноге черноморских двустворчатых моллюсков с разной устойчивостью к окислительному стрессу: Mytilus galloprovincialis Lamarck, 1819 (Mytilidae) и Anadara kagoshimensis (Tokunaga, 1906) (Arcidae). Мидия, сравнительно устойчивая к гипоксии, характеризовалась более высоким содержанием глюкозы в гепатопанкреасе и ноге, свободных аминокислот в ноге, а также повышенной активностью АсАТ в жабрах. По сравнению с анадарой у мидии отмечена более высокая активность ГП и ГР в гепатопанкреасе, ГП в жабрах, а также СОД в гепатопанкреасе и ноге на фоне более высокого содержания ТБК-активных продуктов во всех исследованных тканях. У анадары, обладающей высокой устойчивостью к дефициту кислорода, напротив, выявлено высокое содержание аминокислот в гепатопанкреасе и жабрах. Ткани анадары характеризовались большей активностью ферментов АлАТ и АсАТ в ноге, а также фермента АлАТ в жабрах, что отражает более интенсивные процессы пере- и дезаминирования аминокислот, чем у мидии. На фоне существенно меньшего содержания ТБК-активных продуктов анадара отличалась повышенным ресурсом GSH и высокой активностью ГП в ноге, а также большой активностью СОД, каталазы, ГР и высоким уровнем GSH в жабрах. Выявленные антиоксидантные особенности отражают адаптации данных моллюсков к кислородному режиму обитания с учетом специфики их белково-углеводного метаболизма.
Морские двустворчатые моллюски относятся к организмам, наиболее устойчивым к дефициту кислорода в водной среде. Эти животные способны выживать и сохранять полноценный метаболизм при гипоксии/аноксии в течение многих суток благодаря сравнительно низкой чувствительности и высокой устойчивости к недостатку кислорода (De Zwaan et al., 1991, 2002; Livingstone, 1991, 2001; Фокина и др., 2011). Об этом свидетельствуют низкие величины сублетальной концентрации кислорода SLC50 (1.99 ± 0.16 мг О2/л) и высокие значения среднего летального времени LT50 (свыше 400 ч). Моллюски являются наиболее устойчивыми к аноксии среди беспозвоночных, большинство видов которых выживает без кислорода в течение лишь 5−10 сут (Vaquer-Sunyer, Duarte, 2008).
Среди двустворчатых моллюсков Азово-Черноморского бассейна привлекают внимание мидия Mytilus galloprovincialis Lamarck, 1819 − массовый эврибионтный вид, сравнительно устойчивый к гипоксии (Горомосова, Шапиро, 1984; Митилиды…, 1990), и анадара Anadara kagoshimensis (Tokunaga, 1906) – эвритермный и эвригалинный моллюск, содержащий гемоглобин (Broom, 1985; De Zwaan et al., 1991; Солдатов и др., 2010). Согласно результатам проведенного исследования, в условиях нормоксии интенсивность потребления кислорода у A. kagoshimensis в 6–7 раз меньше, чем у M. galloprovincialis (Солдатов и др., 2008). Это связано с разной устойчивостью данных видов к гипоксии/аноксии, что позволяет говорить об особенностях их тканевого белково-углеводного метаболизма.
Не менее важным адаптационным фактором в условиях недостатка кислорода может быть функционирование антиоксидантного (АО) комплекса двустворчатых моллюсков. Известно, что при избытке и недостатке кислорода в клетке высок риск возникновения и/или усиления окислительного стресса (Лукьянова и др., 2011). При этом увеличивается интенсивность образования активных форм кислорода (АФК), участвующих во многих метаболических процессах. Функционирование АФК связывают, в первую очередь, с окислением мембранных липидов, ряда ферментов, других белков и соединений, а также с повреждением ДНК и иных клеточных структур (Меньщикова, Зенков, 1993; Livingstone, 2001). В этих условиях ведущая роль в обезвреживании АФК и поддержании прооксидантно-антиоксидантного баланса в организме принадлежит антиоксидантному комплексу.
Большое количество исследований посвящено изучению АО комплекса и метаболизма двустворчатых моллюсков. Так, ранее были изучены особенности АО комплекса мидии, анадары и других видов в естественных условиях (Солдатов и др., 2010, 2014; Gostyukhina, Golovina, 2013; Бельчева и др., 2016), а также в условиях гипоксии/аноксии и реоксигенации (Истомина и др., 2010). Определены реакции АО комплекса мидии M. galloprovincialis на естественный и антропогенный окислительный стресс (Солдатов и др., 2014). Рассмотрены особенности взаимодействия ферментного и низкомолекулярного звеньев АО системы анадары A. kagoshimensis (см.: Гостюхина, Андреенко, 2015), взаимосвязь ферментов АО защиты с качественным и количественным составом каротиноидов этого моллюска (Gostyukhina et al., 2013; Soldatov et al., 2017). Выявлены особенности белково-углеводного обмена анадары, а также его перестройка при аноксии и голодании (Андреенко и др., 2009). Ряд исследований посвящен реакциям АО системы разных видов моллюсков на совместное действие гипоксии и загрязнения, а также на другие воздействия (Regoli, Principato, 1995; Doyotte et al., 1997; Livingstone, 2001; Истомина и др., 2010; Бельчева и др., 2016; Taylor et al., 2017). В сравнительном аспекте изучены особенности анаэробного и аэробного обмена у мидии M. galloprovincialis и анадары A. kagoshimensis, взаимосвязь путей обмена с энергетическим статусом моллюсков при гипоксии в условиях эвтрофикации вод в Адриатике (De Zwaan et al., 1991). Установлена специфическая активность некоторых ферментов гликолиза и белкового обмена в эритроцитах A. kagoshimensis по сравнению с мышечной тканью ноги; выявлена роль ферментов в регуляции цитоплазматического редокс-баланса (De Zwaan et al., 1991).
В то же время недостаточно внимания уделено изучению взаимосвязи АО комплекса с белковым и углеводным обменом в тканях моллюсков. Особую актуальность представляет исследование особенностей АО комплекса мидии и анадары, характеризующихся разной устойчивостью к гипоксии/аноксии, на фоне специфики их белково-углеводного метаболизма. В этом заключается цель настоящего исследования.
МАТЕРИАЛ И МЕТОДИКА
Половозрелых особей мидии Mytilus galloprovincialis (семейство Mytilidae, черная морфа) и анадары Anadara kagoshimensis (семейство Arcidae) одного срока оседания собирали одновременно в марте 2014 г. с коллекторных установок мидийно-устричной фермы в прибрежье Голубого залива (Южный берег Крыма). Моллюсков обоих видов выращивали из спата на глубине 4.5−7.0 м. Анадару содержали в устричных садках, мидию – в сетных рукавах. Таким образом, моллюски длительное время обитали в одинаковых условиях: при одних и тех же значениях температуры и солености, а также световом и пищевом режимах. Длина раковины мидии составляла 52–55 мм, анадары − 31–33 мм. После транспортировки животных помещали в аквариумы с проточной морской водой на 2–3 сут для снятия стресса. Температура воды в аквариумах составляла 8.0 ± 1.0°C и соответствовала температуре воды в море в указанный период; соленость воды составляла 17−18‰; фотопериод – 12 ч день : 12 ч ночь.
Ткани моллюсков (гепатопанкреас, жабры, ногу) препарировали, упаковывали в пищевую фольгу и хранили в морозильной камере при температуре не выше −25.0°С. Затем ткани гомогенизировали с использованием ледяной бани при температуре 0−4°С. Для приготовления супернатантов гомогенаты центрифугировали при 3200 g в течение 15 мин с помощью рефрижераторной центрифуги К-23D (Германия).
Содержание свободного аминного азота (аминокислот) определяли по цветной реакции с нингидрином (Колб, Камышников, 1976), оптическую плотность измеряли при длине волны 536 нм. Количество свободного аминного азота выражали в микрограммах на 1 мг ткани. Концентрацию белка определяли по методу Лоури.
Активность аминотрансфераз − аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) − определяли унифицированным динитрофенилгидразиновым методом Райтмана−Френкеля (Меньшиков, 1987). Активность обоих ферментов выражали в микромолях в минуту на 1 мг белка. Содержание глюкозы в тканях моллюсков определяли при помощи глюкозоксидазного метода (Меньшиков, 1987) и выражали в наномолях на 1 мг ткани.
Из показателей АО комплекса оценивали активность следующих ферментов: глутатионпероксидазы (ГП) – по накоплению окисленного глутатиона при длине волны 260 нм, глутатионредуктазы (ГР) – по убыли НАДФН при длине волны 340 нм, супероксиддисмутазы (СОД) – по степени ингибирования восстановления нитросинего тетразолия (НСТ) в присутствии НАДН и феназинметасульфата (ФМС) при длине волны 540 нм (Переслегина, 1989). Активность каталазы определяли по реакции пероксида водорода с молибдатом аммония, экстинкцию измеряли при длине волны 410 нм (Гирин, 1999). Температуру инкубационной среды при определении активности ферментов поддерживали на уровне 25.0 ± 0.5°С. Активность ГП выражали в микромолях (мкмоль) окисленного глутатиона (GSSG) в минуту на 1 мг белка, ГР – в мкмоль НАДФН в минуту на 1 мг белка, СОД – в мкмоль НАДН в минуту на 1 мг белка, каталазы – в мкмоль пероксида водорода в минуту на 1 мг белка.
Для оценки количества восстановленного глутатиона (GSH) гомогенат готовили отдельно, используя 5% метафосфорную кислоту. Проводили реакцию с аллоксановым реактивом (Путилина, 1982). Концентрацию GSH выражали в микрограммах на 1 г ткани.
Содержание продуктов перекисного окисления липидов (ПОЛ) определяли по накоплению продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-активных продуктов). Экстинкцию продукта реакции измеряли при длине волны 532 нм и выражали в микромолях малонового диальдегида (МДА) на 1 г ткани (Ohkawa et al., 1979).
Цифровой материал обработан статистически с использованием стандартных пакетов компьютерных программ. Количество моллюсков в выборке составляло от 10 до 20 особей. Рассчитывали среднее арифметическое ($\bar {x}$), среднее квадратичное отклонение (σ) и ошибку средней ($S\bar {x}$). Для оценки достоверности полученных различий рассчитывали U-критерий Манна−Уитни. Различия считали статистически достоверными при значении р ≤ 0.05–0.01. Результаты на рисунках представлены как среднее ± ошибка среднего.
РЕЗУЛЬТАТЫ
Наиболее высокое содержание ТБК-активных продуктов выявлено у мидии: во всех исследованных тканях оно было в 2.1–3.4 раза выше (p ≤ 0.01), чем у анадары (рис. 1а). Содержание GSH в жабрах и ноге анадары было соответственно в 3.2 (p ≤ 0.05) и 2.4 раза (p ≤ 0.01) выше, чем у мидии (рис. 1б). Существенно выше у мидии была активность ГП: в гепатопанкреасе и жабрах эти значения в 2.0 и 2.9 раза превышали соответствующие показатели у анадары (p ≤ 0.01). В ноге, напротив, активность ГП у анадары была в 1.8 раза выше, чем у мидии (p ≤ 0.01) (рис. 2а). Активность ГР различалась не так однозначно: в гепатопанкреасе она была в 1.8 раза выше у мидии (p ≤ 0.01), а в жабрах в 1.65 раза выше у анадары (p ≤ 0.05). В ноге моллюсков достоверных различий по этому показателю не выявлено (рис. 2б). Активность каталазы и СОД в жабрах анадары была соответственно в 1.8 и 2.3 раза выше (p ≤ 0.01), чем в жабрах мидии (рис. 3а, 3б). В гепатопанкреасе и ноге, напротив, активность СОД была выше у мидии в 1.8 (p ≤ 0.05) и 1.9 раза (p ≤ 0.01) соответственно (рис. 3б).
Рис. 1.
Содержание ТБК-активных продуктов (а) и восстановленного глутатиона − GSH (б) в тканях мидии и анадары. 1 – гепатопанкреас, 2 – жабры, 3 – нога; различия достоверны при *p ≤ 0.05, **p ≤ 0.01; n = 10–20.
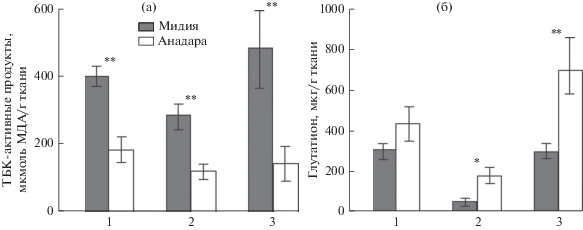
Рис. 2.
Активность глутатионпероксидазы (ГП) (а) и глутатионредуктазы (ГР) (б) в тканях мидии и анадары. 1 – гепатопанкреас, 2 – жабры, 3 – нога; различия достоверны при *p ≤ 0.05, **p ≤ 0.01; n = 10–20.

Рис 3.
Активность каталазы (а) и СОД (б) в тканях мидии и анадары. 1 – гепатопанкреас, 2 – жабры, 3 – нога; различия достоверны при *p ≤ 0.05, **p ≤ 0.01; n = 10–20.

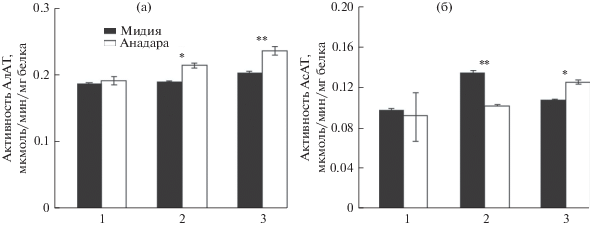
Большинство показателей белкового обмена у анадары были выше таковых у мидии. Активность АлАТ была выше у анадары в жабрах и ноге на 13–16% (p ≤ 0.01), а АсАТ в ноге на 16.7% (p ≤ 0.01) (рис. 4а, 4б). Мидия характеризовалась повышенной на 32.5% по сравнению с таковой у анадары активностью АсАТ в жабрах (p ≤ 0.01) (рис. 4б). Активность этих ферментов в гепатопанкреасе моллюсков достоверно не различалась.
Рис 4.
Активность аланинаминотрансферазы (АлАТ) (а) и аспартатаминотрансферазы (АсАТ) (б) в тканях мидии и анадары. 1 – гепатопанкреас, 2 – жабры, 3 – нога; различия достоверны при *p ≤ 0.05, **p ≤ 0.01; n = 10–20.
Содержание аминокислот у анадары было в 2.7–5.3 раза (p ≤ 0.01) выше в гепатопанкреасе и жабрах; в ноге мидии этот показатель был в 1.7 раза выше, чем у анадары (p ≤ 0.01) (рис. 5а).
Рис. 5.
Содержание аминокислот (а) и глюкозы (б) в тканях мидии и анадары. 1 – гепатопанкреас, 2 – жабры, 3 – нога; различия достоверны при **p ≤ 0.01; n = 10–20.
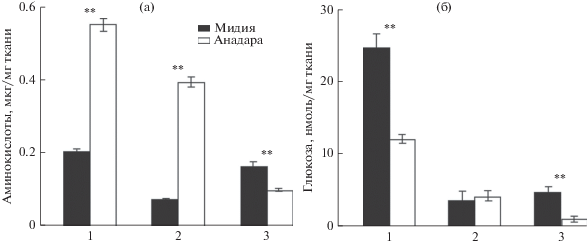
Содержание глюкозы в гепатопанкреасе и ноге мидии в 2.0–4.7 раза превышало значения, полученные для анадары (p ≤ 0.01); в жабрах достоверных различий не выявлено (рис. 5б).
ОБСУЖДЕНИЕ
Анадара и мидия – типичные обитатели донных биоценозов, где нередко возникает дефицит кислорода из-за недостаточно интенсивного перемешивания воды и накопления органических соединений в осадках и придонном слое (Митилиды…, 1990; Ревков, Щербань, 2017). Разная устойчивость мидии и анадары к гипоксии и другим неблагоприятным факторам связана, в первую очередь, с видовыми физиолого-экологическими особенностями этих животных. Так, результаты изучения интенсивности потребления кислорода (Солдатов и др., 2010) показали, что у исследованных видов моллюсков с одинаковой массой мягких тканей в условиях нормоксии (насыщение воды кислородом 95–97%) и при температуре 17–20°С она существенно различалась: у анадары интенсивность потребления кислорода была в 7 раз ниже, чем у мидии. Таким образом, даже в условиях внешней нормоксии в тканях анадары активно протекают анаэробные процессы, а потребление кислорода невелико. Это позволяет говорить о различиях в организации тканевого метаболизма и в состоянии антиоксидантного комплекса у данных видов.
Адаптации двустворчатых моллюсков к дефициту кислорода включают ряд метаболических процессов (Хочачка, Сомеро, 1988; Фокина и др., 2011): снижение интенсивности метаболизма в тканях; использование наиболее эффективных процессов анаэробного ресинтеза макроэргов; удаление токсических продуктов метаболизма; создание повышенных ресурсов энергетических субстратов в тканях (гликогена, аминокислот); увеличение буферной емкости жидких сред организма, предотвращающей изменение величины рН; переход с аэробного на анаэробный обмен. Несмотря на явное снижение количества образуемой АТФ, анаэробные пути позволяют обеспечить эффективное энергосбережение в условиях гипоксии/аноксии. В свою очередь, анаэробный обмен может протекать с участием разных исходных и конечных продуктов в зависимости от ткани и вида животного, в первую очередь, с участием белковых и углеводных субстратов (Фокина и др., 2011). Эти процессы способствуют поддержанию нормального функционирования организма при дефиците кислорода и позволяют ему выживать в течение длительного времени.
Белково-углеводный обмен
Формирование долгосрочной адаптации к гипоксии сопровождается рядом процессов в клетке, в том числе усилением гликолиза и транспорта глюкозы через гистогематические барьеры (Лукьянова и др., 2011). По нашим данным в тканях анадары содержание глюкозы было ниже, а по опубликованным данным (Солдатов и др., 2010) содержание лактата и пирувата, а также активность лактатдегидрогеназы и малатдегидрогеназы были выше, чем у мидии. Соотношение указанных показателей говорит о более интенсивных процессах гликолиза у анадары, которые протекают с использованием глюкозы и с образованием лактата. Однако чрезмерное накопление лактата в тканях, как известно, ведет к развитию ацидоза и нарушению метаболических процессов в организме (Горомосова, Шапиро, 1984). Предполагается, что поступление лактата должно сопровождаться его дальнейшими метаболическими превращениями (Солдатов и др., 2010), среди которых можно выделить два основных пути. В первую очередь отметим преобразование лактата в связи с превращениями аминокислот. По нашим данным гепатопанкреас и жабры анадары, для которых ранее была показана преимущественно анаэробная ориентация обмена (Солдатов и др., 2008, 2010), отличались более высоким уровнем аминокислот по сравнению с таковым у мидии. Это может быть связано с переходом анадары к более экономному энергообеспечению клеток в условиях дефицита кислорода, в том числе и с вовлечением аминокислот (аспартата, глутамата). Об этом свидетельствуют как наши, так и опубликованные данные. Показано, что ткани анадары отличаются высоким уровнем белкового катаболизма (Солдатов и др., 2008). Усиление этого процесса при гипоксии отмечено и у других гидробионтов (Shulman, 2002). Высвобождающиеся аминокислоты, в частности глутамат, в дальнейшем могут использоваться в реакциях обеспечения клеток энергией (Waarde, 1988). В ходе сукцинаттиокиназной реакции глутамат сопрягается с пируватом при участии АлАТ (Mommsen et al., 1980), активность которой в жабрах и ноге у анадары была выше, чем у мидии. В результате образуются аланин и α-кетоглутарат, что уменьшает накопление токсичного лактата, а затем α-кетоглутарат преобразуется в сукцинат с образованием энергетических эквивалентов в виде ГТФ и НАДН2 (Waarde, 1988; Солдатов и др., 2010): пируват + глутамат ↔ аланин + α-кетоглутарат; α-кетоглутарат + НАД+ ↔ сукцинил-КоА + НАДН2; сукцинил-КоА + ГДФ ↔ сукцинат + ГТФ.
Кроме этого, в данные процессы может быть вовлечен аспартат, участвующий в фумаратредуктазной реакции, в ходе которой аспартат превращается в оксалоацетат под действием АсАТ, а затем восстанавливается до малата. В результате высвобождается глутамат, используемый в указанной выше сукцинаттиокиназной реакции (Хочачка, Сомеро, 1988): аспартат + α-кетоглутарат ↔ ↔ оксалоацетат + глутамат. Поступающий в митохондрии малат превращается в фумарат и восстанавливается до сукцината. При этом клетка получает одну молекулу АТФ. В нашей работе отмечена бóльшая активность АсАТ в ноге анадары по сравнению с таковой у мидии. Рост активности этого фермента отмечали также в тканях анадары в условиях экспериментальной аноксии (Андреенко и др., 2009). О высокой вероятности реализации данного пути у анадары при гипоксии может говорить и большой резерв свободного L- и D-аспартата, что характерно для тканей анадары, которые в условиях гипоксии вовлекаются в указанные реакции (Livingstone, 1991). Интересно отметить, что эти процессы протекают у анадары в условиях внешней нормоксии, что было впервые показано в работах Солдатова с соавторами (2008, 2010).
Другим важным механизмом превращения лактата может служить глюкозо-лактатный цикл (цикл Кори), в ходе которого лактат, поступающий из эритроцитов и мышц, преобразуется в печени в пируват, а затем в глюкозу, после чего вновь поступает в кровь и мышцы или утилизируется в печени (Северин и др., 2008). Как известно, в условиях развивающейся гипоксии (при усиленной мышечной работе или при ряде патологий) в клетке активируются анаэробные процессы, в которые вовлекаются “аварийные” механизмы синтеза энергетических субстратов, в первую очередь глюкозы (Северин и др., 2008; Усенко и др., 2013). Наиболее важными субстратами глюконеогенеза при дефиците кислорода выступают лактат (в цикле Кори) и аминокислоты мышечной ткани, подвергающиеся катаболизму (Moon, 1988; Sivaramakrishna, Radhakrishnaiah, 1997). Более низкое, чем у мидии, содержание аминокислот и глюкозы в ноге, а также глюкозы в гепатопанкреасе анадары, но более высокий, чем у мидии, уровень аминокислот в гепатопанкреасе и жабрах анадары, возможно, связаны с описанными процессами. Очевидно, часть пула аминокислот из мышечной ткани анадары используется в гепатопанкреасе для повышения уровня глюкозы, что, вероятно, служит дополнительным источником энергии для этого моллюска, более устойчивого к дефициту кислорода, чем мидия. При этом у мидии, напротив, уровень аминокислот в гепатопанкреасе ниже, а глюкозы выше, чем у анадары. Следовательно, потребность в пополнении запасов глюкозы у мидии ниже, чем у анадары, и интенсивность процессов, направленных на поддержание уровня глюкозы с использованием аминокислот, в тканях мидии также меньше. Данный механизм особенно важен для организма анадары, так как позволяет пополнять запасы глюкозы и энергетических эквивалентов, необходимых для ряда клеток и тканей моллюска, в том числе для эритроцитов, в которых молочная кислота образуется постоянно в силу того, что анаэробный гликолиз является единственным способом образования энергии в этих клетках (Северин и др., 2008); для мышечной ткани ноги, которую, в отличие от мидии, анадара использует для перемещения по грунту и закапывания в субстрат (Олифиренко, 2007). Поддержание уровня глюкозы и энергетических эквивалентов с участием лактата и аминокислот более важно для анадары и потому, что у этого моллюска анаэробные процессы в тканях активно протекают даже в условиях внешней нормоксии (Солдатов и др., 2010).
Указанные процессы в целом имеют общую метаболическую основу у наземных и водных животных (Moon, 1988; Sivaramakrishna, Radhakrishnaiah, 1997; Mota-Rojas et al., 2011; Усенко и др., 2013). Однако отмечены и специфические особенности. В частности, при ряде патологий человека (Усенко и др., 2013) возникающий дефицит кислорода в тканях сопровождается ростом соотношения лактат/пируват более чем в 45 раз, падением скорости утилизации глюкозы, а также развитием метаболического ацидоза из-за избыточного накопления лактата. Напротив, у моллюсков в условиях экспериментальной аноксии на примере анадары установлено, что содержание глюкозы уменьшалось только в гепатопанкреасе, но не в жабрах и ноге, а концентрация лактата не изменялась ни в одной из данных тканей (Андреенко и др., 2009). В этой связи авторы считают, что в организме анадары при аноксии не накапливается излишнее количество лактата, а гликолитические процессы переключаются на образование менее токсичных метаболитов (сукцинаттиокиназная и фумаратредуктазная реакции, описанные выше). Все это позволяет анадаре получать дополнительный ресурс макроэргических соединений при гипоксии/аноксии и эффективно адаптировать свой метаболизм к экстремальному дефициту кислорода.
Следовательно, у наземных видов, живущих в аэробных условиях, включение описанных резервных метаболических путей может быть не так эффективно, как у моллюсков, чаще испытывающих состояние гипоксии и аноксии и выработавших ряд адаптивных механизмов. В этой связи роль таких метаболитов, как лактат, глюкоза, аминокислоты, и их взаимные превращения имеют особое значение для поддержания энергетических процессов в тканях моллюсков и для формирования адаптационных реакций при частом возникновении гипоксических условий обитания.
Антиоксидантный комплекс
Обращает на себя внимание соотношение направленности белково-углеводного энергетического метаболизма и соответствующего АО профиля в тканях анадары и мидии. Как показали результаты наших предыдущих исследований, особенности АО комплекса этих моллюсков в природных условиях различаются (Gostyukhina, 2013; Gostyukhina, Golovina, 2013). Все исследованные ткани мидии отличались значительно более высоким уровнем перекисных процессов, чем ткани анадары, на что указывает повышенное содержание ТБК-активных продуктов.
Гепатопанкреас. На этом фоне в гепатопанкреасе мидии наблюдалась более высокая активность АО ферментов ГП и СОД, а активность каталазы и уровень GSH имели значения, близкие к таковым у анадары. Как известно, ГП и СОД – ферменты разного сродства к субстратам: СОД дисмутирует супероксидный радикал (СОАР), ГП утилизирует низкие концентрации пероксида водорода и гидроперекисей липидов (Меньщикова, Зенков, 1993; Меньщикова и др., 2006). Очевидно, указанные АО процессы более интенсивно протекают в гепатопанкреасе мидии. Оба фермента (ГП и СОД) относят к индуцибельным (Меньщикова, Зенков, 1993); их активация происходит под действием усиления синтеза АФК и нарастания в клетке окислительного стресса. Эти ферменты, вероятно, в наибольшей степени обеспечивают защиту от АФК в пищеварительной железе мидии.
Более низкая активность ГП и СОД в гепатопанкреасе анадары, очевидно, связана с анаэробной направленностью метаболизма в данном органе (Солдатов и др., 2010). Такой АО профиль согласуется с более низким, чем у мидии, содержанием продуктов ПОЛ в гепатопанкреасе анадары. Предполагается, что в условиях анаэробного обмена при пониженном напряжении кислорода в среде не происходит усиления генерации АФК и перекисных продуктов, которое приводило бы к дополнительной активации АО комплекса. В данных условиях его активности, вероятно, достаточно для поддержания окислительного равновесия в гепатопанкреасе анадары.
Жабры. В этом органе у анадары наблюдалось более выраженное, чем у мидии, преобладание АО компонентов, среди которых выявлены системы и высокого (глутатион, ГР), и низкого сродства к субстрату (СОД, каталаза). Очевидно, в жаберной ткани анадары происходит утилизация АФК как в высоких, так и в низких концентрациях. Это согласуется и с более низким, чем у мидии, уровнем ТБК-активных продуктов в жаберной ткани анадары. Если принять во внимание анаэробную направленность метаболизма, реализуемую в условиях гипоксии в донных местообитаниях и даже внешней нормоксии (Солдатов и др., 2008, 2010), то в жабрах анадары возможны следующие процессы: в условиях дефицита кислорода интенсивность ПОЛ невелика, а АО активность превентивно высокая (Фокина и др., 2011; Солдатов и др., 2014); как известно, гипоксия, напротив, способна стимулировать продукцию АФК (Лукьянова и др., 2011), что, в свою очередь, может привести к активации АО ферментов путем усиления экспрессии соответствующих генов по принципу обратной связи и к формированию адаптивного ответа (Меньщикова, Зенков, 1993; Меньщикова и др., 2006). Так, установлено, что при увеличении в клетке концентрации пероксида водорода увеличивается активность СОД (Меньщикова, Зенков, 1993). Описан также эффект тесной кооперации этих ферментов, совместно действующих в каскаде реакций по утилизации пероксида водорода и СОАР (Меньщикова и др., 2006; Вашанов, Каверин, 2009). Как показано на млекопитающих (Вашанов, Каверин, 2009), корреляционный анализ на основе расчета коэффициента Пирсона (r) выявил достоверную прямую зависимость между активностью СОД и каталазы (r = 0.090), последовательно инактивирующих СОАР и пероксид водорода. Одновременная активация обоих ферментов сдерживает чрезмерный рост указанных видов АФК и препятствует развитию окислительного стресса, а также ингибированию самих ферментов. Возможно, с этим связано одновременное преобладание активности обоих ферментов в жабрах анадары по сравнению с таковой у мидии.
Нога. Более высокая активность СОД в ноге мидии, очевидно, обусловлена более интенсивной инактивацией СОАР; в ноге анадары отмечена утилизация низких концентраций перекисей липидов и других АФК с участием глутатионовой системы. Это согласуется с повышенным содержанием ТБК-активных продуктов в данном органе мидии и указывает на более напряженную работу АО комплекса в ноге мидии, чем анадары. В ряде работ выявлены разные реакции глутатионовой системы при окислительном стрессе у моллюсков. Так, у Anadara granosa при действии тяжелых металлов обнаружено повышение уровня глутатиона на фоне снижения активности ГР (Patel et al., 1990). У моллюска Unio tumidus, напротив, под влиянием тяжелых металлов отмечено снижение активности ГР и уровня GSH (Doyotte et al., 1997).
Если учесть аэробную направленность обмена в ноге анадары (Солдатов и др., 2010), то, судя по реакциям АО комплекса, такой тип обмена, очевидно, не способствовал усилению окислительной нагрузки в этом органе, так как в АО реакциях задействован только глутатионовый комплекс – система высокого сродства к субстрату, утилизирующая АФК и продукты ПОЛ преимущественно в низких концентрациях. Однако ГП относится к индуцибельным ферментам (Меньщикова, Зенков, 1993), а значит, к ее высокой активности могло привести некоторое усиление ПОЛ. Последнее может быть обусловлено высоким содержанием каротиноидов в ноге анадары, которое в 6 раз выше, чем у мидии (Gostyukhina et al., 2013). Функция этих соединений может быть двоякой. Так, депонируя кислород в системе двойных связей, каротиноиды способствуют повышению уровня кислорода в ноге, с этим отчасти может быть связана аэробная направленность метаболизма в данном органе (Солдатов и др., 2008, 2010). В то же время некоторые каротиноиды обладают АО действием и могут включаться в процессы АО защиты наряду с другими антиоксидантами. Как показано нами ранее, в ноге анадары выявлена положительная связь между содержанием каротиноидов и глутатиона (R2 = 0.922), а также обратная зависимость между содержанием каротиноидов и активностью ГП (Гостюхина и др., 2012; Gostyukhina et al., 2013). Предполагается, что каротиноиды обладают более высоким сродством к АФК, чем глутатион, и эффективно нейтрализуют их, конкурируя с глутатионом. В повышенных концентрациях каротиноиды могут оказывать прооксидантное действие, вызывая в том числе генерацию Н2О2 и гидроперекисей, что может способствовать активации ГП как индуцибельного фермента (Soldatov et al., 2017).
Описанные особенности АО комплекса, с одной стороны, можно расценивать как несоответствующие выявленному нами уровню ТБК-активных продуктов в тканях анадары и мидии. Наиболее высокие значения АО показателей отмечены в жабрах анадары, где, по-видимому, преобладает анаэробный обмен (Солдатов и др., 2010). При подобном анаэробном обмене в гепатопанкреасе анадары не выявлено высоких значений исследованных АО показателей по сравнению с таковыми у мидии. Напротив, в ноге анадары в условиях аэробного обмена отмечена наименее выраженная АО активность. С другой стороны, особенности АО комплекса могут быть вызваны развитием и/или усилением окислительного стресса, который, как известно, может быть индуцирован дефицитом кислорода (Лукьянова и др., 2011), что могло происходить в жабрах анадары в условиях анаэробного обмена при гипоксических условиях обитания.
Как известно, при дефиците кислорода наблюдается ряд эффектов, неблагоприятных как для энергетики тканей, так и для окислительно-восстановительного баланса в клетке (Меньщикова, Зенков, 1993; Лукьянова и др., 2011): усиление восстановления кислорода по одноэлектронному пути с образованием АФК; разобщение окислительного фосфорилирования и дыхания; активация ряда ферментов (ксантиноксидазы, гидролаз, фосфолипаз) и накопление метаболитов (НАДН, НАДФН и др.), способствующих росту продукции АФК в клетке; усиление окислительного стресса вследствие увеличения уровня АФК и одновременно неспособности клеточных систем эффективно противостоять этому при реоксигенации – так называемый синдром реперфузии (Лукьянова и др., 2011). Подобный эффект отмечен и в тканях моллюсков: в условиях аноксии и последующей реоксигенации (72 ч) в пищеварительной железе анадары наблюдалось полное восстановление АО потенциала, тогда как в жабрах – только частичное (Истомина и др., 2010). Это указывает на более высокую чувствительность жабр к окислительной нагрузке. Действительно, в нашем исследовании у анадары, имеющей повышенную устойчивость к гипоксии, более высокие значения АО параметров, чем у мидии, зарегистрированы именно в жабрах. Такой АО профиль согласуется со стратегией предварительной подготовки АО комплекса устойчивых к гипоксии/аноксии организмов к усилению окислительного стресса (Larade, Storey, 2002; Фокина и др., 2011). В нашем исследовании, вероятно, наблюдается стратегия превентивного наращивания мощности АО комплекса (в наибольшей степени в жабрах анадары) со стороны как ферментного, так и низкомолекулярного звена (СОД, каталаза, ГР, GSH). У мидии такая стратегия, возможно, осуществляется в гепатопанкреасе, но в меньшей степени (отмечена повышенная активность лишь ферментов ГП и СОД).
Таким образом, мидия, сравнительно устойчивая к гипоксии, отличалась более высоким содержанием глюкозы в гепатопанкреасе и ноге, свободных аминокислот в ноге, а также повышенной активностью АсАТ в жабрах. У анадары, обладающей высокой устойчивостью к дефициту кислорода, напротив, наблюдали высокое содержание аминокислот в жабрах и гепатопанкреасе. Анадара характеризовалась более высокой активностью АлАТ в ноге и жабрах, а АсАТ – в ноге, что отражает более интенсивные процессы пере- и дезаминирования аминокислот, чем у мидии. Все исследованные ткани мидии отличались более высоким содержанием ТБК-активных продуктов, что сопровождалось повышенной активностью ГП и ГР в гепатопанкреасе, ГП в жабрах, а также СОД в гепатопанкреасе и ноге моллюска. На фоне существенно меньшей, чем у мидии, интенсивности процессов ПОЛ анадара характеризовалась повышенными ресурсом GSH и активностью ГП в ноге, а также большей активностью СОД, каталазы, ГР и высоким уровнем GSH в жабрах.
Состояние АО комплекса мидии отражает высокую чувствительность тканей этого моллюска к окислительной нагрузке, в первую очередь, гепатопанкреаса и ноги. Особенности АО комплекса анадары, напротив, подтверждают ее статус более устойчивого к гипоксии организма. Об этом свидетельствует меньшее, чем у мидии, количество ТБК-активных продуктов во всех тканях анадары на фоне более высоких уровня глутатиона и активности ряда АО ферментов. Наиболее высокие значения АО показателей выявлены в жабрах анадары, где наблюдали повышенную активность как ферментного (СОД, каталаза, ГР), так и низкомолекулярного (GSH) АО звена. Состояние антиоксидантной системы мидии и анадары, имеющих разную устойчивость к гипоксии и аноксии, отражает адаптации этих моллюсков к условиям обитания на фоне специфических особенностей белково-углеводного метаболизма их тканей.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа подготовлена по теме государственного задания ФГБУН ИМБИ “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом”; номер гос. регистрации АААА-А18-118021490093-4 от 14/02/2018.
Список литературы
Андреенко Т.И., Солдатов А.А., Головина И.В. Адаптивная реорганизация метаболизма двустворчатого моллюска Anadara inaequivalvis Br. в условиях экспериментальной аноксии // Докл. НАН Украины. 2009. № 7. С. 155–159.
Бельчева Н.Н., Довженко Н.В., Истомина А.А. Антиоксидантная система мидии Грэя Crenomytilus grayanus (Dunker, 1853) и приморского гребешка Mizuhopecten yessoensis (Jay, 1857) (Mollusca: Bivalvia) // Биол. моря. 2016. Т. 42. № 5. С. 375–380.
Вашанов Г.А., Каверин Н.Н. Взаимосвязи между основными антиоксидантными системами крови телят разного возраста // Вестн. ВГУ. Серия: химия, биология, фармация. 2009. № 1. С. 58–61.
Гирин С.В. Модификация метода определения активности каталазы в биологических субстратах // Лаб. диагностика. 1999. № 4. С. 45–46.
Горомосова С.А., Шапиро А.З. Основные черты биохимии энергетического обмена мидий. М.: Легкая и пищ. пром-сть. 1984. 120 с.
Гостюхина О.Л., Андреенко Т.И. Особенности взаимодействия разных звеньев антиоксидантной защиты и роль низкомолекулярных антиоксидантов в энергообеспечении тканей Anadara kagoshimensis (Tokunaga, 1906) (Bivalvia: Arcidae) // Биол. моря. 2015. Т. 41. № 4. С. 279–284.
Гостюхина О.Л., Солдатов А.А., Головина И.В., Бородина А.В. Содержание каротиноидов и состояние антиоксидантного ферментативного комплекса тканей у двустворчатого моллюска Anadara inaequivalvis Br. // Журн. эвол. биохим. и физиол. 2012. Т. 48. № 6. С. 542–547.
Истомина А.А., Довженко Н.В., Челомин В.П. Реакция антиоксидантной системы на аноксию и реоксигенацию у морского двустворчатого моллюска Scapharca broughtoni // Вестн. Моск. гос. обл. ун-та. Серия: естественные науки. 2010. С. 39–43.
Колб В.Г., Камышников В.С. Клиническая биохимия: пособие для врачей-лаборантов. Минск: Изд-во Беларусь. 1976. С. 59–62.
Лукьянова Л.Д., Кирова Ю.И., Сукоян Г.В. Новое о сигнальных механизмах адаптации к гипоксии и их роли в системной регуляции // Патогенез. 2011. Т. 9. № 3. С. 4–14.
Меньшиков В.В. Лабораторные методы исследования в клинике [справочник]. М.: Медицина. 1987. 365 с.
Меньщикова Е.Б., Зенков Н.К. Антиоксиданты и ингибиторы радикальных окислительных процессов // Успехи соврем. биол. 1993. Т. 113. № 4. С. 442–455.
Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс. Прооксиданты и антиоксиданты. М.: Фирма “Слово”. 2006. 556 с.
Митилиды Черного моря / Заика В.Е., Валовая Н.А., Повчун А.С., Ревков Н.К. Киев: Наукова думка. 1990. 208 с.
Олифиренко А.Б. Условия формирования поселений двустворчатого моллюска Anadara broughtoni в зал. Петра Великого (Японское море) // Изв. ТИНРО. 2007. Т. 149. С. 122–137.
Переслегина И.А. Активность антиоксидантных ферментов слюны здоровых детей // Лаб. дело. 1989. № 11. С. 20–23.
Путилина Ф.Е. Определение содержания восстановленного глутатиона в тканях // Методы биохим. исслед. Л.: Изд-во ЛГУ. 1982. С. 183–186.
Ревков Н.К., Щербань С.А. Особенности биологии двустворчатого моллюска Anadara kagoshimensis в Черном море // Экосистемы. 2017. Вып. 9. С. 47–56.
Северин Е.С., Алейникова Т.Л., Осипов Е.В., Силаева С.А. Биологическая химия. М.: ООО “Медицинское информационное агентство”. 2008. 364 с.
Солдатов А.А., Андреенко Т.И., Головина И.В. Особенности организации тканевого метаболизма у двустворчатого моллюска-вселенца Anadara inaequivalvis Bruguiere // Доповіді НАН України. 2008. № 4. С. 161–165.
Солдатов А.А., Андреенко Т.И., Головина И.В., Столбов А.Я. Особенности организации тканевого метаболизма у моллюсков с различной толерантностью к внешней гипоксии // Журн. эвол. биохим. и физиол. 2010. Т. 46. № 4. С. 284–290.
Солдатов А.А., Гостюхина О.Л., Головина И.В. Функциональные состояния антиоксидантного ферментного комплекса тканей Mytilus galloprovincialis Lam. в условиях окислительного стресса // Журн. эвол. биохим. и физиол. 2014. Т. 50. № 3. С. 183–189.
Усенко Л.В., Муслин В.П., Мосенцев Н.Ф., Мосенцев Н.Н. Способ нивелирования стресс-индуцированной гипергликемии при тяжелых критических состояниях // Медицина неотложных состояний. 2013. № 1(48). С. 103–114.
Фокина Н.Н., Нефедова З.А., Немова Н.Н. Биохимические адаптации морских двустворчатых моллюсков к аноксии (обзор) // Тр. Карельск. науч. центра РАН. 2011. № 3. С. 121–129.
Хочачка П., Сомеро Дж. Стратегия биохимической адаптации. М.: Мир. 1988. 586 с.
Broom M.J. The biology and culture of marine bivalve molluscs of the genus Anadara // ICLARM Studies and Reviews 12. International Center for Living Aquatic Resources Management, Manila, Philippines. 1985. 37 p.
Gostyukhina O.L. Comparative characteristics of the antioxidant glutathione complex in the Black Sea molluscs Mytilus galloprovincialis Lam. and Anadara inaequivalvis Br. // J. Evol. Biochem. Physiol. 2013. V. 49. № 1. P. 59–65.
Gostyukhina O.L., Golovina I.V. Comparative analysis of antioxidant complex of the Black Sea mollusks Mytilus galloprovincialis, Anadara inaequivalvis and Crassostrea gigas // Hydrobiol. J. (Engl. Transl.). 2013. V. 49. № 3. P. 77–84.
Gostyukhina O.L., Soldatov A.A., Golovina I.V., Borodina A.V. Content of carotenoids and the state of tissue antioxidant enzymatic complex in bivalve mollusc Anadara inaequivalvis Br. // J. Evol. Biochem. Phys. 2013. V. 49. № 3. P. 309−315.
De Zwaan A., Cortesi P., van den Thillart G. Differential sensitivities to hypoxia by two anoxia-tolerant marine molluscs: a biochemical analysis // Mar. Biol. 1991. V. 111. P. 333–341.
De Zwaan A., Babarro J.M.F., Monari M., Cattani O. Anoxic survival potential of bivalves: (arte) facts // Comp. Biochem. Physiol. Part A: Mol. Integr. Physiol. 2002. V. 131. № 3. P. 615–624.
Doyotte A., Cossu C., Jacquin M.-C. et al. Antioxidant enzymes, glutathione and lipid peroxidation as relevant biomarkers of experimental or field exposure in the gills and the digestive gland of the freshwater bivalve Unio tumidus // Aquat. Toxicol. 1997. V. 39. № 2. P. 93–110.
Larade K., Storey K.B. A profile of the metabolic responses to anoxia in marine invertebrates // Cell and molecular responses to stress. V. 3. Sensing, Signalling and Cell Adaptation. Amsterdam: Elsevier. 2002. P. 27–46.
Livingstone D.R. Origins and evolution of pathways of anaerobic metabolism in the animal kingdom // Am. Zool. 1991. V. 31. P. 522–534.
Livingstone D.R. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms // Mar. Pollut. Bull. 2001. V. 42. № 8. P. 656–666.
Mommsen Th.P., French C.J., Hochachka P.W. Sites and patterns of protein and amino acid utilization during spawning migration of salmon // Can. J. Zool. 1980. V. 58. P. 1785–1799.
Moon T.W. Adaptation, constraint, and the function of the gluconeogenic pathway // Can. J. Zool. 1988. V. 66. P. 1059–1068.
Mota-Rojas D., Orozco-Gregorio H., Villanueva-Garcia D. et al. Foetal and neonatal energy metabolism in pigs and human: a review // Vet. Med. 2011. V. 56. P. 215–225.
Ohkawa H., Ohishi N., Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction // Anal. Biochem. 1979. V. 95. № 1. P. 351–358.
Patel B., Chandy J.P., Patel S. Effect of mercury, selenium and glutathione on sulphydryl levels and glutathione reductase in blood clam Anadara granosa L. // Indian J. Mar. Sci. 1990. V. 19. P. 187–190.
Regoli F., Principato G. Glutathione, glutathione-dependent and antioxidant enzymes in mussel, Mytilus galloprovincialis, exposed to metals under field and laboratory conditions: implications for the use of biochemical biomarkers //Aquat. Toxicol. 1995. V. 31. P. 143–164.
Shulman G.E. Metabolic strategy in pelagic squid of genus Sthenoteuthis (Ommastrephidae) as the basis of high abundance and productivity: an overview of the soviet investigations // Bull. Mar. Sci. 2002. V. 71. № 2. P. 815–836.
Sivaramakrishna B., Radhakrishnaiah K. Comparative account on carbohydrate metabolism of freshwater mollusks Pila globosa and Lamellidens marginalis exposed to mercury toxicity // Recent Advances in Ecobiological Res. New Delhi: A.P.H. Publ. Corp. 1997. P. 489–504.
Soldatov A.A., Gostyukhina O.L., Borodina A.V., Golovina I.V. Glutathione antioxidant complex and carotenoid composition in tissues of the bivalve mollusk Anadara kagoshimensis // J. Evol. Biochem. Phys. 2017. V. 53. № 4. P. 289–297.
Taylor M.A., Maher A.W., Ubrihien P.R. Mortality, condition index and cellular responses of Anadara trapezia to combined salinity and temperature stress // J. Exp. Mar. Biol. Ecol. 2017. V. 497. P. 172–179.
Vaquer-Sunyer R., Duarte C.M. Thresholds of hypoxia for marine biodiversity // PNAS. 2008. V. 105. № 40. P. 15452–15457.
Waarde A. Biochemistry of non-protein nitrogenous compounds in fish including the use of amino acids for anaerobic energy production // Comp. Biochem. Physiol. B. Comp. Biochem. 1988. V. 91B. № 2. P. 207–228.
Дополнительные материалы отсутствуют.


