Биология моря, 2019, T. 45, № 3, стр. 177-187
Концентрация металлов в воде и в водорослях: биоаккумуляционный фактор
Е. Н. Чернова 1, 2, *, В. М. Шулькин 1, 2
1 Тихоокеанский институт географии (ТИГ) ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690090 Владивосток, Россия
* E-mail: elena@tigdvo.ru
Поступила в редакцию 30.01.2018
После доработки 03.11.2018
Принята к публикации 29.11.2018
Аннотация
Показано отсутствие достоверной зависимости между содержанием металлов Cu, Cd, Fe и Mn в воде и в бурых водорослях из Японского моря, произрастающих в среде с фоновыми концентрациями элементов. Достоверная связь между содержанием в воде и в водорослях отмечена для цинка, так как это единственный металл, концентрация которого в местах обитания макрофитов варьировала в широких пределах, превышающих фоновые значения. Соответственно, только для цинка установлена достоверная зависимость между биоаккумуляционным фактором (БАФ) водорослей из Японского моря и содержанием этого элемента в воде. Для всех изученных металлов показано, что наиболее высокие и изменчивые величины БАФ водорослей наблюдались в фоновом диапазоне концентраций металлов в водной среде, что позволяет выделить фоновый (или природно-обусловленный) диапазон графически. Учитывая высокую изменчивость БАФ организмов в фоновых условиях, следует очень осторожно интерпретировать данные биомониторинга.
Использование организмов для биомониторинга загрязнения среды базируется на связи их химического состава с химическим составом среды. Для водных организмов такая зависимость установлена в токсикологических экспериментах (Wang et al., 1996; Wang, Dei, 1999) и подтверждена с помощью многочисленных натурных измерений (Bryan, Hummerstone, 1973; Ho, 1990; Haritonidis, Malea, 1995; Chakraborty et al., 2014). Показано, что связь между концентрацией металла в водорослях-биоиндикаторах и в морской воде должна быть линейной, что означает постоянство коэффициента аккумуляции для конкретного элемента в широком диапазоне его содержания в среде (Levine, 1984, цит. по: Jayasekera, Rossbach, 1996). Однако зависимость между химическим составом воды и организмов в естественной среде обитания выявляется, как правило, тогда, когда имеется широкий (более двух порядков) диапазон концентрации элемента в среде (DeForest et al., 2007; Chakraborty et al., 2014). В природных условиях на химический состав водных организмов помимо концентрации растворенных форм металлов оказывают влияние и другие факторы, описанные в литературе в основном в конце XX века: количество элементов во взвешенном веществе и в донных отложениях, особенно при алиментарном поступлении в организм (Патин, Морозов, 1981); гидродинамические условия, обеспечивающие скорость перемешивания воды; наличие органических соединений, способных связывать химические элементы в составе экзо- и эндометаболитов, а также физиологические особенности гидробионтов (Бурдин, Золотухина, 1989; Бурдин и др., 1990; Phillips, 1990; Sanders, Riedel, 1993; Baumann et al., 2009). Важным обстоятельством является различие временных масштабов биогеохимических процессов в организмах и в среде (Wang, Dei, 1999).
Многие исследователи, основываясь на существовании линейной связи между содержанием элементов в воде и в организмах, рассчитали коэффициенты биоаккумуляции или биоконцентрации (Wang, Dei, 1999; Farias et al., 2018). Биоаккумуляционный фактор (БАФ) – отношение содержания элемента в организме (мкг/г сух. массы) к его содержанию в воде в растворенной форме (мкг/мл), которое рассчитывается на основе данных, полученных в натурных исследованиях. В его числителе – концентрация, интегрирующая все доступные водному организму природные источники элемента, в том числе растворенные, взвешенные и полученные из пищи (McGeer et al., 2003; DeForest et al., 2007), а в знаменателе – концентрация растворенного металла. Биоконцентрационный фактор (БКФ) – отношение содержания элемента в организме (мкг/г сух. массы) к его содержанию в воде в растворенной форме (мкг/мл), которое рассчитывается на основе данных, полученных в краткосрочных экспериментах при экспозиции организмов в воде с известной концентрацией металла. Предполагалось использовать БАФ и БКФ для пересчета концентраций элементов в среде через их содержание в организмах, а также наоборот (Wang, Dei, 1999; Zalewska, Danowska, 2017).
Установление экологического статуса водных систем, основанное на определении максимально допустимых концентраций металлов в организмах-индикаторах разных систематических групп – еще одна важная задача биогеохимического мониторинга. В настоящее время для ее решения кроме токсикологического применяется несколько других подходов (Cantillo, 1998; Reimann et al., 2005; Sánchez-Quiles et al., 2017; Zalewska, Danowska, 2017), в одном из которых используется БАФ (Handbook…, 2014). Чтобы использовать этот коэффициент для пересчета содержания элемента в организме на концентрацию элемента в среде, скорости его накопления и выведения должны быть постоянными величинами, а зависимость между БАФ (БКФ) организмов-индикаторов и содержанием металла в воде графически должна представлять собой прямую линию, параллельную оси абсцисс. Такая связь показана при изучении адсорбции кадмия сухими тканями водорослей (Fehrmann, Pohl, 1993). Однако в экспериментах на живых водорослях установлено, что скорость накопления и БКФ уменьшаются при увеличении концентрации металла в среде (Bryan, 1969; Wang, Dei, 1999). Поскольку в экспериментах используется заведомо повышенная и практически недостижимая в природных условиях концентрация металла в среде, рассчитанный в эксперименте БКФ следует осторожно применять для пересчета концентрации элемента в организмах и в нативной среде (Wang, Dei, 1999). В то же время для многих водных организмов (беспозвоночные, рыбы, водоросли) в природных условиях обнаружена отрицательная (логарифмическая) связь между концентрациями микроэлементов в воде и значениями БАФ (McGeer et al., 2003; DeForest et al., 2007). Наличие такой связи вносит ограничения в положение биомониторинга о возможности пересчета концентраций металлов в организме-индикаторе на содержание элементов в воде с использованием полученных в естественной среде величин БАФ.
Цели настоящей работы: 1) рассчитать значения БАФ для макроводорослей на основе опубликованных и собственных данных по западной части Японского моря; 2) рассмотреть изменение значений БАФ в зависимости от содержания растворенных форм металлов в среде; 3) оценить возможности использования БАФ для уточнения фоновых концентраций металлов в среде и в макроводорослях.
МАТЕРИАЛ И МЕТОДИКА
Для расчета значений БАФ использовали полученные в 1987 г. собственные данные по содержанию Fe, Mn, Zn, Cu, Cd и Ni в воде и в водорослях из западной части Японского моря (рис. 1), а также представленные в литературных источниках сведения по содержанию металлов в макрофитах (бурых, красных и зеленых водорослях) и в воде в местах их обитания (табл. 1). Для определения содержания металлов водоросли и воду отбирали в летний период с глубины 1–2 м. Водоросли тщательно отмывали водой с места сбора и помещали в полиэтиленовые емкости, затем упаковывали в полиэтиленовые пакеты и доставляли в лабораторию. Водоросли сушили при температуре 85°С в сушильном шкафу между листами фильтровальной бумаги, избегая соприкосновения с металлическими частями, тщательно очищали от обрастаний и упаковывали в чистые бумажные пакеты для хранения. В дальнейшем измельченные в агатовой ступке водоросли (объединенная проба из 3–5 экз. из одного места сбора) в трех повторностях озоляли концентрированной HNO3 марки ОСЧ на плитке в вытяжном шкафу без металлических частей.
Таблица 1.
Виды водорослей, использованные для расчета биоаккумуляционного фактора (БАФ)
| Вид | Металл | Источник |
|---|---|---|
| Cystoseira sp., Ulva sp., Enteromorpha sp., Padina pavonica, Caulerpa racemosa, Codium fragile, Gracilaria gracilis | Cd, Pb, Cr, Cu, Zn, Fe | Akcali, Kucuksezgin, 2011 |
| Caulerpa sertularioides, Dictyota dichotoma, Halimeda opuntia, Galaxaura obtusata, Cystoseira myrica, Hypnea musciformis, Penicilus sp., Chaetomorpha crassa, Rhipocephalus phoenix, Dictyosphaeria cavernosa, Laurencia poiteaui, Plenosporium sp. | Cd, Pb, Cu | Horta-Puga et al., 2013 |
| Enteromorpha sp. | Cd, Pb, Cr, Cu, Zn, Mn, Ni | Zbikowski et al., 2006 |
| Ulva sp., Fucus vesiculosus, Polysiphonia lanosa, Ascophyllum nodosum | Cd, Pb, Cr, Cu, Zn, Mn, Ni | Ryan et al., 2012 |
| Acathofora specifiera, Enteromorpha sp., E. compressa, Hypnea sp., Ulva lactuca, Lola capillaries,Caulerpa racemosa, Padina gymnospora, Acathofora delilei, Dyctiota bartairesiana,Fucus spp., Sargassum polycystum, Gracilaria verrucosa, Lola sp., Caulerpa scalpeliformis, Dyctiota dichotoma | Cd, Pb, Cr, Cu, Zn, Mn, Ni, Fe | Сhakraborty et al., 2014 |
| Enteromorpha sp., Ulva rigida | Cr, Ni | Haritonidis, Malea, 1995 |
| U. rigida | Cd, Pb, Cu, Zn | Haritonidis, Malea, 1999 |
| U. rigida | Cd, Pb, Cr, Cu, Zn, Mn, Ni, Fe | Malea, Haritonidis, 2000 |
| Padina pavonica | Cd, Pb, Cr, Cu, Zn | Campanella et al., 2001 |
| Sargassum polycystum, S. swartzii, S. mcclurei | Cd, Cu, Zn, Mn, Fe | Христофорова и др., 1983 |
| Enteromorpha sp., Porphyra sp. | Hg, Cd, Cu, Pb | Leal et al., 1997 |
| Sargassum pallidum, S. miyabei, Stephanocystis crassipes, Fucus evanescens, Pelvetia wrightii, Ulva fenestrata | Cd, Cu, Zn, Fe, Mn, Ni, Pb | Данная работа |
Одновременно с отбором проб водорослей в пластиковую канистру брали пробы воды, канистру запаковывали в полиэтилен и доставляли на борт судна. В день отбора пробы воды фильтровали с помощью вакуумного насоса через мембранный фильтр (Millipore Durapore) 0.45 мкм. Фильтраты хранили в холодильнике в пластиковой посуде с добавлением HNO3 марки ОСЧ до рН 1–2. Микроэлементы концентрировали в 100 раз жидкостной экстракцией в системе диэтилдитиокарбаминат-Na-хлороформ, определяли на атомно-абсорбционном спектрофотометре Nippon Jarrel Ash AA-780 в пламенном варианте без коррекции фона. Степень извлечения растворенных ионных форм металлов после концентрирования, неоднократно проверенная экспериментально методом “введено–найдено”, составляла 85–95%.
Содержание металлов (Fe, Mn, Zn, Cu, Cd) в водорослях определяли атомно-абсорбционным методом на приборе Nippon Jarrel Ash AA-780 в пламени ацетилена. Корректность определения концентраций металлов в образцах контролировали холостыми опытами, методом добавок и анализом стандартного образца донных осадков СДО-1. Ошибка измерения составляла 7–10%.
БАФ рассчитывали делением концентрации металла в водоросли (мкг/г сух. массы) на концентрацию растворенного металла в воде (мкг/мл). Для построения рисунков, расчета уравнений регрессии, БАФ и коэффициентов корреляции использовали программы EXCEL и Statistika 6.
РЕЗУЛЬТАТЫ
Величины БАФ для всех видов макроводорослей, рассчитанные на основе собственных и литературных данных, характеризовались высокой изменчивостью в зависимости от содержания растворенных металлов в среде (рис. 2). Так, разброс величин БАФ цинка в водорослях Мирового океана варьировал в диапазоне четырех порядков – от 2 × 102 до 1.4 × 105, при этом максимальный разброс величин соответствовал концентрациям Zn в воде до 2.5 мкг/л (рис. 2). У западного побережья Японского моря максимальные и наиболее изменчивые величины БАФ Zn (2.8 × 104–1.4 × 105; коэффициент вариации 52%) определены у фукусовой водоросли Silvetia babingtonii (Harvey), обитающей в среде с концентрацией растворенного цинка 0.2–0.8 мкг/л (табл. 2). В водорослях Мирового океана значения БАФ меди изменялись от 5.95 × 102 до 5.23 × 104. Максимальные и наиболее изменчивые значения БАФ получены при содержании Cu в среде до 1.3 мкг/л (рис. 2). В фукусовых водорослях Японского моря все величины БАФ (1.9 × 103–5.2 × 104) зарегистрированы в воде с концентрацией растворенного элемента до 0.7 мкг/л (табл. 2). В пределах от 1 × 10–1 до 6.9 × 105 в водорослях Мирового океана изменялся БАФ свинца. Максимальные и наиболее изменчивые величины БАФ Pb находились в диапазоне 0.02–0.03 мкг/л растворенного в воде элемента (табл. 2, рис. 2). Величины БАФ Fe и Mn в водорослях Мирового океана изменялись от 4.4 × 102 до 6.6 × 105 и от 2.1 × 102 до 8.8 × 105 соответственно (рис. 2). В среде, где концентрации растворенных форм Fe и Mn не превышали 10 мкг/л (табл. 2), величины БАФ этих элементов в водорослях были максимальными и наиболее изменчивыми. Максимальные и наиболее изменчивые величины БАФ Fe и Mn в водорослях западного побережья Японского моря зарегистрированы в среде с содержанием растворенных металлов 0.2–2.5 и 0.2–8.0 мкг/л соответственно (табл. 2). Значения БАФ Cd в водорослях Мирового океана варьировали от 50 до 8.3 × 104. Наиболее высокими и изменчивыми величины этого показателя были у водорослей из среды с содержанием Cd до 0.4 мкг/л (рис. 2). В Японском море все значения БАФ (4.1 × 103 – 2.9 × 104, коэффициент вариации 45%) зарегистрированы в водорослях из среды с содержанием кадмия 0.08–0.3 мкг/л (табл. 2).
Рис. 2.
Значения биоаккумуляционного фактора (БАФ) водорослей Мирового океана и Японского моря в зависимости от концентрации растворенного металла в воде. Пунктирная линия – кривая (логарифмическая или степенная), наиболее точно описывающая зависимость между параметрами; R2 – коэффициент аппроксимации.
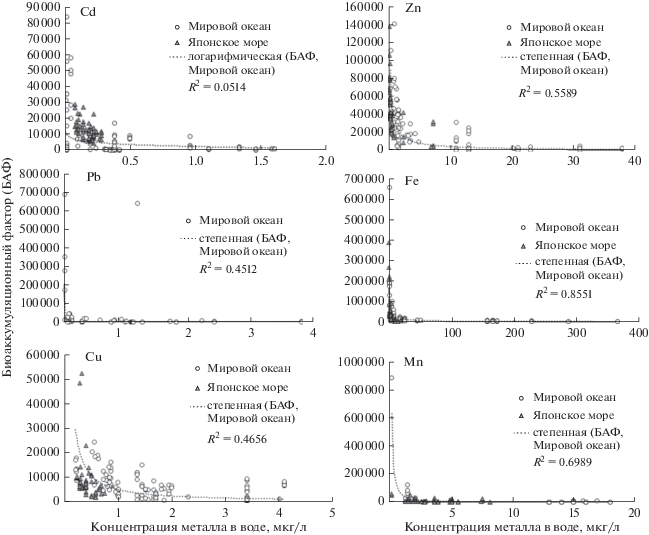
Таблица 2.
Концентрации растворенных металлов (мкг/л): 1 – фоновые для прибрежных акваторий Японского моря (по: Шулькин, 2004; Шулькин и др., 2013); 2 – соответствующие наиболее изменчивым величинам БАФ в водорослях Японского моря; 3 – соответствующие наиболее изменчивым величинам БАФ в водорослях Мирового океана
| Характеристика | Металл | |||||
|---|---|---|---|---|---|---|
| Zn | Cu | Cd | Pb | Fe | Mn | |
| 1 | До 0.5–0.8 | 0.3–1.2 | 0.005–0.04 | 0.05–0.1 | 1–10 | 2.6– 20 |
| 2 | 0.2–0.8 | До 0.7 | До 0.3 | – | 0.2–2.5 | 0.2–8.0 |
| 3 | До 2.5 | До 1.3 | До 0.4 | До 0.03 | До 10 | До 10 |
ОБСУЖДЕНИЕ
Ранее было показано, что у морских и пресноводных беспозвоночных (двустворчатые и брюхоногие моллюски, полихеты, ракообразные) существует достоверная отрицательная линейная связь между логарифмами БАФ и содержанием в воде таких металлов, как Zn, Cu, Hg, Cr, Cd, Pb и As (McGeer et al., 2003; DeForest et al., 2007). Недостоверной она оказалась только для селена у морских беспозвоночных, а также для мышьяка и кадмия у пресноводных. Достоверная отрицательная связь между логарифмами БАФ водорослей и концентрацией элемента в воде ранее была подтверждена для Cd, Zn, Ni и Cu, но не отмечена для Pb (McGeer et al., 2003). На основании литературных и собственных данных (табл. 1) была обнаружена достоверная отрицательная связь между логарифмами БАФ макроводорослей и содержанием растворенных металлов в воде для Fe, Cr, Mn, Zn, Pb, Ni и Hg (табл. 3). Для кадмия отрицательная связь была недостоверна. В то же время при использовании в анализе только собственных данных по содержанию металлов в Silvetia babingtonii, Stephanocystis crassipes (Mertens ex Turner) и Saccharina japonica (J.E. Areschoug) из Японского моря, произрастающих в более узком диапазоне концентраций металлов в среде, достоверная корреляционная связь выявлена лишь для Zn (табл. 4).
Таблица 3.
Коэффициенты линейной корреляции (r) между LnБАФ (водоросли Мирового океана) и LnC (C – содержание металла в воде, мкг/л)
| Показатель | Hg | Cd | Pb | Cr | Cu | Zn | Fe | Mn | Ni |
|---|---|---|---|---|---|---|---|---|---|
| r | –0.71* | –0.18 | –0.57* | –0.79* | –0.45* | –0.74* | –0.92* | –0.84* | –0.66* |
| n | 31 | 137 | 130 | 69 | 137 | 74 | 59 | 40 | 46 |
Таблица 4.
Параметры значимых (р < 0.05) линейных уравнений связи (Y = aX + b): концентрации растворенных металлов в воде Японского моря (Х) – концентрации металлов в водорослях (Y); концентрации растворенных металлов в воде (X) – БАФ (Y)
| Вид | X | Y | a | b | R2/r | n |
|---|---|---|---|---|---|---|
| Stephanocystis crassipes | Ln Cd | Ln Cd | 0.36 | 1.53 | 0.27/0.51 | 19 |
| Ln Cu | Ln БАФ Cu | –0.82 | 7.81 | 0.31/–0.56 | 19 | |
| Ln Fe | Ln Fe | 0.18 | 3.82 | 0.24/0.49 | 19 | |
| Zn | Zn | 2.67 | 16.28 | 0.61/0.78 | 19 | |
| Ln Zn | Ln БАФ Zn | –0.74 | 9.93 | 0.93/–0.96 | 19 | |
| Silvetia babingtonii | Ln Cu | Ln БАФ Cu | –0.54 | 8.21 | 0.45/–0.67 | 12 |
| Zn | Zn | 36.99 | 8.14 | 0.89/0.95 | 12 | |
| Ln Zn | Ln БАФ Zn | –0.43 | 10.60 | 0.4/–0.64 | 12 | |
| Sacсharina japonica | Ln Fe | БАФ Fe | –2059.3 | 13 174.1 | 0.27/–0.52 | 15 |
| Zn | Zn | 1.21 | 17.71 | 0.29/0.53 | 15 | |
| Zn | Ln БАФ Zn | –0.37 | 10.73 | 0.76/–0.87 | 15 |
Высокие и вариабельные величины БАФ в водорослях при низкой концентрации металлов в среде (рис. 2) можно объяснить несколькими причинами. В частности, в области низких значений выше ошибка определения содержания металлов в среде и организмах. Кроме этого многие данные по содержанию тяжелых металлов в природных водах, полученные до 1990-х годов, были признаны завышенными из-за несовершенства пробоотбора и ошибок определения (Benoit et al., 1997; Шулькин, 2004; Савенко, 2006). Завышенные данные по содержанию элементов в воде занижают значения БАФ. Однако результаты, полученные нами в 1987 г. для Fe, Mn, Cu, Zn и Cd, согласуются с более современными данными (табл. 1, рис. 2).
Высокие величины природных значений БАФ при низких концентрациях металлов в среде подтверждены экспериментально (Wang, Dei, 1999; Jarvis, Bielmyer-Fraser, 2015). Так, при содержании зеленой водоросли Ulva lactuca L. в воде с низкими концентрациями металлов (Cd 0.5–2 мкг/г, Zn 1–5 мкг/г) получены более высокие значения БКФ и константы скорости поглощения металлов, чем при ее содержании в среде с высокими концентрациями этих элементов (Cd 10–50 мкг/л, Zn 20–100 мкг/л). Однако даже низкие концентрации металлов в эксперименте в 2–25 раз выше, чем в природных водах (Wang, Dei, 1999). Снижение значений БКФ зарегистрировано также для U. lactuca, помещенной в среду, загрязненную одним из пяти элементов (Cd, Cu, Pb, Zn, Ni) в концентрации от 10 до 100 мкг/л (Jarvis, Bielmyer-Fraser, 2015). Таким образом, экспериментальные данные по расчету значений БКФ и БАФ подтверждают, что при увеличении концентраций металлов в среде снижаются величины этих коэффициентов и интенсивность накопления элементов организмами. Поскольку высокие и наиболее изменчивые значения БАФ наблюдаются при низкой концентрации металлов в воде, необходимо оценить, насколько эти концентрации в среде соответствуют фоновому уровню.
Для прибрежных акваторий северо-западной части Японского моря фоновыми предложено считать следующие концентрации растворенных металлов: Zn – 0.5–0.8; Cu – 0.3–1.2; Pb – 0.05–0.1; Cd – 0.04–0.05 мкг/л (Шулькин, 2004; Шулькин и др., 2013). Фоновые концентрации Fe и Mn в прибрежных водах этого района весьма изменчивы, зависят от сезона и, предположительно, составляют соответственно 1–10 и 2.6–20 мкг/л (Шулькин, 2004; см. табл. 2).
Соотнесение значений БАФ водорослей с соответствующим диапазоном концентраций растворенных Cu, Fe, Zn, Mn, Cd и Pb в прибрежных акваториях северо-западной части Японского моря (табл. 2, рис. 2) показало, что максимальные и наиболее изменчивые величины БАФ действительно получены для фонового диапазона концентраций этих элементов в среде. Таким образом, с помощью кривой изменчивости БАФ металлов в водорослях графически можно довольно точно выделить природный диапазон концентраций элементов в водной среде. Исключение составляли Zn и Cd, для которых наиболее изменчивые величины БАФ у водорослей Мирового океана обнаружены в диапазоне концентраций данных металлов в воде, превышающем фоновый в Японском море соответственно в 3 и 6 раз (табл. 2, рис. 2). Это свидетельствует о существовании акваторий с более высокими, чем в Японском море, фоновыми концентрациями данных элементов. В частности, в Белом море средняя концентрация растворенного Zn составляет около 2.9 мкг/л (Система Белого моря, 2012), что соответствует пограничной концентрации элемента в среде с максимальными величинами БАФ (табл. 2). Возможно, эти пограничные концентрации элементов соответствуют максимальной величине природного содержания, в котором макрофиты способны существовать без дополнительных энергетических затрат на мобилизацию защитных систем организма. Более высокие фоновые концентрации кадмия, вероятно, могут быть зарегистрированы и в открытых водах западной части Японского моря, где собраны пробы водорослей, по сравнению с фоновыми концентрациями, определенными для вод прибрежных закрытых морских акваторий (Шулькин, 2004; Шулькин и др., 2013). Это связано с тем, что концентрация растворенных форм Cd в речных водах (0.002–0.01 мкг/л) часто ниже, чем в морских (0.05–0.08 мкг/л) (Biller, Bruland, 2013). Ранее было показано, что содержание Cd в организмах-биоиндикаторах, в том числе в водорослях, в открытой части моря выше, чем в закрытых прибрежных акваториях (Кавун и др., 1989; Коженкова и др., 2006; Чернова, Коженкова, 2016).
Высокая вариабельность значений БАФ в организмах из среды с низкими концентрациями микроэлементов служит подтверждением того, что в воде с фоновыми концентрациями металлов их содержание в живых организмах контролируется не столько количеством элемента в среде, сколько другими как внешними, так и внутренними факторами. Среди них наиболее значимыми являются видовые особенности, физиологическая необходимость в элементах, накопление вместе с элементами их химических аналогов, а также повышенная фильтрационная активность гидробионтов при низком содержании пищи (Алимов, 1981; Wang et al., 1996).
Для некоторых массовых видов водорослей и морских трав Японского моря определены фоновые (медиана) и пороговые (медиана + двойная медиана абсолютных отклонений от медианы) концентрации элементов (Чернова, 2012; Чернова, Коженкова, 2016, 2017). Предполагается, что организмы с содержанием металлов ниже пороговых значений обитают в фоновых условиях. В Японском море в диапазоне фоновых концентраций растворенного Zn содержание данного элемента в Fucus evanescens (C. Agardh), S. crassipes и Sargassum pallidum (Turner) C. Agardh не превышало пороговые значения для этих видов (табл. 5, рис. 3). У водорослей, произраставших в воде с концентрацией растворенного кадмия 0.08–0.3 мкг/л, его содержание не превышало пороговые значения (3.1–3.2 мкг/г у фукуса и стефаноцистиса, 1.6–1.7 мкг/г у сильвеции и саргассума), несмотря на более высокую, чем фоновая (до 0.05 мкг/л), концентрацию элемента в окружающей среде (табл. 5, рис. 3). В водоемах рыбохозяйственного использования ПДК кадмия составляет 1 мкг/л (СанПиН 2.1.5.980-00). Возможно, макрофиты способны выживать при более высокой концентрации Cd, чем фоновая, установленная для прибрежных вод Японского моря, так как значения БАФ для водорослей выше и вариабельнее в более широком диапазоне природных значений растворенного Cd (до 0.4 мкг/л). Концентрация марганца в водорослях также в основном не превышала пороговые значения в фоновом диапазоне содержания элемента в среде (табл. 5, рис. 4).
Таблица 5.
Максимальная концентрация металлов в водорослях (мкг/г сух. массы) из акваторий Японского моря с фоновым содержанием растворенных металлов
| Вид | Zn | Cd | Cu | Fе | Mn |
|---|---|---|---|---|---|
| Fucus evanescens | 35.6 (80) | n.d. (3.1) | 3.1 (4.1) | 372 (100) | 129 (169) |
| Silvetia babingtonii | 34.3 (39) | 1.2 (1.6) | 5.5 (3.5) | 120 (54) | 16 (33) |
| Sargassum pallidum | 14.3 (24) | 2.3 (1.7) | 3.5 (3.9) | 130 (672) | 183 (455) |
| Stephanocystis crassipes | 23.9 (43) | 2.1 (3.2) | 3.3 (3.6) | 142 (81) | 47 (12) |
| Sacсharina japonica | 26.3 (43) | 1.5 (2.8) | 5.2 (3.9) | 108 (82) | 7 (8) |
Рис. 3.
Содержание Cd (а, б), Zn (в, г) и Cu (д, е) в некоторых видах водорослей из западной части Японского моря в зависимости от концентрации растворенного металла в воде.
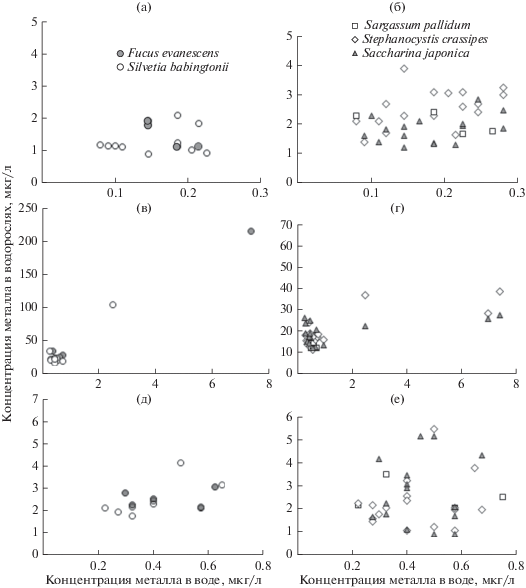
Рис. 4.
Содержание Fe (а, б) и Mn (в, г) в некоторых видах водорослей из западной части Японского моря в зависимости от концентрации растворенного металла в воде.
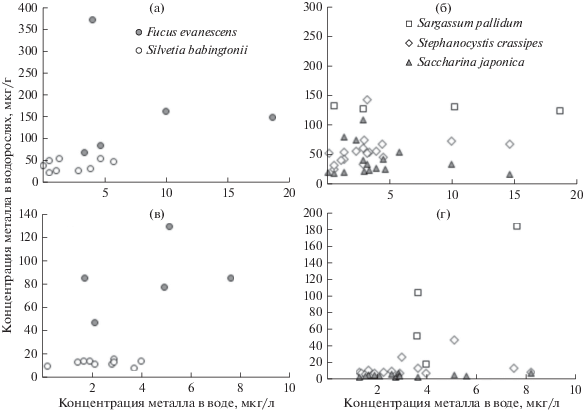
В диапазоне фоновых концентраций Cu в воде (до 1.2 мкг/л) содержание этого элемента в водорослях из западной части Японского моря достигало 5.5 мкг/г, что несколько выше расчетных пороговых концентраций – от 3.5 до 4.1 мкг/г в разных видах водорослей япономорского региона (табл. 5, рис. 3д, 3е). Аналогичная ситуация наблюдалась и для железа: в фоновом диапазоне содержания элемента в воде Японского моря (табл. 5, рис. 4) его концентрация в водорослях превышала пороговый уровень. Вероятно, это связано с тем, что железо в морской воде находится преимущественно во взвешенной форме, а взвесь, налипая на талломы, может способствовать повышению концентрации элемента в макрофитах (Патин, Морозов, 1981; García-Seoane et al., 2018).
В фоновом диапазоне концентраций металлов в воде Японского моря содержание Cd, Zn и Mn в водорослях не превышало пороговые для региона значения, а содержание Fe и Cu иногда было выше пороговых уровней. Для железа это, вероятно, связано с наличием легкодоступных взвешенных форм, которые водоросли способны аккумулировать. Что касается меди, то данный вопрос требует дальнейших исследований.
Регрессионный анализ данных для Японского моря показал, что наиболее высокие и достоверные коэффициенты корреляции и детерминации (р < 0.05) выявлены между содержанием цинка в воде и в макрофитах, в воде и БАФ водорослей (табл. 4). Отсутствие значимой связи между содержанием Fe, Mn, Cu и Cd в воде и их концентрацией в водорослях, а также в воде и БАФ водорослей свидетельствует о том, что организмы обитают в среде с физиологически обусловленными (фоновыми) для них концентрациями данных элементов. Наличие значимой связи только в диапазоне концентраций Zn в среде, существенно превышающем фоновый – 0.3–7.4 мкг/л (рис. 4), подтверждает гипотезу о том, что для обнаружения зависимости между содержанием элемента в среде и в организме пределы концентраций в среде должны различаться как минимум на два порядка (DeForest et al., 2007).
Таким образом, водоросли Японского моря, в которых концентрации металлов не превышали пороговые значения, как правило, обитали в среде с фоновым содержанием растворенных элементов (кроме Cd). Отсутствие корреляции между содержанием Cd, Fe, Cu, Mn в водорослях и в воде, а также наличие этой связи для Zn свидетельствуют о том, что такая связь обусловлена диапазоном концентрации элемента в среде. Наиболее высокие вариабельность и значения БАФ металлов в водорослях отмечены в фоновом диапазоне концентраций элементов в среде, что позволяет графически уточнить фоновые диапазоны концентраций в организмах и природно-обусловленные диапазоны концентраций в среде их обитания. Высокая изменчивость БАФ организмов в фоновых условиях свидетельствует о том, что в таких условиях следует очень осторожно интерпретировать данные биомониторинга.
Список литературы
Алимов А.Ф. Функциональная экология пресноводных двустворчатых моллюсков. Л.: Наука. 1981. 248 с.
Бурдин К.С., Золотухина Е.Ю. Тяжелые металлы в водных растениях (аккумуляция и токсичность). М.: Диалог МГУ. 1989. 202 с.
Бурдин К.С., Крупина М.В., Савельев И.Б. Физиологические механизмы регулирования содержания тяжелых металлов в морских водорослях // Вестн. МГУ. Сер. 16: Биология. 1990. № 2. С. 35–42.
Кавун В.Я., Христофорова Н.К., Шулькин В.М. Микроэлементный состав тканей мидии съедобной из прибрежных вод Камчатки и Северных Курил // Экология. 1989. № 3. С. 53–58.
Коженкова С.И., Чернова Е.Н., Шулькин В.М. Микроэлементный состав зеленой водоросли Ulva fenestrata из залива Петра Великого Японского моря // Биол. моря. 2006. Т. 32. № 5. С. 346–352.
Патин С.А., Морозов Н.П. Микроэлементы в морских организмах и экосистемах. М.: Легкая и пищ. пром-ть. 1981. 153 с.
СанПиН 2.1.5.980-00. ПРИКАЗ Министерства сельского хозяйства РФ от 13 декабря 2016 года № 552 “Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения”. Дата опубл.: 16.01.2017 // http://publication.pravo.gov.ru/Document/ View/0001201701160006?index=12&rangeSize=1
Савенко В.С. Химический состав взвешенных наносов рек мира. М.: ГЕОС. 2006. 175 с.
Система Белого моря. Т. II. Водная толща и взаимодействующие с ней атмосфера, криосфера, речной сток и биосфера. М.: Науч. мир. 2012. 784 с.
Христофорова Н.К., Нгуен Хыу Зинь, Шулькин В.М. и др. Сравнение минерального состава саргассовых водорослей Японского и Южно-Китайского морей // Биол. моря. 1983. № 3. С. 48–54.
Чернова Е.Н. Морская трава Zostera marina как индикатор загрязнения среды металлами: фоновые концентрации и экологическая оценка залива Петра Великого // Современное экологическое состояние залива Петра Великого Японского моря. Владивосток: Изд. Дом ДВФУ. 2012. С. 382–396.
Чернова Е.Н., Коженкова С.И. Определение пороговых концентраций металлов в водорослях-индикаторах прибрежных вод северо-западной части Японского моря // Океанология. 2016. Т. 56. № 3. С. 1–10.
Чернова Е.Н., Коженкова С.И. Фоновые концентрации металлов в зеленой водоросли Ulva lactuca из северо-западной части Японского моря // Геосистемы в Северо-Восточной Азии: территориальная организация и динамика. Владивосток: Дальнаука. 2017. С. 522–526.
Шулькин В.М. Металлы в экосистемах морских мелководий. Владивосток: Дальнаука. 2004. 276 с.
Шулькин В.М., Орлова Т.Ю., Шевченко О.Г., Стоник И.Г. Влияние речного стока и продукции фитопланктона на сезонную изменчивость химического состава прибрежных вод Амурского залива Японского моря // Биол. моря. 2013. Т. 39. № 3. С. 202–212.
Akcali I., Kucuksezgin F. A biomonitoring study: heavy metals in macroalgae from eastern Aegean coastal areas // Mar. Pollut. Bull. 2011. V. 62. P. 637–645.
Baumann H.A., Morrison L., Stengel D.B. Metal accumulation and toxicity measured by PAM-chlorophyll fluorescence in seven species of marine macroalgae // Ecotoxicol. Environ. Saf. 2009. V. 72. P. 1063–1075.
Benoit G., Hunter K.S., Rozan T.F. Sources of trace metal contamination artifacts during collection, handling, and analysis of freshwaters // Anal. Chem. 1997. V. 69. № 6. P. 1006–1011.
Biller D.V., Bruland K.W. Sources and distributions of Mn, Fe, Co, Ni, Cu, Zn, and Cd relative to macronutrients along the central California coast during the spring and summer upwelling season // Mar. Chem. 2013. V. 155. P. 50–70.
Bryan G.W. The absorption of zinc and other metals by the brown seaweed Laminaria digitata // J. Mar. Biol. Assoc. U.K. 1969. V. 49. P. 225–243.
Bryan G.W., Hummerstone L.G. Brown seaweed as an indicator of heavy metals in estuaries in South-West England // J. Mar. Biol. Assoc. U.K. 1973. V. 53. P. 705–720.
Campanella L., Conti M.E., Cubadda F., Sucapane C. Trace metals in seagrass, algae and molluscs from an uncontaminated area in the Mediterranean // Environ. Pollut. 2001. V. 111. P. 117–126.
Cantillo A.Y. Comparison of results of Mussel Watch programs of the United States and France with Worldwide Mussel Watch studies // Mar. Pollut. Bull. 1998. V. 36. № 9. P. 712–717.
Chakraborty S., Bhattacharya T., Singh G., Maity J.P. Benthic macroalgae as biological indicators of heavy metal pollution in the marine environments: a biomonitoring approach for pollution assessment // Ecotoxicol. Environ. Saf. 2014. V. 100. P. 61–68.
DeForest D.K., Brix K.V., Adams W.J. Assessing metal bioaccumulation in aquatic environments: the inverse relationship between bioaccumulation factors, trophic transfer factors and exposure concentration // Aquat. Toxicol. 2007. V. 84. P. 236–246.
Farias D.R., Hurd C.L., Eriksen R.S., Macleod C.K. Macrophytes as bioindicators of heavy metal pollution in estuarine and coastal environments // Mar. Pollut. Bull. 2018. V. 128. P. 175–184.
Fehrmann C., Pohl P. Cadmium adsorption by the non-living biomass of microalgae grown in axenic mass culture // J. Appl. Phycol. 1993. V. 5. P. 555–562.
García-Seoane R., Fernández J.A., Villares R., Aboal J.R. Use of macroalgae to biomonitor pollutants in coastal waters: optimization of the methodology // Ecol. Indic. 2018. V. 84. P. 710–726.
Handbook of parameter values for the prediction of radionuclide transfer to wildlife. Tech. Rep. Ser. IAEA. Vienna. 2014. № 479. 229 p.
Haritonidis S., Malea P. Seasonal and local variation of Cr, Ni and Co concentrations in Ulva rigida C. Agardh and Enteromorpha linza (Linnaeus) from Thermaikos Gulf, Greece // Environ. Pollut. 1995. V. 89. P. 319–327.
Haritonidis S., Malea P. Bioaccumulation of metals by the green alga Ulva rigida from Thermaikos Gulf, Greece // Environ. Pollut. 1999. V. 104. P. 365–372.
Ho Y.B. Metals in Ulva lactuca in Hong Kong intertidal waters // Bull. Mar. Sci. 1990. V. 47. P. 79–85.
Horta-Puga G., Cházaro-Olvera S., Winfield I. et al. Cadmium, copper and lead in macroalgae from the Veracruz Reef System, Gulf of Mexico: spatial distribution and rainy season variability // Mar. Pollut. Bull. 2013. V. 68. P. 127–133.
Jarvis T.A., Bielmyer-Frazer G.K. Accumulation and effects of metal mixtures in two seaweed species // Comp. Biochem. Physiol. Part C: Toxicol. Pharmacol. 2015. V. 171. P. 28–33.
Jayasekera R., Rossbach M. Use of seaweeds for monitoring trace elements in coastal waters // Environ. Geochem. Health. 1996. V. 18. P. 63–68.
Leal F.M.C., Vasconcelos M.T., Sousa-Pinto I., Cabral J.P.S. Biomonitoring with benthic macroalgae and direct assay of heavy metals is seawater of the Oporto coast (Northwest Portugal) // Mar. Pollut. Bull. 1997. V. 34. № 12. P. 1006–1015.
Malea P., Haritonidis S. Use of the green alga Ulva rigida C. Agardh as an indicator species to reassess metal pollution in the Thermaikos Gulf, Greece, after 13 years // J. Appl. Phycol. 2000. V. 12. P. 169–176.
McGeer J.C., Brix K.V., Skeaff J.M. et al. Inverse relationship between bioconcentration factor and exposure concentration for metals: implications for hazard assessment of metals in the aquatic environment // Environ. Toxicol. Chem. 2003. V. 22. № 5. P. 1017–1037.
Phillips D.J.H. Use of macroalgae and invertebrates as monitors of metal levels in estuarine and coastal waters // Heavy metals in the marine environment. Boca Raton, Florida: CRC Press. 1990. P. 81–99.
Reimann C., Filzmoser P., Garrett R.G. Background and threshold: critical comparison of methods of determination // Sci. Total Environ. 2005. V. 346. P. 1–16.
Ryan S., McLoughlin P., O’Donovan O. A comprehensive study of metal distribution in three main classes of seaweed // Environ. Poll. 2012. V. 167. P. 171–177.
Sánchez-Quiles D., Marbà N., Tovar-Sánchez A. Trace metal accumulation in marine macrophytes: hotspots of coastal contamination worldwide // Sci. Total Environ. 2017. V. 576. P. 520–527.
Sanders J.G., Riedel G.F. Trace element transformation during the development of an estuarine algal bloom // Estuaries. 1993. V. 16. P. 521–532.
Wang W.-X., Dei R.C.H. Kinetic measurements of metal accumulation in two marine macroalgae // Mar. Biol. 1999. V. 135. P. 11–23.
Wang W.-X., Fisher N.S., Luoma S.N. Kinetic determinations of trace element bioaccumulation in the mussel Mytilus edulis // Mar. Ecol. Prog. Ser. 1996. V. 140. P. 91–113.
Zalewska T., Danowska B. Marine environment status assessment based on macrophytobenthic plants as bio-indicators of heavy metals pollution // Mar. Pollut. Bull. 2017. V. 118. P. 281–288.
Zbikowski R., Szefer P., Latala A. Distribution and relationships between selected chemical elements in green alga Enteromorpha sp. from the Southern Baltic // Environ. Pollut. 2006. V. 143. P. 435–448.
Дополнительные материалы отсутствуют.



