Биология моря, 2019, T. 45, № 3, стр. 188-196
Изменение ультраструктуры морских микроводорослей из разных отделов в накопительной культуре
Т. Ю. Орлова 1, *, М. А. Сабуцкая 1, Ж. В. Маркина 1, 2
1 Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690950 Владивосток, Россия
* E-mail: torlova06@mail.ru
Поступила в редакцию 16.08.2018
После доработки 27.11.2018
Принята к публикации 18.10.2018
Аннотация
Проведено сравнительное исследование ультраструктуры микроводорослей из разных отделов (Dinoflagellata, Haptophyta, Rhodophyta, Ochrophyta) в условиях накопительной культуры. Описаны внутри- и межвидовые различия в строении клеток на экспоненциальной и стационарной стадиях и на стадии отмирания клеток. В стрессовых условиях длительного культивирования выявлены общие и специфические изменения морфологии клеточных структур микроводорослей, затрагивающие фотосинтетический аппарат, покровы и липидные капли.
Морские микроводоросли являются наиболее чувствительными индикаторами изменений, происходящих в биотопах. Микроводоросли прибрежных морских экосистем обитают в стрессовых условиях (Pezzolesi et al., 2012; Gorelova et al., 2015). От сезона к сезону изменяются не только показатели обилия фитопланктона (численность, биомасса, хлорофилл а), но и морфология микроводорослей. В частности, при наступлении неблагоприятных условий в конце вегетационного периода изменяются форма и размеры клеток, окраска протопласта (Коновалова, 1972, 1984, 1998; Селина, 1998; Орлова, Айздайчер, 2000). Остается неясным, что происходит на ультраструктурном уровне в клетках микроводорослей в условиях стресса и одинаков ли отклик на происходящие изменения у представителей фитопланктона разных таксономических групп.
Лабораторные культуры − это важнейший инструмент при изучении биологии микроводорослей. К настоящему времени накоплены экспериментальные данные о внутривидовых изменениях, происходящих в культурах морских микроводорослей (Boussiba, 2000; Lakeman et al., 2009; Соловченко, 2012). Значительные перестройки, которые наблюдаются в условиях культивирования, затрагивают все аспекты биологии этих организмов: жизненные циклы, физиологию, биохимию и геномы (Murphy, 1978; Kuwata et al., 1993; Connell, Cattolico, 1996; Жукова и др., 1998; Paasche, 2001; Chepurnov, Mann, 2004; Montresor, Lewis, 2005; von Dassow et al., 2006 и др.). Работы, описывающие морфологию клеток в накопительной культуре, единичны (Gantt, Conti, 1966; Орлова, Айздайчер, 2000; Liu, Lin, 2001; Орлова и др., 2011а). Особый интерес представляет сравнительное изучение ультраструктуры микроводорослей из разных таксономических групп в условиях стресса, однако подобные данные отсутствуют. Результаты таких исследований могут дать дополнительную информацию о механизмах адаптации микроводорослей к неблагоприятным условиям и приблизить к пониманию стратегии выживания этих организмов.
Цель настоящей работы − на основании анализа ультраструктуры морских микроводорослей выявить универсальный механизм ответа на стресс у представителей разных систематических групп в накопительной культуре.
МАТЕРИАЛ И МЕТОДИКА
Объектами исследования служили клоновые культуры микроводорослей, поддерживающихся в коллекции морских микроводорослей MBRU ресурсного центра “Морской биобанк” (ННЦМБ ДВО РАН) http://marbank.dvo.ru: Ostreopsis sp. 1 Dinoflagellata (MBRU_ORUS22), Tisochrysis lutea Bendif et Probert Haptophyta (MBRU_Tiso-08), Porphyridium purpureum (Bory) K.M. Drew & R. Ross Rhodophyta (MBRU_PP-AB11) и Heterosigma akashiwo (Hada) Hada ex Y. Hara et Chihara Ochrophyta (MBRU_HAK17). Водоросли выращивали автотрофно в условиях накопительной культуры в колбах Эрленмейера объемом 50 мл при температуре 20°C и освещении белым светом 20 мкмоль/(м2 с) со светотемновым периодом 12 ч свет : 12 ч темнота в климатостатах Binder KBW 400 (Germany). Ostreopsis sp. 1 культивировали на питательной среде К, остальные микроводоросли – на среде f. Питательные среды соленостью 32‰ готовили на основе фильтрованной и стерилизованной морской воды (Орлова и др., 2011б). Водоросли выращивали в течение 60 сут без пересева и добавления свежей питательной среды. Клетки микроводорослей для изучения с помощью трансмиссионной электронной микроскопии (ТЭМ) отбирали на следующих стадиях: логарифмической (экспоненциальной) стадии роста клеток (7 сут), стационарной стадии (30 сут) и на стадии отмирания (60 сут). Логарифмическая стадия роста клеток характеризуется удвоением численности клеток с постоянной скоростью. На стационарной стадии скорость роста популяции равна скорости ее гибели. На стадии отмирания скорость гибели клеток превышает скорость прироста популяции (Fogg, 1966). Скорость роста микроводорослей рассчитывали по общепринятой методике (Guillard, Ryther, 1962).
Световая микроскопия (СМ) и флуоресцентная микроскопия выполнены с помощью микроскопа Imager Z2 (Carl Zeiss, Германия); для регистрации автофлуоресценции хлорофилла а использовали фильтр № 45 (длина волны возбуждения 480 нм, длина волны испускания 690 нм). Снимки получены с помощью камеры AxioCam HRc (Carl Zeiss, Германия). Для ТЭМ клетки водорослей фиксировали в течение 2 ч в 2.5% глютаральдегиде на фосфатном буфере (pH 7.4), а затем в 1% четырехокиси осмия на этом же буфере в течение 1 ч. Для повышения контрастности клетки окрашивали 0.15% раствором рутения красного в течение 15 мин. Материал обезвоживали в серии спиртов возрастающей концентрации и ацетона, затем заливали в смесь эпона и аралдита (Fluka, Швейцария) по стандартной методике (Luft, 1961). Срезы толщиной 70 нм изготавливали с помощью алмазного ножа (Diatome, Швейцария) на ультрамикротоме Ultracut R (Leica microsystem, Germany) и контрастировали 2% раствором уранилацетата и цитратом свинца по стандартной методике (Reynolds, 1963). Срезы изучали на трансмиссионном электронном микроскопе Libra 120 (Carl Zeiss, Germany); ускоряющее напряжение составляло120 кВ.
РЕЗУЛЬТАТЫ
Ostreopsis sp. 1
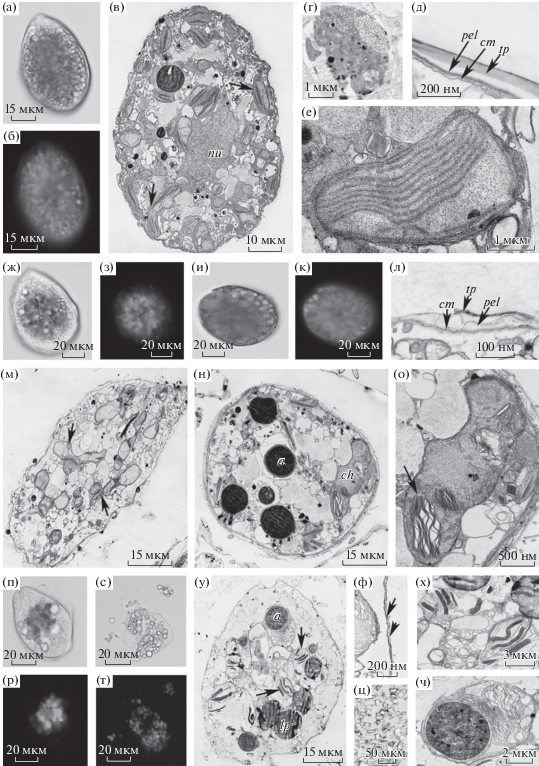
На экспоненциальной стадии роста клетки каплевидной формы, золотисто-коричневого цвета; многочисленные хлоропласты расположены хаотично (рис. 1а–1в). Аккумулятивные (накопительные) тельца округлой формы диаметром до 3 мкм средней электронной плотности с четким контуром и электронно-плотными внутренними включениями (рис. 1г). Амфиесма (оболочка, характерная для динофитовых водорослей) представлена комплексом структур: цитоплазматической мембраной, слоем текальных (или амфиесмальных) пластин и пелликулярным слоем (рис. 1д). Тилакоиды хлоропластов собраны в стопки по 3 (рис. 1е). На стационарной стадии клетки коричневого цвета, округлые, с уплотненным внутренним содержимым (рис. 1ж–1к, 1м, 1н). Наблюдается изменение в строении амфиесмы: частичное разрушение текальных пластин (рис. 1л). Отмечено нарушение топографии тилакоидов, в частности, увеличение интратилакоидного пространства (рис. 1о). Аккумулятивные тельца увеличиваются в размерах до 8–9 мкм (рис. 1н). На стадии отмирания преобладают округлые клетки, они более светлые, чем на предыдущих стадиях (рис. 1п–1у); размер хлоропластов уменьшается, интенсивность их флуоресценции снижается. Амфиесма теряет слой текальных пластин (рис. 1ф). Тилакоиды разрушаются, у многих отсутствует интратилакоидное пространство – наблюдается слияние тилакоидов (рис. 1х). Диаметр аккумулятивных телец увеличивается до 5 мкм (рис. 1ч). На периферии клеток появляются агрегаты кристаллического материала размером до 0.1 мкм в ширину и до 0.2 мкм в длину (рис. 1ц).
Рис. 1.
Ostreopsis sp. 1. а–е – клетки на экспоненциальной стадии роста: а – общий вид (СМ); б – автофлуоресценция хлоропластов; в – общий вид (ТЭМ); г – аккумулятивное тельце; д – амфиесма; е – хлоропласт. ж–о – клетки на стационарной стадии роста: ж, и – общий вид (СМ); з, к – автофлуоресценция хлоропластов; л – амфиесма; м, н – общий вид (ТЭМ), стрелкой указаны хлоропласты; о – строение хлоропластов, стрелкой указаны тилакоиды. п–ч − клетки на стадии отмирания популяции: п–т – общий вид (СМ); р, т – автофлуоресценция хлоропластов; у – общий вид (ТЭМ), стрелками указаны хлоропласты; ф – амфиесма; х – хлоропласт; ц – агрегаты кристаллического материала; ч – аккумулятивное тельце. Обозначения: a – аккумулятивные тельца; ch – хлоропласт; cm – цитоплазматическая мембрана; lp – липидные капли; nu – ядро, стрелками указаны хлоропласты; pel – пелликулярный слой (пелликула); tp – слой текальных пластин.
Tisochrysis lutea
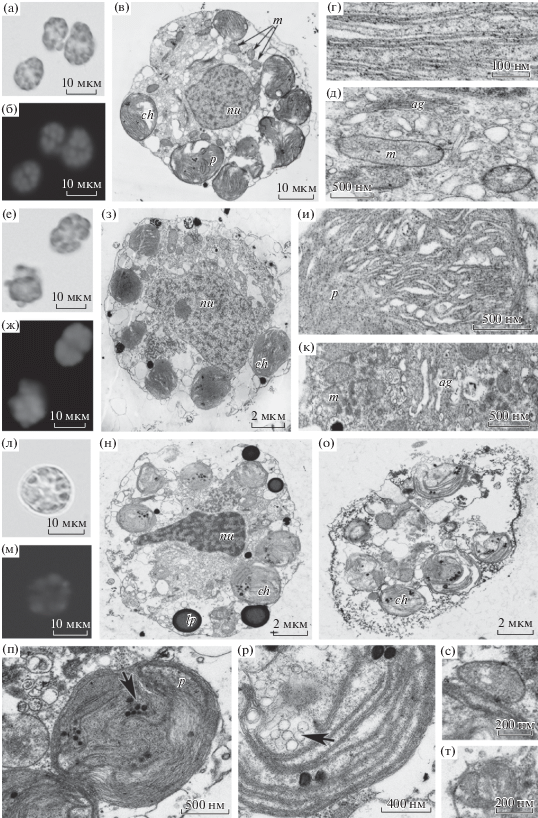
На экспоненциальной стадии роста клетки округлой формы с двумя пристенно расположенными хлоропластами золотистого цвета (рис. 2а, 2б). В цитоплазме видны липидные капли (рис. 2в). Покровы клетки представлены слоем органических чешуек, состоящих из двухслойных пластинок (рис. 2г). Тилакоиды не образуют организованных ламелл (рис. 2д). На стационарной стадии форма клеток не меняется, хлоропласты приобретают светло-коричневую окраску (рис. 2е, 2ж). На периферии клетки появляются липидные капли (рис. 2з, 2и). Морфология тилакоидов сохраняется (рис. 2к). На стадии отмирания преобладают клетки овальной формы; содержимое протопласта окрашено в светло-коричневый цвет (рис. 2л, 2м). В цитоплазме появляются пустоты, не заполненные органеллами (рис. 2н). Периферический слой цитоплазмы вакуолизирован, размер липидных капель увеличивается (рис. 2н, 2о). Отмечено нарушение топографии тилакоидов (рис. 2п).
Рис. 2.
Tisochrysis lutea. а–д − клетки на экспоненциальной стадии роста: а − общий вид (СМ); б – автофлуоресценция хлоропластов; в – общий вид (ТЭМ); г – покровы клетки, стрелками указаны органические щитки; д – хлоропласт. е–к − клетки на стационарной стадии роста: е – общий вид (СМ); ж – автофлуоресценция хлоропласта; з – общий вид (ТЭМ); и – покровы, стрелками указаны щитки панциря; к – хлоропласт. л–п – клетки на стадии отмирания популяции: л − общий вид (СМ); м – автофлуоресценция хлоропласта; н – общий вид (ТЭМ); о − покровы клетки, стрелками указаны щитки панциря; п – хлоропласт. Условные обозначения ch, cm, lp, nu такие же, как на рис. 1.

Porphyridium purpureum
На экспоненциальной стадии роста клетки округлые, с одним ярко-красным крупным звездчатым хлоропластом c пиреноидом в центральной части клетки (рис. 3а, 3б); имеются липидные капли (рис. 3в). Клеточная оболочка состоит из двух слоев: внутреннего целлюлозного и наружного мукополисахаридного толщиной около 0.4 мкм (рис. 3г). Тилакоиды одиночные (рис. 3д). На стационарной стадии форма и окраска клеток изменяются (рис. 3е–3з). Размер липидных капель увеличивается (рис. 3з). Толщина мукополисахаридного конверта возрастает до 1 мкм (рис. 3и). Топография тилакоидов не меняется (рис. 3к). На стадии отмирания форма клеток не меняется; цвет клеток красный, менее насыщенный (рис. 3л); автофлуоресценция хлорофилла более тусклая (рис. 3м). Увеличиваются количество и размер (до 4 мкм в диаметре) липидных капель (рис. 3н). В строме хлоропласта некоторых клеток наблюдается слияние тилакоидов с образованием электронно-плотных структур (рис. 3о); пиреноид сохраняется. У некоторых клеток отмечено появление неизвестного образования, внешне похожего на перфорированную пластинку (рис. 3п). Мукополисахаридный конверт утолщается до 2 мкм (рис. 3р).
Рис. 3.
Porphyridium purpureum. а–д − клетки на экспоненциальной стадии роста: а – общий вид (СМ); б – автофлуоресценция хлоропласта; в – общий вид (ТЭМ), короткой стрелкой указан мукополисахаридный конверт, длинной стрелкой указана клеточная мембрана; г – мукополисахаридный конверт; д – тилакоиды. е–к − клетки на стационарной стадии роста: е – общий вид (СМ); ж – автофлуоресценция хлоропласта; з – общий вид (ТЭМ); и – мукополисахаридный конверт; к – хлоропласт. л–р – клетки на стадии отмирания популяции: л – общий вид (СМ); м – автофлуоресценция хлоропласта; н – общий вид (ТЭМ); о – хлоропласт, короткой стрелкой указаны пластоглобулы, длинной стрелкой указано слипание тилакоидов; п – перфорированная пластинка; р – мукополисахаридный конверт. Условные обозначения ch, lp, nu такие же, как на рис. 1; m – мукополисахаридный конверт.

Heterosigma akashiwo
На экспоненциальной стадии роста клетки овальной формы золотисто-коричневого цвета (рис. 4а); хлоропласты обладают хорошо выраженной флуоресценцией (рис. 4б). Ультраструктура всей клетки представлена на рис. 4в. По 2−3 тилакоида объединены в ламеллы (рис. 4г). Митохондрии вытянутой овальной формы с тубулярными кристами размером 0.5–1.5 мкм (рис. 4в, 4д). На стационарной стадии форма клеток более округлая, их цвет сохраняется (рис. 4е, 4ж). Интратилакоидное пространство в хлоропластах увеличивается (рис. 4и). В цитоплазме появляются пустоты (рис. 4з). Митохондрии не изменяются (рис. 4з, 4к). На стадии отмирания форма клеток округлая; цвет хлоропластов более блеклый, а автофлуоресценция хлорофилла более тусклая (рис. 4е, 4ж). Преобладают клетки с выраженными изменениями (рис. 4н): клеточная оболочка начинает распадаться, часть цитоплазмы светлая и лишена органелл (рис. 4о). Хлоропласты с множеством электронно-светлых областей; количество пластоглобул увеличивается (рис. 4п). Тилакоиды дистанцируются друг от друга; в строме появляется множество небольших электронно-светлых пузырьков диаметром около 80 нм (рис. 4р). Отмечены разрушенные митохондрии (рис. 4с, 4т).
Рис. 4.
Heterosigma akashiwo. а–д – клетки на экспоненциальной стадии роста: а – общий вид (СМ); б – автофлуоресценция хлоропластов; в – общий вид (ТЭМ); г − тилакоиды хлоропластов; д − аппарат Гольджи и митохондрии. е–к – клетки на стационарной стадии роста: е – общий вид (СМ); ж − автофлуоресценция хлоропластов; з – общий вид (ТЭМ); и – хлоропласт; к − фрагмент ультраструктуры клетки. л–т – клетки на стадии отмирания популяции: л – общий вид (СМ); м − автофлуоресценция хлоропластов; н, о – общий вид (ТЭМ); п – хлоропласт, стрелкой указана группа пластоглобул; р – хлоропласт, стрелкой указана вакуолизация стромы хлоропласта; с – неизмененная митохондрия; т – поврежденная митохондрия. Условные обозначения ch, lp, nu такие же, как на рис. 1; ag – аппарат Гольджи, m – митохондрия.
ОБСУЖДЕНИЕ
Исследование показало, что в условиях длительной накопительной культуры у морских микроводорослей из разных таксономических групп изменение ультраструктуры происходило по общему сценарию и у большинства исследованных клеток затрагивало в основном фотосинтетический аппарат, покровы клетки, а также липидные капли (рис. 5). У всех изученных нами видов микроводорослей на стадии отмирания значительно изменялся фотосинтетический аппарат. Это выражалось как в увеличении расстояния между тилакоидами (Heterosigma akashiwo, Tisochrysis lutea), так и в их слиянии (Porphyridium purpureum, Ostreopsis sp. 1). Ранее было показано, что при стрессовых условиях в первую очередь происходит морфологическая и функциональная перестройка фотосинтетического аппарата микроводорослей (Воскобойников, 1980; Voronova et al., 2009; Holzinger, Karsten, 2013). У диатомовой водоросли Attheya ussurensis на стационарной стадии наблюдалось деформирование хлоропластов, а при неблагоприятных условиях отмечено их разрушение и снижение флуоресценции (Орлова и др., 2011а).
Рис. 5.
Ультраструктурные изменения в культурах микроводорослей Ostreopsis sp. 1 (O), Porphyridium purpureum (P), Heterosigma akashiwo (H) и Tisochrysis lutea (T) на стадии экспоненциального роста (а) и на стадии отмирания (б): Хл – хлоропласты, МК – мукополисахаридный конверт, ПЕЛ – пелликулярный слой, Т – тека, Л – липидные гранулы, Ак – агрегаты кристаллического материала. Короткими стрелками указаны аккумулятивные тельца.

Общей чертой развития ответа у микроводорослей на стрессовые условия культивирования было увеличение числа и размера липидных капель. Так, у T. lutea липидные капли на стационарной стадии и при отмирании могли занимать большую часть цитоплазмы клетки. Сходные данные были получены для этого вида ранее (Liu, Lin, 2001). Ультраструктурные исследования показали, что на стационарной стадии роста культуры размеры, а также количество липидных капель увеличивались и наблюдалась их концентрация в межтилакоидном пространстве хлоропластов. У P. purpureum на стационарной стадии липидные капли также заполняли почти весь объем клетки, что согласуется с данными по формированию и мобилизации липидных капель на стационарной стадии роста зеленой водоросли Chlorella vulgaris (см.: Přibyl et al., 2013). Известно, что ответом на недостаток питательных веществ является активное формирование в цитоплазме крупных липидных капель, которые характеризуются высоким содержанием триацилглицеролов, активно участвующих в процессах адаптации фотоавтотрофных организмов к изменению факторов среды и используемых как резервные вещества (Basova, 2005; Hu et al., 2008; Соловченко, 2012; Přibyl et al., 2013; Gorelova et al., 2015). Увеличение количества цитоплазматических и стромальных липидных капель в клетках изученных нами видов микроводорослей подтверждает существование универсального адаптационного процесса, направленного на сохранение жизнеспособности микроводорослей (Соловченко, 2012).
В течение культивирования наиболее значительно строение покровов клетки изменялось у Ostreopsis sp. 1 и P. purpureum. К концу стационарной стадии большинство клеток Ostreopsis sp. 1 утрачивали слой текальных пластин и внешней оболочкой становился пелликулярный слой. Известно, что в период стрессовых воздействий именно этот слой формирует оболочку временных цист динофлагеллят (Коновалова, 1998; Bravo et al., 2012). Ранее неоднократно отмечали, что изменение строения амфиесмы у динофлагеллят зависит не только от внешних условий, но и от фазы роста микроводоросли, а также от клеточного цикла. Данный процесс − это сложный и до конца неясный механизм адаптации к изменяющимся условиям (Kwok, Wong, 2003; Pozdnyakov, Skarlato, 2012; Kalinina et al., 2018). Возможно, перестройка покровов у динофлагеллят связана с перестройкой метаболизма всей клетки и не зависит от нарушений органелл. Изменение покровов, в частности утолщение мукополисахаридного слоя у P. purpureum, может выполнять защитную функцию. Подобное явление отмечено и у других видов микроводорослей при наступлении неблагоприятных условий (Gantt, Conti, 1966; Hagen et al., 2002).
В результате проведенных исследований зарегистрированы внутри- и межвидовые различия ультраструктуры клеток у всех изученных видов на разных стадиях роста. В условиях длительного культивирования (без внесения в среду дополнительных питательных веществ) наиболее значительные ультраструктурные перестройки наблюдали у H. akashiwo, наименьшие – у P. purpureum. Установлены общие и специфические изменения морфологии клеточных структур у микроводорослей из разных таксономических групп. В стрессовых условиях длительного культивирования в первую очередь затрагивались фотосинтетический аппарат, покровы клетки и липидные капли. В хлоропластах наблюдали изменение интратилакоидного пространства, которое либо уменьшалось (P. purpureum, Ostreopsis sp. 1), либо увеличивалось (H. akashiwo, T. lutea). Отмечено увеличение количества и размера липидных капель у всех изученных водорослей, а также появление агрегатов кристаллического материала у Ostreopsis sp. 1. Формирование агрегатов кристаллического материала ранее было описано у пелликулярных цист и гипнозигот динофлагеллят на стадии покоя (Doucette et al., 1989). Предполагается, что данные образования могут участвовать в закладке дополнительных клеточных покровов на стадии цистирования (Doucette et al., 1989). Мы также полагаем, что наблюдаемые изменения в культуре Ostreopsis sp. 1 могут свидетельствовать о подготовке клеток динофлагелляты к переходу в состояние покоя.
Список литературы
Воскобойников Г.М. Морфо-функциональные изменения одноклеточной водоросли Euglena gracilis Klebs при длительном содержании в темноте на минеральной среде: Автореф. дис. … канд. биол. наук. Л. 1980. 22 с.
Жукова Н.В., Орлова Т.Ю., Айздайчер Н.А. Жирнокислотный состав как показатель физиологического состояния диатомовой водоросли Pseudonitzschia pungens в природной среде и в культуре // Биол. моря. 1998. Т. 24. № 1. С. 44−48.
Коновалова Г.В. Сезонная характеристика фитопланктона в Амурском заливе Японского моря // Океанология. 1972. Т. 12. № 1. С. 123−128.
Коновалова Г.В. Структура планктонного фитоценоза зал. Восток // Биол. моря. 1984. № 1. С. 13−23.
Коновалова Г.В. Динофлагелляты (Dinophyta) дальневосточных морей России и сопредельных акваторий Тихого океана. Владивосток: Дальнаука. 1998. 299 с.
Орлова Т.Ю., Айздайчер Н.А. Особенности развития в культуре диатомовой водоросли Chaetoceros salsugineus из Японского моря // Биол. моря. 2000. Т. 26. № 1. С. 11–15.
Орлова Т.Ю., Айздайчер Н.А., Стоник И.В. и др. Морфология, развитие и состояние фотосинтетического аппарата диатомовой водоросли Attheya ussurensis Stonik, Orlova et Crawford, 2006 (Bacillariophyta) в условиях длительного культивирования // Биол. моря. 2011а. Т. 37. № 6. С. 403–412.
Орлова Т.Ю., Айздайчер Н.А., Стоник И.В. Лабораторное культивирование морских микроводорослей, включая продуцентов фитотоксинов: научно-методическое пособие. Владивосток: Дальнаука. 2011б. 89 с.
Селина М.С. Фитопланктон залива Восток Японского моря: Автореф. дис. … канд. биол. наук. Владивосток. 1998. 25 с.
Соловченко А.Е. Физиологическая роль накопления нейтральных липидов эукариотическими микроводорослями при стрессах // Физиол. раст. 2012. Т. 59. С. 192–202.
Basova M.M. Fatty acid composition of lipids in microalgae // Int. J. Algae. 2005. V. 7. P. 33–57.
Boussiba S. Carotenogenesis in the green alga Haematococcus pluvialis: cellular physiology and stress response // Physiol. Plant. 2000. V. 108. № 2. P. 111–117.
Bravo I., Vila M., Casabianca S. et al. Life cycle stages of the benthic palytoxin-producing dinoflagellate Ostreopsis cf. ovata (Dinophyceae) // Harmful Algae. 2012. V. 18. P. 24–34.
Chepurnov V.A., Mann D.G. Auxosporulation of Licmophora communis (Bacillariophyta) and a review of mating systems and sexual reproduction in araphid pennate diatoms // Phycol. Res. 2004. V. 52. P. 1–12.
Connell L., Cattolico R.A. Fragile algae: axenic culture of field-collected samples of Heterosigma carterae // Mar. Biol. 1996. V. 125. P. 421–426.
Doucette G.J., Cembella A.D., Boyer L.G. Cyst formation in the red tide dinoflagellate Alexandrium tamarense (Dinophyceae): effects of iron stress // J. Phycol. 1989. V. 25. P. 721–731.
Fogg G.E. Algal culture and phytoplankton ecology. Madison: Univ. of Wisconsin Press. 1966. 104 p.
Gantt E., Conti S.F. Granules associated with the chloroplast lamellae of Porphyridium cruentum // J. Cell Biol. 1966. V. 39. P. 423–434.
Gorelova O., Baulina O., Solovchenko A. et al. Coordinated rearrangements of assimilatory and storage cell compartments in a nitrogen-starving symbiotic chlorophyte cultivated under high light // Arch. Microbiol. 2015. V. 197. № 2. P. 181–195.
Guillard R.R.L., Ryther J.H. Studies of marine planktonic diatoms. 1. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) Gran // Can. J. Microbiol. 1962. V. 8. № 2. P. 229–239.
Hagen C., Siegmund S., Braune W. Ultrastructural and chemical changes in the cell wall of Haematococcus pluvialis (Volvocales, Chlorophyta) during aplanaspore formation // Eur. J. Phycol. 2002. V. 37. P. 217–226.
Holzinger A., Karsten U. Desiccation stress and tolerance in green algae: consequences for ultrastructure, physiological and molecular mechanisms// Front. Plant Sci. 2013. V. 4. P. 327. https://doi.org/10/3389/fpls.2013.00327
Hu Q., Sommerfeld M., Jarvis E. et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances // Plant J. 2008. V. 54. P. 621–639.
Kalinina V., Matantseva O., Berdieva M., Skarlato S. Trophic strategies in dinoflagellates: how nutrients pass through the amphiesma// Protistology. 2018. V. 12. P. 3–11.
Kuwata A., Hama T., Takahashi M. Ecophysiological characterization of two life forms, resting spores and resting cells, of a marine planktonic diatom, Chaetoceros pseudocurvisetus, formed under nutrient depletion // Mar. Ecol. Prog. Ser. 1993. V. 102. P. 245–255.
Kwok A.C.M., Wong J.T.Y. Cellulose synthesis is coupled to cell cycle progression at G1 in the dinoflagellate Crypthecodinium cohnii // Plant Physiol. 2003. V. 131. P. 1681–1691.
Lakeman M.B., von Dassow P., Cattolico R.A. The strain concept in phytoplankton ecology // Harmful Algae. 2009. V. 8. P. 746–758.
Liu C., Lin L. Ultrastructural study and lipid formation of Isochrysis sp. CCMP1324 // Bot. Bull. Acad. Sin. 2001. V. 42. P. 207–214.
Luft J.H.J. Improvements in epoxy resin embedding methods // J. Biophys. Biochem. Cytol. 1961. V. 9. P. 409–414.
Montresor M., Lewis J.M. Phases, stages and shifts in the life cycles of marine phytoplankton //Algal cultures, analogues of blooms and applications. Enfield, USA: Science Publishers. 2005. P. 91–129.
Murphy L.S. Biochemical taxonomy of marine phytoplankton by electrophoresis of enzymes. II. Loss of heterozygosity in clonal cultures of the centric diatoms Skeletonema costatum and Thalassiosira pseudonana // J. Phycol. 1978. V. 14. P. 247–250.
Paasche E. A review of the coccolithophorid Emiliania huxleyi (Prymnesiophyceae), with particular reference to growth, coccolith formation, and calcification-photosynthesis interactions // Phycologia. 2001. V. 40. P. 503−529.
Pezzolesi L., Guerrini F., Ciminiello P. et al. Influence of temperature and salinity on Ostreopsis cf. ovata growth and evaluation of toxin content through HR LC-MS and biological assays // Water Res. 2012. V. 46. P. 82–92.
Pozdnyakov I., Skarlato S. Dinoflagellate amphiesma at different stages of the life cycle // Protistology. 2012. V. 7. P. 108–115.
Přibyl P., Cepák V., Zachleder V. Production of lipids and formation and mobilization of lipid bodies in Chlorella vulgaris // J. Appl. Phycol. 2013. V. 25. P. 545–553.
Reynolds E. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy // J. Cell Biol. 1963. V. 17. P. 208–212.
von Dassow P., Chepurnov V.A., Armbrust E.V. Relationships between growth rate, cell size, and induction of spermatogenesis in the centric diatom Thalassiosira weissflogii (Bacillariophyta) // J. Phycol. 2006. V. 42. P. 887–899.
Voronova E.N., Konyukhov I.V., Kazimirko Yu.V. et al. Changes in the condition of photosynthetic apparatus of a diatom alga Thalassiosira weisflogii during photoadaptation and photodamage // Russ. J. Plant Physiol. 2009. V. 56. № 6. P. 753–760.
Дополнительные материалы отсутствуют.


