Биология моря, 2019, T. 45, № 4, стр. 250-259
Ультраструктура спермиев и особенности репродуктивной системы симбиотрофного двустворчатого моллюска Calyptogena pacifica Dall, 1891 (Vesicomyidae: Pliocardiinae)
А. Л. Дроздов 1, 4, *, Е. М. Крылова 2, А. А. Кудрявцев 3, 5, С. В. Галкин 2, С. А. Тюрин 1, 4
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
2 Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
3 Зоологический институт РАН
199034 Санкт-Петербург, Россия
4 Дальневосточный федеральный университет
690950 Владивосток, Россия
5 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: anatoliyld@mail.ru
Поступила в редакцию 07.08.2018
После доработки 07.02.2019
Принята к публикации 07.02.2019
Аннотация
Плиокардиины (Bivalvia: Vesicomyidae: Pliocardiinae) являются хемосимбиотрофной группой двустворчатых моллюсков, облигатных для восстановительных биотопов. Эти моллюски содержат в клетках жабр внутриклеточные тиосимбиотрофные бактерии и живут за счет органики, синтезируемой данными бактериями. Изучены ультраструктура сперматозоидов и состояние гонад в июне 2016 г. у Calyptogena pacifica. Материал был собран в Беринговом море на склонах вулкана Пийпа на глубине 466 м. Моллюски находились в преднерестовом состоянии. В гонадах отмечены активные процессы сперматогенеза и овогенеза. Зрелые сперматозоиды имели удлиненную пулеобразную головку длиной 4 ± 0.2 мкм от кончика акросомы до основания средней части. Средняя часть была образована комплексом из четырех сферических митохондрий диаметром около 0.7 мкм каждая. В дистальном районе средней части спермия располагался электронно-плотный материал, предположительно липидной природы. Диаметр зрелых яиц С. pacifica составлял около 200 мкм. Вновь полученные результаты обсуждаются в контексте уже известных данных о морфологии гамет плиокардиин.
Восстановительные биотопы, формирующиеся в районах выходов метан- и сульфидсодержащих флюидов, резко отличаются от фоновой среды по физико-химическим параметрам. В условиях восстановительных биотопов развиваются сообщества организмов, основанные на бактериальном хемосинтезе. Такие биотопы и ассоциированные с ними сообщества имеют ярко выраженное “островное” распределение и при этом широко распространены в Мировом океане. Некоторые облигатные для восстановительных условий хемосимбиотрофные виды характеризуются протяженным трансокеаническим распространением, при котором места их нахождений разделены громадными пространствами, непригодными для жизни взрослых особей. Для понимания механизмов расселения облигатных хемосимбиотрофных животных и формирования фауны разобщенных восстановительных биотопов актуальны вопросы, связанные с особенностями репродуктивной биологии.
Плиокардиины (Bivalvia: Vesicomyidae: Pliocardiinae) являются одной из характерных симбиотрофных групп. В настоящее время в подсемействе насчитывается более 110 видов (Johnson et al., 2017). Они распространены в Мировом океане от шельфа до океанических желобов и населяют все типы восстановительных биотопов (Krylova, Sahling, 2010). Выделяют 20 родов плиокардиин (Krylova et al., 2014), однако многие виды не имеют однозначного родового определения, а система подсемейства не доработана, несмотря на использование признаков строения раковин, мягкого тела и молекулярных маркеров (Audzijonyte et al., 2012; Decker et al., 2012; Johnson et al., 2017).
Известно, что признаки строения сперматозоидов – одни из наиболее филогенетически значимых для двустворчатых моллюсков (Дроздов, Иванков, 2000; Bieler et al., 2014). Тем не менее сведения по морфологии гамет плиокардиин в литературе скудны. По опубликованным данным (Fujiwara et al., 1998; Parra et al., 2009) для них характерен тип спермиев, адаптированных к наружному осеменению, так называемые примитивные (Franzén, 1956), или классические (Дроздов, Иванков, 2000), спермии. Этот тип жгутиковых спермиев характеризуется бочонковидной, пулеобразной или цилиндрической головкой, состоящей из ядра с акросомой, и средней частью спермия с двумя взаимно перпендикулярными центриолями, окруженными четырьмя митохондриями; от дистальной центриоли отходит хвостовой жгут. Признаки спермиев, которые могли бы быть характерными для отдельных родов плиокардиин, неизвестны.
Одним из наиболее крупных родов в подсемействе является род Calyptogena Dall, 1891, включающий 10 видов (Krylova, Sahling, 2006). Типовой вид рода С. pacifica Dall, 1891 широко распространен в Тихом океане: он встречается в его восточной части вдоль Северо-Американского побережья от Аляски до Калифорнии, а также в северо-западной Пацифике в Беринговом море на склоне вулкана Пийпа (Krylova, Sahling, 2006) и на склоне Корякского нагорья (Данилин, 2013; Krylova et al., 2018). Обычно С. pacifica обитает на глубине 500–900 м, хотя известны ее находки с глубины от 361 м (район северной Калифорнии) до 2423 м (хребет Хуан де Фука, северо-восточная Пацифика) (Krylova, Sahling, 2006; Audzijonyte et al., 2012).
В литературе имеются немногочисленные данные о строении репродуктивной системы и сперматозоидов у C. pacifica из зал. Монтерей, Калифорния (Lisin et al., 1997), а также у другого вида из рода Calyptogena – C. gallardoi, обитающего у побережья Чили (Parra et al., 2009). В настоящей работе исследованы ультраструктура спермиев и состояние гонад в июне 2016 г. у C. pacifica, обитающей на склонах вулкана Пийпа. Вновь полученные данные, а также опубликованная информация о строении спермиев и яйцеклеток, о синхронности и сезонности репродуктивных процессов у плиокардиин обсуждаются в сравнительном аспекте. Мы полагаем, что сведения о структуре спермиев у разных представителей плиокардиин помогут разрешить проблемы, связанные с построением системы родов подсемейства, а информация о биологии размножения необходима для понимания механизмов поддержания обширных разорванных ареалов многих видов плиокардиин.
МАТЕРИАЛ И МЕТОДИКА
Материал для исследования репродуктивной системы получен от двух половозрелых экземпляров Calyptogena pacifica, собранных в Беринговом море в районе подводного вулкана Пийпа в 75-м рейсе НИС “Академик Лаврентьев” с помощью манипулятора телеуправляемого необитаемого подводного аппарата (ТНПА) “Команч 18” (станция LV-75-15, 55°22.9′ N, 167°15.66′ E, 466 м, 16 июня 2016 г., материал хранится в Институте океанологии РАН). Для подтверждения таксономического определения моллюсков использовали 14 экз. C. pacifica, фиксированных в этаноле, которые были собраны на этой же станции.
Моллюсков сразу после сбора поместили в емкость с забортной морской водой. Фрагменты гонад отбирали спустя несколько часов после сбора животных. Перед фиксацией фрагменты гонад и содержимое мантийной полости изучали с помощью инвертированного светового микроскопа Leica DM IL. Для ультраструктурного исследования сперматозоидов кусочки семенников фиксировали в 2.5% глютаральдегиде на 0.1 М какодилатном буфере с добавлением хлорида натрия до тоничности морской воды. Материал дофиксировали в 1% OsO4 на какодилатном буфере, обезвоживали по стандартной методике в спиртах и заключали в смесь эпон–аралдит. Ультратонкие срезы получали на ультратоме Ultracut фирмы Reichert. Срезы последовательно окрашивали уранилацетатом и цитратом свинца, затем просматривали в электронном микроскопе Carl Zeiss Libra 120.
Район сбора материала
Подводный вулкан Пийпа находится в Командорской котловине Берингова моря в 75 км от о-ва Беринга и в 335 км от п-ва Камчатка. Вулкан имеет Южную (447 м) и Северную (360 м) вершины, которые находятся в двух милях друг от друга и разделены седловиной с максимальной глубиной 650 м (Сагалевич и др., 1992). Особи C. pacifica встречались на глубине 466–489 м на Южной вершине вдоль трещин в покровных гидротермальных отложениях, присыпанных слоем зеленовато-серого осадка. Предполагается, что через трещины происходит поступление низкотемпературного флюида, обогащенного метаном (Сагалевич и др., 1992).
РЕЗУЛЬТАТЫ
Морфология взрослых моллюсков
Раковины сильно коррозированы (рис. 1). У некоторых экземпляров створки настолько истончены, что наблюдается растворение подмакушечной части замкового края, а в районах отпечатков аддукторов имеются сквозные отверстия. Зубы замка развиты нормально. На правой створке замочный аппарат состоит из вентрального кардинального зуба, подмакушечного кардинального зуба с передней и широкой задней ветвями, а также из гребня, расположенного на нимфе. На левой створке развиты передний подмакушечный кардинальный зуб с передней и задней ветвями, а также задний кардинальный зуб, который длиннее половины нимфы. У раковин всех экземпляров имеются глубокий щиток и хорошо заметная мантийная линия без синуса.
Все исследованные моллюски раздельнополы. Наблюдается половой диморфизм: у самцов раковины обычно меньше, чем у самок, они более вытянуты, с покатым заднедорсальным краем, в то время как у самок раковины более крупные, широкоовальной формы, с менее покатым задне-дорсальным краем (рис. 1).
Строение репродуктивной системы
У самок в яичниках в центральной части трубочек расположены зрелые яйца, а по периферии к стенкам трубочек прилегают растущие овоциты, которых сравнительно много. Основная часть овоцитов еще не закончила рост и не готова к нересту. Диаметр зрелых яиц достигает 200 мкм (рис. 2). Они окружены двумя оболочками: желточной толщиной 2 мкм и внешней толщиной 7 мкм. Цитоплазма яиц заполнена многочисленными желточными гранулами и липидными каплями.
Рис. 2.
Овоциты Сalyptogena pacifica: а – растущий овоцит; б – зрелая яйцеклетка (целостность нарушена). n – ядро; nc – ядрышко, стрелкой обозначена оболочка яйцеклетки. Шкала 50 мкм.

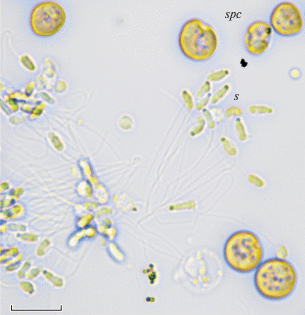
Семенники изученных моллюсков организованы как система трубочек и ацинусов. Стенки семенников выстланы герминативным эпителием и вспомогательными клетками. Герминативный эпителий включает гаметогенные клетки на разных стадиях развития: сперматогонии, сперматоциты и сперматиды. Большую часть ацинусов занимают сперматоциты сферической формы с зернистой цитоплазмой и ядром. Диаметр сперматоцитов около 6 мкм. Зрелые сперматозоиды локализованы в просвете ацинусов. При изучении нефиксированного материала сперматоциты и зрелые сперматозоиды легко вымывались из семенников (рис. 3).
Рис. 3.
Зрелые сперматозоиды и сперматогенные клетки Сalyptogena pacifica, вымытые из гонад. Прижизненные наблюдения. s – спермии, spc – сперматогенные клетки. Шкала 10 мкм.
Зрелые сперматозоиды имеют удлиненную пулеобразную головку длиной 4.3 ± 0.2 мкм от кончика акросомы до основания средней части (рис. 3–5). Средняя часть спермия образована комплексом из четырех сферических митохондрий диаметром около 0.7 мкм каждая, связанных между собой межмитохондриальными контактами (рис. 4е, 4ж). Митохондрии окружены двумя взаимно перпендикулярными центриолями: проксимальной и дистальной. Проксимальная центриоль расположена во впячивании дистальной части ядра – в центриолярной ямке. Дистальная центриоль окружена перицентриолярным комплексом, фиксирующим ее в дистальной части спермия. От дистальной центриоли отходит хвостовой жгутик длиной около 25 мкм. В средней части дистальнее митохондрий расположено кольцо гомогенного электронно-плотного материала предположительно липидной природы.
Рис. 4.
Сперматозоиды Сaliptogena pacifica в просвечивающем электронном микроскопе. а – продольный срез спермия; б – продольный срез акросомы; в – поперечный срез акросомы сперматиды; г – поперечный срез в дистальной части акросомы спермия; д, е, ж – поперечные срезы средней части спермия: д – видна электронно-плотная липидная капля, е – четыре митохондрии окружают дистальную центриоль с отходящим жгутиком, ж – митохондрии окружают взаимно перпендикулярно расположенные проксимальную и дистальную центриоли. Обозначения: ac – акросомный комплекс, av – акросомный пузырек, dc – дистальная центриоль, f – жгутик, imc – межмитохондриальный контакт, lm – липидный материал, m – митохондрия, n – ядро, pc – проксимальная центриоль, pm – субакросомный материал. Шкала: а – 1 мкм; б, в, г, д, е, ж – 0.5 мкм.
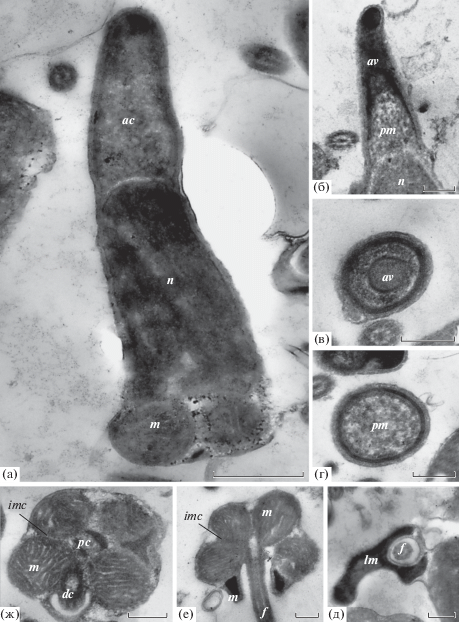
Удлиненно-коническая акросома длиной около 1.5 мкм расположена в апикальной части головки. Акросома состоит из двух частей: акросомного пузырька удлиненно-куполообразной формы, заполненного электронно-плотным гомогенным материалом, и зернистого субакросомного материала, примыкающего к ядру. Форма ядра усеченно-коническая со слегка выпуклой апикальной частью.
ОБСУЖДЕНИЕ
Морфология взрослых моллюсков
Анализ морфологических признаков изученных нами моллюсков, их сравнение с ранее собранными особями Calyptogena pacifica со склонов вулкана Пийпа (Krylova, Sahling, 2006), а также неопубликованные молекулярные данные (С. Шарина, неопубл. данные) свидетельствуют о правильности определения используемого в работе вида как C. pacifica.
В популяции C. pacifica со склона вулкана Пийпа был отмечен наружный половой диморфизм, описанный у этого вида и из других районов обитания (Coan et al., 2000; Krylova, Sahling, 2006). Половой диморфизм, выраженный в таких же вариациях формы раковины, показан для еще одного вида рода Calyptogena – C. gallardoi (см.: Parra et al., 2009). Поскольку сходные вариации в форме раковины имеются у многих видов рода Calyptogena (Krylova, Sahling, 2006), можно предположить, что половой диморфизм характерен для рода в целом.
Репродуктивный цикл
Судя по морфологии гонад, моллюски со склона вулкана Пийпа в середине июня 2016 г. были в преднерестовом состоянии. У самок и самцов при наличии зрелых гамет наблюдался активный процесс гаметогенеза. Эта информация согласуется с данными, полученными для C. pacifica, обитающей в районе углеводородных сочений в зал. Монтерей (Калифорния) на глубине 600 м (Lisin et al., 1997) (табл. 1). В течение трех месяцев с августа по октябрь 1994 г. в гонадах были представлены гаметы на разных стадиях развития, в том числе готовые к нересту яйцеклетки и сперматозоиды; количественные показатели развития репродуктивных тканей варьировали незначительно. Одновременное присутствие гамет на разных стадиях развития, включая зрелые, отмечено также для Phreagena soyoae (цит. как Calyptogena kilmeri, см.: Lisin et al., 1997), неописанного вида плиокардиин из района Блэйк Ридж (Heyl et al., 2007), для “Calyptogena” magnifica (Berg, 1985) и C. gallardoi (Parra et al., 2009). Асинхронность роста овоцитов свидетельствует о годовом репродуктивном цикле с несколькими нерестами или с непрерывным типом нереста, что не говорит об отсутствии сезонности в размножении.
Таблица 1.
Характеристика репродуктивной системы двустворчатых моллюсков плиокардиин (Vesicomyidae: Pliocardiinae)
| Вид | Размеры зрелых овоцитов, мкм | Максимальная длина головки со средней частью; максимальная длина жгутика, мкм | Форма ядра сперматозоида; число митохондрий | Форма и длина акросомы | Овоциты на разных стадиях роста в одной особи: есть (+) или нет (−); время наблюдений (если указано) | Сезонность нереста | Район сбора |
|---|---|---|---|---|---|---|---|
| “Calyptogena” magnifica | 309–482 (2) 100–200 (7) |
3; 8.5 (1) | Бочкообразная; 4 (8) | – | +; февраль 1979 (2) | – | Галапагосский рифт, 2450 м (2); 9° N, ВТП, 2515 м (7); ?(1); Калифорнийский залив, поднятие Аларкон, 2293 м (8) |
| Abyssogena phaseoliformis | 180 (7) | 4.8 (7) | Бочкообразная; 4 (4) | – | + (4) | – | Японский желоб, 5130–5695 м (4, 7) |
| “Archivesica” laubieri | – | – | – | – | + (4) | – | Каньон Тенрю, 3800–4020 м (4) |
| Phreagena soyoae | 4.5 (5) | Бочкообразная; 4 (5) | Куполообразная; 0.8 мкм (5) | + (3) | Нет; 11 актов нереста за 1.5 года (5) | Зал. Сагами, 1160 м (3), 1175 м (5) | |
| Phreagena soyoae (как Calyptogenakilmeri) | 180–237 (9) | – | – | – | +; июнь 1994– март 1995 (9) | Осенью и весной нерест более интенсивный, чем летом (9) | Зал. Монтерей, 900 м (9) |
| Phreagena okutanii | 210–250 (11) | – | – | – | + (11) | – | Зал. Сагами, 856–1055 м (11) |
| Pliocardia sp. | 200 (6) | – | – | – | + (6) | – | Западная Атлантика, Блейк Ридж, 2155 м (6) |
| Calyptogena gallardoi | 273.78 ± 23.12 (10) | 3.7±0.2; 26.5±2.5 (10) | Усеченно-коническая; 4 (10) | Удлиненно-коническая (10) | + (10) | – | Восточная Пацифика, зал. Консепсьон, 760–800 м (10) |
| Calyptogena pacifica | 180–220 (9) 200 (12) |
3.5; 12 (1) 4.3±0.2; 25 (12) |
Усеченно-коническая; 4 (12) | Удлиненно-коническая; 1.5 мкм (12) | +; август–октябрь 1994 (9); + (12) | ? (9) | ? (1); Зал. Монтерей, 600 м (9); Берингово море, вулкан Пийпа, 466 м (12) |
Примечание. В скобках указан литературный источник: 1 − Beninger, Le Pennec, 1997; 2 − Boss, Turner, 1980; 3 − Endow, Ohta, 1990; 4 − Fiala-Medioni, Le Pennec, 1989; 5 − Fujiwara et al., 1998; 6 − Heyl et al., 2007; 7 − Le Pennec, Beninger, 2000; 8 − Krylova, Sahling, в печати; 9 − Lisin et al., 1997; 10 − Parra et al., 2009; 11 − Ikuta et al., 2016; 12 − настоящее исследование.
Исследования на более длительном временном отрезке указывают на возможно имеющиеся сезонные различия в интенсивности нереста у плиокардиин. Например, у Ph. soyoae (цит. как Calyptogena kilmeri, см.: Lisin et al., 1997), обитающей в районе углеводородных сочений в зал. Монтерей на глубине 900 м, было отмечено увеличение среднего диаметра овоцитов с августа по ноябрь в 1994 г. и в марте 1995 г. (Lisin et al., 1997). Изменение пропорций репродуктивных и соматических тканей в женских гонадах Ph. soyoae с июня 1994 г. по март 1995 г. также указывает на существование сезонности с пиками репродуктивной активности в ноябре и марте, однако некоторое количество зрелых овоцитов в гонадах присутствовало в течение всего периода исследований (Lisin et al., 1997). Вероятно, несмотря на сезонные различия, нерест возможен в течение всего года. Например, для Ph. soyoae из другого района (зал. Сагами, 1175 м) опубликованы данные об 11 случаях нереста за 1.5 года, вызванных небольшим повышением температуры (Fujiwara et al., 1998). Первыми нерестились самцы, а, как правило, в последующие 10 мин нерестились самки (Fujiwara et al., 1998). Приуроченности нереста к определенному сезону не отмечено.
Размеры овоцитов
По нашим данным зрелые овоциты C. pacifica со склона вулкана Пийпа достигают размера 200 мкм, что укладывается в диапазон размеров овоцитов C. pacifica, обитающей в зал. Монтерей (Lisin et al., 1997). У C. gallardoi диаметр зрелых овоцитов несколько больше (273.78 ± 23.12 мкм), но в целом размеры овоцитов у разных видов плиокардиин близки (табл. 1). Среди двустворчатых моллюсков овоциты плиокардиин одни из самых крупных (Beninger, Le Pennec, 1997). По традиционным представлениям такие размеры соответствуют лецитотрофному или прямому типам развития (Ockelmann, 1965; Дроздов, Касьянов, 1985), что подразумевает короткую планктонную стадию личинки. В этом аспекте интересно предположение Бенингера и Ле Пеннека (Beninger, Le Pennec, 1997) о том, что запасы питательных веществ в крупных овоцитах симбиотрофной двустворки Acharax alinae (семейство Solemyidae) способствуют увеличению периода жизни лецитотрофной личинки. Сейчас накапливается информация о том, что ареалы видов плиокардиин довольно протяженные, несмотря на узкие экологические требования и пространственную разобщенность биотопов, пригодных для их проживания (Krylova et al., 2010; Audzijonyte et al., 2012; Decker et al., 2012). Наличие личинки с протяженным периодом развития объяснило бы генетическую однородность, которую часто отмечают для пространственно разобщенных субпопуляций плиокардиин (LaBella et al., 2016). Возможно, что для плиокардиин, как и для ахаракса, классические представления о лецитотрофной личинке с короткой планктонной стадией нуждаются в коррекции.
Строение сперматозоидов
По общему типу строения сперматозоидов C. pacifica не отличается от большинства двустворчатых моллюсков, в частности, относящихся к отряду Venerida. Это классические жгутиковые сперматозоиды, характерные для животных с наружным осеменением (Franzén, 1955, 1983; Popham, 1979; Дроздов, Касьянов, 1985; Healy, 1996; Дроздов, Иванков, 2000).
Изображения, полученные в нашей работе, позволяют подтвердить наличие межмитохондриальных контактов (ММК) в спермиях у C. pacifica. ММК уже были отмечены в сперматозоидах двустворчатых моллюсков, например, у Modiolus modiolus (Kafanov, Drozdov, 1998) и Glycymeris yessoensis (Пащенко, Дроздов, 1991); их можно видеть на изображениях спермиев Mytilus edulis, Atactodea striata, Modiolus rumphii и Eucrassatella cumingii (Bieler et al., 2014, см. рис. 24B–E). Помимо сперматозоидов ММК обнаружены в клетках таких активно функционирующих тканей животных, как мышечные (Бакеева и др., 1982; Бакеева, Ченцов, 1989) и нервные (Машанский и др., 1984). Для сперматозоидов Vesicomyidae ММК были отмечены впервые. Ультраструктура ММК универсальна для разных групп; ММК имеют одинаковые параметры и морфологические особенности: щель между митохондриями составляет 15–20 нм, размер частиц, образующих поперечные соединения между митохондриями, составляет 6–8.5 нм, расстояние между частицами достигает 13–18 нм (Машанский и др., 1984). Предполагается, что ММК необходимы для формирования единой энергетической системы клетки – митохондриома, благодаря которому возможно быстрое распространение энергии в объеме клетки (Skulachev, 2001).
На нашем материале впервые для сперматозоидов везикомиид было обнаружено кольцо электронно-плотного материала, расположенное дистальнее митохондрий. Предполагается, что это образование имеет липидную природу. Липидный материал в средней части спермиев был отмечен у разных групп животных. В частности, у клипестероидного плоского морского ежа Scaphechinus griseus в средней части спермия обнаружены две липидные капли (Дроздов, Винникова, 2010). По-видимому, липиды служат дополнительным источником энергии для спермиев, обеспечивающим удлинение активной фазы.
Сравнительный анализ спермиев плиокардиин
Несмотря на общий план строения, сперматозоиды разных групп двустворчатых моллюсков различаются частными особенностями ультраструктуры (Дроздов, Касьянов, 1985; Healy et al., 2000, 2008). Эти особенности являются одними из наиболее информативных морфологических признаков в систематике двустворчатых моллюсков (Bieler et al., 2014). Система и филогения Pliocardiinae интенсивно разрабатываются с использованием морфологических и молекулярных методов (Decker et al., 2012; Krylova et al., 2014; Johnson et al., 2017), однако отношения между многими родами еще не разрешены. Использование признаков строения сперматозоидов может оказаться продуктивным для решения таксономических проблем группы. Мы собрали все имеющиеся сведения о строении спермиев плиокардиин, включая впервые полученные в настоящей работе для C. pacifica из Берингова моря (табл. 1). Ранее для C. pacifica были приведены размеры головки и жгутика (Beninger, Le Pennec, 1997), которые значительно отличаются от наших (табл. 1). В частности, по данным этих авторов жгутик спермия C. pacifica в два раза короче, чем у изученных нами моллюсков. Мы полагаем, что расхождение в размерах может быть связано не с вариабельностью спермиев в пределах одного вида, а с неверным определением вида. Во время написания работы (Beninger, Le Pennec, 1997) таксономическая неопределенность в семействе везикомиид была очень велика как на видовом, так и на родовом уровне (см. обсуждение: Krylova, Sahling, 2006). Молекулярные исследования продемонстрировали большое число “скрытых” видов в семействе (Peek et al., 1997; Goffredi et al., 2003). К тому же авторы (Beninger, Le Pennec, 1997) не указали место происхождения материала, так что даже по косвенным признакам мы не можем говорить о достоверности определения вида.
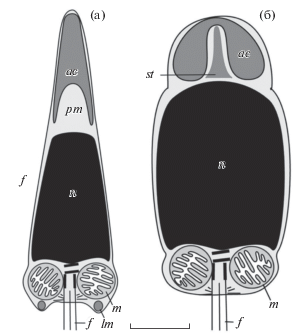
Сведения о размерах, количестве митохондрий и форме ядра сперматозоида опубликованы для пяти видов плиокардиин из четырех родов: C. gallardoi, C. pacifica, Ph. soyoae, “Calyptogena” magnifica и Abyssogena phaseoliformis, а о форме и длине акросомы – только для C. gallardoi, C. pacifica и Ph. soyoae. Максимальная длина головки сперматозоида варьирует от 3 мкм (“Calyptogena” magnifica) до 4.8 мкм (A. phaseoliformis); максимальная длина жгутика – от 8.5 мкм (“Calyptogena” magnifica) до 26.5 ± 2.5 мкм (C. gallardoi). У всех изученных видов в средней части сперматозоида имеется четыре митохондрии. У обоих видов рода Calyptogena усеченно-коническая форма ядра, в то время как у представителей других родов форма ядра бочкообразная. Второй признак, обособляющий оба вида рода Calyptogena, это удлиненно-коническая форма акросомы. Сперматозоид Ph. soyoae отличается от спермиев C. gallardoi и C. pacifica акросомой куполообразной формы и наличием стержня в субакросомном материале (Fujiwara et al., 1998; рис. 5).
Рис. 5.
Схема строения сперматозоидов Сalyptogena pacifica (а) и Phreagena soyoae (б) (по: Fujiwara et al., 1998). st – осевой стержень; остальные обозначения, как на рис. 4. Шкала 1 мкм.
Виды родов Calyptogena и Phreagena часто образуют многочисленные поселения в непосредственной близости друг от друга (Barry, Kochevar, 1998; Goffredi, Barry, 2002). Показано, что нерест Ph. soyoae можно вызвать повышением температуры среды, превышающим 0.1°C (Fujiwara et al., 1998). Очевидно, изменение температуры не является видоспецифичным стимулом и вызывает нерест у разных видов двустворок, живущих в непосредственной близости. В условиях массового нереста разных видов с наружным осеменением значительные различия в строении сперматозоидов могут иметь особое значение, уменьшая риск оплодотворения яиц чужого вида, образования гибридов и расхода ценного репродуктивного материала.
Различия в строении сперматозоидов у моллюсков родов Calyptogena и Phreagena поддерживают выводы, сделанные ранее на основе морфологических признаков раковин и мягкого тела (Krylova, Janssen, 2006; Krylova, Sahling, 2006), а также молекулярных маркеров (Johnson et al., 2017) об отдаленном родстве этих родов. Полученные в нашей работе данные впервые указывают на то, что признаки сперматозоидов можно использовать для диагностики родов в пределах подсемейства Pliocardiinae.
Список литературы
Бакеева Л.Е., Ченцов Ю.С. Митохондриальный ретикулум: строение и некоторые функциональные свойства // Итоги науки и техники. Сер. общ. биол. М.: ВИНИТИ. 1989. № 9. 104 с.
Бакеева Л.Е., Ченцов Ю.С., Скулачев В.П. Межмитохондриальные контакты кардиомиоцитов // Цитология. 1982. Т. 245. С. 161–166.
Данилин Д.Д. Двустворчатые моллюски как потенциальные индикаторы районов гидротермальной активности // Материалы конф., посвященной Дню вулканолога. Петропавловск-Камчатский: ИВиС ДВО РАН. 2013. С. 291–294.
Дроздов А.Л., Винникова В.В. Морфология гамет морских ежей залива Петра Великого Японского моря // Онтогенез. 2010. Т. 41. № 1. С. 47–57.
Дроздов А.Л., Иванков В.Н. Морфология гамет животных. 2000. М.: Круглый год. 460 с.
Дроздов А.Л., Касьянов В.Л. Размеры и форма гамет у морских двустворчатых моллюсков // Биол. моря. 1985. № 4. С. 33–40.
Машанский В.Ф., Озирская Е.В., Туманова Н.Л., Дроздов A.Л. Межмитохондриальные контакты в нейронах переднего мозга ящерицы Ophisaurus apodus // Цитология. 1984. Т. 26. № 6. С. 740–743.
Пащенко C.B., Дроздов A.Л. Ультраструктура гамет и акросомная реакция спермиев у двустворчатого моллюска глицимериса японского // Цитология. 1991. Т. 33. № 7. С. 20–24.
Сагалевич А.М., Торохов П.В., Матвеенков В.В. и др. Гидротермальные проявления подводного вулкана Пийпа (Берингово море) // Изв. РАН. Сер. геол. 1992. № 9. С. 104–114.
Audzijonyte A., Krylova E.M., Sahling H., Vrijenhoek R.C. Molecular taxonomy reveals broad trans-oceanic distributions and high species diversity of deep-sea clams (Bivalvia: Vesicomyidae: Pliocardiinae) in chemosynthetic environments // Syst. Biodiversity. 2012. V. 10. P. 403–415.
Barry J.P., Kochevar R.E. A tale of two clams: differing chemosynthetic life styles among vesicomyids in Monterey Bay cold seeps // Cah. Biol. Mar. 1998. V. 39. 329–331.
Beninger P., Le Pennec M. Reproductive characteristics of a primitive bivalve from a deep-sea reducing environment: giant gametes and their significance in Acharax alinae (Cryptodonta: Solemyidae) // Mar. Ecol. Prog. Ser. 1997. V. 157. P. 195–206.
Berg C.J. Reproductive strategies of mollusks from abyssal hydrothermal vent communities // Bull. Biol. Soc. Wash. 1985. V. 6. P. 185–197.
Bieler R., Mikkelsen P.M., Collins T.M. et al. Investigating the Bivalve Tree of Life – an exemplar-based approach combining molecular and novel morphological characters // Invertebr. Syst. 2014. V. 28. P. 32–115.
Boss K.J., Turner R.D. The giant white clam from the Galapagos Rift, Calyptogena magnifica species novum // Malacologia. 1980. V. 20. P. 161–194.
Coan E.V., Scott P.V., Bernard F.R. Bivalve seashells of western North America: Marine bivalve mollusks from Arctic Alaska to Baja California // Santa Barbara Museum of Natural History Monographs. Studies in Biodiversity. 2000. V. 2. 764 p.
Decker C., Olu K., Cunha R.L., Arnaud-Haond S. Phylogeny and diversification patterns among vesicomyid bivalves // PLoS One. 2012. V. 7. e33359.
Endow K., Ohta S. Occurrence of bacteria in the primary oocytes of vesicomyid clam Calyptogena soyoae // Mar. Ecol. Prog. Ser. 1990. V. 64. P. 309–311.
Fiala-Medioni A., Le Pennec M. Adaptive features of the bivalve molluscs associated with fluid venting in the subduction zones off Japan // Palaeogeogr. Palaeoelimatol. Palaeoecol. 1989. V. 71. P. 161–167.
Franzén Å. Comparative morphological investigations into the spermiogenesis among Mollusca // Zool. Bidr. Uppsala. 1955. V. 30. P. 399–456.
Franzén Å. On spermiogenesis, morphology of the spermatozoon, and biology of fertilization among invertebrates // Zool. Bidr. Uppsala. 1956. V. 31. P. 355–482.
Franzén Å. Ultrastructural studies of spermatozoa in three bivalve species with notes on evolution of elongated sperm nucleus in primitive spermatozoa // Gamete Res. 1983. V. 7. P. 199–214.
Fujiwara Y., Tsukahara J., Hashimoto J., Fujikura K. In situ spawning of a deep-sea vesicomyid clam: evidence for an environmental cue // Deep-Sea Res. Part I. 1998. V. 45. P. 1881–1889.
Goffredi S.K., Barry J.P. Species-specific variation in sulfide physiology between closely related Vesicomyid clams // Mar. Ecol. Prog. Ser. 2002. V. 225. P. 227–238.
Goffredi S.K., Hurtado L.A., Hallam S., Vrijenhoek R.C. Evolutionary relationships of deep-sea vent and cold seep clams (Mollusca: Vesicomyidae) of the “pacifica/lepta” species complex // Mar. Biol. 2003. V. 142. P. 311–320.
Healy J.M. Molluscan sperm ultrastructure: correlation with taxonomic units within the Gastropoda, Cephalopoda and Bivalvia // Origin and evolutionary radiation of the Mollusca. Oxford: Oxford Univ. Press. 1996. P. 99–113.
Healy J.M., Keys J.L., Daddow L.Y.M. Comparative sperm ultrastructure in pteriomorphian bivalves with special reference to phylogenetic and taxonomic implications // Geol. Soc. London, Spec. Publ. 2000. V. 177. P. 169–190.
Healy J.M., Mikkelsen P.M., Bieler R. Sperm ultrastructure in Hemidonax pictus (Hemidonacidae, Bivalvia, Mollusca): comparison with other heterodonts, especially Cardiidae, Donacidae and Crassatelloidea // Zool. J. Linn. Soc. 2008. V. 153. P. 325–347.
Heyl T.P., Gilhooly W.P., Chambers R.M. et al. Characteristics of vesicomyid clams and their environment at the Blake Ridge cold seep, South Carolina, USA // Mar. Ecol. Prog. Ser. 2007. V. 339. P. 169–184.
Ikuta T., Igawa K., Tame A. et al. Surfing the vegetal pole in a small population: extracellular vertical transmission of an ‘intracellular’ deep-sea clam symbiont // Roy. Soc. Open Sci. 2016. V. 3. P. 160130.
Johnson S.B., Krylova E.M., Audzijonyte A. et al. Phylogeny and origins of chemosynthetic vesicomyid clams // Syst. Biodiversity. 2017. V. 15. № 4. P. 346–360.
Kafanov A.I., Drozdov A.L. Comparative sperm morphology and phylogenetic classification of recent Mytiloidea (Bivalvia) // Malacologia. 1998. V. 39. P. 129–139.
Krylova E.M., Janssen R. Vesicomyidae from Edison Seamount (South Western Pacific: Papua New Guinea: New Ireland fore-arc basin) (Bivalvia: Glossoidea) // Arch. Molluskenkd. 2006. V. 135. P. 233–263.
Krylova E.M., Kolpakov E.V., Sharina S.N. et al. Distribution patterns of chemosymbiotic bivalves of the subfamily Pliocardiinae (Bivalvia: Vesicomyidae) from the North-West Pacific // 15-th International deep-sea biological Symposium, 9–14 September, 2018. Monterey, USA: Monterey Bay Aquarium Research Institute. 2018. P. 32–33.
Krylova E.M., Sahling H. Recent bivalve molluscs of the genus Calyptogena (Vesicomyidae) // J. Molluscan Stud. 2006 . V. 72. P. 359–395.
Krylova E.M., Sahling H. Vesicomyidae (Bivalvia): current taxonomy and distribution // PLoS One. 2010. V. 5. № 4. P. e9957.
Krylova E.M., Sahling H., Janssen R. Abyssogena: a new genus of the family Vesicomyidae (Bivalvia) from deep water vents and seeps // J. Molluscan Stud. 2010. V. 76. P. 107–132.
Krylova E.M., Sellanes J., Valdés F., D’Elía G. Austrogena: a new genus of chemosymbiotic bivalves (Bivalvia; Vesicomyidae; Pliocardiinae) from the oxygen minimum zone off central Chile described through morphological and molecular analyses // Syst. Biodiversity. 2014. V. 12. P. 225–246.
LaBella A.L., Van Dover C.L., Jollivet D., Cunningham C.W. Gene flow between Atlantic and Pacific Ocean basins in three lineages of deep-sea clams (Bivalvia: Vesicomyidae: Pliocardiinae) and subsequent limited gene flow within the Atlantic // Deep-Sea Res. Part II. 2016. V. 137. P. 307–317.
Le Pennec M., Beninger P.G. Reproductive characteristics and strategies of reducing-system bivalves // Comp. Bioch. Physiol. Part A: Mol. Integr. Physiol. 2000. V. 126. P. 1–16.
Lisin E.S., Hannan E.E., Kochevar R.E. et al. Temporal variation in gametogenic cycles of vesicomyid clams // Invertebr. Reprod. Dev. 1997. V. 31. P. 307–318.
Ockelmann K.W. Developmental types in marine bivalves and their distribution along the Atlantic coast of Europe // Proc. 1st Eur. Malacol. Congr., London. Conchological Society of Great Britain and Ireland; Malacological Society of London. 1965. P. 25–35.
Parra M., Sellanes J., Dupré E., Krylova E. Reproductive characteristics of Calyptogena gallardoi (Bivalvia: Vesicomyidae) from a methane seep area off Concepción, Chile // J. Mar. Biol. Assoc. U.K. 2009. V. 89. № 1. P. 161–169.
Peek A.S., Gustafson R.G., Lutz R.A., Vrijenhoek R.C. Evolutionary relationships of deep-sea hydrothermal vent and cold-water seep clams (Bivalvia: Vesicomyidae): results from mitochondrial cytochrome oxidase subunit I // Mar. Biol. 1997. V. 130. P. 151–161.
Popham J.D. Comparative spermatozoon morphology and bivalve phylogeny // Malacol. Rev. 1979. V. 12. P. 1–20.
Skulachev V.P. Mitochondrial filaments and clusters as intracellular power transmitting cables // Trends Biochem. Sci. 2001. V. 26. № 1. P. 23–29.
Дополнительные материалы отсутствуют.



