Биология моря, 2019, T. 45, № 4, стр. 231-239
Сезонная динамика роста Fucus distichus subsp. evanescens (C. Agardh) H.T. Powell, 1957 (Phaeophyceae: Fucales) в Авачинской губе (юго-восточная Камчатка)
А. Н. Кашутин 1, А. В. Климова 1, *, Н. Г. Клочкова 1
1 Камчатский государственный технический университет
683003 Петропавловск-Камчатский, Россия
* E-mail: annaklimovae@mail.ru
Поступила в редакцию 09.06.2018
После доработки 11.03.2019
Принята к публикации 28.03.2019
Аннотация
С 1 апреля по 7 октября 2017 г. изучали особенности линейного роста и морфогенез у меченых растений промысловой бурой водоросли Fucus distichus subsp. evanescens из Авачинской губы (юго-восточная Камчатка). Всего было исследовано пять размерных групп, включавших по пять меченых растений. В ходе проведения исследования во время сизигийных отливов с периодичностью 1–2 раза в месяц у растений измеряли длину дихотомических ветвей каждого порядка, определяли их прирост и состояние зрелости апикальных ветвей. За период наблюдений меченые растения сформировали от четырех до шести новых дихотомических ветвлений. При этом у образцов, имевших в апреле только одну дихотомию, скорость роста была выше, чем у образцов, которые к началу исследований имели 3–5 дихотомических ветвлений. К концу наблюдений водоросли с 1, 2, 3, 4 и 5-ю дихотомиями имели ветви 7, 7, 8, 8 и 9-го порядков соответственно. Абсолютная скорость роста F. distichus subsp. evanescens варьировала от 23.2 до 36.7 мм/мес; ее максимальное значение (2.33 мм/сут) отмечено в июне. Установлено, что фукусу свойственен более активный, чем считали ранее, рост. Поскольку в течение одного вегетационного сезона камчатские представители вида могут формировать несколько дихотомических ветвлений, их количество не является показателем возраста растений, как предполагали ранее.
Бурая водоросль Fucus distichus subsp. evanescens (C. Agardh) H.T. Powell, 1957 имеет широкий аркто-тихоокеанский ареал и распространена во всех морях российского Дальнего Востока (Петров, 1975; Перестенко, 1980; Klochkova, 1998). В полярных и приполярных районах фукус встречается в сублиторали, в умеренных широтах произрастает в литоральной зоне, в основном в ее среднем горизонте. Эта крупная многолетняя водоросль является доминантом и эдификатором климаксных альгосообществ (Шунтов, 2001). Она представляет собой уплощенный правильно дихотомически разветвленный кустик. В местах с оптимальными условиями произрастания фукус может формировать заросли с биомассой до 70 кг/м2 и с плотностью до 630 экз./м2 (Суховеева, Подкорытова, 2006). Его общие запасы в дальневосточных морях России оцениваются более чем в 1 млн т (Возжинская, Селицкая, 1970).
Интерес к практическому использованию F. distichus subsp. evanescens обусловлен его исключительным химическим составом, прежде всего высоким содержанием сульфатированных полисахаридов – фукоиданов, альгиновых кислот (Суховеева, Подкорытова, 2006; Анастюк и др., 2014). Эти соединения обладают многообразным и порой уникальным биологическим действием: гепариноподобным, антикоагуляционным и антитромботическим, противовирусным, противовоспалительным, противоопухолевым и др. (Nagumo, Nishiro, 1996; Mourão, 2004; Усов, Билан, 2009; Анастюк и др., 2014). Содержание фукоиданов в талломах дальневосточных представителей порядка Fucales колеблется от 1.5 до 7.9% сухой массы (Имбс и др., 2009; Skriptsova et al., 2010) и зависит от сезона, состояния зрелости и репродуктивного статуса растений (Анастюк и др., 2014).
Для рационального использования дальневосточных фукусовых водорослей в разных сферах народного хозяйства прежде всего необходимо иметь представление о скорости восстановления их ресурсов. Наиболее значимыми характеристиками любого промыслового вида являются скорость роста, возраст половой зрелости и продолжительность жизни. До сих пор считали, что F. distichus – медленно растущий вид, формирующий 1–2 дихотомических ветвления в течение вегетационного сезона в условиях Белого и Баренцева морей (Кузнецов, 1960; Максимова, 1980) и у юго-восточной Камчатки (Чмыхалова, 2010). Однако имеются данные о том, что скорость роста фукуса в Авачинском заливе более высокая – от двух до пяти дихотомий за два месяца (Селиванова, Жигадлова, 2009). Ответить на вопрос, существует ли зависимость между количеством дихотомий и продолжительностью жизни, можно лишь при изучении меченых разновозрастных растений в течение вегетационного сезона.
Цель настоящего исследования – определение скорости линейного роста, количества образующихся в течение вегетационного сезона дихотомических ветвей и продолжительности жизни у представителей камчатской популяции F. distichus subsp. evanescens.
МАТЕРИАЛ И МЕТОДИКА
Линейный рост и морфогенез Fucus distichus subsp. evanescens изучали с 1 апреля по 7 октября 2017 г. в б. Сероглазка, расположенной во внутренней части Авачинской губы (юго-восточная Камчатка). В южной части бухты были выбраны защищенные от прибоя крупновалунные участки среднего горизонта литорали (рис. 1) с зарослями разноразмерных слоевищ фукуса, имевших от одного до 11 дихотомических ветвлений. Около 60% слоевищ составляли образцы с 5, 6 и 7-ю дихотомическими ветвями. Часть растений 1 апреля уже имела в разной степени развитые рецептакулы. Площадь каждого участка с мечеными растениями фукуса составляла 2–4 м2; суммарная площадь исследованной литорали в б. Сероглазка составляла 40 м2. Динамику роста и развития фукуса определяли, наблюдая за проростками с раздвоенной верхушкой (D1), а также за стерильными растениями, имеющими 2 (D2), 3 (D3), 4 (D4) и 5 (D5) дихотомий, на которых были установлены пластиковые метки. Каждая размерная группа была представлена пятью растениями (Малавенда, 2009; Гончарова, Шошина, 2013). Дополнительно в районе исследований выборочно просматривали немеченые растения фукуса из разных размерных групп.
Рис. 1.
Меченые растения Fucus distichus subsp. evanescens на одном из экспериментальных участков литорали в б. Сероглазка (Авачинская губа, юго-восточная Камчатка) 1 апреля (а) и 8 июня (б). Обозначения соответствуют номерам меток.

Линейные размеры фукуса определяли, измеряя растения во время сизигийных отливов 1 и 16 апреля, 13 мая, 8 июня, 12 и 28 июля, 8 и 23 августа, 18 сентября и 7 октября. Позднее в связи с выравниванием сизигийных и квадратурных приливов меченые растения постоянно находились под водой, поэтому измерить их было невозможно. Поскольку у фукуса наблюдается синхронный рост ветвей одного порядка, для определения их прироста за период между двумя измерениями у образца измеряли по 5–8 ветвей каждого порядка. При очередном измерении определяли среднюю длину ветвей каждого порядка (Ln) для размерной группы (D1–D5) и общие линейные размеры каждого растения (Lобщ) (рис. 2). Значение последнего показателя использовали для вычисления средней месячной (AGRмес., мм/мес.) и средней суточной (AGRсут, мм/сут) абсолютной скорости роста растений из каждой размерной группы. Продолжительность изучения F. distichus subsp. evanescens составила 190 сут. Формулы вычисления AGRсут и AGRмес идентичны (Hunt, 1990):
Рис. 2.
Схема определения количества дихотомий у Fucus distichus subsp. evanescens и измерения длины ветвей разных порядков (L1–L9).

Для расчета AGRвет было проведено 1290 измерений ветвей растений из размерных групп D1 и D2, 2570 измерений для групп D3 и D4, а также 2565 измерений для группы D5. Для характеристики роста ветвей разных порядков значения AGRвет были разделены на четыре группы в соответствии с интенсивностью роста: 1) затухающий (AGRвет от 0.001 до 0.02 мм/сут), 2) слабый (AGRвет от 0.02 до 0.5 мм/сут), 3) активный (AGRвет от 0.5 до 0.8 мм/сут) и 4) интенсивный (AGRвет более 0.8 мм/сут).
Параметры среды в местах проведения наблюдений оценивали с помощью портативного профилографа RINKO-AAQ171 (JEF Advantech Co, Япония). В фазе стояния воды на глубине 50–80 см измеряли температуру поверхностного слоя воды (°С), концентрацию растворенного кислорода (мг/л), водородный показатель (pH) и соленость (‰). Данные по температуре воздуха, длине светового дня и облачности брали из открытых источников сервиса Gismeteo (http://www.gismeteo.ru) и определяли их средние за декаду величины.
РЕЗУЛЬТАТЫ
Характеристика района исследований
Температура прибрежных вод в районе произрастания меченых образцов Fucus distichus subsp. evanescens с 1 апреля по 18 октября изменялась от 1.2 до 18°C (рис. 3а). Активный прогрев воды начался в последней декаде мая; максимальное значение температуры воды (18°C) отмечено в начале августа. В последующее время температура воды постепенно понижалась и к середине октября составляла 6.3°C. Насыщение поверхностного слоя воды кислородом в начале апреля составляло 12.49 мг/л, к концу сентября оно снизилось до 8.15 мг/л, а затем к окончанию периода наблюдений возросло до 10.02 мг/л. Максимальное значение этого показателя (13.53 мг/л) было зарегистрировано 8.06.2017 г. Водородный показатель в течение всего периода наблюдений почти не изменялся и в среднем составлял 5.9. Соленость воды варьировала в широких пределах: в период паводков и речного половодья она достигала 30.58‰, а затем снижалась до минимального за время исследования значения 4.9‰; среднее значение солености воды с конца мая до начала сентября составляло 9.5‰; поздней осенью соленость не опускалась ниже 25‰.
Рис. 3.
Гидрологические показатели морской воды (а) и климатические факторы (б) в местах произрастания меченых растений Fucus distichus subsp. evanescens. Условные обозначения: 1 – температура воды, °С; 2 – концентрация растворенного кислорода, мг/л; 3 – водородный показатель, pH; 4 – соленость, ‰; 5 – температура воздуха, °С; 6 – длина светового дня, ч; 7 – облачность, %.

Средняя для декады температура воздуха изменялась от 2 до 19°C, наиболее высокой она была в конце июля – в начале августа. Соотношение светового и темнового периодов составляло 13 : 11 ч; с конца мая до начала августа продолжительность светового дня достигала 16 ч, а с 10 октября она сократилась до 11 ч.
Особенности роста F. distichus subsp. evanescens
Средние значения абсолютного прироста общей длины растений F. distichus subsp. evanescens всех размерных групп значительно изменялись (табл. 1). Максимальный прирост наблюдался у растений размерных групп D3 (36.7 мм/мес. и 1.16 мм/сут) и D1 (32.8 мм/мес. и 1.04 мм/сут); в остальных размерных группах прирост был на 23.7–36.7% меньше. К концу наблюдений общая длина растений в группах D1 и D4 варьировала в пределах 231–239 мм, в группах D3 и D5 – 279–284 мм, а в группе D2 не превышала 180 мм.
Таблица 1.
Месячная (AGRмес.) и суточная (AGRсут) скорость роста меченых растений Fucus distichus subsp. evanescens и количество дихотомий, образовавшихся за шесть месяцев
| Характеристика | Размерная группа | ||||
|---|---|---|---|---|---|
| D1 | D2 | D3 | D4 | D5 | |
| AGRмес. (мм/мес.) | 32.8 | 23.2 | 36.7 | 28.0 | 24.0 |
| AGRсут (мм/сут) | 1.04 | 0.73 | 1.16 | 0.88 | 0.76 |
| Количество дихотомий | 6 | 5 | 5 | 4 | 4 |
За 190 сут наблюдений у меченых фукусов образовалось от четырех до шести новых дихотомических ветвлений. В группе D1 сформировалось 6 новых дихотомий, из которых 4 возникли в летнее время (табл. 1). Для растений из размерных групп D2 и D3 также было характерно активное образование ветвлений в летний период (4 из пяти образовавшихся ветвей). Осенью (сентябрь–октябрь) в группах D4 и D5 сформировались одна и 2 ветви соответственно, а за все время наблюдений – 4 ветви.
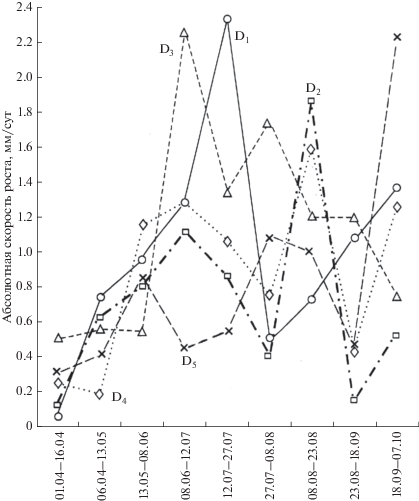
С 1 апреля по 13 мая у всех растений зарегистрирован наименьший суточный прирост общей длины (рис. 4). Сравнительно низкий прирост был отмечен в большинстве случаев также в августе. Заметное увеличение прироста отмечено осенью, хотя и в это время года прослеживалась значительная межгрупповая изменчивость. Для размерной группы D1 прирост общей длины растений более чем на 1 мм/сут был отмечен в июне–июле и достигал максимального значения 2.33 мм/сут (рис. 4). Активный рост фукусов группы D2 наблюдался в августе, когда их прирост составлял 1.87 мм/сут. Для представителей размерный группы D3 был характерен резкий всплеск ростовых процессов в начале лета до 2.26 мм/сут и их плавное снижение до 1.19 мм/сут к середине сентября. У растений группы D4, как и у представителей группы D2 (рис. 4), максимальное значение AGRсут было отмечено в августе и составляло 1.6 мм/сут. У растений группы D5 значение AGRсут в течение лета незначительно варьировало от 0.46 до 1.08 мм/сут, однако в середине сентября зарегистрировано резкое увеличение AGRсут до 2.21 мм/сут (рис. 4).
Анализ данных о скорости изменения размерных характеристик и морфологии слоевищ меченых растений в процессе их роста по различиям среднесуточного прироста ветвей разных порядков показал (рис. 5), что наиболее активно, особенно с середины мая до середины июня, увеличивалась длина за счет интенсивного роста ветвей L2, L3, L4 и L5 у фукусов группы D1. К этому времени продолжительность дня достигла максимума, повысилась температура воздуха и прогрелись прибрежные воды (рис. 3), а соленость быстро понизилась до 4.9‰. В июле и августе при низкой солености, а также высокой температуре воздуха и воды интенсивность линейного роста растений из групп D1–D3 снизилась. Вновь она увеличилась только в конце августа; рост ветвей разных порядков продолжался и после появления новых дихотомий (рис. 5). Для первых из ветвей L1 выявлен прирост даже после появления ветвей 5-го порядка. Достаточно необычно у растений группы D3 росли ветви L7. Они появились 8 июня. В период интенсивного снижения солености воды и повышения ее температуры рост ветвей стал более активным, чем в начале июня. С 8 по 23 августа растения группы D3 характеризовались интенсивным среднесуточным приростом и формированием ветвей следующего порядка (L8).
Рис. 5.
Развитие дихотомических ветвей (1–5) и динамика изменения их среднесуточного прироста у меченых растений Fucus distichus subsp. evanescens размерных групп D1–D5 с 1 апреля по 7 октября 2017 г. Условные обозначения: 1 – ветвь, прекратившая рост; 2 – с затухающим ростом; 3 – со слабым ростом; 4 – с активным ростом и 5 – с интенсивным ростом.

Растения размерной группы D4 в начале вегетационного сезона уже имели ветви с формирующимися рецептакулами, поэтому их слабо выраженный линейный рост в апреле происходил одновременно с созреванием репродуктивных органов (рис. 5). В период активного линейного роста вплоть до начала июня эти растения не формировали новых дихотомических ветвлений, которые появились с 08.06 по 12.07.2017 г. Седьмое дихотомическое ветвление у меченых растений D4 зарегистрировано в августе, а ветви L8 появились только после 18 сентября.
Верхушечный и интеркалярный рост ветвей у меченых растений размерной группы D4 по сравнению с таковым у растений групп D2 и D1 был заметно снижен, особенно во время активного весеннего роста, когда многие апикальные ветви начинали формировать рецептакулы. Самым активным в течение короткого периода времени был рост ветвей L7 в августе. Сходным образом развивались растения группы D5, которые к началу нового вегетационного сезона были достаточно сформированными. К этому времени в связи с завершением созревания половых продуктов часть ветвей у растений группы D5 прекратила рост. Другие ветви фукусов этой группы имели развивающиеся концептакулы, и только не более трети ветвей оставались стерильными и продолжали расти. В период наиболее активного поздневесеннего роста растения группы D5 образовали еще одно ветвление, при этом появившиеся ветви L6 интенсивно росли. Ветви L7 сформировались достаточно быстро – с 27.07 до 08.08.2017 г., но затем скорость их роста снизилась. Следующие ветви (L8 и L9) появились у растений этой группы только к середине сентября, и их AGRвет была незначительной.
ОБСУЖДЕНИЕ
На развитие Fucus distichus subsp. evanescens существенное влияние оказывают температура и соленость воды. В период наших наблюдений их значительное изменение совпало со снижением AGRсут конечных ветвей. Наиболее благоприятными для развития F. distichus subsp. evanescens в Авачинской губе являются весенний и осенний периоды, когда температура воды не превышает 10–11°C, а соленость выше 10‰. В работе Малавенда (2011) имеются сведения об увеличении массы, длины и площади баренцевоморского F. distichus при переменной солености 10–25‰, приведена также нижняя граница устойчивости этого вида к солености – 5–10‰.
Изучение особенностей развития растений разного размера (D1–D5) в прикамчатских водах показало, что фукусы размерной группы D1 характеризуются наибольшей скоростью линейного роста. К концу первой декады октября они способны формировать до семи дихотомических ветвлений и уже при трех дихотомических ветвлениях могут участвовать в размножении. За период с 1 апреля по 7 октября растения группы D2 сформировали семь порядков ветвей, растения групп D3 и D4 – восемь порядков, а группы D5 – девять.
Скорость роста F. distichus subsp. evanescens из Авачинской губы в период наблюдений варьировала от 23.2 до 36.7 мм/мес. или, если выразить в среднесуточном приросте их слоевищ, от 0.73 до 1.16 мм/сут. В работе Камнева (1999) для этого вида указывается максимальный суточный прирост – 0.8 мм/сут. Для растений F. distichus, произрастающих у берегов Ванкувера, максимальное значение AGR зарегистрировано в осеннее время – 14 мм/мес. (Ang, 1991), что существенно ниже, чем у камчатских фукусов. Вероятно, это связано с более южным расположением Ванкувера и, соответственно, с большим прогревом морских вод в целом. F. distichus является бореально-арктическим видом (Guiry, Guiry, 2019), и, как следствие, максимальные размеры слоевища характерны для популяций этого вида из более северных широт (Lüning, 1990; Coyer et al., 2006).
Показано, что для атлантических популяций F. distichus значение AGR изменяется от 25 до 40 мм/мес. (Sideman, Mathieson, 1983; Keser, Larson, 1984). Абсолютная скорость роста у других представителей рода Fucus значительно варьирует. У F. vesiculosus она может изменяться от 35 до 60 мм/мес. (Mathieson et al., 1976; Keser, Larson, 1984). Наименьшая скорость роста (19–28 мм/мес.) отмечена у F. spiralis (Niemeck, Mathieson, 1976). Учитывая эти данные, камчатскую популяцию F. distichus subsp. evanescens можно охарактеризовать как быстрорастущую. Растения наименьшей из исследованных нами размерных групп фукуса группы D1 за полгода достигли промысловых размеров – 23 см и более. Полученные данные актуальны как для организации рационального изъятия водорослевых ресурсов, так и для искусственного выращивания фукуса.
При определении возраста и продолжительности жизни у представителей рода Fucus подсчитывают дихотомические ветвления (Камнев, 1989). Так, в Белом и Баренцевом морях у видов F. vesiculosus и F. distichus любой возрастной группы за один год формируется две дихотомии (Кузнецов, 1960; Максимова, 1980). Этот подход широко используется в современных исследованиях баренцевоморских фукусов (Шошина, Капков, 2014; Евсеева, 2015; Канищева, Шошина, 2015).
Продолжительность жизни F. distichus оценивают по-разному. В большинстве отечественных исследований, посвященных изучению фукусов, указано, что она составляет от семи до 12 лет и в среднем, как правило, не превышает 9 лет. Например, для F. distichus из Баренцева моря это 8–9 лет (Максимова, 1980), из Японского моря – 7–9 лет (Камнев, 1999), из прибрежных вод юго-восточной Камчатки – не более 7 лет (Чмыхалова, 2010). Зарубежные исследователи считают, что продолжительность жизни F. distichus из тихоокеанских и атлантических популяций не превышает трех лет (Sideman, Mathieson, 1983; Ang, 1991). Наши исследования скорости роста F. distichus subsp. evanescens разного размера из Авачинской губы позволяют предположить, что возраст этого вида завышен. Поскольку растения в течение вегетационного периода образуют разное количество дихотомий (от 4 до 6), то очевидно, что метод определения возраста по количеству дихотомических ветвлений не подходит для камчатской популяции F. distichus. Наши данные о росте фукуса поддерживают мнение зарубежных исследователей о том, что продолжительность жизни этого вида составляет 2–3 года.
Таким образом, наиболее активный рост F. distichus subsp. evanescens в условиях Авачинской губы наблюдался у проростков фукуса с одним дихотомическим ветвлением. К концу вегетационного сезона их длина почти достигла таковой у растений, начавших свое развитие в конце осени предыдущего года. Максимальная скорость роста фукусов размерной группы D1 была отмечена в конце сентября (2.21 мм/сут). Это позволяет рассматривать фукус как возможный объект марикультуры, перспективный для получения ценных в фармакологическом отношении полисахаридов. Для введения вида в марикультуру необходимо продолжить изучение биологии его развития (Кашутин, Климова, 2016) особенно на ранних стадиях эмбриогенеза, а также разработать метод выращивания в искусственных условиях, в морских водоемах или в установках замкнутого цикла.
Список литературы
Анастюк С.Д., Беседнова Н.Н., Богданович Л.Н. и др. Фукоиданы – сульфатированные полисахариды бурых водорослей. Структура и биологические свойства. Владивосток: Дальнаука. 2014. 379 с.
Возжинская В.Б., Селицкая Н.М. Видовой состав, распределение и запасы фукоидов в Охотском море // Тр. Ин-та океанол. АН СССР. 1970. Т. 88. С. 281–287.
Гончарова О.В., Шошина Е.В. Морфофункциональные параметры Fucus vesiculosus в условиях Кольского залива // Вестн. МГТУ. 2013. Т. 16. № 3. С. 437–448.
Евсеева Н.В. Структура ценопопуляций промысловых фукусовых водорослей на литорали западного Мурмана // Тр. ВНИРО. 2015. Т. 154. С. 70–79.
Имбс Т.И., Красовская Н.П., Ермакова С.П. и др. Сравнительное исследование химического состава и противоопухолевой активности водно-этанольных экстрактов бурых водорослей Laminaria cichorioides, Costaria costata и Fucus evanescens // Биол. моря. 2009. Т. 35. № 2. С. 140–146.
Камнев А.Н. Структура и функции бурых водорослей. М.: Изд-во МГУ. 1989. 200 с.
Камнев А.Н. Возрастная морфофизиология бурых водорослей (на примере представителей порядков фукусовых и ламинариевых водорослей): Автореф. дис. … док. биол. наук. М.: Изд-во МГУ. 1999. 74 с.
Канищева О.В., Шошина Е.В. Возрастная структура поселений Fucus vesiculosus на литорали Кольского залива // Вестн. Удмурт. ун-та. 2015. Т. 25. Вып. 1. С. 40–47.
Кашутин А.Н., Климова А.В. Раннее развитие камчатских представителей Fucus evanescens (Phaeophyceae, Fucales) в условиях лабораторного культивирования // Вестн. КамчатГТУ. 2016. № 37. С. 50–56.
Кузнецов В.В. Белое море и биологические особенности его флоры и фауны. М.; Л.: Изд. АН СССР. 1960. 320 с.
Максимова О.В. Некоторые сезонные особенности развития и определения возраста беломорских фукоидов. Донная флора и продукция краевых морей СССР. М.: Наука. 1980. С. 73–78.
Малавенда С.В. Устойчивость фукоидов Баренцева моря к переменной солености // Ботан. журн. 2011. Т. 96. № 3. С. 342–349.
Малавенда С.С. Морфофизиологические особенности бурой водоросли Fucus distichus L. в экосистемах Баренцева моря: Автореф. дис. … канд. биол. наук. М.: Изд-во МГУ. 2009. 24 с.
Перестенко Л.П. Водоросли залива Петра Великого. Л.: Наука. 1980. 232 с.
Петров Ю.Е. Ламинариевые и фукусовые водоросли морей СССР (морфология, экология, филогения, систематика): Автореф. дис. … док. биол. наук. Л.: Изд-во БИН АН СССР. 1975. 53 с.
Селиванова О.Н., Жигадлова Г.Г. Морские водоросли-макрофиты прибрежных вод острова Старичков // Биота острова Старичков и прилегающей к нему акватории Авачинского залива: Тр. КФ ТИГ ДВО РАН. Петропавловск-Камчатский. 2009. Вып. 8. С. 25–57.
Суховеева М.В., Подкорытова А.В. Промысловые водоросли и травы морей Дальнего Востока: биология, распространение, запасы, технология переработки. Владивосток: ТИНРО-центр. 2006. 243 с.
Усов А.И., Билан М.И. Фукоиданы – сульфатированные полисахариды бурых водорослей // Успехи химии. 2009. Т. 78. С. 846–862.
Чмыхалова В.Б. Особенности развития фукуса в прикамчатских водах. Петропавловск-Камчатский: Изд-во КамчатГТУ. 2010. 105 с.
Шошина Е.В., Капков В.И. Экологические особенности промысловых фукусовых водорослей мурманского побережья Баренцева моря // Вестн. МГТУ. 2014. Т. 17. № 1. С. 180–189.
Шунтов В.П. Биология дальневосточных морей России. Владивосток: ТИНРО-центр. 2001. Т. 1. 580 с.
Ang P.O. Jr. Age- and size-dependent growth and mortality in a population of Fucus distichus // Mar. Ecol.: Prog. Ser. 1991. V. 78. P. 173–187.
Coyer J.A., Hoarau G., Oudot-Le Secq M.-P. et al. A mtDNA-based phylogeny of the brown algal genus Fucus (Heterokontophyta; Phaeophyta) // Mol. Phylogenet. Evol. 2006. V. 39. № 1. P. 209–222.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org (Accessed on: 14.01.2019).
Hunt R. Absolute growth rates // Basic Growth Analysis. Dordrecht: Springer-Verlag. 1990. P. 17–24. https://doi.org/10.1007/978-94-010-9117-6_2 (Accessed on: 05.02.2019).
Keser M., Larson B.R. Colonization and growth dynamics of three species of Fucus // Mar. Ecol.: Prog. Ser. 1984. V. 15. P. 125–134.
Klochkova N.G. An annotated bibliography of marine macroalgae of the northwest coast of the Bering Sea and Southeast Kamchatka. First Revision of Flora // Algae. 1998. V. 13. № 4. P. 375–418.
Lüning K. Seaweeds: Their Environment, Biogeography and Ecophysiology. New York: John Wiley. 1990. 537 p.
Mathieson A.C., Shipman J.W., O’Shea J.R., Hasevlat R.C. Seasonal growth and reproduction of estuarine fucoid algae in New England // J. Exp. Mar. Biol. Ecol. 1976. V. 25. P. 273–284.
Mourão P.A.S. Use of sulfated fucans as anticoagulant and antithrombotic agents: future perspectives // Curr. Pharmaceut. Des. 2004. V. 10. P. 967–981.
Nagumo T., Nishino T. Fucan sulfates and their anticoagulant activities // Polysaccharides in medicinal applications / Ed. S. Dumitriu. New York: CRC Press. 1996. P. 545–574.
Niemeck R.A., Mathieson A.C. An ecological study of Fucus spiralis L. // J. Exp. Mar. Biol. Ecol. 1976. V. 24. P. 33–48.
Sideman E.J., Mathieson A.C. The growth, reproductive phenology, and longevity of non-tide-pool Fucus distichus (L.) Powell in New England // J. Exp. Mar. Biol. Ecol. 1983. V. 68. P. 111–127.
Skriptsova A.V., Shevchenko N.M., Zvyagintseva T.N., Imbs T.I. Monthly changes in the content and monosaccharide composition of fucoidan from Undaria pinnatifida (Laminariales, Phaeophita) // J. Appl. Phycol. 2010. V. 22. № 1. P. 79–86.
Дополнительные материалы отсутствуют.