Биология моря, 2019, T. 45, № 5, стр. 309-314
Постэмбриональное развитие гидротермальной вестиментиферы Oasisia alvinae Jones, 1985 (Annelida: Siboglinidae)
М. М. Ганцевич 1, *, Н. П. Карасева 1, Н. Н. Римская-Корсакова 1, В. В. Малахов 1
1 Московский государственный университет им. М.В. Ломоносова (МГУ)
119234 Москва, Россия
* E-mail: mgantsevich@gmail.com
Поступила в редакцию 30.09.2018
После доработки 16.12.2018
Принята к публикации 07.02.2019
Аннотация
Исследован аллометрический рост гидротермальной вестиментиферы Oasisa alvinae Jones, 1985 в постэмбриональном развитии. Установлено, что в процессе роста животного длина туловищного отдела относительно общей длины тела увеличивается с 51 до 83.4%, тогда как относительные размеры обтюракулярного и вестиментального отделов, а также опистосомы уменьшаются. Это связано с усиленным развитием трофосомы и гонад в туловищном отделе. Предполагается, что преобладающий рост туловищного отдела в онтогенезе – общая закономерность для всех вестиментифер. Обсуждаются различия в пропорциях тела у вестиментифер, обитающих как в гидротермальных очагах, так и в холодных углеводородных просачиваниях.
Вестиментиферы – это крайне своеобразная группа морских беспозвоночных. Они лишены рта и кишечника и живут за счет симбиоза с внутриклеточными хемоавтотрофными бактериями, населяющими трофосому (Cavanaugh et al., 1981, 2013; Cavanaugh, 1983). Первый представитель вестиментифер был описан полвека назад и отнесен к погонофорам, которые в те годы рассматривались как отдельный тип животного царства (Webb, 1969). Впоследствии вестиментиферы некоторое время рассматривались как самостоятельный тип животного царства (Jones, 1985), но затем их таксономический ранг был сильно понижен. С середины 1990-х гг. стала укрепляться точка зрения на вестиментифер и погонофор как на представителей кольчатых червей (Bartolomaeus, 1995; Rouse, Fauchald, 1995, 1997; McHugh, 1997; Kojima, 1998; Boore, Brown, 2000; Halanych et al., 2002; Schulze, 2003; Halanych, 2005). В настоящее время вестиментиферы рассматриваются в качестве одного из четырех подсемейств в составе семейства Siboglinidae кольчатых червей (Hilário et al., 2011; Карасева и др., 2016). По современным представлениям вестиментиферы относятся к типу Annelida, однако расчленение тела у этих животных сильно отличается от такового у типичных кольчатых червей. Тело вестиментифер подразделяют на обтюракулярный отдел, несущий многочисленные щупальца; вестиментальный отдел, снабженный на дорсальной стороне кожными складками (вестиментальными крыльями) и несущий на вентральной стороне ресничное поле, а также на длинный туловищный отдел, на заднем конце которого располагается опистосома (рис. 1). Только опистосома состоит из типичных для аннелид сегментов с поперечными рядами крючковидных щетинок (Jones, 1985; Малахов, Галкин, 1998). Относительная длина отделов тела сильно различается у разных видов вестиментифер и служит важным систематическим признаком в этой группе животных (Jones, 1985; Малахов, Галкин, 1998; Карасева и др., 2016).
Рис. 1.
Внешняя морфология Oasisia alvinae (с вентральной стороны). а – экземпляр с длиной тела 101 мм (масштаб 5 мм), б – экземпляр с длиной тела 5.5 мм (масштаб 1 мм). Обозначения: cf – вентральное ресничное поле, OB – обтюракулярный отдел, OS – опистосома, TR – туловищный отдел, VE – вестиментальный отдел, vn – вентральный нервный ствол.

Постэмбриональное развитие вестиментифер до сих пор слабо изучено, в том числе отсутствует информация о закономерностях аллометрического роста вестиментифер в постэмбриональном онтогенезе. Отчасти это связано с тем, что некоторые виды известны по одному или нескольким экземплярам. Однако и для тех видов, которые присутствуют в коллекциях в большом количестве, данные сведения ограничены. Изменение относительных размеров отделов тела в постэмбриональном развитии исследовано лишь у массовой вестиментиферы гидротермальных очагов Тихого океана Riftia pachyptila Jones, 1980 (Andersen et al., 2002).
В распоряжении авторов настоящей статьи оказалась небольшая коллекция особей вестиментиферы Oasisa alvinae Jones, 1985, в которой представлен полный размерный ряд – от крошечной вестиментиферы длиной 3.5 мм до крупного червя длиной более 10 см. Мы воспользовались возможностью проследить изменение пропорций тела в постэмбриональном развитии O. alvinae.
МАТЕРИАЛ И МЕТОДИКА
Особи, использованные для исследования, были собраны с использованием глубоководных обитаемых аппаратов “Мир-1” и “Мир-2” в гидротермальных оазисах Восточно-Тихоокеанского поднятия в 2003 г. в ходе 49-го рейса научно-исследовательского судна “Академик Мстислав Келдыш” (табл. 1). Материал представлен 10 особями разного размера.
Таблица 1.
Географические координаты и глубины места сбора вестиментиферы Oasisia alvinae
| № экземпляра | Географические координаты | Глубина, м |
|---|---|---|
| 1, 2, 4 | 9°50.80′ N; 104°17.56′ W | 2519 |
| 3, 5, 7 | 9°50.53′ N; 104°17.51′ W | 2520 |
| 6, 8 | 20°50′ N; 109°05′ W | 2610 |
| 9, 10 | 9°50.53′ N; 104°17.52′ W | 2524 |
Сразу после подъема на борт судна червей вместе с трубками фиксировали жидкостью Буэна, в дальнейшем хранили в 70% этаноле. Перед изучением вестиментифер извлекали из трубок. Морфометрическое исследование включало следующие размерные характеристики: общая длина, длина каждого отдела тела (обтюракулярного, вестиментального, туловищного и опистосомы) и отношение длины каждого отдела к общей длине тела. Из 10 особей только 7 оказались неповрежденными, у остальных животных опистосома и, возможно, какая-то часть туловищного отдела оказались оторванными.
Для биометрического анализа использовали только целые экземпляры. В этом случае попарно сравнивали относительные длины обтюракулярного и вестиментального отделов, а также опистосомы и туловищного отдела. Результаты представлены как диаграммы, включающие линии регрессии. Согласованность в изменчивости признаков оценивали с помощью коэффициента корреляции Пирсона (Puth et al., 2014).
РЕЗУЛЬТАТЫ
Сравнение внешней морфологии крупных и мелких особей вестиментиферы Oasisa alvinae показало, что у крупных особей относительная длина туловищного отдела была больше, чем у мелких (рис. 1, 2). По мере роста животных относительная длина туловищного отдела увеличивалась с 51% (у особи размером 5.3 мм) до 83.4% (у особи с длиной тела 101 мм) (табл. 2). Длина обтюракулярного отдела, выраженная в процентах от общей длины тела, сильно варьировала. Коэффициент Пирсона применительно к отношению длина обтюракулярного отдела/длина туловищного отдела оказался недостоверным. Относительные размеры вестиментального отдела уменьшались с 25.5% у особи с длиной тела 5.3 мм до 7.5% у особи с длиной тела 101 мм (рис. 2). Очень высокое значение негативной корреляции отношения длина вестиментального отдела/длина туловищного отдела (r = –0.99, p = 0.003) свидетельствует о замедлении роста вестиментального отдела по сравнению с туловищным. Относительные размеры опистосомы также заметно уменьшались. Относительная длина опистосомы у самого крупного червя была более чем в 5 раз меньше, чем у самого мелкого экземпляра. Отмечено очень высокое значение негативной корреляции применительно к паре длина опистосомы/длина туловищного отдела (r = –0.94, p = 0.002).
Рис. 2.
Изменение пропорций тела в процессе роста у Oasisia alvinae (представлены только целые экземпляры). Левый (черный) столбик – общая длина тела, правый столбик – относительная длина отделов тела, %. Обозначения, как на рис. 1.
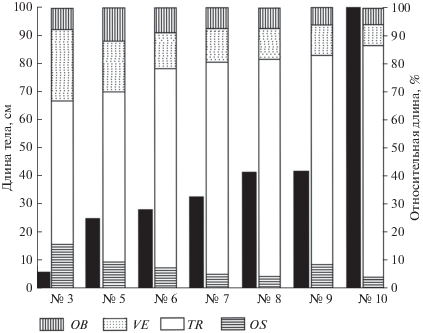
Таблица 2.
Размерные характеристики экземпляров вестиментиферы Oasisia alvinae
| № | Общая длина тела | OB | VE | TR | OS | ||||
|---|---|---|---|---|---|---|---|---|---|
| длина | % | длина | % | длина | % | длина | % | ||
| 1 | 3.5+ | 0.5 | – | 1 | – | 2+ | – | – | – |
| 2 | 5.2+ | 0.7 | – | 1.5 | – | 3+ | – | – | – |
| 3 | 5.3 | 0.4 | 7.5 | 1.35 | 25.5 | 2.7 | 51 | 0.85 | 16 |
| 4 | 8.4+ | 1.15 | – | 2.25 | – | 5+ | – | – | – |
| 5 | 24.8 | 3 | 12.1 | 4.5 | 18.1 | 15 | 60.5 | 2.3 | 9.3 |
| 6 | 27.7 | 2.5 | 9 | 3.5 | 12.6 | 19.7 | 71.1 | 2 | 7.2 |
| 7 | 32.2 | 2.4 | 7.5 | 3.9 | 12.1 | 24.2 | 75.2 | 1.7 | 5.3 |
| 8 | 41.1 | 3 | 7.3 | 4.7 | 11.4 | 31.5 | 76.6 | 1.9 | 4.6 |
| 9 | 41.6 | 2.7 | 6.5 | 4.3 | 10.3 | 31.3 | 75.2 | 3.3 | 7.9 |
| 10 | 101 | 6.2 | 6.1 | 7.5 | 7.4 | 84.2 | 83.4 | 3.1 | 3.1 |
Таким образом, в процессе постэмбрионального развития O. alvinae характеризуется аллометрическим ростом разных отделов тела. Относительная длина туловищного отдела существенно возрастает, а относительная длина других отделов тела уменьшается.
ОБСУЖДЕНИЕ
Отмеченные для Oasisa alvinae закономерности аллометрического роста в процессе постэмбрионального развития проявляются в онтогенезе и некоторых других вестиментифер. Так, для массовой вестиментиферы гидротермальных оазисов Тихого океана Riftia pachyptila сходная закономерность опережающего роста туловищного отдела отмечена Андерсеном с соавторами (см.: Andersen et al., 2002). Эти исследователи разделили выборку из 16 экз. R. pachyptila на три размерные группы на основе средней длины животных: мелкие особи (6.33 см), средние (11.95 см) и крупные (24.67 см). У мелких особей R. pachyptila длина туловищного отдела в среднем составляла 47% от общей длины тела, у крупных – 57%; относительная длина обтюракулярного отдела – соответственно 38 и 27% (Andersen et al., 2002). Результаты биометрической обработки материала для отношения длина обтюракулярного отдела/длина туловищного отдела показали наличие значимой негативной корреляции между длинами обтюракулярного и туловищного отделов в процессе постэмбрионального развития R. pachyptila. Негативная корреляция между длиной вестиментального и туловищного отделов для R. pachyptila оказалась недостоверной (Andersen et al., 2002), а отношение длины опистосомы к длине туловищного отдела в цитированной работе не определяли.
Существенное увеличение относительных размеров туловищного отдела в постэмбриональном онтогенезе можно объяснить двумя факторами. Первый из них – это развитие трофосомы – органа симбиотрофного питания, который локализуется в туловищном отделе. Второй фактор, предположительно влияющий на преобладающий рост туловищного отдела, – развитие половой системы, которая также локализуется в туловищном отделе (Малахов, Галкин, 1998). Преобладающий рост туловищного отдела в постэмбриональном развитии в настоящее время отмечен только для O. alvinae и R. pachyptila, однако не исключено, что подобная закономерность характерна для всех вестиментифер.
Заслуживает внимания уменьшение относительной длины обтюракулярного отдела, который несет щупальца и обеспечивает абсорбцию кислорода, сульфида и углекислоты, необходимых для жизнедеятельности симбионтов. Уменьшение относительной длины этого отдела не обязательно означает уменьшение относительной поверхности газообмена. Дело в том, что у взрослых вестиментифер лучше развита система пиннул (тончайших выростов на щупальцах), в результате чего рассчитанная суммарная площадь поверхности щупалец крупных особей R. pachyptila, отнесенная к общей поверхности тела, даже немного больше таковой у мелких особей (Andersen et al., 2002).
Ранее было показано (Малахов и др., 1996; Карасева и др., 2011), что вестиментальные крылья червей характеризуются высокой концентрацией многоклеточных грушевидных желез. Эти железы выделяют материал, из которого строится трубка, поэтому именно вестиментальный отдел играет главную роль в ее наращивании. Возможно, уменьшение относительных размеров вестиментального отдела связано с замедлением роста трубки у взрослых червей. Это наблюдается у многих видов вестиментифер, если судить по уменьшению расстояний между воротничками в дистальной части трубки (Карасева и др., 2016).
Сегментированная опистосома несет поперечные ряды крючковидных щетинок и выполняет функцию якоря, удерживающего червя в трубке. При сборе вестиментифер манипуляторами глубоководных подводных аппаратов опистосома нередко отрывается и остается на субстрате вместе с задним концом трубки. Относительно более крупные размеры опистосомы у небольших экземпляров можно объяснить тем, что для мелких червей, обитающих в короткой трубке, заякоривающая функция щетинконосной опистосомы, вероятно, имеет большое значение.
Отношение отделов тела у разных видов вестиментифер значительно варьирует. Так, у вестиментифер из гидротермальных очагов Тихого океана отношение длины обтюракулярного и вестиментального отделов изменяется от 1 : 1 до 3 : 1 (Jones, 1985; Малахов, Галкин, 1998; Карасева и др., 2016). Относительно большие размеры обтюракулярного отдела обусловлены тем, что вестиментиферы гидротермальных очагов, прикрепляющиеся к субстрату задним концом трубки, поглощают сульфид, кислород и углекислоту только через щупальца. Следует учесть, что при высокой температуре воды в центральных участках гидротермальных очагов концентрация растворенных газов низкая, а это требует большой абсорбирующей поверхности. Рассчитано, например, что у R. pachyptila около 90% всей поверхности тела приходится на поверхность щупалец (Andersen et al., 2002).
У вестиментифер, обитающих в холодной воде углеводородных просачиваний и на холодной периферии гидротермальных очагов, обтюракулярный отдел меньше вестиментального в 2–5 раз (Малахов, Галкин, 1998; Карасева и др., 2016). В данных условиях растворимость газов выше, чем в горячей воде гидротермальных оазисов, поэтому обитающие в холодной воде углеводородных просачиваний вестиментиферы имеют меньшее число щупальцевых ламелл и укороченный обтюракулярный отдел. К тому же вестиментиферы из районов углеводородных просачиваний через щупальца поглощают только кислород и углекислый газ. Обтюракулярный отдел у таких форм не участвует в поглощении сульфида. Задний конец трубки у этих червей глубоко погружен в толщу мягкого осадка. Через рыхлые стенки задней части трубки вестиментиферы сульфид диффундирует из толщи осадка и поглощается через покровы ее туловищного отдела (Julian et al., 1999; Freytag et al., 2001; Dattagupta et al., 2006). Не удивительно, что вестиментиферы, обитающие в районах холодных углеводородных просачиваний, обладают наибольшей длиной туловищного отдела. К сожалению, многие виды вестиментифер до сих пор известны только по экземплярам с оторванным задним концом. У неповрежденных особей вестиментифер, обитающих в этих районах, протяженность туловищного отдела может составлять 97% от общей длины тела, как, например, у Lamellibrachia barhami (Webb, 1969). Таким образом, размерные отношения отделов могут служить отражением характерных особенностей экологии вестиментифер и заслуживают специального внимания исследователей.
Список литературы
Карасева Н.П., Малахов В.В., Галкин С.В. Морфология и анатомия вестиментиферы Oasisia alvinae Jones, 1985 (Annelida: Siboglinidae). I. Внешняя морфология, обтюракулы, щупальца // Биол. моря. 2011. Т. 37. № 6. С. 413–422.
Карасева Н.П., Римская-Корсакова Н.Н., Галкин С.В., Малахов В.В. Таксономия, географическое и батиметрическое распространение вестиментифер (Annelida: Siboglinidae) // Зоол. журн. 2016. Т. 95. № 6. С. 624–659.
Малахов В.В., Галкин С.В. Вестиментиферы – бескишечные беспозвоночные морских глубин. M.: KMK Scientific Press. 1998. 205 с.
Малахов В.В., Попеляев И.С., Галкин С.В. Микроскопическая анатомия вестиментиферы Ridgeia phaeophiale и проблема положения вестиментифер в системе животного царства. 1. Общая анатомия, обтюракулы, щупальца // Биол. моря. 1996. Т. 22. № 2. С. 71–81.
Andersen A.C., Jolivet S., Claudinot S., Lallier F.H. Biometry of the branchial plume in the hydrothermal vent tubeworm Riftia pachyptila (Vestimentifera: Annelida) // Can. J. Zool. 2002. V. 80. P. 320–332.
Bartolomaeus T. Structure and formation of the uncini in Pectinaria koreni, Pectinaria auricoma (Terebellida) and Spirorbis spirorbis (Sabellida): implications for annelid phylogeny and the position of the Pogonophora // Zoomorphology. 1995. V. 115. P. 161–177.
Boore J.L., Brown W.M. Mitochondrial genomes of Galathealinum, Helobdella, and Platynereis: sequence and gene arrangement comparisons indicate that Pogonophora is not a phylum and Annelida and Arthropoda are not sister taxa // Mol. Biol. Evol. 2000. V. 17. № 1. P. 87–106.
Cavanaugh C.M., Gardiner S.L., Jones M.L. et al. Prokaryotic cells in the hydrothermal vent tube worm Riftia pachyptila Jones: possible chemoautotrophic symbionts // Science. 1981. V. 213. № 4505. P. 340–342.
Cavanaugh C.M. Symbiotic chemoautotrophic bacteria in marine invertebrates from sulfide-rich habitats // Nature. (Lond.). 1983. V. 302. № 3. P. 58–61.
Cavanaugh C.M., McKiness Z.P., Newton I.L.G., Stewart F.J. Marine chemosynthetic symbioses // The Prokaryotes. Prokaryotic biology and symbiotic associations. Fourth Edition. Berlin, Heidelberg: Springer-Verlag. 2013. P. 579–626.
Dattagupta S., Miles L.L., Barnabei M.S., Fisher Ch.R. The hydrocarbon seep tubeworm Lamellibrachia luymesi primarily eliminates sulfate and hydrogen ions across its roots to conserve energy and ensure sulfide supply // J. Exp. Biol. 2006. V. 209. P. 3795–3805.
Freytag J.K., Girguis P.R., Bergquist D.C. et al. A paradox resolved: Sulfide acquisition by roots of seep tubeworms sustains net chemoautotrophy // Proc. Natl. Acad. Sci. U.S.A. 2001. V. 98. № 23. P. 13408–13413.
Halanych K.M., Dahlgren T.G., McHugh D. Unsegmented Annelids? Possible origins of four lophotrochozoan worm taxa // Integ. Comp. Biol. 2002. V. 42. № 3. P. 678–684.
Halanych K.M. Molecular phylogeny of siboglinid annelids (a.k.a. pogonophorans): a review // Hydrobiologia. 2005. V. 535/536. P. 297–307.
Hilário A., Capa M., Dahlgren T.G. et al. New perspectives on the ecology and evolution of Siboglinid Tubeworms // PLoS One. 2011. V. 6. Issue. 2. P. 1–13.
Jones M.L. On the Vestimentifera, new phylum: Six new species, and other taxa, from hydrothermal vents and elsewhere // Bull. Biol. Soc. Wash. 1985. V. 6. P. 117–158.
Julian D., Gaill F., Wood E. et al. Roots as a site of hydrogen sulphide uptake in the hydrocarbon seep vestimentiferan Lamellibrachia sp. // J. Exp. Biol. 1999. V. 202. P. 2245–2257.
Kojima S. Paraphyletic status of Polychaeta suggested by phylogenetic analysis based on the amino acid sequences of elongation factor-1a // Mol. Phylogenet. Evol. 1998. V. 9. P. 255–261.
McHugh D. Molecular evidence that echiurans and pogonophorans are derived annelids // Proc. Natl. Acad. Sci. U.S.A. 1997. V. 94. № 15. P. 8006–8009.
Puth M.T., Neuhauser M., Ruxton G.D. Effective use of Pearson’s product-moment correlation coefficient // Animal Behaviour. 2014. V. 93. P. 183–189.
Rouse G.W., Fauchald K. The articulation of annelids // Zoologica Scripta. 1995. V. 24. № 4. P. 269–301.
Rouse G.W., Fauchald K. Cladistics and polychaetes // Zoologica Scripta. 1997. V. 26. P. 139–204.
Schulze A. Phylogeny of Vestimentifera (Siboglinidae, Annelida) inferred from morphology // Zoologica Scripta. 2003. V. 32. № 4. P. 321–342.
Webb M. Lamellibrachia barhami, gen. nov., sp. nov. (Pogonophora), from the Northeast Pacific // Bull. Mar. Sci. 1969. V. 19. P. 18–47.
Дополнительные материалы отсутствуют.


