Биология моря, 2019, T. 45, № 5, стр. 315-322
Зараженность макропаразитами рака-крота Upogebia major (De Haan, 1841) (Decapoda: Gebiidea) из залива Петра Великого Японского моря
Н. И. Селин *
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: nikselin@yandex.ru
Поступила в редакцию 25.12.2018
После доработки 28.03.2019
Принята к публикации 03.04.2019
Аннотация
В апреле–ноябре 2017 г. исследовали особенности заражения рака-крота Upogebia major из поселения в зал. Восток (зал. Петра Великого) Японского моря изоподами-бопиридами Gyge ovalis и Progebiophilus sp. и корнеголовым ракообразным Sacculina upogebiaе. Паразиты встречались с весны до поздней осени. Экстенсивность инвазии U. major паразитическими изоподами составила 5.42%, самки и самцы были заражены в равной степени. Экстенсивность инвазии саккулиной составила 1.26%, этот паразит чаще встречался на самках. Изоподы обнаружены на раках-кротах размером более 42 мм, экстерны корнеголовых раков – на особях крупнее 57 мм. Наибольшая степень заражения зарегистрирована летом (7.44%). Случаи одновременного заражения U. major паразитами разных видов не отмечены.
Обитающие в норах десятиногие ракообразные инфраотрядов Gebiidea и Axiidea играют важную роль в функционировании морских прибрежных экосистем (Pillay, Branch, 2011; Dworschak et al., 2012; Корниенко, 2013). В дальневосточных морях России они сравнительно мало изучены (Макаров, 1938; Виноградов, 1950; Марин, 2013), хотя в других регионах издавна являются объектом пристального внимания ученых. Крупный рак-крот Upogebia major (De Haan, 1841), часто называемый грязевой креветкой (mud shrimp) из-за приуроченности скоплений к местам с заиленным песчаным осадком, – один из представителей этой группы животных. Лишь в текущем десятилетии установлено, что данный вид является обычным представителем сообществ донных организмов эстуарных зон зал. Петра Великого в Японском море, где находит благоприятные условия для размножения, роста и формирования поселений с многовозрастной структурой (Селин, 2015а, 2015б, 2017). Настоящая работа является продолжением исследования биологии и экологии U. major. Задача исследования заключалась в оценке степени зараженности этого вида макропаразитами – изоподами и корнеголовыми ракообразными, приводящей к частичной или полной паразитической кастрации хозяина.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования послужили особи рака-крота Upogebia major, собранные в апреле–ноябре 2017 г. из поселения в районе устья р. Волчанка, впадающей в зал. Восток (зал. Петра Великого Японского моря). В середине каждого месяца в течение 1 нед. животных собирали на обширном участке песчаного с заилением дна на глубине 0.5–1.5 м. Для сбора использовали гидростатический насос (yabby pump) и пластиковый трубчатый пробоотборник (подробнее см.: Селин, 2017). Грунт промывали через сито с диаметром ячеи 2.0 мм. У всех животных с точностью до 1 мм измеряли длину тела (расстояние от кончика рострума до заднего края тельсона). Присутствие макропаразитов регистрировали визуально: паразитических изопод по асимметричности тела рака-крота в области головогруди; корнеголовых ракообразных по наличию экстерны (репродуктивной стадии жизненного цикла паразита) или рубца на месте ее прикрепления на вентральной поверхности плеона хозяина. Пол U. major определяли по внешним морфологическим признакам и наличию яиц у самок (Dworschak, 1988; Chapman, Carter, 2014). Всего были просмотрены и возвращены в среду обитания 799 самцов и 787 самок рака-крота с длиной тела от 8 до 117 мм. Животные с длиной тела менее 15 мм, пол которых не могли определить, были исключены из статистического анализа.
Результаты учета численности инфицированных особей U. major использовали для расчета экстенсивности инвазии этого вида паразитическими изоподами и/или корнеголовым раком (отношение численности зараженных особей к объему выборки, выраженное в процентах) в зависимости от пола и размера тела хозяина, а также времени года (месяц, сезон). При сравнении размерно-частотного распределения животных по длине их тела использовали непараметрический U-критерий Манна–Уитни, при сравнении экстенсивности инвазий – биномиальный тест. Статистическую обработку данных выполняли по общепринятым алгоритмам, реализованным в пакете прикладных программ SPSS 17.
РЕЗУЛЬТАТЫ
За период наблюдений на особях Upogebia major из зал. Восток обнаружены корнеголовый рак Sacculina upogebiaе Shiino, 1943 и паразитические изоподы, преимущественно Gyge ovalis (Shiino, 1939), а у трех особей – Progebiophilus sp.
Внешний вид зараженного хозяина и паразитов
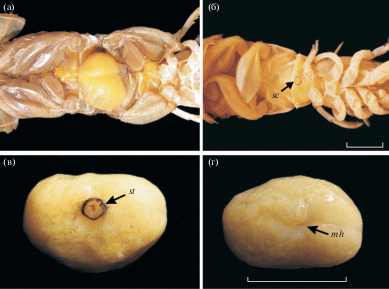
Оба вида паразитических изопод обнаружены в бранхиальной полости U. major (рис. 1) с левой или с правой стороны. Изоподы всегда встречались парами: самка и самец. Самец был значительно меньше самки и по внешнему виду существенно отличался от нее. Как правило, самец располагался на брюшной стороне самки рака-крота в районе плеоподов. Изоподы были серовато-белого и желтого цвета, особенно характерного для взрослых особей в период созревания половых продуктов.
Рис. 1.
Изопода Gyge ovalis, паразитирующая на раке-кроте Upogebia major. а – внешний вид зараженного рака-крота; б – вскрытая бранхиальная полость рака-крота с изоподой; в – самка изоподы с дорсальной (drs) и вентральной (vnt) сторон, стрелкой показано обычное положение самца на теле самки; г – самец изоподы. Масштаб – 10 мм.

У раков-кротов, зараженных корнеголовым ракообразным S. upogebiaе, на вентральной стороне первого или второго брюшного сегмента располагалась одна фасолевидная экстерна (рис. 2). В мае–июне встречались как мелкие незрелые экстерны, так и крупные экстерны молочно-желтого и желтого цвета; в остальное время исследований это были в основном крупные экстерны, иногда коричневого цвета разной степени насыщения. У некоторых крупных экстерн сквозь мантию просматривались яйцевые трубочки и развивающиеся эмбрионы. У четырех самцов и двух самок рака-крота, инфицированных S. upogebiaе, экстерна отсутствовала, но отчетливо был виден рубец в том месте, где ранее она прикреплялась к хозяину.
Рис. 2.
Корнеголовый рак Sacculina upogebiaе, паразитирующий на раке-кроте Upogebia major. а – экстерна S. upogebiaе на плеоне хозяина; б – самка рака-крота, утратившая экстерну паразита; в – экстерна паразита, вид сзади; г – экстерна паразита, вид спереди; sc – рубец на месте прежнего прикрепления экстерны; st – стебелек экстерны; mh – мантийное отверстие. Масштаб – 10 мм.
Размеры раков-кротов и степень их зараженности
Длина тела собранных особей U. major изменялась от 15 до 116 мм у самцов и до 117 мм у самок. Размерно-частотное распределение раков-кротов было бимодальным; в составе населения отчетливо выделялись 2 группы: животные с длиной тела от 15 до 40–50 мм и более крупные особи (рис. 3). В первой группе, в которой преобладали животные с длиной тела 29–34 мм, возраст раков-кротов не превышал одного года. Во второй группе, представленной двух-трехлетними и, возможно, более взрослыми особями, преобладали животные размером 75–95 мм.
Рис. 3.
Размерный состав самцов (а) и самок (б) рака-крота Upogebia major и встречаемость макропаразитов.
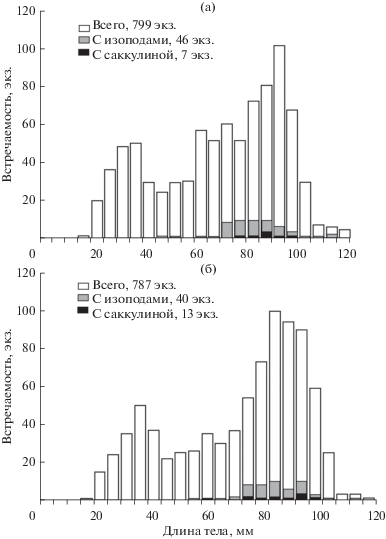
Из 1586 просмотренных особей U. major зараженными оказались 106 экз. (6.7%). Паразитические изоподы отмечены у 5.4% упогебий; около 1.3% раков-кротов были заражены Rhizocephala (табл. 1). Паразитические изоподы встречались у раков-кротов с длиной тела более 42 мм, а экстерны S. upogebiaе обнаружены у особей крупнее 57 мм. В соответствии с этим размерный состав раков-кротов, зараженных паразитами, значимо отличался от размерного состава незараженных животных (U-тест; Р ≤ 0.002). Однако при сравнении размерно-частотных распределений лишь в диапазоне заражения (42–117 мм) различий не обнаружено (Р ≤ 0.394).
Таблица 1.
Объем исходного материала (N, экз.) и экстенсивность инвазии (Ext, %) самцов и самок рака-крота Upogebia major паразитическими изоподами Gyge ovalis и Progebiophilus sp. и корнеголовым ракообразным Sacculina upogebiae
| Сезон | N1 | N2 | Ext1 | Ext2 | N1 + N2 | Ext1 + Ext2 |
|---|---|---|---|---|---|---|
| Isopoda | ||||||
| Весна | 282/14 | 238/10 | 4.96 | 4.20 | 520/24 | 4.62 |
| Лето | 267/23 | 311/20 | 8.61 | 6.43 | 578/43 | 7.44 |
| Осень | 250/9 | 238/10 | 3.60 | 4.20 | 488/19 | 3.89 |
| Всего | 799/46 | 787/40 | − | − | 1586/86 | − |
| Средняя | − | − | 5.76 | 5.08 | − | 5.42 |
| Rhizocephala | ||||||
| Весна | 282/2 | 238/4 | 0.71 | 1.68 | 520/6 | 1.15 |
| Лето | 267/4 | 311/7 | 1.50 | 2.25 | 578/11 | 1.90 |
| Осень | 250/1 | 238/2 | 0.40 | 0.84 | 488/3 | 0.61 |
| Всего | 799/7 | 787/13 | − | − | 1586/20 | − |
| Средняя | − | − | 0.88 | 1.52 | − | 1.26 |
Зараженность U. major в зависимости от пола и сезона
Паразитические изоподы и корнеголовый ракообразный S. upogebiaе были обнаружены как у самцов, так и у самок U. major. Экстенсивность инвазии изоподами G. ovalis и Progebiophilus sp. самок рака-крота составляла 5.08%, самцов – 5.76% (табл. 1). Сравнительный анализ показал, что наблюдаемое различие экстенсивности инвазии в зависимости от пола хозяина носит случайный характер (биномиальный тест; Р = 0.551). Экстенсивность инвазии самок рака-крота корнеголовыми ракообразными составляла 1.52%. Самцов упогебии, пораженных этим паразитом, было почти в 2 раза меньше (0.88%); экстенсивность инвазии значимо различалась между полами (биномиальный тест; Р = 0.021).
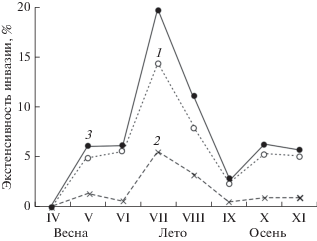
В течение года экстенсивность инвазии U. major макропаразитами изменялась. В апреле визуальные признаки заражения раков-кротов не отмечены, возможно, из-за малочисленности выборки животных (рис. 4). В мае доля раков-кротов, зараженных паразитическими изоподами и корнеголовым ракообразным, составляла 6.1%. В летний период экстенсивность инвазии возрастала и достигала максимума (19.8%) в июле. Затем доля зараженных раков-кротов постепенно снижалась до минимума в сентябре (2.8%), но в последующие осенние месяцы немного увеличилась и составляла 5–6% от объема выборки. Данная сезонная динамика экстенсивности инвазии U. major макропаразитами отчетливо прослеживалась и при раздельном анализе численности животных, зараженных изоподами и S. upogebiaе (табл. 1). Парное сравнение числа зараженных особей U. major по сезонам в весенний, летний и осенний периоды исследований показало значимое различие экстенсивности инвазии (биномиальный тест; Р ≤ 0.035); экстенсивность инвазии самок рака-крота, зараженных паразитическими изоподами, весной и осенью характеризовалась одинаковой величиной.
ОБСУЖДЕНИЕ
Паразитические изоподы Gyge ovalis и Progebiophilus sp., обнаруженные на Upogebia major из зал. Восток, как и представитель Rhizocephala Sacculina upogebiaе, ранее известны из прибрежных вод Японии, Кореи и Китая (An et al., 2009, 2015; Lützen et al., 2016); для северо-западной части Японского моря эти виды ракообразных отмечены впервые.
Изоподы из семейства Bopyridae и корнеголовые ракообразные из семейства Sacculinidae принадлежат к обширным группам преимущественно морских организмов, насчитывающим в настоящее время соответственно 605 и 280 видов (Høeg, Lützen, 1995; Williams, Boyko, 2012; Høeg et al., 2014; Lützen et al., 2016). Первые сведения об этих животных получены в XVIII и XIX вв., но поистине вал открытий наблюдался в последние десятилетия в связи с бурным развитием электронно-микроскопических и молекулярно-генетических методов исследования. Достигнуты большие успехи в познании их таксономии, морфологии, жизненных циклов, эволюции и филогении (Høeg, 1995; Høeg, Lützen, 1995; Trilles, 1999; Crustacean parasites, 2005; Исаева, Шукалюк, 2007; Boyko et al., 2012, 2013; Williams, Boyko, 2012, и др.). Установлено, что Isopoda и Rhizocephala обитают в пелагиали и бентосе от мелководий до глубин более 5000 м в соответствии с местом обитания своих хозяев; регистрируемое неравномерное пространственное распределение их видового обилия в разных частях Мирового океана отражает региональные различия в изученности фауны (An et al., 2009, 2015; Markham, 2009; Головань, Малютина, 2010; Williams, Boyko, 2012, и др.).
Изоподы-бопириды на стадии личинки инвазируют Calanoida (Copepoda), которые служат промежуточным хозяином; а окончательными хозяевами являются представители Decapoda (Williams, Boyko, 2012). Самцы и самки декапод-хозяев заражаются в равной степени или с некоторым преобладанием самок, однозначное объяснение этого до настоящего времени отсутствует (Repetto, Griffen, 2012; Asson et al., 2017; Mouritsen et al., 2018; настоящее исследование). Присутствие паразита часто вызывает у хозяина морфологические, физиологические и поведенческие изменения, а также полную или частичную кастрацию, но не приводит его к гибели. Один и тот же вид декапод может быть подвержен заражению как Isopoda, так и Rhizocephala (Корниенко и др., 2018; Mouritsen et al., 2018; настоящее исследование).
Визуальный анализ признаков заражения декапод, обычно используемый при оценке экстенсивности инвазии, свидетельствует о том, что Isopoda и Rhizocephala заражают животных, почти достигших и/или уже достигших размера (возраста) половой зрелости (Smith et al., 2008; Dumbauld et al., 2011, и мн. др.). В нашем исследовании установлено, что рак-крот U. major заражается на втором году жизни при длине тела более 42 мм. Степень его зараженности изменялась от сезона к сезону; максимальные значения (до 19.8%) зарегистрированы в теплое время года (июль), что в целом характерно для динамики размножения многих морских беспозвоночных, часто демонстрирующих в течение года 1–2 пика пополнения населения молодью (Lützen, 1984; Pascal et al., 2016; Mouritsen et al., 2018, и др.). Экстенсивность инвазии Isopoda в среднем составляла около 5%, а для Rhizocephala незначительно превышала 1%. Следует заметить, что для Rhizocephala эти данные могут быть занижены, поскольку при учете не только внешних признаков заражения (экстерны), но и наличия у хозяина внутренней части паразита (интерны), а также при молекулярном анализе оценки инвазии бывают выше (см., например: Mouritsen et al., 2018).
Снижая репродуктивный потенциал популяций декапод-хозяев, многие из которых являются доминирующими или массовыми формами сообществ, паразиты опосредованно определяют структурно-функциональные свойства последних. Известно, что у раков-отшельников, служащих основными хозяевами, по меньшей мере, для 30 видов Rhizocephala и 83 видов Isopoda, экстенсивность инвазии изменяется от 0.1–4 до 25% (см.: McDermott et al., 1998, 2010). Еще более высокие оценки зараженности паразитами получены для раков-отшельников из зал. Петра Великого Японского моря, для которых экстенсивность инвазии составляла от 6 до 35% (Корниенко и др., 2018). Установлено, что примерно за 30 лет численность некогда самого массового в этом районе вида Pagurus middendorffii существенно снизилась; его место в сообществе занял P. minutus, ранее встречавшийся единично (Волвенко, 1995; Селин и др., 2016). Предполагается, что увеличение в несколько раз экстенсивности инвазии P. middendorffii корнеголовыми ракообразными и паразитическими изоподами (до 35% населения) привело к нарушению процесса пополнения молодью из-за стерильности зараженных особей этого вида.
Роль паразитов в функционировании морских экосистем еще значительнее в тех случаях, когда их хозяином являются организмы-эдификаторы среды. К последним относятся норные десятиногие ракообразные, в том числе раки-кроты из рода Upogebia (см.: Pillay, Branch, 2011; Dworschak et al., 2012 и литературу этих обзоров). Считается, что Axiidea и Gebiidea – одни из самых влиятельных биотурбаторов по воздействию, которое они оказывают на биогеохимию донных осадков и на структуру сообществ, возникающих в результате их жизнедеятельности (Dworschak, 2000; Felder, 2001; Dworschak et al., 2012). Любое изменение активности этих экосистемных инженеров, обусловленное увеличением или снижением их численности (плотности поселения), нарушением физиологического статуса отдельных организмов и популяций и т.д., неизбежно сказывается на состоянии окружающей биоты. Известны драматические ситуации в системе паразит–хозяин, когда паразитом оказывался интродуцированный вид, к которому местные норные десятиногие ракообразные не были адаптированы. Так, в конце прошлого века из Юго-Восточной Азии на тихоокеанское побережье Северной Америки с балластными водами была завезена паразитическая изопода Orthione griffenis. Это привело к массовому заражению местного вида рака-крота Upogebia pugettensis (экстенсивность инвазии в отдельных случаях достигала 100%) и к резкому сокращению численности его популяций (Smith et al., 2008; Dumbauld et al., 2011; Chapman et al., 2012; Asson et al., 2017, и др.).
В тех случаях, когда в качестве хозяина выступают декаподы, относящиеся к объектам питания человека, паразитарная инвазия становится одной из причин снижения потенциально возможного объема продукции промысловых видов крабов и креветок. Особенно широко распространено заражение промысловых видов крабов паразитическими Rhizocephala (Meyers, 1990; Слизкин, Сафронов, 2000; Elumalai et al., 2014). Например, в Охотском море, изобилующем промысловыми видами крабов, экстенсивность инвазии равношипого краба Lithodes aequispinus корнеголовым раком Briarosaccus callosus в 1998, 2000 и 2015 гг. составляла соответственно около 3, 7 и 19.3% (Селин, 1998; Исаева и др., 2005; Метелёв и др., 2017). Зараженность многошипого краба Paralomis multispina в этом районе была еще больше: 26.2% самцов и 20.1% самок были заражены B. callosus (Клинушкин и др., 2016). Для многих промысловых Decapoda сравнительно высокая экстенсивность инвазии в значительной степени обусловлена нерациональной схемой использования ресурса, при которой пойманных зараженных крабов не перерабатывают и не уничтожают, а возвращают в естественную среду, тем самым увеличивая их долю в скоплении.
Таким образом, в зал. Восток Японского моря обычными паразитами рака-крота U. major являются изоподы-бопириды G. ovalis, Progebiophilus sp. и корнеголовый рак S. upogebiaе. Средние показатели степени зараженности особей U. major не превышали 7%. Полученные ранее данные по обилию, размножению, структуре и динамике состава населения, а также результаты настоящего исследования свидетельствуют о том, что U. major в этой части ареала находится в благоприятных условиях существования; являясь общепризнанными организмом-эдификатором, он в значительной мере определяет облик донного населения и способствует стабильности приустьевой экосистемы.
Список литературы
Виноградов Л.Г. Определитель креветок, раков и крабов Дальнего Востока // Изв. ТИНРО. 1950. Т. 33. С. 179–358.
Волвенко И.В. Механизмы регуляции динамики численности и продукционная биология раков-отшельников. Владивосток: Дальнаука. 1995. 284 с.
Головань О.А., Малютина М.В. Равноногие раки (Isopoda). Биота российских вод Японского моря. Владивосток: Дальнаука. 2010. Т. 9. Ч. 1. 357 с.
Исаева В.В., Долганов С.М., Шукалюк А.И. Корнеголовые ракообразные – паразиты промысловых крабов и других десятиногих // Биол. моря. 2005. Т. 31. № 4. С. 256–261.
Исаева В.В., Шукалюк А.И. Колониальные корнеголовые ракообразные (Crustacea: Rhizocephala): бесполое размножение, стволовые клетки, репродуктивная стратегия. М.: Наука. 2007. 132 с.
Клинушкин С.В., Васильев А.Г., Метелёв Е.А., Абаев А.Д. Глубоководные виды крабов (Paralomis multispina, Lithodes couesi, Paralomis verrilli) центральной части Охотского моря: особенности биологии и распределения // Исследования водных биологических ресурсов Камчатки и сев.-зап. части Тихого океана. 2016. Вып. 41. С. 43–50.
Корниенко Е.С. Роющие раки инфраотрядов Gebiidea и Axiidea (Crustacea: Decapoda) // Биол. моря. 2013. Т. 39. № 1. С. 3–16.
Корниенко Е.С., Корн О.М., Селин Н.И. Паразитофауна массовых видов раков-отшельников залива Восток (Японское море) // Биол. моря. 2018. Т. 44. № 2. С. 80–85.
Макаров В.В. Anomura. Фауна СССР. Ракообразные. М.; Л.: Изд-во АН СССР. 1938. Т. 10. Вып. 3. 324 с.
Марин И.Н. Малый атлас десятиногих ракообразных России. М.: Товарищество науч. изд. КМК. 2013. 145 с.
Метелёв Е.А., Абаев А.Д., Клинушкин С.В., Васильев А.Г. Распределение и численность промысловых видов крабов в центральной части Охотского моря // Тр. ВНИРО. 2017. Т. 165. С. 3–11.
Селин Н.И. Рейсовый отчет по плану экспедиционных исследований недоиспользуемых и малоизученных объектов и районов промысла дальневосточных морей и контрольному лову на 1998 г. Владивосток: ТИНРО. Науч. арх. № 22940. 1998.
Селин Н.И. Особенности пространственного распределения рака-крота Upogebia major (De Haan, 1841) (Decapoda: Upogebiidae) в заливе Восток Японского моря // Биол. моря. 2015а. Т. 41. № 3. С. 215–218.
Селин Н.И. Некоторые особенности биологии рака-крота Upogebia major (De Haan 1841) (Crustacea: Decapoda) из залива Петра Великого Японского моря // Зоол. журн. 2015б. Т. 94. № 8. С. 989–992.
Селин Н.И., Корниенко Е.С., Корн О.М. Видовой состав и особенности распределения раков-отшельников (Decapoda: Paguroidea) в заливе Восток Японского моря // Биол. моря. 2016. Т. 42. № 6. С. 458–464.
Селин Н.И. Популяционная динамика и рост рака-крота Upogebia major (De Haan, 1841) (Crustacea: Decapoda) из залива Петра Великого Японского моря // Биол. моря. 2017. Т. 43. № 4. С. 229–234.
Слизкин А.Г., Сафронов С.Г. Промысловые крабы прикамчатских вод. Петропавловск-Камчатский: Северная Пацифика. 2000. 180 с.
An J., Jason D., Williams J.D., Yu H. The Bopyridae (Crustacea: Isopoda) parasitic on thalassinideans (Crustacea: Decapoda) from China // Proc. Biol. Soc. Wash. 2009. V. 122. № 2. P. 225–246.
An J., Boyko C.B., Li X. A Review of bopyrids (Crustacea: Isopoda: Bopyridae) parasitic on caridean shrimps (Crustacea: Decapoda: Caridea) from China // Bull. Am. Mus. Nat. Hist. 2015. № 399. 85 p.
Asson D., Chapman J.W., Dumbauld B.R. No evidence that the introduced parasite Orthione griffenis Markham, 2004 causes sex change or differential mortality in the native mud shrimp, Upogebia pugettensis (Dana, 1852) // Aquat. Invasions. 2017. V. 12. № 2. Р. 213–224. https://doi.org/10.3391/ai.2017.12.2.09
Boyko C.B., Moss J., Williams J.D., Shields J.D. A molecular phylogeny of Bopyroidea and Cryptoniscoidea (Crustacea: Isopoda) // Syst. Biodiversity. 2013. V. 11. P. 495–506.
Boyko C.B., Williams J.D., Markham J.C. Recent and fossil Isopoda Bopyridae parasitic on squat lobsters and porcelain crabs (Crustacea: Anomura: Chirostyloidea and Galatheoidea), with notes on nomenclature and biogeography // Zootaxa. 2012. V. 3150. P. 1–35.
Chapman J.W., Carter C.S. A rapid intertidal megafauna survey method applied to Upogebia pugettensis, and its introduced parasite, Orthione griffensis // J. Crust. Biol. 2014. V. 34. № 3. P. 349–356.
Chapman J.W., Dumbauld B.R., Itani G., Markham J.C. An introduced Asian parasite threatens northeastern Pacific estuarine ecosystems // Biol. Invasions. 2012. V. 14. P. 1221–1236.
Crustacean parasites // Marine parasitology / Ed. K. Rohde. Australia: CSIRO Publishing. 2005. Ch. 4. P. 123–169.
Dumbauld B.R., Chapman J.W., Torchin M.E., Kuris A.M. Is the collapse of mud shrimp (Upogebia pugettensis) populations along the Pacific Coast of North America caused by outbreaks of a previously unknown bopyrid isopod parasite (Orthione griffenis)? // Estuaries Coasts. 2011. V. 34. № 2. P. 336–350.
Dworschak P.C. The biology of Upogebia pusilla (Petagna) (Decapoda, Thalassinidea). III. Growth and production // Pubbl. Stn. Zool. Napoli. I: Mar. Ecol. 1988. V. 9. № 1. P. 51–77.
Dworschak P.C. Global diversity in the Thalassinidea (Decapoda) // J. Crustacean Biol. 2000. V. 20. P. 238–245.
Dworschak P.C., Felder D.L., Tudge C.C. Infraorders Axiidea de Saint Laurent, 1979 and Gebiidea de Saint Laurent, 1979 (formerly known collectively as Thalassinidea) // Treatise on zoology – anatomy, taxonomy, biology. The Crustacea. Leiden: Brill. 2012. V. 9. Part B. № 69. P. 109–219.
Elumalai V., Viswanathan C., Pravinkumar M., Raffi S.M. Infestation of parasitic barnacle Sacculina spp. in commercial marine crabs // J. Parasit. Dis. 2014. V. 38. № 3. P. 337–339.
Felder D.L. Diversity and ecological significance of deep-burrowing macrocrustaceans in coastal tropical waters of the Americas (Decapoda: Thalassinidea) // Interciencia. 2001. V. 26. P. 440–449.
Høeg J.T. The biology and life cycle of the Rhizocephala (Cirripedia) // J. Mar. Biol. Assoc. U.K. 1995. V. 75. P. 517–550.
Høeg J.T., Lützen J. Life cycle and reproduction in the Cirripedia Rhizocephala // Oceanogr. Mar. Biol. Annu. Rev. 1995. V. 33. P. 427–485.
Høeg J.T., Chan B.K.K., Rybakov A.V. Rhizocephala // Atlas of crustacean larvae / Eds J.W. Martin, J. Olesen, J.T. Høeg. Baltimore: Johns Hopkins Univ. Press. 2014. P. 111–113.
Lützen J. Growth, reproduction, and life span in Sacculina carcini Thompson (Cirripedia: Rhizocephala) in the Isefjord, Denmark // Sarsia. 1984. V. 69. № 2. P. 91–105.
Lützen J., Itani G., Jespersen A. et al. On a new species of parasitic barnacle (Crustacea: Rhizocephala), Sacculina shiinoi sp. nov., parasitizing Japanese mud shrimps Upogebia spp. (Decapoda: Thalassinidea: Upogebiidae), including a description of a novel morphological structure in the Rhizocephala // Zool. Sci. 2016. V. 33. P. 204–212.
Markham J.C. A review of the Bopyridae (Crustacea: Isopoda) of Singapore, with the addition of four species to that fauna // Raffles Bull. Zool. 2009. Suppl. № 22. P. 225–236.
McDermott J.J. Prevalence of two epicaridean isopods (Bopyridae and Entoniscidae) associated with the hermit crab Pagurus longicarpus Say, 1817 (Anomura) from the New Jersey coast (U.S.A.) // J. Parasitol. 1998. V. 84. P. 1042–1045.
McDermott J.J., Williams J.D., Boyko C.B. The unwanted guests of hermits: a global review of the diversity and natural history of hermit crab parasites // J. Exp. Mar. Biol. Ecol. 2010. V. 394. P. 2–44.
Meyers T.R. Diseases of Crustacea. 3.2. Diseases caused by protistans and metazoans // Diseases of marine animals. Hamburg: Biologische Anstalt Helgoland. 1990. V. 3. P. 350–389.
Mouritsen K.N., Geyti S.N.S., Lützen J. et al. Population dynamics and development of the rhizocephalan Sacculina carcini, parasitic on the shore crab Carcinus maenas // Dis. Aquat. Org. 2018. V. 131. P. 199–211.
Pascal L., de Montaudouin X., Grémare A., Maire O. Dynamics of the Upogebia pusilla–Gyge branchialis marine host–parasite system // Mar. Biol. 2016. V. 163. № 9. P. 163–195. https://doi.org/10.1007/s00227-016-2969-9
Pillay D., Branch G.M. Bioengineering effects of burrowing thalassinidean shrimps on marine soft-bottom ecosystems // Oceanogr. Mar. Biol. Annu. Rev. 2011. V. 49. P. 137–192.
Repetto M., Griffen B.D. Physiological consequences of parasite infection in the burrowing mud shrimp, Upogebia pugettensis, a widespread ecosystem engineer // Mar. Freshwater Res. 2012. V. 63. P. 60–67.
Smith A.E., Chapman J.W., Dumbauld B.R. Population structure and energetics of the bopirid isopod parasite Orthione griffenis in mud shrimp Upogebia pugettensis // J. Crustacean Biol. 2008. V. 28. № 2. P. 228–233.
Trilles J.-P. Ordre des isopodes sous-ordre des epicarides (Epicaridea Latreille, 1825) // Traité de Zoologie – anatomie, systematique, biologie (Pierre-P. Grassé). T. VII, Fasc. IIIA, Crustaces Peracarides / Ed. J. Forest. Mem. Inst. Oceanogr. Monaco. 1999. V. 19. P. 279–352.
Williams J.D., Boyko C.B. The Global Diversity of Parasitic Isopods Associated with Crustacean Hosts (Isopoda: Bopyroidea and Cryptoniscoidea) // PLoS One. 2012. V. 7. № 4. e35350. https://doi.org/10.1371/journal.pone.0035350
Дополнительные материалы отсутствуют.