Биология моря, 2020, T. 46, № 1, стр. 37-44
Перспективы использования промысловых и потенциально промысловых бурых водорослей дальневосточных морей в качестве источника полифенолов
Н. М. Аминина 1, *, Т. И. Вишневская 1, Е. П. Караулова 1, Н. В. Епур 1, Е. В. Якуш 1
1 Тихоокеанский филиал ФГБНУ “ВНИРО” (“ТИНРО”)
690091 Владивосток, Россия
* E-mail: natalya.aminina@tinro-center.ru
Поступила в редакцию 17.12.2018
После доработки 24.04.2019
Принята к публикации 30.05.2019
Аннотация
Исследованы свойства экстрактов полифенолов, полученных из морских бурых водорослей семейств Laminariaceae, Alariaceae, Arthrothamnaceae, Costariaceae, Сystoseiraceae и Fucaceae. Показано, что выход полифенолов из водорослей определялся их видовой принадлежностью и зависел от природы используемого экстрагента. По сумме полифенолов и антиоксидантной активности максимальный эффект проявляли этанольные экстракты водорослей из родов Agarum, Thalassiophyllum, Fucus, Stephanocystis и Arthrothamnus. Высокой эффективностью характеризовались водные экстракты водорослей из родов Saccharina, Alaria и Costaria. Наибольший выход суммы полифенолов с высокой антиоксидантной активностью, в том числе флоротаннинов, определен для экстрактов Agarum turneri. К перспективным источникам полифенолов с высокой антиоксидантной активностью можно отнести также Fucus evanescens, Thalassiophyllum clathrus и Stephanocystis crassipes. Среди водных экстрактов высокой антиоксидантной активностью обладал водный экстракт Costaria costata.
Водоросли – это ценный промысловый ресурс, интерес к которому можно объяснить его значительными запасами и применением в разных отраслях промышленности. Уникальный химический состав водорослей делает их перспективным источником биологически активных веществ. В последнее время особое внимание исследователей привлекают бурые водоросли, содержащие значительное количество полифенолов. Полифенольные вещества являются продуктами вторичного метаболизма водорослей. По соединению гидроксильной группы с ароматической группой углеводорода эти вещества делят на несколько групп (Waterman, Mole, 1994; Yuan, 2007). Известно, что в бурых водорослях наиболее широко представлены соединения, мономерной единицей которых является флороглюцин (1,3,5-тригидроксибензол). При соединении остатков флороглюцина через связи C-C и/или C-O-C образуются полимерные молекулы флоротаннинов с разнообразными структурами. По типу связи выделяют фугалолы и флоретолы (эфирная связь), фуколы (фенильная связь), фукофлоретолы (эфирная и фенильная связи), эколы и кармалолы (дибензодиоксиновая связь) (Singh, Bharate, 2006). Считается, что фуколы и фукофлоретолы (флоротаннины “Fucus type”) характерны для водорослей семейства Fucaceae, флоретолы и эколы – для водорослей семейств Laminariaceae и Lessoniaceae (Имбс, Звягинцева, 2018). При увеличении степени полимеризации флоротаннинов увеличивается их структурное разнообразие и изменяются свойства.
Известно, что флоротаннины бурых водорослей обладают биологической активностью: антиоксидантной (Li et al., 2009), антимикробной, антипролиферативной, радиозащитной, противовирусной (ВИЧ) (Artan et al., 2008) и противовоспалительной, а также проявляют положительное действие против болезни Альцгеймера (Nguyen et al., 2011). Отмечено, что эти активные соединения могут быть фактором, предупреждающим появление диабета (Korczyński et al., 2015). У бурых водорослей дальневосточных морей выявлена антиоксидантная и гепатопротекторная активность экстрактов, содержащих полифенольные соединения (Спрыгин и др., 2012, 2013, 2017; Аминина и др., 2017). Данные исследования позволяют говорить о перспективности использования полифенолов водорослей в пищевой промышленности, фармакологии, косметологии и сельском хозяйстве. Однако сведения о составе и свойствах полифенолов, содержащихся в водорослях, в настоящее время практически отсутствуют. В связи с этим изучение бурых водорослей из российских морей как источника биологически активных полифенолов представляет несомненный интерес. Цель данной работы – определение антиоксидантной активности экстрактов, полученных из бурых водорослей разных семейств, и содержания в них полифенольных соединений.
МАТЕРИАЛ И МЕТОДИКА
Собранные в разных районах тихоокеанского побережья России (табл. 1) образцы 10 видов бурых водорослей высушивали на воздухе при комнатной температуре до влажности 15–20%, измельчали и упаковывали.
Таблица 1.
Исследованные виды водорослей, районы и время сбора образцов
| Порядок, семейство | Вид | Район и месяц сбора образцов |
|---|---|---|
| Laminariales, Laminariaceae | Saccharina cichorioides (Miyabe) Lane, Mayes, Druehl, Saunders, 2006 | Охотское море, зал. Анива, август |
| Laminariales, Laminariaceae | S. bongardiana (Postels & Ruprecht) Selivanova, Zhigadlova, Hansen, 2007 | Тихоокеанское побережье Камчатки, Авачинский залив, август |
| Laminariales, Laminariaceae | S. sculpera Lane, Mayes, Druehl, Saunders, 2006 | Охотское море, зал. Терпения, июль |
| Laminariales, Alariaceae | Alaria angusta Kjellman, 1889 | Тихоокеанское побережье Камчатки, б. Спасения, июнь |
| Laminariales, Arthrothamnaceae | Arthrothamnus bifidus (Gmelin) Ruprecht, 1851 | Тихоокеанское побережье Камчатки, Авачинский залив, август |
| Laminariales, Costariaceae | Costaria costata (Agardh) Saunders, 1895 | Японское море, Татарский пролив, июнь |
| Laminariales, Costariaceae | Thalassiophyllum clathrus (Gmelin) Postels, Ruprecht, 1840 | Тихоокеанское побережье Камчатки, Авачинский залив, август |
| Laminariales, Costariaceae | Agarum turneri Postels, Ruprecht, 1840 | Тихоокеанское побережье Камчатки, Авачинский залив, сентябрь |
| Fucales, Сystoseiraceae | Stephanocystis crassipes (Mertens, Turner) Draisma, Ballesteros, F. Rousseau & T. Thibaut 2010 | Охотское море, зал. Анива, август |
| Fucales, Fucaceae | Fucus evanescens Agardh, 1820 | Охотское море, зал. Анива, август |
На электронных весах марки VIBRA HT взвешивали 10 г измельченного образца каждой водоросли, затем образцы помещали в термостойкие колбы, в которые добавляли 100 мл дистиллированной воды или 70% этилового спирта. Колбы встряхивали и выдерживали при комнатной температуре в течение 16 ч. Затем смесь в течение 10 мин центрифугировали при 8000 об./мин на центрифуге Hitachi RX II series. Надосадочную жидкость отфильтровывали через бумажный фильтр и использовали для анализа.
Общее содержание полифенолов (ПФ) в экстрактах определяли в соответствии с модифицированным методом Фолина–Чекольте (Koivikko et al., 2005), используя флороглюцинол (phloroglucinol, 99%, HPLC, Sigma-Aldrich) в качестве стандарта; оптическую плотность продуктов реакции регистрировали при 750 нм на планшетном спектрофотометре Polarstar Omega.
Количество флоротаннинов определяли по результатам реакции с 2.4-диметоксибензальдегидом (DMBA, 2.4-dimethoxybenzaldehyde, 98%, Sigma-Aldrich) (Stern et al., 1996). В качестве стандарта использовали флороглюцинол (99%, HPLC, Sigma-Aldrich). Оптическую плотность продуктов реакции регистрировали при 494 нм на микропланшетном сканере Polarstar Omega.
Суммарную антиоксидантную активность (АОА) растворов определяли с использованием 2.2-дифенил-1-пикрилгидразила (DPPH) (Molyneux, 2004). Оптическую плотность раствора определяли при 517 нм на планшетном спектрофотометре Polarstar Omega. Антиоксидантную активность выражали в миллиграммах аскорбиновой кислоты на 1 мл экстракта.
Измерения проводили трижды; данные анализировали с помощью программного обеспечения Statistica 7. Результаты выражали в виде среднего значения со стандартным отклонением. Значения с 95% доверительным интервалом (Р < 0.05) считали статистически значимыми.
РЕЗУЛЬТАТЫ
В настоящей работе суммарное содержание полифенолов и количество флоротаннинов определено у 10 видов бурых водорослей, принадлежащих к шести семействам. Изучено влияние растворителя (вода и 70% раствор этанола) на выход полифенолов, в том числе флоротаннинов.
При использовании 70% раствора этанола выход ПФ был наибольшим у пяти видов: Agarum turneri, Thalassiophyllum clathrus, Fucus evanescens, Stephanocystis crassipes и Arthrothamnus bifidus (табл. 2). В водных экстрактах этих водорослей содержание ПФ было в 1.4–3.5 раза меньше, чем в этанольных. Наибольшие значения концентраций полифенольных соединений в водных экстрактах водорослей распределялись следующим образом: A. turneri > > F. evanescens > C. costata > S. crassipes > T. clathrus.
Таблица 2.
Общее содержание полифенолов и флоротаннинов в водных и этанольных экстрактах бурых водорослей
| Водоросль | Полифенолы (мг/мл) | Флоротаннины (мкг/мл) | ||
|---|---|---|---|---|
| водный экстракт | этанольный экстракт | водный экстракт | этанольный экстракт | |
| Agarum turneri | 5.713 ± 0.141 | 10.109 ± 1.350 | 15.55 ± 2.390 | 601.133 ± 79.367 |
| Thalassiophyllum clathrus | 0.260 ± 0.011 | 0.900 ± 0.143 | 4.100 ± 1.114 | 103.980 ± 18.332 |
| Fucus evanescens | 0.422 ± 0.022 | 0.734 ± 0.080 | 17.45 ± 1.061 | 49.050 ± 2.192 |
| Stephanocystis crassipes | 0.296 ± 0.016 | 0.423 ± 0.015 | 6.167 ± 1.358 | 50.850 ± 0.212 |
| Arthrothamnus bifidus | 0.209 ± 0.012 | 0.229 ± 0.015 | 2.000 ± 0.300 | 7.867 ± 0.208 |
| Saccharina sculpera | 0.185 ± 0.006 | 0.116 ± 0.028 | 3.533 ± 1.002 | 13.550 ± 3.465 |
| Costaria costata | 0.365 ± 0.020 | 0.074 ± 0.012 | 16.067 ± 0.603 | 2.367 ± 0.058 |
| Alaria angusta | 0.093 ± 0.004 | 0.062 ± 0.006 | 0.000 ± 0.000 | 2.200 ± 0.100 |
| Saccharina bongardiana | 0.082 ± 0.002 | 0.059 ± 0.021 | 0.967 ± 0.208 | 1.800 ± 0.100 |
| S. cichorioides | 0.058 ± 0.015 | 0.054 ± 0.011 | 0.000 ± 0.000 | 2.133 ± 0.058 |
Содержание флоротаннинов было наибольшим в этанольных экстрактах, полученных из A. turneri, T. clathrus, S. crassipes и F. evanescens, что коррелирует с данными по общему количеству ПФ (табл. 2). Следующим по количеству ПФ был этанольный экстракт A. bifidus, а по количеству флоротаннинов – экстракт S. sculpera.
В водных экстрактах C. costata концентрации флоротаннинов, как и полифенолов в целом, были более высокими, чем в этанольных. В водных экстрактах S. cichorioides и A. angusta флоротаннины отсутствовали, а в водных экстрактах остальных видов содержание флоротаннинов было ниже, чем в этанольных, в 2–40 раз (табл. 2). В водных экстрактах количество флоротаннинов в зависимости от вида водоросли снижалось в ряду: F. evanescens > C. costata > A. turneri > S. crassipes > > T. clathrus > S. sculpera > A. bifidus > S. bongardiana. Прямой зависимости между общим содержанием ПФ и количеством флоротаннинов в водных экстрактах не выявлено, однако для этанольных экстрактов исследованных видов водорослей такая тенденция наблюдалась.
Экстракты всех исследованных водорослей обладали антиоксидантной активностью, которая различалась в зависимости от вида водоросли и типа экстрагента (табл. 3). Максимальная АОА выявлена в обоих экстрактах A. turneri, причем она на порядок превышала таковую экстрактов других видов водорослей. Для остальных водорослей в спиртовых экстрактах АОА уменьшалась в следующем ряду: F. evanescens > S. сrassipes > > T. clathrus > A. bifidus > S. sculpera > C. costata > > S. cichorioides > A. angusta = S. bongardiana. В водных экстрактах этот порядок был другим: F. evanescens > T. clathrus > C. costata > S. crassipes > A. bifidus > S. sculpera > A. angusta > S. bongardiana > > S. cichorioides.
Таблица 3.
Антиоксидантная активность водных и этанольных экстрактов бурых водорослей (миллиграмм аскорбиновой кислоты/мл)
| Водоросль | Водный экстракт | Этанольный экстракт |
|---|---|---|
| Agarum turneri | 2.527 ± 0.480 | 8.448 ± 2.191 |
| Thalassiophyllum clathrus | 0.175 ± 0.014 | 0.279 ± 0.066 |
| Fucus evanescens | 0.233 ± 0.049 | 0.537 ± 0.098 |
| Stephanocystis crassipes | 0.142 ± 0.007 | 0.293 ± 0.079 |
| Arthrothamnus bifidus | 0.105 ± 0.004 | 0.143 ± 0.030 |
| Saccharina sculpera | 0.078 ± 0.016 | 0.065 ± 0.012 |
| Costaria costata | 0.149 ± 0.016 | 0.037 ± 0.002 |
| Alaria angusta | 0.043 ± 0.003 | 0.024 ± 0.004 |
| Saccharina bongardiana | 0.036 ± 0.004 | 0.025 ± 0.004 |
| S. cichorioides | 0.020 ± 0.002 | 0.033 ± 0.004 |
ОБСУЖДЕНИЕ
В многочисленных исследованиях показано, что содержание полифенолов в разных видах водорослей значительно различалось. К настоящему времени установлены некоторые закономерности накопления полифенолов водорослями из разных систематических групп; определено повышенное количество флоротаннинов в фукусовых водорослях по сравнению с таковым в ламинариевых (Chkhikvishvili, Ramazanov, 2000; Клиндух, Облучинская, 2013). Вариации содержания полифенолов и их антиоксидантной активности связаны также с условиями экстракции, в частности, с видом экстрагента (Аминина и др., 2017).
Для выделения полифенолов из водорослей традиционно используются полярные растворители, среди которых наиболее популярны водные растворы ацетона, метанола и этанола (Боголицын и др., 2018). В некоторых исследованиях для экстракции полифенолов из водорослей использовали воду (Spurr, 2014; Machu et al., 2015; Аминина и др., 2017). Мы изучили влияние двух наиболее часто используемых в пищевой промышленности растворителей (воды и водного раствора этанола) на степень извлечения полифенолов из разных видов бурых водорослей и установили, что эффективность применения экстрагентов изменялась в зависимости от вида водоросли (рис. 1а).
Рис. 1.
Соотношение концентраций полифенолов (а) и флоротаннинов (б) в водных и этанольных экстрактах бурых водорослей.
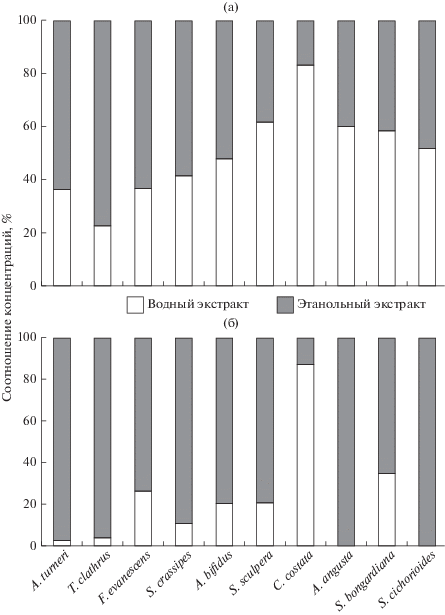
Экстракция ПФ из Costaria costata, Saccharina sculpera, Alaria angusta, Saccharina bongardiana и S. cichorioides протекала лучше при использовании воды, чем 70% этанола, особенно в случае C. costata, когда количество полифенолов в водном экстракте было почти в 5 раз больше, чем в этанольном. Высокая эффективность применения воды для экстракции ПФ из водорослей родов Costaria, Saccharina и Alaria, по-видимому, обусловлена различиями в природе межмолекулярных связей полифенолов с другими органическими соединениями, например, с полисахаридами. Предполагается также, что при добавлении воды в органические растворители происходит ослабление водородных связей между молекулами полифенолов и белков (Wissam et al., 2012).
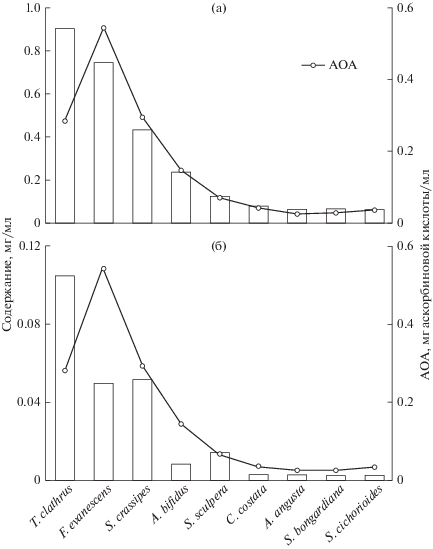
Максимальная эффективность экстракции флоротаннинов у всех видов водорослей, кроме C. costata, отмечена при использовании 70% раствора этанола (рис. 1б). Количество флоротаннинов в водном экстракте C. costata было практически в 7 раз выше, чем в этанольном, что косвенным образом указывало на различия в составе и структуре полифенолов этой водоросли. Сравнение АОА экстрактов показало, что для основной группы исследованных водорослей эффективность экстрактов была выше при использовании этанола, однако у C. costata, A. angusta, S. sculpera и S. bongardiana АОА была значительно выше при использовании воды в качестве экстрагента (рис. 2). Следовательно, соотношение содержания полифенольных соединений и АОА экстрактов различалось у разных видов водорослей и изменялось при использовании разных экстрагентов. Например, в этанольных экстрактах Thalassiophyllum clathrus содержание ПФ, в том числе флоротаннинов, было почти в 2 раза выше, чем в экстрактах Stephanocystis crassipes, а АОА экстрактов практически не различалась (рис. 3). В экстракте Fucus evanescens концентрация флоротаннинов была меньше, чем у указанных выше видов, а АОА была почти в 2 раза интенсивнее (рис. 3б). Соотношение общего количества ПФ и АОА этанольных экстрактов в среднем изменялось в пределах 1 : 1–1 : 3, причем самой низкой активностью при пересчете на количество полифенолов обладали экстракты T. clathrus (рис. 3а). Предстоит выяснить, с чем это связано: с особенностью структуры полифенолов водорослей или с присутствием в экстрактах антиоксидантов другой природы.
Рис. 2.
Соотношение антиоксидантной активности (АОА) водных и этанольных экстрактов бурых водорослей.
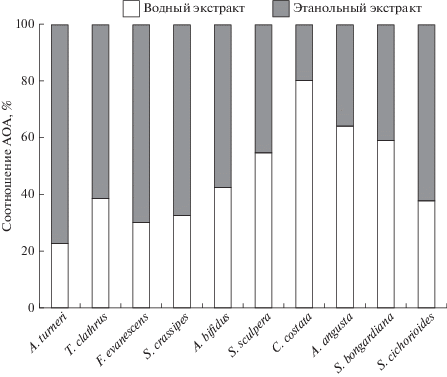
Рис. 3.
Содержание в этанольных экстрактах полифенолов (а) и флоротаннинов (б) и их антиоксидантная активность (АОА).
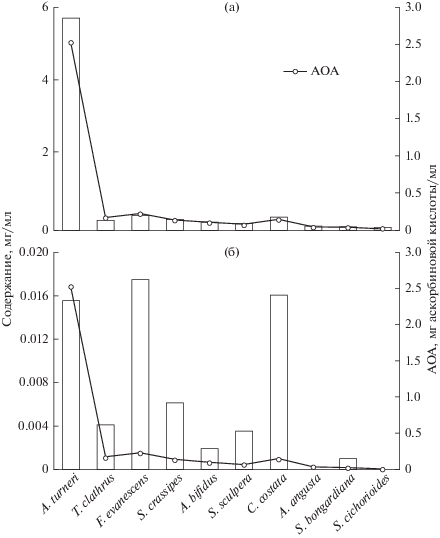
Для водных экстрактов изученных видов водорослей наблюдалась почти прямая зависимость АОА от содержания общего количества ПФ, но не от концентрации флоротаннинов (рис. 4). По отношению к концентрации флоротаннинов АОА водных экстрактов значительно варьировала – от 1 : 9 до 1 : 162 (рис. 4б). Возможно, в водных экстрактах флоротаннины некоторых видов ламинариевых водорослей проявляли более сильную антиоксидантную активность, так как известно, что АОА коррелирует с количеством гидроксильных групп в молекуле полифенола (Имбс, Звягинцева, 2018). Кроме этого, в водных экстрактах могли присутствовать вещества другой природы с высокой АОА.
Рис. 4.
Содержание в водных экстрактах полифенолов (а), флоротаннинов (б) и их антиоксидантная активность (АОА).
Таким образом, выход полифенолов из бурых водорослей зависел от видовой принадлежности и применяемого экстрагента – воды или 70% этанола. В любом случае из Agarum turneri можно получить максимальное количество ПФ, присутствие которых, скорее всего, связано с высокой антиоксидантной активностью экстрактов. Достаточно высокие значения содержания ПФ и АОА обнаружены у обоих экстрактов из F. evanescens, а также у этанольных экстрактов T. clathrus и S. crassipes. Для водорослей из родов Costaria, Saccharina и Alaria в качестве экстрагента можно использовать воду, которая позволяет извлечь из сырья бóльшее количество полифенолов, чем раствор этанола. При этом максимальный выход ПФ и значимую АОА экстракта показала C. costata. Известно, что состав и структура полифенольных соединений в водорослях варьируют в зависимости от видовой принадлежности. Например, бурые водоросли разных семейств содержат флоротаннины, структура которых различается (Shibata et al., 2004; Cérantola et al., 2006). Скорее всего, они проявляют разные свойства и обладают разным физиологическим действием. Дальнейшие исследования биологической активности полифенолов бурых водорослей могут показать новые возможности для применения морского растительного сырья дальневосточных морей в пищевой промышленности и медицине.
Список литературы
Аминина Н.М., Вишневская Т.И., Караулова Е.П., Якуш Е.В. Содержание полифенолов и антиоксидантная активность экстрактов из некоторых видов морских водорослей // Изв. ТИНРО. 2017. Т. 189. С. 184–191.
Боголицын К.Г., Дружинина А.С., Овчинников Д.В. и др. Полифенолы бурых водорослей // Химия раст. сырья. 2018. № 3. С. 5–21.
Имбс Т.И., Звягинцева Т.Н. Флоротаннины – полифенольные метаболиты бурых водорослей // Биол. моря. 2018. Т. 44. № 4. С. 217–227.
Клиндух М.П., Облучинская Е.Д. Сравнительное исследование химического состава бурых водорослей Fucus vesiculosus и Ascophyllum nodosum // Вестн. МГТУ. 2013. Т. 16. № 3. С. 466–471.
Спрыгин В.Г., Кушнерова Н.Ф., Фоменко С.Е. и др. Морские водоросли – перспективный источник полифенольных антиоксидантов и комплексов эссенциальных фосфолипидов // Изв. Самар. науч. центра РАН. 2012. Т. 14. № 1(9). С. 2299–2302.
Спрыгин В.Г., Кушнерова Н.Ф., Фоменко С.Е. и др. Гепатопротекторные свойства экстракта из бурой водоросли Saccharina japonica // Биол. моря. 2013. Т. 39. № 1. С. 50–54.
Спрыгин В.Г., Кушнерова Н.Ф., Фоменко С.Е. и др. Влияние экстракта из морской бурой водоросли Sargassum pallidum (Turner) C. Agardh, 1820 на метаболические реакции печени при экспериментальном токсическом гепатите // Биол. моря. 2017. Т. 43. № 6. С. 444–449.
Artan M., Li Y., Karadeniz F. et al. Anti-HIV-1 activity of phloroglucinol derivative, 6,6-bieckol, from Ecklonia cava // Bioorg. Med. Chem. 2008. V. 16. P. 7921–7926.
Cérantola S., Breton F., Gall E.A., Deslandes E. Co-occurrence and antioxidant activities of fucol and fucophlorethol classes of polymeric phenols in Fucus spiralis // Bot. Mar. 2006. V. 49. P. 347–351.
Chkhikvishvili I.D., Ramazanov Z.M. Phenolic substances of brown algae and their antioxidant activity // Appl. Biochem. Microbiol. 2000. V. 36. № 3. P. 289–291.
Koivikko R., Loponen J., Honkanen T., Jomalainen V. Contents of soluble, cell-wall-bound and exuded phlorotannins in the brown alga Fucus vesiculosus, with implications on their ecological functions // J. Chem. Ecol. 2005. V. 31. № 1. P. 195–212.
Korczyński M., Witkowska Z., Opaliński S. et al. Algae extract as a potential feed additive // Marine algae extracts: Processes, products, and applications. Weinheim, Germany: Wiley-VCH Verlag. 2015. P. 614–615.
Li Y., Qian Z.J., Ryu B. et al. Chemical components and its antioxidant properties in vitro: an edible marine brown alga, Ecklonia cava // Bioorg. Med. Chem. 2009. V. 17. P. 1963–1973.
Machu L., Misurcova L., Ambrozova J.V. et al. Phenolic content and antioxidant capacity in algal food products // Molecules. 2015. V. 20. № 1. P. 1118–1133.
Molyneux P. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity // Songklanakarin J. Sci. Technol. 2004. V. 26. № 2. P. 211–219.
Nguyen P.H., Choi I.-W., Kim S.-K., Jung W.-K. Immune regulatory effects of phlorotannins derived from marine brown algae (Phaeophyta) // Handbook of marine macroalgae: Biotechnology and applied phycology. Chichester, U.K.: John Wiley & Sons. 2011. P. 340–343.
Shibata T., Kawaguchi S., Hama Y. et al. Local and chemical distribution of phlorotannins in brown algae // J. Appl. Phycol. 2004. V. 16. P. 291–296.
Singh I.P., Bharate S.B. Phloroglucinol compounds of natural origin // Nat. Prod. Rep. 2006. V. 23. P. 558–591.
Spurr H.I. Extraction, separation and purification of polyphenols, polysaccharides and pigments from British seaweed for high-value applications: PhD thesis. Univ. of Leeds. 2014. 224 p.
Stern J.L., Hagerman A.E., Steinberg P.D., Mason P.K. Phlorotannin-protein interactions // J. Chem. Ecol. 1996. V. 22. P. 1877–1899.
Waterman P.G., Mole S. Analysis of polyphenolic plant metabolites. Methods in Enzymology. London: Blackwell Scientific Publications. 1994. 238 p.
Wissam Z., Ghada B., Wassim A., Warid K. Effective extraction of polyphenols and proanthocyanidins from Pomegranate’s peel // Int. J. Pharm. Pharm. Sci. 2012. V. 4. Suppl. 3. P. 675–682.
Yuan Y.V. Antioxidants from edible seaweeds // ACS Symp. Ser. 2007. V. 956. P. 268–301.
Дополнительные материалы отсутствуют.


