Биология моря, 2020, T. 46, № 1, стр. 45-52
Первая находка бурой эндофитной водоросли Laminariocolax aecidioides (Rosenvinge) A.F. Peters, 1998 в дальневосточных морях России
А. В. Скрипцова 1, *, Т. Л. Калита 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: askriptsova@mail.ru
Поступила в редакцию 29.11.2018
После доработки 14.01.2019
Принята к публикации 07.02.2019
Аннотация
Бурая эндофитная водоросль Laminariocolax aecidioides (Ectocarpales: Chordariaceae), произрастающая на Undaria pinnatifida, впервые обнаружена в Уссурийском заливе (зал. Петра Великого Японского моря). Эта находка – первое свидетельство обитания данного вида в дальневосточных морях России. Описана морфология L. aecidioides в природе и культуре; приведены некоторые сведения о биологии этого вида.
Несмотря на многолетнюю историю изучения флоры дальневосточных морей России, современные сведения о видовом составе морских макрофитов данных акваторий не могут считаться окончательными. В текущем столетии уже описан ряд новых для науки видов водорослей из этого региона (Селиванова, Жигадлова, 2003, 2014, 2016; Селиванова, 2008; Писарева, Клочкова, 2013). Изучение новых сборов и ревизия гербарного материала позволяют дополнить видовые списки как локальных флор, так и флоры российского сектора Тихого океана в целом (Левенец, 1996; Перестенко, Штрик, 2005; Левенец и др., 2006; Жигадлова, 2011, 2014; Селиванова, Жигадлова, 2014; Евсеева, 2016; Скрипцова, Титлянова, 2017).
При изучении популяции бурой водоросли Undaria pinnatifida (Harvey) Suringar, 1873 в зал. Петра Великого (Японское море) у значительной части растений, собранных в прибрежных водах г. Владивостока, были обнаружены морфологические аномалии. На пластине и спорофиллах ундарии в большом количестве развивались темно-коричневые пятна разной формы диаметром от 2–3 до 30 мм (рис. 1а, 1б), а поверхность пластины часто была волнистой. При исследовании пятен под микроскопом в тканях ундарии была найдена бурая эндофитная водоросль, идентифицированная как Laminariocolax aecidioides (Rosenvinge) A.F. Peters, 1998 (Ectocarpales, Phaeophyceae). Данный вид известен под несколькими синонимами: Streblonema aecidioides (Rosenvinge) Foslie ex Jaasund, 1963; Gononema aecidioides (Rosenvinge) P.M. Pedersen, 1981; Entonema aecidioides (Rosenvinge) Kylin, 1947; Myrionema aecidioides (Rosenvinge) Sauvageau, 1897; Ectocarpus aecidioides Rosenvinge, 1893 и Phycocelis aecidioides (Rosenvinge) Kuckuck, 1894. Он распространен в основном в северной Атлантике (в том числе в Балтийском море), вдоль северо-западного побережья Северной Америки, у побережья Аргентины и в Арктике (Белое море, о-в Шпицберген) (Guiry, Guiry, 2018). В азиатском секторе Тихого океана L. aecidioides встречался только у берегов Японии (Yoshida, Akiyama, 1979; Yoshida et al., 2015). Типичными базифитами этого вида являются ламинариевые водоросли родов Agarum, Undaria, Alaria, Laminaria и Hedophyllum (см.: Edelstein, McLachlan, 1968; Abbott, Hollenberg, 1976; Yoshida, Akiyama, 1979; Peters, Schaffelke, 1996; Burkhardt, Peters, 1998; Gauna et al., 2009). Находка L. aecidioides в зал. Петра Великого Японского моря – первое свидетельство обитания данного вида в российских водах Тихого океана.
Рис. 1.
Эндофит Laminariocolax aecidioides на талломах Undaria pinnatifida: а – внешний вид U. pinnatifida, зараженной L. aecidioides, более темная пятнистая окраска вдоль ребра ундарии обусловлена присутствием эндофита в ее слоевище; б – фрагмент пластины U. pinnatifida с пятнами L. aecidioides; в – нити L. aecidioides (показаны стрелками) в сердцевине U. pinnatifida и многогнездные зооидангии (pl) эндофита на ее поверхности; г – дисковидные хлоропласты L. aecidioides; д – настоящий волосок (h); е – эцидий, образованный многогнездными зооидангиями (pl) L. aecidioides на поверхности таллома ундарии; ж – многогнездные зооидангии (pl); з – одногнездный зооидангий. Масштаб: в, г, ж, з – 20 мкм; д, е – 30 мкм.

Как и большинство бурых эндофитных водорослей, L. aecidioides считается высокопатогенным видом, вызывающим морфологические аномалии базифита, которые часто приводят к снижению прочности его слоевищ и к отрыву пластин во время штормов, что наблюдалось в январе 1990 г. у юго-западного побережья Норвегии (Lein et al., 1991). Поражение ламинарий эндофитом L. aecidioides является серьезной проблемой при их культивировании, так как снижает товарное качество продукции (Yoshida, Akiyama, 1979). Распространение L. aecidioides в российских водах также может представлять угрозу для популяций ламинариевых водорослей, которые в зал. Петра Великого относятся к ценозообразующим видам. В связи с этим изучение биологии и патогенности L. aecidioides в зал. Петра Великого представляет несомненный интерес.
В настоящей работе дано описание L. aecidioides в естественных условиях обитания и в культуре; приведены некоторые сведения о биологии этого вида в зал. Петра Великого.
МАТЕРИАЛ И МЕТОДИКА
Слоевища Undaria pinnatifida собирали в б. Соболь и южнее мыса Зеленый (Уссурийский залив, зал. Петра Великого, Японское море) в июле 2015 г. (31 таллом) и 2017 г. (48 талломов), а также в марте–августе и в ноябре 2018 г. Объем проанализированного в 2018 г. материала представлен на рис. 2. Для обнаружения других возможных носителей Laminariocolax aecidioides собирали талломы Costaria costata и Sargassum pallidum (по несколько талломов каждого вида), росших среди слоевищ U. pinnatifida. В б. Соболь дополнительно ежемесячно с августа по октябрь 2018 г. собирали по несколько талломов S. pallidum. Этот вид вегетирует круглогодично и поселяется среди зарослей U. pinnatifida, поэтому может быть местом депонирования эндофита во время отсутствия спорофитов ундарии в природе. Кроме этого были проанализированы слоевища U. pinnatifida, собранные в мае–июне 2001 г. и хранящиеся в гербарии лаборатории автотрофных организмов ННЦМБ ДВО РАН (10 талломов).
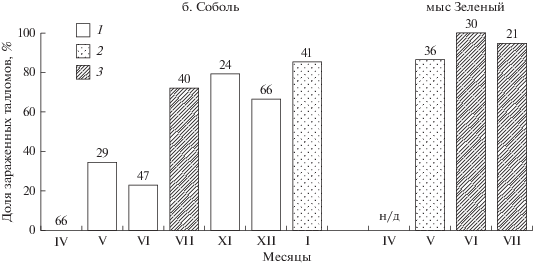
Рис. 2.
Доля зараженных талломов Undaria pinnatifida и степень инфицирования ундарии бурой эндофитной водорослью Laminariocolax aecidioides в двух акваториях зал. Петра Великого (Японское море) в 2018 г. 1 – единичные (до 5 экз. на пластине) пятна диаметром до 3 мм; 2 – многочисленные (более 10 экз. на пластине) несливающиеся пятна диаметром до 5 мм; 3 – многочисленные (более 50 экз. на пластине) часто сливающиеся пятна диаметром более 5 мм, покрывающие более 10% поверхности пластины. Н/д – нет данных; цифры над столбцами – количество проанализированных талломов.
Макроводоросли просматривали в проходящем свете для обнаружения более темных пятен и других аномалий. Срезы с пятен, а также из верхней, средней и нижней частей пластины U. pinnatifida изготавливали с помощью бритвенного лезвия. Срезы просматривали под световым микроскопом CarlZeiss AxioVert 200M, микрофотографии выполняли с помощью цифровой фотокамеры AxioCam HRc.
В июне 2018 г. образцы L. aecidioides выделили в свободноживущую культуру. Для этого фрагменты пластины U. pinnatifida, содержавшие эндофит с развитыми многогнездными зооидангиями, помещали в чашки Петри со стерильной морской водой (ультрафиолет, фильтрация 0.2 мкм, кипячение), обогащенной средой ES (Provasoli, 1968), и выдерживали при температуре 15 ± 1°C, освещенности 10 мкЕ/(м2 с) и фотопериоде 12 ч свет : 12 ч темнота для выхода спор L. aecidioides. Через 3 сут после прорастания спор L. aecidioides фрагменты ундарии удалили, а микроскопические проростки L. aecidioides содержали в прежних условиях до формирования видимых невооруженным глазом талломов. Сформировавшиеся нитчатые слоевища L. aecidioides с помощью блендера разбили на мелкие (3–5-клеточные) фрагменты, которые выделили в чистую культуру. До настоящего времени культура содержится в условиях, аналогичных указанным выше. Изолированные культуры депонировали с номером LamAec1 в раздел коллекции гаметофитов морских бурых водорослей в составе Биоресурсной коллекции “Морской биобанк” ННЦМБ ДВО РАН (РК “Морской биобанк”, реестровый № 506171).
Для определения влияния температуры на рост и развитие L. aecidioides образцы выращивали в чашках Петри в течение 2 нед. из спор при температуре 5 и 15°C. Прочие условия соответствовали описанным выше. В каждом температурном варианте под микроскопом анализировали не менее 10 талломов водоросли.
РЕЗУЛЬТАТЫ
Морфология Laminariocolax aecidioides внутри слоевищ Undaria pinnatifida в естественных условиях
Слоевище L. aecidioides эндофитное, образует характерные темные пятна на пластине, реже на спорофиллах и ребре U. pinnatifida. Вегетативные нити однорядные, неправильно поочередно разветвленные, глубоко проникают в ткани хозяина и развиваются среди ситовидных трубок и гиф, не проникая в них (рис. 1в). Клетки нитей прямые и извилистые, шириной 6.2–16.5 мкм и длиной 17–68 мкм, с одним или с несколькими дисковидными или лентовидными хлоропластами (рис. 1г). Под коровыми клетками хозяина нити формируют округлую псевдопаренхимную структуру, которая по мере роста боковых вертикальных коротких нитей (направленных к поверхности слоевища хозяина) разрывает коровый слой базифита, образуя эцидий (aecidium) – подушковидное или линзовидное образование в коровом слое базифита (рис. 1е), состоящее из многогнездных зооидангиев и волосков, среди которых иногда встречаются одногнездные зооидангии и короткие вегетативные нити. Настоящие волоски состоят из прозрачных клеток шириной 4.1–8.2 мкм и длиной до 79 мкм (рис. 1д). Многогнездные зооидангии однорядные, цилиндрические; их ширина 7.8–12 мкм, длина – 23–44 мкм (рис. 1ж). Одногнездные зооидангии овальные (ширина – 9–14 мкм, длина – 17–37 мкм), сидячие или на одноклеточной ножке (рис. 1з).
Морфология L. aecidioides в культуре
Слоевище микроскопическое; состоит из однорядных неправильно поочередно ветвящихся нитей; боковые ветви отходят практически под прямым углом; толщина нитей к вершине уменьшается (рис. 3а). Молодые клетки цилиндрические, бочонковидные, расширенные в середине или извилистые, шириной до 15 мкм, а в быстрорастущей культуре до 7 мкм; отношение ширины к длине составляет 1 : 2–10. Форма клеток более старых нитей варьирует от бочонковидной до четковидной; их ширина 7–15 мкм, отношение ширины к длине составляет 1 : 0.5–1. Хлоропласты пластинчатые, лентовидные, с пиреноидом, по 1–2 в клетке. В некоторых частях талломов отмечено массовое образование боковых червеобразных нитей, формирующих округлые структуры (рис. 3б). Волоски длинные, развиваются латерально; они обильны в молодой культуре и единичны в старой (рис. 3в). Многогнездные зооидангии однорядные, цилиндрические, сидячие или на одноклеточной ножке (размер 7–11 × 40–90 мкм); развиваются латерально (рис. 3г). Одногнездные зооидангии овальные, сидячие или на ножке (размер 11 × 20 мкм).
Рис. 3.
Морфология бурой эндофитной водоросли Laminariocolax aecidioides в культуре: а – внешний вид водоросли; б – округлые структуры, образованные разрастанием червеобразных нитей; в – многочисленные волоски; г – многогнездные зооидангии; д – образцы, выращенные из спор, на 14-е сут культивирования при температуре 5°C; е – образцы, выращенные из спор, на 14-е сут культивирования при температуре 15°C. Масштаб: а, г, е – 100 мкм; б – 50 мкм; д – 20 мкм.

При выращивании L. aecidioides из спор при температуре 5°C через 2 нед. слоевища состояли из 4–10 клеток; размеры талломов не превышали 100 мкм (рис. 3д). При температуре 15°C через 2 нед. сформировались хорошо развитые разветвленные талломы длиной более 2 мм с обильными волосками, многогнездными и одногнездными зооидангиями (рис. 3е).
Инфицированность слоевищ U. pinnatifida эндофитом L. aecidioides в природе
В 2018 г. признаки заражения талломов U. pinnatifida эндофитной нитчатой бурой водорослью L. aecidioides появлялись в мае и постепенно усиливались к июлю (рис. 2). В апреле нити L. aecidioides отсутствовали даже на срезах пластины ундарии. У мыса Зеленый доля зараженных растений летом 2018 г. достигала 100%, а в б. Соболь – 80%. Зараженность талломов U. pinnatifida в б. Соболь в июне–июле 2015 и 2017 гг. была сходной: доля талломов с видимыми пятнами эндофита, иногда покрывавшими бóльшую часть пластины, достигала 90%. В 2018 г. в б. Соболь в ноябре до 79%, а в декабре 66% талломов U. pinnatifida имели признаки заражения эндофитом: небольшие (до 2 мм) темно-коричневые пятна и перфорации на дистальном конце пластины на расстоянии не более 3 см от ее вершины. К январю 2019 г. степень заражения ундарии достигала 86%; почти у 35% растений эндофит занимал до 5% поверхности таллома, образуя пятна диаметром до 5 мм в его дистальной части. На срезе, сделанном через пятно, в сердцевине базифита были видны многочисленные нити L. aecidioides, а на поверхности таллома – обширные сорусы многогнездных зооидангиев. Вне пятна нити эндофита в базифите не найдены.
Анализ гербарного материала, собранного в 2001 г., не выявил слоевищ U. pinnatifida, зараженных L. aecidioides.
На талломах ундарии пятна эндофита наиболее часто располагались в средней и дистальной частях пластины, преимущественно вдоль ребра и менее обильно в латеральной части (рис. 1а). Эндофит практически не развивался в зоне роста (основание пластины) и очень редко встречался на ребре. Присутствие L. aecidioides, по-видимому, не влияло на репродуктивный потенциал базифита, поскольку взрослые растения ундарии имели хорошо развитые спорофиллы со зрелой спороносной тканью. Споры, полученные от таких растений, были жизнеспособными и формировали гаметофиты. Кроме этого, внешние признаки заражения спорофилл наблюдались лишь у 5% исследованных талломов U. pinnatifida. На талломах Costaria costata и Sargassum pallidum, растущих среди зараженных талломов U. pinnatifida, эндофит L. aecidioides не обнаружен.
ОБСУЖДЕНИЕ
Морфология Laminariocolax aecidioides из зал. Петра Великого соответствует оригинальному описанию вида (Rosenvinge, 1893), а также его описаниям из природных популяций других регионов (Abbott, Hollenberg, 1976; Gauna et al., 2009) и культуры (Pedersen, 1981; Gauna et al., 2009). Развивающиеся зооидангии, прорастая на поверхность плотной группой, приподнимают и разрывают коровый слой базифита, формируя на поверхности водоросли-хозяина подушковидные скопления, так называемые эцидии, которые являются характерной особенностью вида. Наличие этого признака позволило с уверенностью определить видовую принадлежность эндофита в талломах Undaria pinnatifida. Одним из диагностических признаков рода является поверхностное расположение нитей, которые стелются по поверхности и образуют дерновинки или неглубоко проникают в ткани базифита (Abbott, Hollenberg, 1976; Перестенко, 1980). Однако в ряде исследований показано, что нити могут достигать сердцевины, образуя густую распростертую сеть (Peters, Schaffelke, 1996; Gauna et al., 2009). В изученных талломах U. pinnatifida нити L. aecidioides располагались преимущественно в сердцевине. Глубокое проникновение эндофита в U. pinnatifida, вероятно, связано с особенностями анатомии ундарии. По сравнению с другими ламинариевыми водорослями, U. pinnatifida имеет довольно рыхлый и тонкий коровый слой, а также рыхлую сердцевину с большим количеством полостей, где свободно могут развиваться нити L. aecidioides.
До недавнего времени считали, что в дальневосточных морях России род Laminariocolax представлен двумя видами: у берегов Камчатки – L. tomentosoides (см.: Клочкова и др., 2009) и у берегов Приморья – L. draparnaldioides (см.: Перестенко, 1980). Находка L. aecidioides в зал. Петра Великого Японского моря – первое свидетельство обитания этого вида в российских водах Тихого океана. Ранее в сопредельных водах данный вид указывался только для Японии (Yoshida, Akiyama, 1979; Yoshida et al., 2015). Возможно, он мог быть занесен в зал. Петра Великого из Японии с судовыми балластными водами. Отсутствие L. aecidioides на талломах U. pinnatifida, собранных в 2001 г. и хранящихся в гербарии, позволяет говорить о возможной инвазии вида в российские воды из сопредельных акваторий в начале XXI века.
Все виды эндофитных бурых водорослей считаются высокопатогенными. Инфицированность ими представителей порядка Laminariales – довольно обычное и широко распространенное явление (Yoshida, Akiyama, 1979; Apt, 1988; Kawai, Tokuyama, 1995; Peters, Schaffelke, 1996; Gauna et al., 2009). Морфологически присутствие эндофита в талломах U. pinnatifida проявлялось в образовании темных пятен, которые различались по форме и размеру, а также в появлении перфораций в средней и дистальной частях пластины, преимущественно вдоль ребра, реже на спорофиллах и ребре. Других морфологических аномалий (деформация пластины, ее гиперплазия, образование галлов и опухолевидных разрастаний), отмеченных ранее для зараженных L. aecidioides ламинариевых водорослей (Apt, 1988; Gauna et al., 2009; Murúa et al., 2017), мы не обнаружили.
Количество зараженных L. aecidioides талломов U. pinnatifida было наибольшим осенью, зимой и летом, когда их доля в популяции достигала 72–100%. Эндофит обычно располагался в дистальной наиболее старой части таллома, здесь же отмечена его наибольшая концентрация в течение периода вегетации ундарии. Лишь в июне–июле пятна L. aecidioides встречались в средней части таллома вдоль ребра и на спорофиллах. Полученные данные согласуются с мнением исследователей, считающих, что в природе инфицирование базифита эндофитными водорослями происходит на ранних стадиях его развития (Peters, Schaffelke, 1996; Bernard et al., 2018). Ранее для Saccharina japonica было показано, что только проростки могут быть инфицированы эндофитной бурой водорослью Streblonema sp., так как нити эндофита не проникают в ткань зрелых растений с неповрежденной поверхностью (Apt, 1988). По мере роста талломов ламинариевых водорослей, который обеспечивается делением и растяжением клеток в расположенной на границе между стволиком и пластиной интеркалярной зоне роста, инфицированные части пластины отодвигаются к верхушке пластины, где и наблюдается максимальная концентрация эндофита. В зал. Петра Великого первые проростки U. pinnatifida появлялись в конце октября – в начале ноября. Длина талломов, собранных в середине ноября, не превышала 10 см. Пятна L. aecidioides находили даже у растений длиной 3–4 см. Однако в этот период концентрация эндофита на пластине U. pinnatifida была минимальной (не более пяти пятен диаметром менее 2 мм). В январе 2019 г. степень заражения ундарии L. aecidioides составляла 86%; более чем у 1/3 растений эндофит занимал до 5% поверхности таллома в дистальной части, образуя пятна диаметром до 5 мм. Максимальное развитие эндофита в талломах U. pinnatifida отмечено в июне–июле. В это время на пластине насчитывали до 100 пятен диаметром от 3 до 30 мм. Следует заметить, что июнь–июль – период спороношения U. pinnatifida и естественного разрушения ее пластины в результате разрыхления тканей. Наряду с высокой температурой воды (>15°C) это способствует массовому развитию L. aecidioides в слоевищах ундарии. Активный рост эндофита при температуре 15°C мы наблюдали при исследовании развития L. aecidioides в свободной культуре. Низкая доля инфицированных талломов ундарии в апреле–мае может быть обусловлена прижизненным разрушением дистальной части таллома, что характерно для всех ламинариевых водорослей и в результате чего происходит потеря инфицированных участков талломов.
В литературе обсуждается предположение, что поселение эндофитных водорослей в талломах других водорослей является стрессовым для базифитов и может влиять на устойчивость их популяции к флуктуациям условий обитания (Schaffelke et al., 1996; Eggert et al., 2010; Schoenrock et al., 2013). Показано, что массовое развитие эндофита Streblonema sp. ингибирует формирование сорусов у Laminaria hyperborea, снижая способность популяции к возобновлению (Lein et al., 1991). Эти же авторы предполагают, что уменьшение прочности талломов L. hyperborea в результате развития эндофита снижает их устойчивость к волновому воздействию (Lein et al., 1991). Показано, что при заражении красной водоросли Chondrus crispus зелеными эндофитными водорослями Acrochaete operculata и A. heteroclada снижались темпы роста базифита, прочность его талломов и их способность к регенерации. Кроме этого, инфицированные эндофитами талломы макроводорослей легко подвергаются заражению вторичной бактериальной инфекцией (del Campo et al., 1998), к тому же их более активно поедают травоядные беспозвоночные (Correa, McLachlan, 1992; Buschmann et al., 1997). Высокая степень инфицирования U. pinnatifida в зал. Петра Великого бурой эндофитной водорослью L. aecidioides, вероятно, может представлять серьезную угрозу для популяции ценозообразующего вида и способствовать ее сокращению. Поэтому необходимы дальнейшие исследования биологии и патогенности L. aecidioides в условиях зал. Петра Великого.
Список литературы
Евсеева Н.В. Дополнения к флоре морских водорослей-макрофитов южного Сахалина и южных Курильских островов (Россия) // Альгология. 2016. Т. 26. № 4. С. 387–402.
Жигадлова Г.Г. Эпифиты и эндофиты водорослей рода Palmaria Stackhous у берегов восточной Камчатки // Изв. ТИНРО. 2011. Т. 164. С. 300–311.
Жигадлова Г.Г. Первая находка красной эпифитной водоросли Pseudorhododiscus nipponicus Masuda, 1976 (Rhodophyta: Palmariales) в Авачинском заливе (восточная Камчатка) // Биол. моря. 2014. Т. 40. № 3. С. 238–239.
Клочкова Н.Г., Королева Т.Н., Кусиди А.Э. Атлас водорослей-макрофитов прикамчатских вод. Петропавловск-Камчатский: КамчатНИРО. 2009. Т. 1. 218 с.
Левенец И.Р. Дополнение к флоре морских водорослей района острова Кунашир (Курильские острова) // Ботан. журн. 1996. Т. 81. № 3. С. 133–137.
Левенец И.Р., Скрипцова А.В., Попова Л.И. Флористические находки в заливе Петра Великого Японского моря // Ботан. журн. 2006. Т. 91. № 7. С. 1107–1109.
Перестенко Л.П. Водоросли залива Петра Великого. Л.: Наука. 1980. 232 с.
Перестенко Л.П., Штрик В.А. Новые и интересные виды бурых водорослей острова Сахалин // Новости системат. низш. раст. 2005. Т. 39. С. 75–88.
Писарева Н.А., Клочкова Н.Г. Два новых вида водорослей рода Neoabbottiella (Rhodophyta: Halymeniales) из морей российского Дальнего Востока // Биол. моря. 2013. Т. 39. № 6. С. 411–421.
Селиванова О.Н. Fauchea guiryi sp. n.: первая находка представителя семейства Faucheaceae (Rhodophyta: Rhodymeniales) в дальневосточных морях России // Биол. моря. 2008. Т. 34. № 6. С. 396–403.
Селиванова О.Н., Жигадлова Г.Г. Phycodrys valentinae sp. nov. (Delesseriaceae, Rhodophyta) с обсуждением других видов рода Phycodrys из северной Пацифики // Биол. моря. 2003. Т. 29. № 4. С. 240–248.
Селиванова О.Н., Жигадлова Г.Г. Эпифитон морских бентосных водорослей шельфа восточной Камчатки // Международ. журн. прикл. и фундамент. исслед. 2014. Т. 11. Ч. 1. С. 54–58.
Селиванова О.Н., Жигадлова Г.Г. Flabellina avachensis gen. et sp. n. – новые род и вид семейства Delesseriaceae (Rhodophyta) из прикамчатских вод Тихого океана // Биол. моря. 2016. Т. 42. № 3. С. 179–188.
Скрипцова А.В., Титлянова Т.В. Дополнения к флоре морских макроводорослей острова Кунашир // Ботан. журн. 2017. № 7. С. 936–943.
Abbott I.A., Hollenberg G.J. Marine algae of California. Stanford, California: Stanford Univ. Press. 1976. 827 p.
Apt K.E. Etiology and development of hyperplasia induced by Streblonema sp. (Phaeophyta) on members of the Laminariales (Phaeophyta) // J. Phycol. 1988. V. 24. P. 28–34.
Bernard M., Rousvoal S., Jacquemin B. et al. qPCR-based relative quantification of the brown algal endophyte Laminarionema elsbetiae in Saccharina latissima: variation and dynamics of host–endophyte interactions // J. Appl. Phycol. 2018. V. 30. № 5. P. 2901–2911.
Burkhardt E., Peters A.F. Molecular evidence from nrDNA ITS sequences that Laminariocolax (Phaeophyceae, Ectocarpales sensu lato) is a worldwide clade of closely related kelp endophytes // J. Phycol. 1998. V. 34. P. 682–691.
Buschmann A.H., Correa J.A., Beltrán J., Retamales C. Determinants of disease expression and survival of infected individual fronds in wild populations of Mazzaella laminarioides (Rhodophyta) in central and southern Chile // Mar. Ecol. Prog. Ser. 1997. V. 154. P. 269–280.
Correa J.A., McLachlan J.L. Endophytic algae of Chondrus crispus (Rhodophyta). IV. Effects on the host following infections by Acrochaete operculata and A. heteroclada (Chlorophyta) // Mar. Ecol. Prog. Ser. 1992. V. 81. P. 73–87.
del Campo E., García-Reina G., Correa J.A. Degradative disease in Ulva rigida (Chlorophyceae) associated with Acrochaete geniculata (Chlorophyceae) // J. Phycol. 1998. V. 34. P. 160–166.
Edelstein T., McLachlan J. Investigations of the marine algae of Nova Scotia. V. Additional species new or rare to Nova Scotia // Can. J. Bot. 1968. V. 46. P. 993–1003.
Eggert A., Peters A.F., Küpper F.C. Potential impact of climate change on endophyte infections in kelp sporophytes // Seaweeds and their role in globally changing environment / Eds J. Seckbach, R. Einav, A. Israel. Dordrecht: Springer. 2010. P. 139–154.
Gauna M.C., Parodi E.R., Cáceres E.J. Epi-endophytic symbiosis between Laminariocolax aecidioides (Ectocarpales, Phaeophyceae) and Undaria pinnatifida (Laminariales, Phaeophyceae) growing on Argentinian coasts // J. Appl. Phycol. 2009. V. 21. P. 11–18.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Galway: Natl. Univ. Ireland. 2018. http://www.algaebase.org. Cited November 20, 2018.
Kawai H., Tokuyama M. Laminarionema elsbetiae gen. et sp. nov. (Ectocarpales, Phaeophyceae), a new endophyte in Laminaria sporophytes // Phycol. Res. 1995. V. 43. P. 185–190.
Lein T.E., Sjøtun K., Wakili S. Mass-occurrence of brown filamentous endophyte in the lamina of the kelp Laminaria hyperborea (Gunnerus) Foslie along the southwestern coast of Norway // Sarsia. 1991. V. 76. P. 187–193.
Murúa P., Westermeier R., Muñoz L.A. et al. Laminariocolax aecidioides as the causative agent of malformations in Lessonia berteroana from Atacama: DNA barcoding, ultrastructure and field prevalence // Phycologia. 2017. V. 56. № 4. P. 133.
Pedersen P.M. The life histories in culture of the brown algae Gononema alariae sp. nov. and G. aecidioides comb. nov. from Greenland // Nord. J. Bot. 1981. V. 1. P. 263–270.
Peters A.F., Schaffelke B. Streblonema (Ectocarpales, Phaeophyceae) infection in the kelp Laminaria saccharina (Laminariales, Phaeophyceae) in the western Baltic // Hydrobiologia. 1996. V. 326–327. P. 111–116.
Provasoli L. Media and prospects for the cultivation of marine algae // Cultures and collections of algae / Eds A. Watanabe, A. Hattori. Proc. U.S.-Japan Conf. Hakone, Japan, September 1966. Japanese Society of Plant Physiology. 1968. P. 63–75.
Rosenvinge L.K. Grønlands Havalger // Meddelelser om Grønland. 1893. V. 3. P. 763–981.
Schaffelke B., Peters A.F., Reusch T. Factors influencing depth distribution of soft bottom Laminaria saccharina (L.) Lamour in Kiel Fjord, Baltic Sea // Hydrobiologia. 1996. V. 326–327. P. 117–123.
Schoenrock K., Amsler C.D., McClintock J.B., Baker B.J. Endophyte presence as a potential stressor on growth and survival in Antarctic macroalgal hosts // Phycologia. 2013. V. 52. № 6. P. 595–599.
Yoshida T., Akiyama K. Streblonema (Phaeophyta) infection in the frond of cultivated Undaria (Phaeophyceae) // Proc. Ninth Int. Seaweed Symp. 1979. V. 9. P. 219–223.
Yoshida T., Suzuki M., Yoshinaga K. Checklist of marine algae of Japan (revised in 2015) // Jpn. J. Phycol. 2015. V. 63. P. 129–189.
Дополнительные материалы отсутствуют.


