Биология моря, 2020, T. 46, № 1, стр. 3-13
Сравнительная морфологическая классификация иммунных клеток морских беспозвоночных
Ю. А. Каретин 1, *, Е. А. Пименова 1, А. А. Калитник 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: yura15cbx@gmail.com
Поступила в редакцию 20.12.2018
После доработки 06.05.2019
Принята к публикации 06.05.2019
Аннотация
Сочетание фрактального формализма с линейными методами анализа изображений лежит в основе статистически достоверного описания морфологии и классификации таких иррегулярных с точки зрения евклидовой геометрии форм, как распластанные амебоидные клетки in vitro. Разработан алгоритм классификации на основе морфологических признаков иммунных клеток четырех видов морских беспозвоночных: двустворчатых моллюсков Spisula sachalinensis (Schrenck, 1862) и Callista brevisiphonata (Carpenter, 1864), а также иглокожих Aphelasterias japonica (Bell, 1881) и Asterias amurensis (Lütken, 1871). Морфологические признаки клеток включали размерностные характеристики (площадь, периметр), особенности описывающей клетку окружности и выпуклой оболочки, характеристики симметричности и округлости клетки, а также фрактальную размерность и лакунарность, которые были определены несколькими способами, оценивающими пространственную сложность клеток. Показано, что оптимальная классификационная структура иммунных клеток всех видов основана на сходном универсальном алгоритме, включающем иерархическую классификацию методом Варда, при использовании переменных с самым высоким индексом мультимодальности, которые в факторном анализе нагружают разные факторы.
Количественная характеристика и классификация фибробластоподобных клеток сложной неправильной формы остаются актуальными задачами, решение которых позволит идентифицировать клеточные типы на разных стадиях дифференцировки и изучать морфогенетические преобразования клеток как in vivo, так и in vitro. В отличие от клеток с четко распознаваемыми и типизируемыми элементами структуры, например, нейронов (Benavides-Piccione et al., 2006), иммунные клетки беспозвоночных (гемоциты двустворчатых моллюсков и целомоциты иглокожих) не имеют однозначно различимых структурных элементов внешней морфологии. Среди филоподий, ламеллоподий и других типов псевдоподий встречается множество переходных форм, а граница между телом клетки и отростками не всегда очевидна. Это затрудняет описание и классификацию данных клеток с помощью общепринятых структурных параметров.
Для описания сложных и хаотичных с точки зрения евклидовой геометрии биологических паттернов стандартом de facto используют параметры квазифрактальной организации (Li, 2000). В рамках этого подхода природный паттерн рассматривается как квазифрактал, фрактальную размерность и пространственную неоднородность (лакунарность) которого можно определить разными методами. В данной работе для сравнительной классификации гемоцитов двустворчатых моллюсков и целомоцитов иглокожих, позволяющей выделить характерные для каждого вида животных морфотипы прикрепленных к субстрату иммунных клеток, применен комплексный подход, сочетающий классические морфометрические параметры с квазифрактальными.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на двустворчатых моллюсках Spisula sachalinensis (Schrenck, 1862) и Callista brevisiphonata (Carpenter, 1864), а также на морских звездах Aphelasterias japonica (Bell, 1881) и Asterias amurensis (Lütken, 1871). Животных собирали в б. Восток (зал. Петра Великого, Японское море). Моллюсков вскрывали и из сердечной сумки шприцем набирали гемолимфу; целомическую жидкость морской звезды выделяли, надрезая кончик луча. Гемолимфу и целомическую жидкость сразу помещали на покровные стекла и выдерживали в течение 1 ч при комнатной температуре. Затем клетки фиксировали в 4% растворе формалина на морской воде. После фиксации препараты окрашивали гематоксилин–эозином, обезвоживали и заключали в канадский бальзам. Распластанные клетки фотографировали с помощью цифровой камеры (10 Мпикс) микроскопа Zeiss Axiovert 200M Apotome, выводили на экран планшетного компьютера, зарисовывали и переводили в однобитный формат. Всего обработано 458 гемоцитов S. sachalinensis и 628 гемоцитов C. brevisiphonata, 569 целомоцитов A. japonica и 400 целомоцитов A. amurensis. Анализировали как силуэтные, так и контурные двумерные изображения распластанных клеток. В контурных изображениях использовали однопиксельный абрис внешней границы клетки. Фрактальный анализ выполняли при помощи плагина FracLac 2.5 для программы анализа изображений ImageJ 1.41, линейные параметры просчитывали средствами ImageJ 1.41 и с помощью Photoshop SC3. Статистическую обработку результатов осуществляли в программных пакетах STATISTICA 12.0 и NCSS 2007.
Для параметризации клеток использовали 36 параметров, включая 19 параметров линейной морфологии и 17 параметров квазифрактального анализа (Каретин, 2016; Karetin, Pushchin, 2017), из которых для описания клеточной морфологии и классификации отобрали 18 параметров: Area – площадь; Per – периметр клетки; LCFD PreLac – мера гетерогенности или трансляционной инвариантности изображения при разных вариантах наложения решетки; in50/out50 – отношение площади клетки во внешней половине описывающей клетку окружности к площади клетки во внутренней половине окружности; 1/2half – соотношение площадей частей клетки, оказавшихся в двух половинах описывающей клетку окружности, диаметр которой проводится в направлении, максимально неравномерно разделяющем изображение клетки (этот параметр используется как мера асимметричности клетки); AR – соотношение максимального и минимального радиусов описывающего объект эллипса; M/M RadCirc – отношение максимального радиуса к минимальному из центра описывающей объект окружности на границу выпуклой оболочки; M/MHull'sCM – соотношение максимального и минимального радиусов из центра масс выпуклой оболочки на точку на границе объекта; BiggestD – фрактальная размерность контурных изображений, подсчитанная с учетом квадратов лишь больше среднего размера; outMeanD – среднее значение фрактальной размерности, рассчитанное методом подсчета квадратов с учетом множественного наложения решетки с разной ориентацией квадратов на контурное изображение клетки; LF – лакунарность, рассчитанная на основе различий числа пикселей в каждом квадрате изображения при всех ориентациях квадратной решетки с учетом пикселей изображения и без учета пикселей фона (F – foreground mass, пиксели изображения), LF = (Σ[FΛ])/GRIDS; outMeanLFD – средняя локальная фрактальная размерность контурных изображений клеток, подсчитанная этим же способом; outMeanLCFD – средняя локальная связанная фрактальная размерность контурных изображений клеток; outLCFD PreLac – мера гетерогенности или трансляционной инвариантности контурного изображения клеток; MeanΛ – средняя лакунарность, подсчитанная при разных ориентациях решетки; LCFD – связанная локальная размерность, которая подсчитывается непосредственно вокруг пикселя, соединенного с соседними пикселями изображения (пиксель считается связанным, если в квадрате 8 на 8 пикселей вокруг него имеются другие пиксели); MMFD – средняя массовая размерность силуэтных изображений: фрактальная размерность, подсчитанная с учетом числа пикселей в квадратах пробирующей функции DBmass = lim ε → 0[ln με/ln ε], lim ε → 0, определяется как наклон линии регрессии для με и ε, где με – среднее число пикселей в квадрате со стороной ε; Circ – округлость клетки, равна 4π × площадь/периметр2 клетки; Hull’sCirc – округлость выпуклой оболочки, равна 4π × площадь/периметр2 выпуклой оболочки. Параметры были нормализованы для выравнивания их вклада в классификацию в качестве кластерных переменных.
Одна из главных проблем кластерного анализа, так называемое “проклятие размерности”, заключается в том, что качество кластеризации быстро ухудшается с увеличением размерности модели – числа параметров (Gordon, 1999; Xu, Wunsch, 2008).
Корреляцию между параметрами измеряли с помощью метода линейного корреляционного анализа Пирсона. Для сокращения числа переменных из анализа исключали параметры, имеющие высокое значение линейной корреляции Пирсона, предположительно описывающие близкие морфологические свойства. При выборе из двух высоко коррелированных параметров предпочтение отдавали параметру с более высоким индексом мультимодальности, определяющим, является ли распределение значений признака моно-, би- или мультимодальным (Schweitzer, Renehan, 1997). Среди параметров, нагружающих каждый фактор, отбирали параметры с максимальным индексом мультимодальности (Karetin, Pushchin, 2015).
При выделении факторов в факторном анализе использовали ортогональное вращение основных факторных осей методом Варимакс (Varimax). Метод Варимакс максимизирует разброс квадратов нагрузок для каждого фактора, что приводит к увеличению больших и к уменьшению малых значений факторных нагрузок.
Для классификации клеток использовали иерархический кластерный анализ с правилом объединения кластеров по методу Варда и с евклидовым расстоянием в качестве меры близости. Снижение размерности параметрического пространства осуществляли с помощью факторного анализа. Для проверки кластерной структуры использовали дисперсионный анализ.
Статистическую достоверность кластерных решений определяли, оценивая значимость различий между кластерами с использованием однонаправленных ANOVA тестов Крускала–Уоллиса с ретроспективными тестами Манна–Уитни U (Sheskin, 2000). Оценивали также величину эффекта между кластерными различиями. Эта статистика обеспечивает лучшее понимание факторов, лежащих в основе межкластерных различий, позволяя сравнивать результаты, полученные в разных условиях, для разных видов и т.д., а также, что более важно, выявляет небольшие и тривиальные эффекты, формальное значение которых может быть обусловлено чрезмерным размером выборки (Fritz et al., 2012). В настоящем исследовании в качестве величины эффекта для сравнения парных различий между кластерами использован коэффициент Коэна r (Cohen, 1988), который рассчитывали следующим образом: r = Z/SQRT(N), где Z – Z-оценка для соответствующего сравнения, а N – объединенный размер выборки.
РЕЗУЛЬТАТЫ
В результате проведенного анализа установлено, что 31–34 параметра клеток каждого вида показали достоверно высокую (p < 0.05000) корреляцию с одним параметром или более. Для анализа морфологии гемоцитов и целомоцитов отбирали 9–11 слабо коррелированных (менее 0.6) или некоррелированных параметров с наибольшим индексом мультимодальности (табл. 1).
Таблица 1.
Некоррелированные параметры морфологии иммунных клеток исследованных видов беспозвоночных с самым высоким индексом мультимодальности (ИМ)
| Вид | Параметр | ИМ |
|---|---|---|
| Aphelasterias japonica | LCFD PreLac | 0.780407 |
| in50/out50 | 0.770734 | |
| 1/2half | 0.622101 | |
| AR | 0.608966 | |
| M/M RadCirc | 0.58754 | |
| MMFD | 0.580189 | |
| Area | 0.517929 | |
| M/MHull'sCM | 0.496707 | |
| BiggestD | 0.478169 | |
| outMeanLFD | 0.3825 | |
| Spisula sachalinensis | LCFD PreLac | 0.70528 |
| 1/2half | 0.690094 | |
| Per | 0.649817 | |
| M/M RadCirc | 0.582813 | |
| in50/out50 | 0.571991 | |
| AR | 0.533511 | |
| M/MHull'sCM | 0.496496 | |
| Hull’sCirc | 0.460161 | |
| MMFD | 0.379436 | |
| outLCFD PreLac | 0.370878 | |
| outMeanLFD | 0.342725 | |
| Callista brevisiphonata | AR | 0.649615 |
| M/M RadCirc | 0.621261 | |
| Circ | 0.612525 | |
| in50/out50 | 0.576105 | |
| Per | 0.575295 | |
| 1/2half | 0.503101 | |
| MMFD | 0.463013 | |
| outMeanLCFD | 0.409034 | |
| Asterias amurensis | 1/2half | 0.820338 |
| AR | 0.648875 | |
| in50/out50 | 0.623412 | |
| Per | 0.615885 | |
| M/M RadCirc | 0.600593 | |
| LCFD PreLac | 0.508746 | |
| MeanΛ | 0.483697 |
Для дальнейшего уменьшения числа переменных применяли два подхода: отбор некоррелированных переменных с индексом мультимодальности выше заданного порога и факторный анализ. При этом для классификации использовали как сами факторы, так и нагружающие их параметры.
У исследованных видов (кроме C. brevisiphonata) параметры нагружали 4 фактора. При этом первый фактор у всех четырех видов был нагружен фрактальными размерностями и лакунарностями разных типов; в целом он отражал квазифрактальные характеристики морфологии клеток. Второй фактор был нагружен параметрами, отражающими такие размерные характеристики клетки, как площадь, периметр, размеры описывающей клетку окружности и выпуклой оболочки. Третий фактор (у A. japonica – четвертый) был нагружен параметрами, описывающими округлость и вытянутость клетки, а также ее выпуклой оболочки (Round, AR, Hull’sCirc); четвертый фактор (у A. japonica – третий) был нагружен параметрами, связанными с локальной фрактальной размерностью и массовой размерностью контурных изображений клеток: outMeanLCFD, outMeanLFD, outLCFD PreLac и outMMFD. Таким образом, у всех исследованных видов нагрузки большинства параметров оказались распределены сходным образом по четырем факторам, определяющим основные характеристики клеточной морфологии. Пятый фактор у C. brevisiphonata оказался нагружен квазифрактальными параметрами контурных изображений, которые у остальных видов объединялись с квазифрактальными параметрами силуэтных изображений в первом факторе. Однако объясненная нагрузка четвертого фактора у C. brevisiphonata упала ниже 3, тогда как у остальных видов ниже 3 она была только у факторов, не имеющих ни одного достоверно нагружающего их параметра. Чтобы формально и единообразно ограничить число использованных в кластеризации параметров, в качестве переменных использовали факторы лишь с объясненной нагрузкой выше 3 и достоверно нагружаемые хотя бы одним параметром. Данным условиям у каждого вида соответствовали 4 фактора, взятые в качестве четырех параметров для кластеризации. Кроме этого для кластерного анализа использовали параметры с максимальным индексом мультимодальности, нагружающие каждый фактор (табл. 2).
Таблица 2.
Параметры морфологии иммунных клеток исследованных видов беспозвоночных, отобранные для оптимального кластерного решения
| Asterias amurensis | Aphelasterias japonica | Callista brevisiphonata | Spisula sachalinensis |
|---|---|---|---|
| AR | AR | AR | AR |
| Per | BiggestD | Per | Per |
| MeanΛ | MMFD | MMFD | LF |
| outMeanLFD | outMeanLFD | outMeanD | outLCFD PreLac |
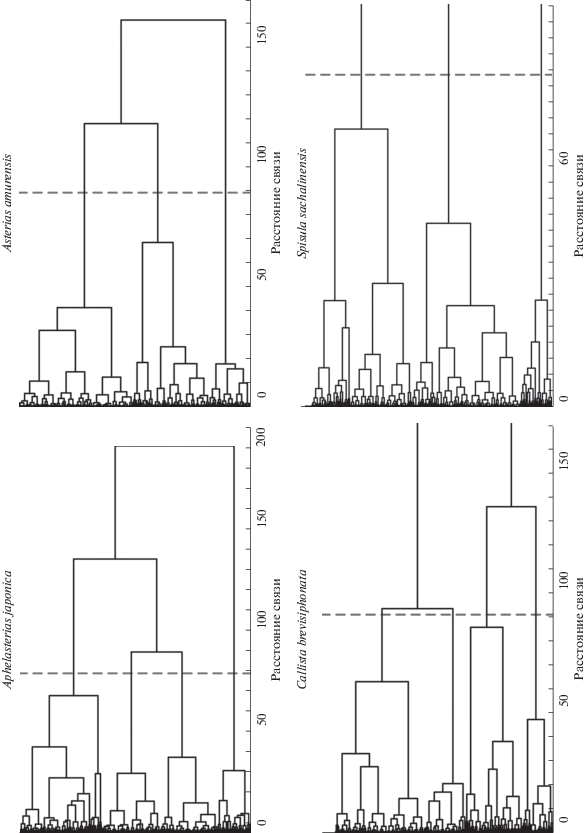
Самая низкая величина эффекта (0.26–0.38), подсчитанная для использованных параметров всех пар кластеров, получена для кластерных решений на основе четырех параметров, отобранных только по величине индекса мультимодальности, без факторного анализа. Более высокой величиной эффекта (0.39–0.46) характеризовались кластерные структуры с факторами, использованными в качестве параметров кластеризации. Однако у всех изученных видов наибольшие значения величины эффекта (0.41–0.47) имели кластерные структуры, построенные на основе нагружающих выбранные факторы четырех параметров с наивысшим индексом мультимодальности (табл. 2). Самую высокую величину эффекта для A. japonica и C. brevisiphonata показало четырехкластерное решение (0.4782 и 0.46957 соответственно), а для A. amurensis и S. sachalinensis оптимальным было трехкластерное решение (0.46884 и 0.46506 соответственно) (рис. 1).
Рис. 1.
Кластерные решения с самой высокой величиной эффекта для иммунных клеток Aphelasterias japonica, Callista brevisiphonata, Asterias amurensis и Spisula sachalinensis.
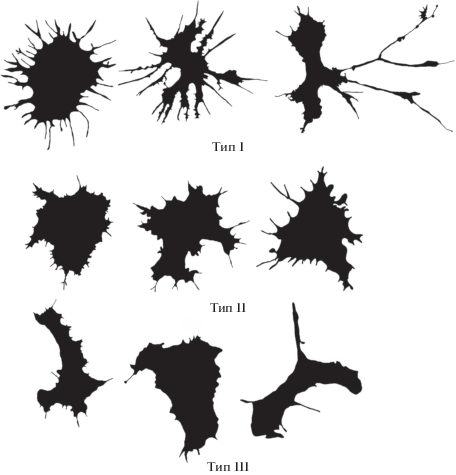
Кластерная модель классификации целомоцитов A. japonica выделила четыре морфологических типа клеток (рис. 2). Тип I – крупные наименее отростчатые клетки с самым низким значением фрактальной размерности контурных изображений (outMeanD), что характерно для клеток с простой топологией клеточных границ. Тип II – самые мелкие клетки с простой микроскульптурой границ, не имеющей филоподиальных отростков. Тип III объединил самые крупные симметричные (практически округлые) клетки со сложной микроскульптурой границ, покрытой мелкими многочисленными отростками. Тип IV – это клетки наиболее неправильной асимметричной формы с самыми низкими значениями параметров округлости (Circularity) и закругленности (Roundness), а также с наиболее высокими значениями лакунарности (LF) и параметра 1/2half, отражающего асимметричность клетки внутри описывающей клетку окружности.
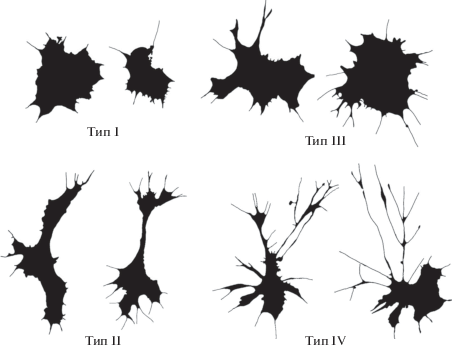
Оптимальная кластерная структура C. brevisiphonata включала четыре морфологических типа клеток (рис. 3). Тип I – клетки с наиболее простой микроскульптурой границ, с низкими лакунарностью и фрактальной размерностью контурных изображений, а также с самыми высокими значениями округлости и плотности, что характеризует морфологически простые симметричные клетки. Тип II – это вытянутые клетки; значение закругленности у клеток данного типа было значительно ниже, чем у клеток других морфотипов. Морфологически тип III объединил несколько более отростчатые, чем в типе I, клетки; по многим параметрам они ближе к клеткам типа II, но значительно отличаются от них большим значением лакунарности (LF) и параметром закругленности, который ближе к таковому у клеток типа I. Тип IV – это крупные клетки самой сложной морфологии с длинными ветвящимися отростками. Клетки типа IV больше клеток других типов по фрактальной размерности контурных изображений (outMeanD), площади и лакунарности. Они характеризуются минимальными значениями параметров округлости и плотности как асимметричные клетки с большой площадью стратификации отростков.
Рис. 3.
Силуэтные изображения разных типов гемоцитов двустворчатого моллюска Callista brevisiphonata.
Классификация иммунных клеток A. amurensis с лучшим значением величины эффекта включала три типа клеток (рис. 4). Тип I – самые крупные клетки с большими отростками неправильной формы, а также с наибольшими значениями площади, лакунарности, фрактальной размерности контурных изображений и с минимальным значением параметра плотности. Тип II – округлые клетки почти без отростков с наименьшими значениями LF и outMeanD и с максимальным значением округлости. Клетки типа III – это вытянутые клетки средней сложности наименьшего размера с максимальным значением AR; в данный тип входят клетки с оптически перфорированной в процессе распластывания мембраной, характерные для распластанных целомоцитов A. amurensis.
Оптимальная кластерная модель S. sachalinensis, как и A. amurensis, выделила три типа клеток. Тип I – клетки с самыми высокими среди выделенных типов клеток значениями параметров outMeanD, LF и Per, что характеризует клетки сложной морфологии с большим числом крупных и мелких отростков. Клетки типа II, как и клетки этого типа у C. brevisiphonata, имеют самое высокое значение параметра LCFD PreLac и среднее, но достоверно отличное, значение фрактальной размерности контурных изображений. Визуально у таких клеток более простая “усредненная” форма с меньшим числом небольших отростков. К типу III отнесены клетки c меньшей, чем у других типов, площадью распластывания, с самым высоким значением параметра AR и низким показателем outMeanD. Визуально они имеют наиболее простую микроскульптуру границ с минимальным числом отростков, однако общая форма клеток типа III разнообразна и асимметрична. Как правило, клетки этого типа вытянутые, а иногда слегка закругленные, что характерно для движущихся клеток (рис. 5).
В соответствии с тестом множественного сравнения Tukey–Kramer на различие средних значений, выделенные клеточные типы достоверно различались по большинству классифицирующих параметров и по ряду иных параметров линейной и квазифрактальной морфологии. Исходя из значений частной лямбды Уилкса, кластерная структура A. japonica опиралась прежде всего на квазифрактальные параметры. Вклад параметров в классификацию клеток A. amurensis и S. sachalinensis был близок к равномерному; вклад всех четырех использованных параметров в классификацию клеток C. brevisiphonata также оказался высоким, причем наибольшим он был для параметра AR (табл. 3).
Таблица 3.
Частная лямбда Уилкса для параметров морфологии иммунных клеток исследованных видов беспозвоночных, использованных в избранных кластерных структурах
| Вид | Параметр | Частная лямбда Уилкса |
|---|---|---|
| Aphelasterias japonica | AR | 0.961618 |
| BiggestD | 0.565155 | |
| MMFD | 0.403119 | |
| outMeanLFD | 0.665635 | |
| Spisula sachalinensis | LF | 0.746466 |
| Per | 0.761195 | |
| AR | 0.773631 | |
| outLCFD PreLac | 0.565398 | |
| Asterias amurensis | AR | 0.774968 |
| Per | 0.765077 | |
| outMeanLFD | 0.611673 | |
| MeanΛ | 0.597782 | |
| Callista brevisiphonata | MeanMassFD | 0.692703 |
| Per | 0.795709 | |
| outMeanD | 0.779820 | |
| AR | 0.405223 |
ОБСУЖДЕНИЕ
Несмотря на то, что лучшая классификация клеток каждого исследованного вида включает разные параметры и выделяет видоспецифичные типы, которые различаются аспектами морфологии, оптимальная классификационная структура иммунных клеток всех изученных видов основана на сходном алгоритме, который включает иерархическую классификацию методом Варда, а в качестве межкластерного различия используется евклидово расстояние. Данный метод кластеризации показал наилучшие результаты при классификации нейронов (Pushchin, Karetin, 2009, 2014) и иммунных клеток беспозвоночных (Karetin, Pushchin, 2015). Количество тестируемых кластеров не превышало число клеточных типов, обычно выделяемое в иммунной системе беспозвоночных (3–6) (Dyrynda et al., 1997; Chang et al., 2005); тестировались также наборы кластеров с расстоянием межкластерной связи, визуально значительно превосходящим расстояния между следующими бифуркациями деления кластеров.
Для классификации отбираются параметры с самым высоким индексом мультимодальности, нагружающие факторы факторного анализа. Классификационная модель с наилучшей кластерной структурой сочетает как линейные, так и квазифрактальные параметры, отражая разные аспекты клеточной морфологии. В одни и те же факторы, полученные в результате факторного анализа, распределяются параметры, описывающие схожие аспекты морфологии. Благодаря этому в классификации клеток исследованных видов представлены параметры, отражающие асимметрию клеток (AR) и размерные характеристики (Per), а также квазифрактальные параметры, описывающие сложность структуры силуэтных (MMFD) и контурных изображений клеток (outMeanD). При этом из всех параметров, представляющих каждый аспект морфологии, выбран один, распределение которого в выборке наиболее мультимодально, следовательно, выборка по данному параметру гетерогенна и этот параметр наиболее четко раскрывает ее составную структуру, включающую клетки разных морфологических типов.
Согласно традиционной цитологической классификации, адгезированные in vitro клетки исследованных беспозвоночных можно отнести к одному типу, который характеризуется агранулярной базофильной цитоплазмой. Однако в широкой морфологической вариабельности адгезированных клеток четко выделяются видоспецифичные морфотипы, различающиеся некоторыми линейными и нелинейными морфологическими параметрами.
Традиционные цитологические параметры классификации иммунных клеток беспозвоночных включают такие признаки, как гранулярность цитоплазмы, ядерно-цитоплазматические отношения и способность к фагоцитозу. Агранулоциты характеризуются меньшими размерами, чем гранулоциты, более высоким отношением ядра к цитоплазме и отсутствием гранул (Donaghy et al., 2009; Matozzo, Bailo, 2015). Гиалиноциты, как и гранулоциты, делят на маленькие и большие (Preziosi, Bowden, 2016). Многие из этих признаков обладают вариабельностью (Fisher, 1986), например, гранулоциты могут иметь агранулярных предшественников; по опубликованным данным (Martin, Hose, 1992), гранулы могут появляться или теряться при изменении условий или присутствовать в клетках, которые по другим морфологическим признакам определяются как гиалиноциты.
Характеристика внешней морфологии в естественной классификации иммунных клеток беспозвоночных занимает не последнее место, поскольку внешняя морфология клеток определяется множеством факторов: функциональной динамикой, в частности, реакциями на особенности внешней среды (Paine et al., 1994); внеклеточным матриксом (Ingber, 1990); генетическими (Qiu et al., 2002) и биохимическими (Fairbanks et al., 2009) особенностями, в частности, структурой цитоскелета (Suzuki, Ohno, 2006), а также набором молекул клеточной адгезии (Racusen, 1994). Анализ морфологии клеток принципиален для понимания их функционального состояния и закономерностей онтогенеза (Kilian et al., 2010).
Главный с биологической точки зрения вопрос при рассмотрении морфологии клеток разных видов животных: чем определяется различие морфологии распластанных гемоцитов у разных видов беспозвоночных? Независимо от того, лежат ли в основе различий форм гемоцитов и целомоцитов у разных видов экологические причины и подвержены ли особенности их морфологии естественному отбору, кажется несомненным, что различие клеточных форм определяется генетически. Оно связано с такими различиями клеточной физиологии, как общая структура и динамика цитоскелета, видоспецифические особенности клеточного поведения, функционирование рецепторов клеточной адгезии, взаимодействие клетка–клетка и клетка–субстрат. Поэтому логичен переход к рассмотрению клеточных форм на основе биологического анализа параметров, описывающих формы клеток. Возможно, это даст ответ на вопрос: какие именно генетические и цитофизиологические видоспецифичные особенности клетки определяют значение того или иного рассматриваемого параметра, а также позволит прогнозировать особенности клеточной физиологии, исходя из детального морфологического анализа. Разработка численного формального алгоритма описания внешней морфологии клеток in vitro имеет практическое значение для статистически достоверного описания морфологии культивируемых клеток как в норме, так и в эксперименте, где до сих пор используется неформализованный, неточный язык описания клеточных форм.
Предложенная методология классификации клеток по морфологическим критериям позволила выделить обладающий наибольшей дискриминирующей силой набор морфологических параметров для каждого исследованного вида беспозвоночных. При этом общий алгоритм оптимальной классификации остается неизменным, несмотря на различие отобранных параметров и индивидуальные морфологические особенности типов клеток, выделенных из разных животных. Примененный нами подход классификации иммунных клеток по морфологическим критериям с использованием квазифрактальных параметров может стать альтернативой или дополнением к классическим подходам описания и классификации полиморфных клеток, в частности элементов иммунной системы беспозвоночных, позволяя выделить присутствующие в популяции морфотипы клеток и благодаря этому повышая дискриминирующую способность существующих моделей классификации клеток in vitro.
Список литературы
Каретин Ю.А. Нелинейный анализ морфологии гемоцитов морских звезд Aphelasterias japonica (Bell, 1881), Patiria pectinifera (Muller et Troschel, 1842) и двустворчатого моллюска Callista brevisiphonata (Carpenter, 1864) // Биол. моря. 2016. Т. 42. № 4. С. 275–282.
Benavides-Piccione R., Hamzei-Sichani F., Ballesteros-Yáñez I. et al. Dendritic size of pyramidal neurons differs among mouse cortical regions // Cereb. Cortex. 2006. V. 16. P. 990–1001.
Chang S.J., Tseng S.M., Chou H.Y. Morphological characterization via light and electron microscopy of the hemocytes of two cultured bivalves: a comparison study between the hard clam (Meretrix lusoria) and Pacific oyster (Crassostrea gigas) // Zool. Stud. 2005. V. 44. № 1. P. 144–153.
Cohen J. Statistical power analysis for the behavioral sciences: 2nd ed. Hillsdale, N.J.: Lawrence Erlbaum Associates. 1988. 400 p.
Donaghy L., Lambert C., Choi K.S., Soudant P. Hemocytes of the carpet shell clam (Ruditapes decussatus) and the Manila clam (Ruditapes philippinarum): Current knowledge and future prospects // Aquaculture. 2009. V. 297. № 1–4. P. 10–24.
Dyrynda E.A., Pipe R.K., Ratcliffe N.A. Sub-populations of haemocytes in the adult and developing marine mussel, Mytilus edulis, identified by use of monoclonal antibodies // Cell Tissue Res. 1997. V. 289. № 3. P. 527–536.
Fairbanks B.D., Schwartz M.P., Halevi A.E. et al. A versatile synthetic extracellular matrix mimic via thiol-norbornene photopolymerization // Adv. Mater. 2009. V. 21. № 48. P. 5005–5010.
Fisher W.S. Structure and functions of oyster hemocytes // Immunity in Invertebrates / Ed. M. Brehélin. Proceedings in Life Sciences. Berlin: Springer-Verlag. 1986. P. 25–35.
Fritz C.O., Morris P.E., Richler J.J. Effect size estimates: current use, calculations, and interpretation // J. Exp. Psychol. Gen. 2012. V. 141. № 1. P. 2–18.
Gordon A.D. Classification: 2nd ed. Boca Raton; London: Chapman and Hall/CRC. 1999. 272 p. (Monographs on Statistics and Applied Probability; № 82).
Ingber D.E. Fibronectin controls capillary endothelial cell growth by modulating cell shape // Proc. Natl. Acad. Sci. U.S.A. 1990. V. 87. № 9. P. 3579–3583.
Karetin Yu.A., Pushchin I.I. Analysis of the shapes of hemocytes of Callista brevisiphonata in vitro (Bivalvia, Veneridae) // Cytometry. Part A. 2015. V. 87. P. 773–776.
Karetin Yu.A., Pushchin I.I. Analysis of the shapes of coelomocytes of Aphelasterias japonica in vitro (Echinodermata: Asteroidea) // Protoplasma. 2017. V. 254. P. 1805–1811.
Kilian K.A., Bugarija B., Lahn B.T., Mrksich M. Geometric cues for directing the differentiation of mesenchymal stem cells // Proc. Natl. Acad. Sci. U.S.A. 2010. V. 107. № 11. P. 4872–4877.
Li B.-L. Fractal geometry applications in description and analysis of patch patterns and patch dynamics // Ecol. Model. 2000. V. 132. № 1–2. P. 33–50.
Martin G.G., Hose J.E. Vascular elements and blood (hemolymph) // Microscopic anatomy of invertebrates. V. 10: Decapod Crustacea. 1992. New York: Wiley-Liss. P. 117–146.
Matozzo V., Bailo L. A first insight into haemocytes of the smooth venus clam Callista chione // Fish Shellfish Immunol. 2015. V. 42. № 2. P. 494–502.
Paine R. 3rd., Christensen P., Toews G.B., Simon R.H. Regulation of alveolar epithelial cell ICAM-1 expression by cell shape and cell-cell interactions // Am. J. Physiol. Lund Cell. Mol. Physiol. 1994. V. 266. P. L476–L484.
Preziosi B.M., Bowden T.J. Morphological characterization via light and electron microscopy of Atlantic jackknife clam (Ensis directus) hemocytes // Micron. 2016. V. 84. P. 96–106.
Pushchin I.I., Karetin Yu.A. Retinal ganglion cells in the eastern newt Notophthalmus viridescens: topography, morphology, and diversity // J. Comp. Neurol. 2009. V. 516. P. 533–552.
Pushchin I., Karetin Y. Retinal ganglion cells in the Pacific redfin, Tribolodon brandtii dybowski, 1872: morphology and diversity // J. Comp. Neurol. 2014. V. 522. P. 1355–1372.
Qiu J.L., Jilk R., Marks M.D., Szymanski D.B. The Arabidopsis SPIKE1 gene is required for normal cell shape control and tissue development // Plant Cell. 2002. V. 14. № 1. P. 101–118.
Racusen L.C. Cell shape changes and detachment in cell culture: models of renal injury // Nephrol. Dial. Transplant. 1994. V. 9. Suppl. 4. P. 22–25.
Schweitzer L., Renehan W.E. The use of cluster analysis for cell typing // Brain Res. Protoc. 1997. V. 1. P. 100–108.
Sheskin D.J. Handbook of parametric and nonparametric statistical procedures: 2nd ed. Boca Raton, Fla.: Chapman and Hall/CRC. 2000. 982 p.
Suzuki A., Ohno S. The PAR-aPKC system: lessons in polarity // J. Cell Sci. 2006. V. 119. P. 979–987.
Xu R., Wunsch D. Clustering. Hoboken, N.J.: Wiley-IEEE Press. 2008. 368 p.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря