Биология моря, 2020, T. 46, № 1, стр. 14-23
Сравнительная характеристика молоди горбуши Oncorhynchus gorbuscha (Walbaum, 1792) при ее естественном и заводском воспроизводстве в Сахалинской области
О. В. Зеленников 1, *, К. А. Проскуряков 2, Г. С. Рудакова 3, М. С. Мякишев 3
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
2 ООО “Салмо”
693006 Южно-Сахалинск, Россия
3 Сахалинский филиал ФГБУ “Главрыбвод”
693006 Южно-Сахалинск, Россия
* E-mail: Oleg_Zelennikov@rambler.ru
Поступила в редакцию 14.12.2018
После доработки 28.02.2019
Принята к публикации 19.03.2019
Аннотация
Анализировали размер и массу тела, а также изучали морфофизиологическое состояние комплекса внутренних органов у природной молоди горбуши, выловленной в пяти реках в период ската, и у заводской молоди, отобранной перед выпуском на всех 22 рыбоводных заводах, на которых ее выращивали в Сахалинской области в 2016 и 2017 гг. Установлено, что масса тела у природной молоди горбуши из разных рек и в разные годы достоверно различалась. Заводские мальки перед выпуском в среднем были в 1.5–2.5 раза крупнее природных, причем на разных заводах масса тела мальков тесно коррелировала с суммой набранных градусо-дней. Все мальки от естественного нереста в период ската имели остаток желточного мешка, хотя часть мальков активно питалась уже в пресной воде. Независимо от темпа роста заводских мальков перед выпуском у них также сохранялся остаток желточного мешка. Во всех группах природной и заводской молоди выявлены разные варианты микроморфологической организации печеночной паренхимы.
В настоящее время Сахалинская область, где воспроизводство тихоокеанских лососей имеет вековую историю (Живоглядов, 2012), является единственным регионом России, в котором выращивают молодь горбуши. Однако сведения о роли рыбоводных заводов в формировании промыслового стада этого вида довольно противоречивы. С одной стороны, опубликована информация об эффективности работы горбушевых рыбоводных заводов в Сахалинской области (Романчук, 1999; Коряковцев, 2001; Хованский, 2005) и о повышении выживаемости заводских рыб после перехода заводов на современную биотехнологию, предусматривающую кратковременную подкормку молоди перед выпуском (Тарасюк, Тарасюк, 2007), а также о недооценке роли искусственного воспроизводства в общем формировании стада горбуши (Хоревина, Хоревин, 2004). С другой стороны, влияние заводского воспроизводства на динамику улова горбуши ставится под сомнение (Каев, 2010а); высказано мнение о пониженной жизнеспособности заводской молоди горбуши по сравнению с молодью от естественного нереста (Стекольщикова, 2015). С последним трудно согласиться, так как, во-первых, у молоди горбуши, выращенной на рыбоводных заводах, ни на цитоморфологическом уровне (Обухов и др., 2005), ни при анализе ионорегуляции (Grant et al., 2009, 2010) не выявлены признаки одомашнивания. Во-вторых, не вызывает сомнения роль заводского воспроизводства в формировании крупных стад кеты (Любаева и др., 1999; Mayama, Ishida, 2003; Кловач и др., 2018), а это самый близкородственный горбуше вид среди тихоокеанских лососей (Осинов, 1999).
При оценке жизнеспособности горбуши нельзя исключить возможность методической погрешности. Как известно, подсчет молоди, скатывающейся с естественных нерестилищ, проводят на участках контрольных рек, или контрольно-наблюдательных станциях. Затем данные, полученные для нескольких водотоков, экстраполируются на весь нерестовый фонд (Антонов, 2006; Каев и др., 2011). В настоящее время этот метод является единственно возможным способом оценки численности природной молоди горбуши, необходимым для прогнозирования численности производителей. Однако его применение показывает, что подсчитать заводскую и природную молодь горбуши с одинаковой точностью методически невозможно, так как при подсчете численности заводской молоди экстраполяцию данных не применяют.
Предлагаемый нами подход, не отрицая существующих методов исследования, предусматривает комплексный сравнительный морфофизиологический анализ заводской и природной молоди. Отметим, что все лососевые рыбоводные заводы (ЛРЗ) в Сахалинской области были построены или перестроены в течение последних 25 лет и приобрели новые технические характеристики.
Цель данной работы – сравнить темпы роста, размерную разнокачественность, динамику потребления желтка, состояние печени и разных отделов пищеварительного тракта у природной молоди из ряда рек и у заводской молоди, отобранной на всех рыбоводных заводах. Мы полагаем, что полноценная заводская молодь горбуши с точки зрения функционирования систем жизнеобеспечения при прочих равных условиях должна иметь такие же возможности для выживания, как молодь от естественного нереста.
МАТЕРИАЛ И МЕТОДИКА
Изучали природную молодь горбуши, которую отлавливали в пяти реках ночью во время ската, и заводскую молодь первой партии, отобранную непосредственно перед выпуском на 22 рыбоводных заводах, на которых в 2016 и 2017 гг. в Сахалинской области выращивали горбушу (рис. 1). У всех мальков от естественного нереста и у большинства заводских мальков анализировали размерно-возрастные ряды. При исследовании молоди с пяти рыбоводных заводов (Анивский, Тымовское, Скальный, Курильский и Рейдовый) использовали результаты анализа, проведенного рыбоводами перед ее выпуском с этих предприятий.
Рис. 1.
Места отлова молоди горбуши в реках и на рыбоводных заводах Сахалина и о-ва Итуруп. Реки: 1 – Пугачевка, 2 – Бахура, 3 – Очепуха, 4 – Таранай, 5 – Рыбацкая; рыбоводные заводы: 6 – Нитуй, 7 – Поречье, 8 – Лазовой, 9 – Пугачевский, 10 – Тихая, 11 – Мануй, 12 – Урожайный, 13 – Фирсовка, 14 – Красноярка, 15 – Бахура, 16 – Долинка, 17 – Лесной, 18 – Анивский, 19 – Таранайский, 20 – Монетка, 21 – Куйбышевский, 22 – Курильский, 23 – Китовый, 24 – Бухта Оля, 25 – Рейдовый, 26 – Скальный. На схеме отсутствует завод Тымовское, расположенный в центральной части о-ва Сахалин.
Для гистофизиологического исследования по 50 мальков из каждой партии природной и заводской молоди фиксировали в жидкостях Буэна или Серра. У фиксированных особей выделяли весь комплекс внутренних органов, который обрабатывали по традиционной гистологической методике (Микодина и др., 2009). Для каждой особи делали по 80–120 серийных поперечных срезов в области печени, кардиального и пилорического отделов желудка, средней кишки и пилорических придатков. Срезы окрашивали железным гематоксилином по Гейденгайну. Всего были выделены и гистологически обработаны комплексы внутренних органов 523 особей. Оценивая состояние печени, у каждого малька на трех случайно взятых участках печеночной паренхимы площадью 0.02 мм2 подсчитывали число гепатоцитов; результаты трех подсчетов усредняли.
Полученные данные обрабатывали статистически. Достоверность различий средних показателей определяли с использованием t-критерия Стьюдента. Размерно-массовые параметры мальков из разных мест отлова сравнивали, применяя непараметрический критерий Манна–Уитни. Взаимосвязь между суммарным количеством полученного молодью тепла и массой рыб оценивали с помощью коэффициента парной корреляции Пирсона.
РЕЗУЛЬТАТЫ
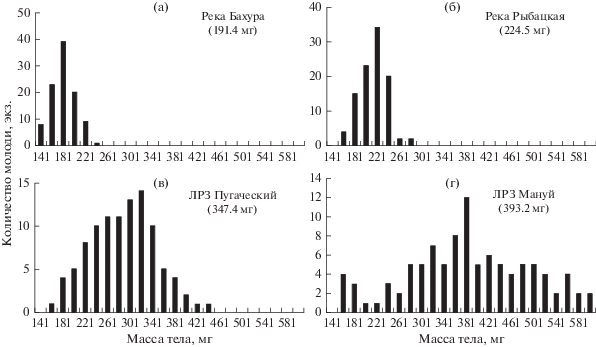
Средняя масса тела мальков горбуши от естественного нереста варьировала от 191.4 мг в р. Бахура до 224.5 мг в р. Рыбацкая (табл. 1); полученные различия, оцененные с применением критерия Манна–Уитни, были достоверными (р < 0.05). Масса тела мальков заметно изменялась в одной реке и в разные годы. Так, в р. Очепуха в 2016 г. масса тела мальков двух групп по 100 экз. в среднем составляла 200.8 и 199.8 мг, а в 2017 г. – 219.0 и 223.7 мг (р < 0.05; табл. 1). Размерный ряд в группах одновременно пойманных рыб был сравнительно коротким (рис. 2а, 2б). Например, масса тела молоди, выловленной в реках Бахура и Рыбацкая, варьировала соответственно от 141 до 236 мг и от 178 до 295 мг (табл. 1), а диапазон между наименьшим и наибольшим значениями составил около 100 мг.
Таблица 1.
Размерно-массовая характеристика природной и заводской молоди горбуши
| Место отбора молоди | Дата отбора | Длина рыб, мм | Масса тела, мг | |
|---|---|---|---|---|
| L | l | |||
| Река | ||||
| Бахура* | 10.06.16 | − | − | 191.4 (152–242) |
| Пугачевка* | 09.06.16 | − | − | 195.8 (127–253) |
| Очепуха** | 07.06.17 | 35.1 (32–39) | 31.1 (29–34) | 199.8 (164–255) |
| 35.4 (31–43) | 31.3 (28–38) | 200.8 (142–302) | ||
| Таранай | 02.06.17 | 35.4 (31–38) | 31.5 (29–34) | 203.2 (149–251) |
| Очепуха** | 27.05.16 | 35.1 (32–38) | 31.2 (29–34) | 219.0 (177–287) |
| 34.6 (31–39) | 30.6 (27–35) | 223.7 (161–318) | ||
| Рыбацкая | 02.06.16 | 33.9 (31–36) | 30.0 (27–32) | 224.5 (178–295) |
| Лососевый рыбоводный завод | ||||
| Поречье | 15.06.17 | 35.5 (30–42) | 31.7 (27–37) | 282.0 (165–420) |
| Анивский | 30.05.16 | 38.7 (37–42) | 34.6 (32–38) | 284.5 (221–370) |
| Таранайский | 30.05.16 | 38.2 (34–42) | 34.5 (31–38) | 284.8 (181–401) |
| Лазовой | 10.06.16 | 39.0 (34–45) | 34.6 (29–40) | 295.6 (160–574) |
| Пугачевский | 09.06.16 | 38.5 (29–45) | 33.7 (26–40) | 298.3 (169–456) |
| Долинка | 16.06.16 | 40.0 (35–47) | 35.3 (30–43) | 307.0 (170–510) |
| Тымовское | 20.06.16 | 38.5 (34–45) | 34.1 (30–40) | 314.1 (200–480) |
| Тихая | 09.06.16 | 38.4 (30–47) | 34.1 (26–42) | 316.1 (170–580) |
| Красноярка | 25.05.17 | 39.1 (31–45) | 35.2 (30–42) | 321.4 (169–583) |
| Скальный | 20.06.16 | 35.1 (33–39) | 32.4 (29–36) | 333.2 (275–452) |
| Фирсовка | 14.06.16 | 39.3 (34–45) | 34.7 (29–40) | 334.9 (160–488) |
| Курильский | 10.06.16 | 39.1 (36–46) | 35.1 (32–42) | 346.2 (243–486) |
| Бахура | 09.06.16 | 40.5 (34–48) | 35.9 (30–44) | 347.5 (191–547) |
| Лесной | 27.06.16 | 33.9 (31–36) | 30.0 (28–31) | 246.5 (185–292) |
| 07.06.16 | 40.3 (35–48) | 36.7 (31–45) | 349.0 (182–563) | |
| Урожайный | 31.05.16 | 41.7 (35–49) | 38.1 (32–44) | 353.9 (181–572) |
| Нитуй | 10.06.16 | 40.3 (39–42) | 35.9 (35–38) | 355.8 (193–547) |
| Монетка | 31.05.16 | 41.4 (34–49) | 37.0 (30–43) | 383.3 (156–601) |
| Мануй | 14.06.16 | 40.5 (32–50) | 36.1 (28–45) | 393.2 (165–616) |
| Куйбышевский | 06.06.16 | 36.1 (30–43) | 32.3 (25–39) | 400.0 (201–633) |
| Китовый | 10.06.16 | 40.7 (34–48) | 36.8 (30–45) | 428.1 (180–749) |
| Рейдовый | 10.06.16 | 43.4 (36–51) | 39.3 (32–47) | 523.9 (257–819) |
| Бухта Оля | 23.06.16 | 54.4 (43–67) | 49.5 (39–62) | 1201.1 (509–2088) |
Примечание. L – длина тела от вершины рыла до конца средних лучей хвостового плавника (по Смитту); l – длина тела от вершины рыла до конца чешуйчатого покрова. *Фиксация материала в жидкости Серра привела к деформации хвостового плавника, что не позволило измерить длину тела молоди. **Из р. Очепуха в 2016 и 2017 гг. для анализа отловлено по 200 экз. рыб; в таблице эти данные представлены как две группы по 100 экз.
Рис. 2.
Размерный ряд достоверно различающейся по массе молоди горбуши от естественного нереста из рек Бахура и Рыбацкая и с рыбоводных заводов Пугачевский и Мануй. В скобках указана средняя масса тела мальков.
Размерно-массовая характеристика заводской молоди была качественно иной. Во-первых, вся заводская молодь была значительно крупнее природной. Так, масса мальков горбуши, выловленных в реках Очепуха (06.06), Пугачевка (09.06) и Бахура (10.06), в среднем составляла соответственно 206.0, 191.4 и 195.8 мг, а масса заводской молоди, выпущенной в этот же день с находящихся на этих реках заводов (Лесной, Пугачевский и Бахура), составляла соответственно 349.0, 347.4 и 347.5 мг. Таким образом, масса тела у заводской молоди была на 70–80% больше, чем у мальков от естественного нереста. Во-вторых, масса тела заводских мальков из первых партий при выпуске в сходные сроки, но с разных предприятий, различалась несопоставимо более существенно, чем масса мальков от естественного нереста; она варьировала от 284.5 мг на Анивском ЛРЗ до 523.9 мг на Рейдовом ЛРЗ (табл. 1). И это без учета мальков с ЛРЗ Бухта Оля – одного из наиболее тепловодных заводов в Сахалинской области, на котором воспроизводят кету, но в 2015–2016 гг. в режиме производственного эксперимента выращивали также партию молоди горбуши.
По мере увеличения средней массы тела молоди встречались особи со все бóльшей массой тела. Однако в каждой группе сохранялись активно питающиеся мальки с индивидуально пониженным темпом роста, масса тела которых перед выпуском не превышала 200 мг. Именно поэтому размерные ряды заводских мальков оказывались значительно длиннее по сравнению с таковыми мальков от естественного нереста: чем больше была средняя масса тела рыб, тем шире был диапазон значений (рис. 2в, 2г). Следует отметить, что масса тела заводских мальков горбуши до начала кормления незначительно отличалась от массы тела мальков от естественного нереста. Перед выпуском в течение 2–4 нед. заводских рыб подкармливают и их масса быстро увеличивается. Например, на Лесном ЛРЗ в течение последних 10 сут выращивания масса тела мальков увеличилась с 246.5 до 349.0 мг (табл. 1). При этом масса тела мальков была тесно связана с суммой набранных ими градусо-дней (r = 0.85).
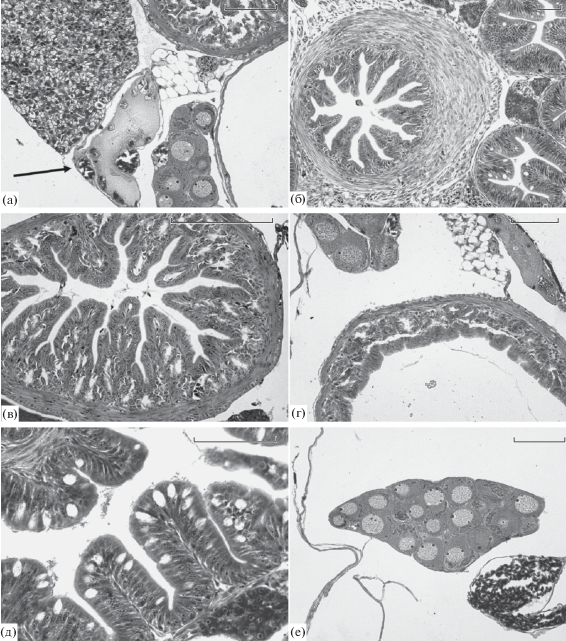
У всех мальков горбуши от естественного нереста в период ската сохранялся желточный мешок. У одних рыб он занимал до 30–40% поперечного среза через комплекс внутренних органов, а у других был практически полностью утилизирован и его можно было обнаружить только после гистологической обработки (рис. 3а). Состояние пилорического (рис. 3б) и кардиального (рис. 3в) отделов желудка у большинства рыб было характерным для непитающейся молоди: высокие складки пищеварительного эпителия практически закрывали внутренний просвет; в основании складок кардиального отдела желудка находились анатомически сформированные пищеварительные железы (рис. 3в). Однако в каждой из рек среди природных мальков были найдены особи, перешедшие на экзогенное питание: даже при отсутствии пищи в пищеварительном тракте стенка их желудка оставалась растянутой, а складки пищеварительного эпителия были расправленными (рис. 3г). У всех мальков в складках пищеварительного эпителия передней расширенной части средней кишки присутствовали отдельные бокаловидные слизевые клетки (рис. 3д). В яичниках всех исследованных рыб практически завершилось формирование единственной генерации ооцитов периода превителлогенеза (рис. 3е). Половые клетки более ранних стадий развития – гонии и ооциты периода ранней профазы мейоза – присутствовали как исключение.
Рис. 3.
Характерное состояние внутренних органов у мальков горбуши, отловленных в реках Бахура (а, г, е), Очепуха (б, в) и Рыбацкая (д). У всех особей обнаружен остаток желточного мешка (а – стрелка); у непитающихся мальков видны высокие складки пищеварительного эпителия в пилорическом (б) и кардиальном отделах желудка (в); у питающихся рыб складки в кардиальном отделе растянуты (г); слизевые клетки в составе пищеварительного эпителия переднего отдела средней кишки до начала экзогенного питания малочисленны (д); в яичниках всех самок ооциты периода превителлогенеза (е). Масштаб: а–г, е – 0.1 мм; д – 0.05 мм.
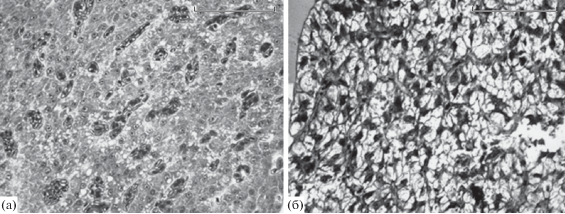
При анализе состояния печени среди групп молоди из каждой реки выявили широкую вариацию организации печеночной паренхимы. У одних рыб в гепатоцитах практически отсутствовали жировые включения, а ядра клеток располагались сравнительно плотно – до 8–9 на единицу площади среза печени (рис. 4а). У других рыб печень выглядела как ажурная из-за высокого содержания жировых включений (рис. 4б), а число ядер на единицу площади было в 2–3 раза меньше.
Рис. 4.
Состояние печеночной паренхимы у мальков горбуши: а – в клетках печени относительно небольшое содержание жира (р. Бахура); б – в клетках многочисленные жировые включения (р. Рыбацкая). Шкала – 0.05 мм.
В отличие от природной молоди, все заводские мальки активно питались. В пилорическом (рис. 5а) и кардиальном (рис. 5б) отделах желудка мальков присутствовала пища в разной степени переваривания; стенки обоих отделов были растянуты, а складки пищеварительного эпителия сравнительно низкими. В основании складок кардиального отдела желудка были видны железы в активном функциональном состоянии. Об этом, в частности, свидетельствовало то, что внутренний просвет на срезах пищеварительных желез был больше их боковых стенок (рис. 5в). В средней кишке выявлены не только отдельные бокаловидные клетки, но и их комплексы с высоким содержанием секрета (рис. 5г).
Рис. 5.
Характерное состояние внутренних органов у питающихся мальков горбуши перед выпуском с ЛРЗ Лесной (а, б), Фирсовка (в), Бахура (г) и Мануй (д, е). Поперечный срез через пилорический (а) и кардиальный отделы желудка при наличии (б) и отсутствии (в) пищи, видны растянутые складки пищеварительного эпителия; г – срез через передний отдел средней кишки, клетки кишечного эпителия содержат значительное количество секрета; д – характерное состояние печени при умеренном содержании жировых включений; е – остаток желточного мешка у малька горбуши массой 445 мг, расположенный между яичником (слева) и участком печени. Масштаб: а, б, е – 0.1 мм; в, г, д – 0.05 мм.
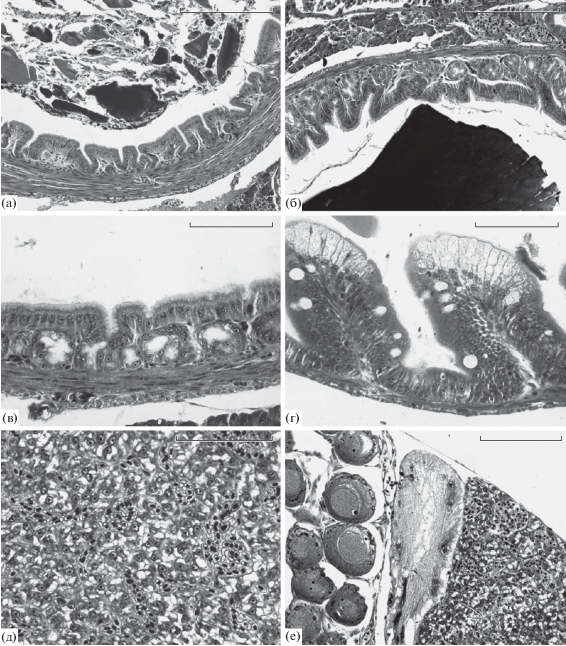
Гистологический анализ показал, что у мальков, взятых на каждом заводе, состояние печени существенно различалось. Жировые включения могли практически отсутствовать или присутствовать как в умеренном (рис. 5д), так и в значительном количестве. Мы подсчитали число ядер гепатоцитов у природных мальков и у рыб, отобранных на предприятиях, расположенных на тех же реках или неподалеку. В пределах всех групп наблюдалась широкая вариабельность по данному показателю, но среднее число гепатоцитов у рыб, взятых на разных заводах, статистически не различалось, как и среднее количество гепатоцитов у заводских и природных особей (табл. 2).
Таблица 2.
Число ядер гепатоцитов на 0.02 мм2 площади печеночной паренхимы у мальков горбуши, выловленных в период ската в четырех реках и взятых перед выпуском на ближайших лососевых рыбоводных заводах (ЛРЗ) (M ± m; диапазон значений)
| Река | Количество ядер, экз. | Завод | Количество ядер, экз. |
|---|---|---|---|
| Очепуха | 5.36 ± 0.26 (4.44–6.15) | Лесной, 27.05 | 4.83 ± 0.38 (3.08–5.81) |
| Лесной, 07.06 | 4.48 ± 0.37 (2.74–7.18) | ||
| Бахура, 01.06. | 6.96 ± 0.51 (4.79–8.54) | Бахура | 6.04 ± 0.34 (4.79–7.52) |
| Бахура, 10.06. | 5.76 ± 0.59 (3.41–7.87) | ||
| Пугачевка | 6.55 ± 0.46 (5.47–7.87) | Пугачевский | 5.53 ± 1.04 (3.79–8.51) |
| Рыбацкая | 5.81 ± 0.71 (3.41–8.54) | Курильский, Китовый* | 4.86 ± 0.75 (3.08–6.84) |
У всех мальков перед выпуском с рыбоводных предприятий сохранялся остаток желточного мешка (рис. 5е). При этом желток был обнаружен не только у сравнительно тугорослых рыб, масса тела которых перед выпуском не превышала 200–250 мг, но и у мальков с максимально высоким темпом роста, масса которых перед выпуском с заводов составляла 400–600 мг и более. Мы не можем судить, сохранялся ли запас желтка у очень крупных мальков с ЛРЗ Бухта Оля, масса тела которых достигала 1000 мг, поскольку у этих рыб обрабатывали не весь комплекс внутренних органов, а отдельно печень, гонады и разные отделы пищеварительного тракта.
ОБСУЖДЕНИЕ
Анализируя полученные данные, в первую очередь отметим, что масса молоди от естественного нереста в разных реках, а также в одной реке, но в разные годы может достоверно различаться. Очевидно, это свидетельствует о том, что условия развития в разных реках или в разные годы также оказываются различными, ведь масса рыб в течение сезона ската в одной реке в среднем не изменяется (Зеленников, Федоров, 2005). Казалось бы, масса тела заводских рыб, выращенных на разных ЛРЗ, различается более существенно, чем масса природной молоди из разных рек. Однако имеется обстоятельство, на которое следует указать особо. Молодь горбуши воспроизводят на наиболее холодноводных заводах или при наиболее холодноводных режимах, если предприятия обеспечены несколькими источниками водоснабжения и могут регулировать температуру воды. Таким образом, на многочисленных предприятиях создаются сходные термические условия для выращивания горбуши. В результате в начале–середине мая к началу кратковременной подкормки масса личинок горбуши на разных рыбоводных заводах в среднем оказывается сходной. При этом различия между наименьшим и наибольшим значениями у заводских и природных мальков близки.
Температурные различия проявляются на завершающем этапе выращивания при повышении температуры речной воды. Поскольку молодь лососей характеризуется экспоненциальным ростом (Самарский, 2005), то именно условия выращивания в течение последних 2–4 нед., которые совпадают с периодом кормления, играют наиболее важную роль при увеличении массы тела. То, что увеличение размерного ряда не является особенностью заводских рыб, было установлено нами ранее при выращивании природной молоди горбуши на Анивском ЛРЗ (Зеленников, Федоров, 2005). Молодь от естественного нереста, как и заводская молодь, переходила на искусственное вскармливание и быстро росла, соответственно, увеличивался ее размерный ряд.
В результате нашего исследования установлено, что различия между заводской и природной молодью при современных условиях воспроизводства не столь существенны, как полагали ранее. Оказалось, что природная молодь горбуши переходит на экзогенное питание уже в пресной воде. И хотя факт питания молоди горбуши в пресной воде хорошо известен (Смирнов, 1975), мы полагали, что в сравнительно коротких сахалинских реках молодь этого вида не питается (Казарновский, 1962). В яичниках всех исследованных рыб завершилось формирование единственной генерации ооцитов периода превителлогенеза, что характерно для моноцикличных лососевых (Зеленников, 2003; Зеленников, Юрчак, 2019).
При оценке качества мальков специалисты в первую очередь обращают внимание на состояние печени. При этом от рыбоводов можно слышать определение “песочная печень”, характеризующее ее значительное ожирение. В результате анализа большого числа рыб нами установлено, что во всех группах пойманной одновременно природной молоди, как и в группах содержавшихся совместно одновозрастных заводских мальков, встречались разные варианты микроморфологической организации печени. В каждой группе присутствовали особи, в гепатоцитах которых практически отсутствовали включения, а также мальки с большим содержанием жировых включений.
Неожиданным оказалось обнаружение остатка желточного мешка у всех мальков, выращенных на горбушевых рыбоводных заводах, причем как у сравнительно тугорослых особей, так и у рыб с максимально высоким темпом роста. Поскольку кормить молодь горбуши начинают после того, как содержимое желточного мешка уменьшается до 5%, мы полагали, что с началом экзогенного питания желток потребляется полностью. Однако, если рассматривать желток как запас питательных веществ, то сохранение его остатка следует признать естественным. Можно полагать, что, получая пищу извне, организм малька способен зарезервировать ненужный на данный момент остаток желтка. Согласно последним данным, остаточный запас желтка у мальков горбуши играет важную роль в поддержании водного баланса при их попадании в морскую среду (Gallagher et al., 2013), так как становление системы осморегуляции у этих рыб завершается после выхода в прибрежье (Краюшкина и др., 1995).
С учетом выявленного сходства между природной и заводской горбушей рассмотрим два обстоятельства, относящихся к оценке выживания молоди этого вида. Во-первых, несмотря на то, что горбуша – доминирующий вид лососевых в Северной Пацифике (Ruggerone, Nielsen, 2004), в Сахалинской области в течение последних 20 лет количество выращиваемой молоди горбуши постепенно уменьшилось. При этом увеличился выпуск молоди кеты (Каев, 2010а; Живоглядов, 2012). Так, в 2017 г. из 52 ЛРЗ на 48 предприятиях воспроизводили кету, на 22 – горбушу и только на четырех предприятиях горбуша была единственным выращиваемым видом. Очевидно, что кета, обладающая более стабильным хомингом, оказывается экономически выгоднее горбуши. Однако очевидно и то, что при снижении численности заводской молоди горбуши уменьшается ее доля в промысловом стаде. Во-вторых, хорошо известна способность горбуши широко расселяться от родной реки (Смирнов, 1975; Agler et al., 2001; Мякишев и др., 2019), а в отдельные годы при определенных условиях совершать глобальные межрегиональные миграции (Глубоковский, Животовский, 1986). Эта особенность горбуши в полной мере проявилась при ее интродукции на европейский Север России, когда молодь, выпущенная в бассейне Белого моря, вернулась на нерест в реки от Исландии до побережья Карского моря (Исаев, 1961; Крупицкий, Устюгов, 1977; Дорофеева и др., 2006; Алексеев и др., 2008).
По совокупности полученных данных можно полагать, что заключение о пониженной жизнеспособности заводской молоди базируется на непреодолимых трудностях сравнительного подсчета численности заводских и природных мальков. Представляется очевидным, что если мы можем подсчитать, а сейчас и пометить (Kawana et al., 2001; Акиничева и др., 2012) всю заводскую молодь, то для природной молоди это невозможно. Специалисты, занимающиеся оценкой молоди, скатывающейся с естественных нерестилищ, указывают, что подсчет мальков даже в одной конкретной реке может сопровождаться большой ошибкой (Каев, 2010б). Мы не знаем, какова величина этой ошибки, но опубликованные данные позволяют получить представление о ее масштабе. В период с 13 мая по 1 июля 2014 г. по стандартной схеме был проведен учет ската природной и заводской молоди горбуши в р. Рейдовая. Согласно итогам учета, по реке скатилось 10.6 млн мальков. При этом известно, что с ЛРЗ Рейдовый, расположенного на реке в 11 км выше от места учета молоди, было выпущено 49.7092 млн мальков (Зеленихина и др., 2015). Следовательно, мальков (природных и заводских) по реке скатилось примерно в 5 раз меньше, чем было выпущено с рыбоводного завода. О тщательности выполненного специалистами ВНИРО учета говорит тот факт, что в статье приведены подробные данные не только за каждый день, но и за каждый час работы. Однако и численность рыбоводной продукции в течение года также неоднократно оценивается в ходе инвентаризации под контролем специалистов нескольких организаций. Несоответствие данных можно объяснить ошибкой, заложенной в методике проведения работ. Очевидно, эта ошибка многократно умножается при экстраполяции результатов, полученных для одной реки, на весь фонд естественных нерестилищ.
Исходя из высказанных соображений, можно заключить, что ни данные, полученные нами, ни сведения, имеющиеся в литературе, не позволяют выявить критерии, за счет которых заводская молодь могла бы быть менее жизнеспособной. Она крупнее, чем молодь от естественного нереста, активно питается и, как и природная молодь, имеет запас желтка, который, согласно литературным данным, несомненно, помогает ей перейти с искусственного вскармливания на самостоятельное питание.
Список литературы
Алексеев А.П., Дорофеева Е.А., Зеленников О.В. Проблемы и перспективы акклиматизации дальневосточной горбуши в бассейне Белого моря // Рыбоводство и рыб. хоз-во. 2008. № 8. С. 24–28.
Акиничева Е.Г., Шубин А.О., Стекольщикова М.Ю. Современное состояние исследований по маркированию и идентификации заводских лососей в Сахалино-Курильском регионе // Сб. науч. тр. СахНИРО. 2012. Т. 13. С. 83–90.
Антонов А.А. Результаты учета покатной молоди горбуши из рек Сахалина и южных Курильских островов в 2006 г. // Бюл. № 1 реализации “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. Владивосток: ФГУП “ТИНРО-центр”. 2006. С. 232–236.
Глубоковский М.К., Животовский Л.А. Популяционная структура горбуши: система флуктуирующих стад // Биол. моря. 1986. № 2. С. 39–44.
Дорофеева Е.А., Алексеев А.П., Зеленников О.В., Зеленков В.М. Дальневосточная горбуша в бассейне Белого моря // Рыб. хоз-во. 2006. № 6. С. 71–73.
Живоглядов А.А. Обзор исследований в области лососеводства Сахалина и Курил. Основные этапы, направления и проблемы // Сб. науч. тр. СахНИРО. 2012. Т. 13. С. 34–43.
Зеленихина Г.С., Ельников А.Н., Точилина Т.Г. Покатная миграция сеголетков горбуши и кеты в р. Рейдовой о. Итуруп (южные Курильские острова) в весенне-летний период 2014 г. // Тр. ВНИРО. 2015. Т. 158. С. 6–15.
Зеленников О.В. Сравнительный анализ состояния яичников у молоди тихоокеанских лососей в связи с проблемой становления моноциклии // Вопр. ихтиологии. 2003. Т. 43. № 4. С. 490–498.
Зеленников О.В., Федоров К.Е. Ранний гаметогенез горбуши Oncorhynchus gorbuscha Walbaum при ее естественном и заводском воспроизводстве на островах Сахалин и Итуруп // Вопр. ихтиологии. 2005. Т. 45. Вып. 5. С. 653–664.
Зеленников О.В., Юрчак М.И. Гаметогенез тихоокеанских лососей. 1. Состояние гонад у молоди горбуши Oncorhynchus gorbuscha Walbaum при ее естественном и заводском воспроизводстве в Сахалинской области // Вопр. ихтиологии. 2019. Т. 59. № 6. С. 741–744.
Исаев А.И. Акклиматизация тихоокеанских лососей в Баренцевом и Белом морях // Вопр. ихтиологии. 1961. Т. 1. Вып. 1. С. 46–51.
Каев А.М. Значение заводского разведения горбуши и кеты для их промысла в Сахалинской области // Рыб. хоз-во. 2010а. № 5. С. 57–61.
Каев А.М. Методические аспекты количественного учета покатной молоди лососей в реках Сахалино-Курильского региона // Изв. ТИНРО. 2010б. Т. 162. С. 194–206.
Каев А.М., Антонов А.А., Захаров А.В. и др. К оценке покатной молоди горбуши в реках Восточного Сахалина и южных Курильских островов // Бюл. № 6 реализации “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. Владивосток: ФГУП “ТИНРО-центр”. 2011. С. 112–117.
Казарновский М.Я. Питание покатной молоди горбуши и мальмы в реках Сахалина // Рыб. хоз-во. 1962. № 6. С. 24–25.
Кловач Н.В., Леман В.Н., Ельников А.Н., Вараксин И.А. Воспроизводство и промысел кеты о. Итуруп (южные Курильские острова): прошлое, настоящее и будущее // Рыб. хоз-во. 2018. № 6. С. 42–47.
Коряковцев Л.В. Эффективность работы горбушевых рыбоводных заводов Сахалина // Рыб. хоз-во. 2001. № 6. С. 36–37.
Краюшкина Л.С., Степанов Ю.И., Семенова О.Г., Панов А.А. Функциональное состояние осморегуляторной системы молоди горбуши Oncorhynchus gorbuscha в речной (предмиграционный) и морской (миграционный) периоды жизни // Вопр. ихтиологии. 1995. Т. 35. № 3. С. 388–393.
Крупицкий Ю.Г., Устюгов А.Ф. Горбуша Oncorhynchus gorbuscha (Walb.) в реках севера Красноярского края // Вопр. ихтиологии. 1977. Т. 17. № 2. С. 360–363.
Любаева Т.Н., Любаев В.Я., Сидорова С.В. Формирование заводских популяций кеты и их вселение в естественную среду (на примере Охотского ЛРЗ) // Вопросы взаимодействия естественных и искусственных популяций лососей: Материалы Российско-американской конф. по сохранению лососевых. Хабаровск. 1999. С. 70–79.
Микодина Е.В., Седова М.А., Чмилевский Д. и др. Гистология для ихтиологов: опыт и советы. М.: Изд-во ВНИРО. 2009. 112 с.
Мякишев М.С., Иванова М.А., Зеленников О.В. К вопросу о мечении молоди лососей и эффективности работы рыбоводных заводов // Биол. моря. 2019. Т. 45. № 5. С. 342–348.
Обухов Д.К., Затулякин А.В., Обухова Е.В., Королева Т.В. Влияние среды на формирование ЦНС молоди горбуши Oncorhynchus gorbuscha (Walb., 1792) // Структурно-функциональные особенности биосистем Севера (особи, популяции, сообщества): Материалы международ. конф. Петрозаводск. 26–30 сент. 2005. Ч. 2. С. 61–64.
Осинов А.Г. Лососевые рыбы Salmo, Parasalmo и Oncorhynchus: генетическая дивергенция, филогения и классификация // Вопр. ихтиологии. 1999. Т. 39. № 5. С. 595–611.
Романчук Е.Д. Взаимодействие смешанных популяций горбуши искусственного и естественного воспроизводства в Сахалино-Курильском бассейне // Вопросы взаимодействия естественных и искусственных популяций лососей: Материалы Российско-американской конф. по сохранению лососевых. Хабаровск. 1999. С. 96–102.
Самарский В.Г. Формирование размерного состава молоди кеты и структуры ее чешуи в условиях искусственного воспроизводства: Автореф. дис. … канд. биол. наук. М. 2005. 24 с.
Смирнов А.Н. Биология, размножение и развитие тихоокеанских лососей. М.: МГУ. 1975. 336 с.
Стекольщикова М.Ю. Некоторые результаты мониторинга заводских стад горбуши зал. Анива (о. Сахалин) // Изв. ТИНРО. 2015. Т. 183. С. 51–60.
Тарасюк Е.В., Тарасюк С.Н. Оценка влияния подращивания молоди горбуши на ее возврат // Динамика численности тихоокеанских лососей и прогнозирование их подходов: Международ. науч. конф. Южно-Сахалинск, 3–5 окт. 2007. С. 35–36.
Хованский И.Е. Эколого-физиологические и биотехнологические факторы эффективности лососеводства: на примере искусственного разведения тихоокеанских лососей на северном побережье Охотского моря: Автореф. дис. … д-ра биол. наук. Хабаровск. 2005. 47 с.
Хоревина Н.Б., Хоревин Л.Д. Эффективность и значение искусственного разведения тихоокеанских лососей в Сахалино-Курильском регионе // Тр. международ. форума по проблемам науки, техники и образования. М. 2004. С. 22–23.
Agler B.A., Hagen P.T., Scott J.R. et al. Wandering pink salmon: 1999 and 2000 thermal mark recoveries in Southeast Alaska // NPAFC Tech. Rep. 2001. № 3. P. 47–49.
Gallagher Z.S., Bystriansky J.S., Farrell A.P., Brauner C.J. A novel pattern of smoltification in the most anadromous salmonid: Pink salmon (Oncorhynchus gorbuscha) // Can. J. Fish. Aquat. Sci. 2013. V. 70. № 3. P. 349–357.
Grant A.M., Gardner M., Hanson L.M. et al. Early life stage salinity tolerance of wild and hatchery-reared juvenile pink salmon Oncorhynchus gorbuscha // J. Fish. Biol. 2010. V. 77. № 6. P. 1282–1292.
Grant A.M., Gardner M., Nendick L. et al. Growth and ionoregulatory ontogeny of wild and hatchery-raised juvenile pink salmon (Oncorhynchus gorbuscha) // Can. J. Zool. 2009. V. 87. № 3. P. 221–228.
Kawana M., Urawa S., Hagen P., Munk K.M. High-seas ocean distribution of Alaskan hatchery pink salmon estimated by otolith marks // NPAFC Tech. Rep. 2001. № 3. P. 27–30.
Mayama H., Ishida Y. Japanese studies on the early ocean life of juvenile salmon // NPAFC Bull. 2003. № 3. P. 41–67.
Ruggerone G.T., Nielsen J.L. Evidence for competitive dominance of pink salmon (Oncorhynchus gorbuscha) over other salmonids in the North Pacific Ocean // Rev. Fish Biol. Fish. 2004. V. 14. № 3. P. 371–390.
Дополнительные материалы отсутствуют.


