Биология моря, 2020, T. 46, № 1, стр. 53-59
Оценка токсического воздействия ионов цинка и наночастиц оксида цинка на раннее развитие морского ежа Scaphechinus mirabilis (Agassiz, 1864) (Echinodermata: Echinoidea)
А. А. Мазур 1, *, Е. В. Журавель 2, В. В. Слободскова 1, М. А. Мазур 2
1 Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690950 Владивосток, Россия
* E-mail: mazur.aa@poi.dvo.ru
Поступила в редакцию 02.09.2019
После доработки 03.10.2019
Принята к публикации 03.10.2019
Аннотация
Показано, что нано- и ионная формы цинка в концентрациях 50–100 мкг/л оказывали токсическое воздействие на эмбрионы плоского морского ежа Scaphechinus mirabilis (Agassiz, 1864) и полностью подавляли развитие личинок при содержании 200–400 мкг/л. Эффективные концентрации ЕС50, нарушавшие оплодотворяющую способность сперматозоидов и развитие личинок S. mirabilis, для наноформы цинка составили 490 ± 16 и 29 ± 4 мкг/л, а для ионной формы – 6526 ± 99 и 67 ± 12 мкг/л соответственно. Установлено, что на раннее развитие S. mirabilis наноформа оксида цинка оказывала влияние в более низких концентрациях, чем ионная форма этого металла.
Развитие нанотехнологий как приоритетного направления мировой промышленности способствовало значительному увеличению объемов производства и использования наноматериалов, в том числе на основе оксида цинка, что привело к росту поступления этих соединений в окружающую среду. Благодаря своим размерам, наночастицы обладают уникальными физико-химическими свойствами, увеличивающими их биодоступность и токсичность для живых организмов (Mukherjee, Acharya, 2018).
Загрязнение окружающей среды соединениями цинка происходит в результате естественных процессов, например, при разрушении и растворении горных пород и цинксодержащих минералов, а также при добыче и переработке цинксодержащих руд, сжигании минерального топлива, в металлургическом и химическом производстве. Нанодисперсный ZnO активно используется при изготовлении пластмасс, керамики, стекла, цемента, резины и красителей (Fairbarn et al., 2011; Ma et al., 2013). Кроме этого, благодаря способности поглощать и отражать ультрафиолет, наночастицы ZnO входят в состав косметических средств, в том числе солнцезащитных кремов. Вследствие активного применения наночастицы ZnO попадают непосредственно в водную среду (Gottschalk et al., 2009; Ma et al., 2013).
Воздействие наночастиц металлов, в том числе оксида цинка, на гидробионтов недостаточно изучено. Имеются немногочисленные данные о том, что токсичность наноформы ZnO может проявляться при прямом воздействии на генетический материал или при индуцировании активных форм кислорода и образовании токсичных ионов, высвобождающихся из находящихся в воде наночастиц (Magdolenova et al., 2014). Некоторые авторы отмечают, что ионная форма цинка менее токсична, чем наноформа ZnO (Navarro et al., 2008; Farré et al., 2009; Manzo et al., 2013). Исследования, проведенные на рыбе Danio rerio, показали, что на ранних стадиях развития животных наночастицы оксида цинка более токсичны, чем таковые алюминия и титана (Zhu et al., 2008).
Из-за недостатка информации невозможно прогнозировать последствия проникновения соединений цинка в морские биоценозы и разработать рекомендации по безопасному применению данных соединений. Всестороннее изучение влияния нано- и ионной форм цинка на гидробионтов остается актуальной проблемой современной экотоксикологии, так как независимо от способа попадания этих соединений в окружающую среду со временем они проникают в морские экосистемы (Кукла и др., 2017).
Известно, что ранние стадии развития морских беспозвоночных наименее устойчивы к воздействию металлов. Благодаря высокой чувствительности и относительной доступности гамет, эмбрионов и личинок морских ежей, их часто используют для определения токсичности отдельных химических веществ и природных сред. Опубликованы данные о влиянии ионов цинка на эмбриональное и личиночное развитие морских ежей, обитающих в разных районах Мирового океана (Phillips et al., 1998; Larrain et al., 1999; Kobayashi, Okamura, 2004; Nadella et al., 2013; Tellis et al., 2014). Сведения о токсическом воздействии наноформ оксида цинка на морских ежей пока немногочисленны (Fairbairn et al., 2011; Manzo et al., 2013).
Цель настоящего исследования – изучение токсичности ионов цинка и наноразмерных частиц оксида цинка при воздействии на сперматозоиды и ранние стадии развития плоского морского ежа Scaphechinus mirabilis.
МАТЕРИАЛ И МЕТОДИКА
Особей морского ежа Scaphechinus mirabilis собирали в зал. Восток (зал. Петра Великого Японского моря) на глубине 4.0–4.5 м и выдерживали в аквариумах с морской водой, взятой в месте их сбора, в течение 2 сут для акклиматизации.
Половые продукты S. mirabilis получали, стимулируя нерест 0.5 М раствором хлорида калия. Яйцеклетки подготавливали по стандартной методике (Бузников, Подмарев, 1975). Сперму собирали непосредственно перед экспериментом и разбавляли чистой морской водой. Для проверки качества половых клеток проводили контрольное оплодотворение; яйцеклетки с уровнем оплодотворения ниже 95% в тестах не использовали.
Раствор, содержавший наночастицы, готовили из оксида цинка в ультрадисперсной форме (Sigma-Aldrich, размер частиц <50 нм). К навеске добавляли необходимый объем дистиллированной воды, после этого раствор помещали в ультразвуковую ванну “Сапфир” на 30 мин. Для приготовления раствора, содержавшего ионы цинка, использовали хлорид цинка. Концентрации тестируемых растворов составляли 20, 50, 100, 200 и 400 мкг/л ионов цинка и наночастиц оксида цинка с учетом их содержания в воде из системы аквариальной (10 мкг/л цинка), которую использовали для приготовления растворов.
Проведено два варианта эксперимента. В опыте 1 (спермиотест – влияние тестируемых растворов на оплодотворяющую способность сперматозоидов) сперматозоиды выдерживали в течение 1 ч в тестируемых растворах и затем использовали для оплодотворения яйцеклеток; оплодотворение проводили в чистой стерильной морской воде. Через 10 мин после внесения суспензии сперматозоидов подсчитывали количество оплодотворенных яйцеклеток. В опыте 2 (эмбриотест – влияние тестируемых растворов на развитие эмбрионов и личинок), согласно описанной ранее методике (Manzo et al., 2013), оплодотворение проводили в чистой морской воде, затем зиготы помещали в тестируемые растворы, в которых в течение 48 ч проходило дальнейшее развитие эмбрионов и личинок. Подсчитывали нормально и аномально развивающиеся эмбрионы и личинки на стадии бластулы (10 ч), гаструлы (18 ч) и среднего плутеуса I стадии (48 ч). Влияние цинка оценивали по количеству аномалий на всех стадиях развития. Для промеров и изготовления фотографий часть личинок фиксировали 0.02% раствором глутаральдегида. Через 48 ч после начала эксперимента измеряли длину первой пары рук у 100 личинок из каждой пробы с помощью микроскопа Axio Imager A1 (Carl Zeiss), оснащенного фотокамерой.
Показатель токсичности EC50 соединений цинка для сперматозоидов и среднего плутеуса I стадии рассчитывали с помощью метода пробит-анализа с использованием таблиц (Прозоровский и др., 1978). Результаты всех экспериментов обрабатывали, используя пакеты программ Excel и Statistica: определяли среднее арифметическое и стандартное отклонение. Достоверность различий оценивали с помощью однофакторного дисперсионного анализа по критерию Даннетта (Dunnett).
РЕЗУЛЬТАТЫ
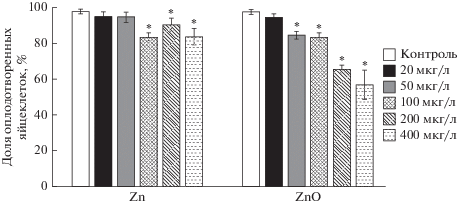
Проведенный нами спермиотест показал, что нано- и ионная формы цинка снижали оплодотворяющую способность сперматозоидов морского ежа Scaphechinus mirabilis. Доля оплодотворенных яйцеклеток достоверно уменьшилась после экспозиции сперматозоидов в растворах, содержавших 50 мкг/л наноразмерного оксида цинка и 100 мкг/л ионной формы этого элемента. При воздействии на сперматозоиды раствора ZnO в концентрации 400 мкг/л число оплодотворенных яйцеклеток снизилось почти до 50%. При воздействии ионной формы цинка в этой же концентрации оплодотворяющая способность спермиев снизилась менее чем на 20% (рис. 1).
Рис. 1.
Влияние ионов цинка и наночастиц оксида цинка на оплодотворяющую способность сперматозоидов морского ежа Scaphechinus mirabilis (среднее ± стандартное отклонение, n = 8). *Отличие от контроля достоверно (р < 0.05).
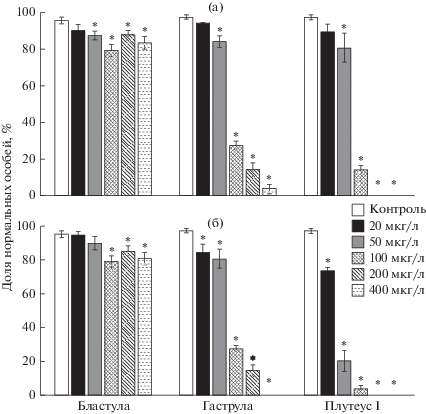
В ходе эмбриотеста отставание от контроля и нарушения в развитии наблюдали уже на стадии бластулы, аномалии развития отмечены у 10–20% эмбрионов. Это были деформированные или несформированные бластулы, прекратившие развитие на стадии морулы. На стадии гаструлы при концентрации токсикантов 100 мкг/л количество аномальных личинок достигало 70% (рис. 2); заметим, что уровень 50% является критическим для нормального воспроизводства популяции или лабораторной культуры и свидетельствует о сильном ингибирующем воздействии. При низких концентрациях токсикантов гаструлы отставали в развитии от контроля, а при концентрациях выше 100 мкг/л имели неправильную цилиндрическую форму. В небольшом количестве встречались мезенхимные бластулы и экзогаструлы.
Рис. 2.
Результаты эмбриотеста на разных стадиях развития морского ежа Scaphechinus mirabilis при воздействии ионов цинка (а) и наночастиц оксида цинка (б) (среднее ± стандартное отклонение, n = 8). *Отличие от контроля достоверно (р < 0.05).
На стадии среднего плутеуса под действием тестируемых растворов цинка в концентрациях 200 и 400 мкг/л аномалии развития (преимущественно отсутствие сформированного скелета) были отмечены у 100% личинок (рис. 3). Нарушение развития на этой стадии проявилось и как изменение размеров плутеусов; достоверное различие размеров экспериментальных и контрольных личинок S. mirabilis выявлено при воздействии обоих токсикантов в концентрации 100 мкг/л (табл. 1).
Рис. 3.
Личинки морского ежа Scaphechinus mirabilis через 48 ч после начала эксперимента. Масштабная линейка 100 мкм.

Таблица 1.
Размеры личинок морского ежа Scaphechinus mirabilis на стадии среднего плутеуса (48 ч) в опыте и контроле (n = 100)
| Концентрация, мкг/л | Длина первой пары рук (среднее ± станд. откл.), мкм | |
|---|---|---|
| Zn2+ | ZnO (нано) | |
| Контроль | 247.2 ± 17.9 | 247.2 ± 17.9 |
| 20 | 213.2 ± 13.3 | 226.4 ± 22.9 |
| 50 | 206.5 ± 25.2 | 194.3 ± 16.2 |
| 100 | 186.1 ± 10.3* | 182.4 ± 9.2* |
На основе полученных данных рассчитаны эффективные концентрации ЕС50 соединений цинка. Нарушающая оплодотворяющую способность у 50% сперматозоидов ЕС50 для цинка в ионной форме составила 6526 ± 99 мкг/л, а для наночастиц оксида цинка – 490 ± 16 мкг/л. Приводящая к нарушениям развития на стадии среднего плутеуса ЕС50 для ионной формы цинка составила 67 ± 12 мкг/л, а для наноразмерного оксида цинка – 29 ± 4 мкг/л.
ОБСУЖДЕНИЕ
В результате проведенного исследования установлено, что на развитие плоского морского ежа Scaphechinus mirabilis наночастицы оксида цинка оказывали более токсичное воздействие, чем ионы этого металла. Таким образом, подтверждены данные, полученные ранее для других видов морских ежей. Для средиземноморского Paracentrotus lividus было показано, что при инкубации оплодотворенных яйцеклеток в растворе, содержавшем 100 мкг/л ZnCl2, после 48 ч у 75% личинок наблюдались нарушения в формировании личиночного скелета, а при концентрации ZnCl2 200 мкг/л аномалии развития имели все личинки. При инкубации личинок в воде с добавлением наночастиц оксида цинка уже при концентрации 60 мкг/л на стадии среднего плутеуса все личинки имели аномалии развития (Manzo et al., 2013).
Нарушение формирования скелета плутеуса при воздействии растворов цинка, вероятно, связано с тем, что данный элемент препятствует нормальному накоплению кальция на начальных этапах развития личинки морского ежа. Считают, что цинк способен ингибировать действие белка Ca2+-АТФазы, в свою очередь, это приводит к снижению накопления ионов Ca2+. Как правило, эффект ингибирования наблюдался на стадии образования бластулы и во время гаструляции, что впоследствии влияло на формирование скелета плутеуса (Tellis et al., 2014). В нашем эксперименте при высоких концентрациях токсикантов на стадии среднего плутеуса все личинки имели аномии развития, у них отсутствовал сформированный скелет (рис. 3). Подобные аномалии личинок, формировавшихся в присутствии ионов цинка в концентрации выше 50 мкг/л, описаны и у морского ежа Anthocidaris crassispina (см.: Kobayashi, Okamura, 2004).
Одной из причин нарушения раннего развития морских ежей может быть токсическое воздействие соединений цинка на генном уровне. Показано, что ионы цинка в концентрации 0.62 мкМ/л (40 мкг/л) и наночастицы оксида цинка размером 100 нм в концентрации 0.92 мкМ/л (60 мкг/л) после 30-минутной экспозиции вызывали повреждение ДНК в сперматозоидах морского ежа P. lividus, но практически не влияли на их оплодотворяющую способность (Oliviero et al., 2019).
Токсичность наночастиц оксида цинка изучали на представителях разных групп гидробионтов: на микроводорослях, ракообразных и рыбах. Установлено, что нано-ZnO токсичен для эмбрионов и личинок рыбы Danio rerio: он снижал скорость их развития и приводил к появлению аномалий (Zhao et al., 2013). Для D. rerio, как и для морского ежа в нашем исследовании, на ранних стадиях развития острая токсичность наночастиц оксида цинка была выше, чем токсичность ионов цинка.
В экспериментах с ветвистоусым рачком Ceriodaphnia affinis все животные погибали после 48-часовой экспозиции в растворе ZnSO4, концентрация которого составляла 20 и 10 мг/л. Через 7 сут пребывания в воде, содержавшей 1 мг/л сульфата цинка, продолжительность жизни и суммарная плодовитость рачков достоверно снижались (Томилина и др., 2014). Суспензия нано-ZnO с концентрацией 100 мкг/л за 96 ч экспозиции вызывала слабую иммобилизацию особей дафнии Daphnia magna. Увеличение концентрации до 1 мг/л приводило к гибели 100% животных; рассчитанная для них средняя летальная концентрация нано-ZnO составила 0.62 мг/л (Томилина и др., 2011).
Сравнение эффективных концентраций, полученных в результате нашего эксперимента, с литературными данными показало, что влияние исследованных соединений цинка на оплодотворяющую способность сперматозоидов S. mirabilis значительно ниже, чем у других морских ежей; в то же время обнаружена высокая степень чувствительности на стадии среднего плутеуса (48 ч) (табл. 2). Результаты многих экспериментов, в которых были использованы разные тест-организмы, подтвердили более высокую токсичность наночастиц оксида цинка по сравнению с таковой ионов цинка.
Таблица 2.
Сравнение чувствительности традиционных тест-организмов к цинку в нано- и ионной формах
| Тест-организм | Тест-реакция | Эффективная концентрация, мг/л | Источник | |
|---|---|---|---|---|
| Zn2+ | ZnO (нано) | |||
| Бактерии | ||||
| Vibrio fischeri | Ингибирование люминесценции, ЕС50 | 1.9 | 0.18 | Heinlaan et al., 2008 |
| Микроводоросли | ||||
| Isochrysis galbana | Рост численности культуры | 1.41 | 0.97 | Miller et al., 2010 |
| Dunaliella tertiolecta | Рост численности культуры, ЕС50 4 сут | 2.42 | 0.65 | Manzo et al., 2014 |
| Ракообразные | ||||
| Daphnia magna | Подвижность, LC50 (48) | 0.58 | 0.07 | Franklin et al., 2007 |
| Подвижность, LC50 (48) | 6.1 | 3.2 | Heinlaan et al., 2008 | |
| Подвижность, LC50 (48) | 0.76 | 0.89–1.10 | Lopes et al., 2014 | |
| Выживаемость, плодовитость, ЕС50 21 сут | 0.25–0.40 | 0.26–0.36 | ||
| Thamnocephalus platyurus | Гибель, LC50 (24) | 0.98 | 0.18 | Heinlaan et al., 2008 |
| Рыбы | ||||
| Mugilogobius chulae | Личиночное развитие, LC50 5 сут | – | 45.50 | Li et al., 2018 |
| Иглокожие (морские ежи) | ||||
| Strongylocentrotus purpuratus | Оплодотворение, ЕС50 Личиночное развитие, ЕС50 (96) |
0.004–0.100 0.097–0.107 |
– | Phillips et al., 1998 |
| Arbacia spatuligera | Оплодотворение, ЕС50 | 0.116 | – | Larrain et al., 1999 |
| Lytechinus pictus | Личиночное развитие, ЕС50 (96) | – | 0.099 | Fairbairn et al., 2011 |
| Paracentrotus lividus | Оплодотворение, LOEC* | 0.060* | 0.300* | Manzo et al., 2013 |
| Личиночное развитие, ЕС50 (48) | 0.121 | 0.060* | ||
| Scaphechinus mirabilis | Оплодотворение, ЕС50 | 6.53 | 0.49 | Собственные данные |
| Личиночное развитие, ЕС50 (48) | 0.067 | 0.029 | ||
Чаще всего токсический эффект наночастиц оксидов металлов объясняют тем, что при попадании суспензии наночастиц в воду внесенное вещество растворяется и высвобождаются ионы исходных металлов, которые являются токсичными (Miller et al., 2010; Fairbairn et al., 2011). Однако показано, что наночастицы многих металлов более токсичны, чем их ионные формы (Navarro et al., 2008; Farré et al., 2009), и неблагоприятное воздействие наноразмерных частиц не может быть объяснено лишь высвобождением ионов металлов. Собственный механизм токсичности наночастиц металлов до настоящего времени не выяснен (Miao et al., 2010). Возможно, высвобождающиеся из наноформы ZnO ионы Zn2+ усиливают токсичность наночастиц. В связи с этим водные экосистемы будут испытывать сочетанное воздействие наночастиц оксида цинка и высвобожденных из него ионов Zn2+ (Chen et al., 2014; Zhao et al., 2016). Другая возможная причина токсичности наночастиц – генерация активных форм кислорода (АФК), ведущая к окислительному стрессу. Кроме этого, считают, что фотохимические характеристики наночастиц ZnO также способствуют их токсичности. Предполагается, что фотон света активирует наноформу оксида цинка и стимулирует генерацию АФК (Ma et al., 2010, 2013). На токсичность наноформы оксида цинка существенно влияют физико-химические свойства самих частиц, параметры окружающей среды, а также чувствительность гидробионтов (Zhao et al., 2016).
В экспериментах мы использовали нано- и ионную формы цинка в концентрациях, многократно превышающих содержание цинка в природных водах. В Японском море в зал. Восток концентрация растворенной формы цинка составляла 0.2 мкг/л, а в б. Рудная, известной высоким уровнем загрязнения тяжелыми металлами, – 5.6 мкг/л (Шулькин, 2004). По данным ежегодника “Качество морских вод по гидрохимическим показателям” (2018) в 2013–2017 гг. в наиболее загрязненных акваториях зал. Петра Великого (бухты Золотой Рог и Улисс в прол. Босфор-Восточный) среднегодовые концентрации цинка составляли 22–30 мкг/л, а максимальные разовые достигали 100–300 мкг/л. Это соответствует наибольшим протестированным в нашем эксперименте концентрациям, при которых появлялись аномальные личинки S. mirabilis.
Данные о содержании наночастиц оксида цинка в природных водах практически отсутствуют. Однако известно, что в 2003 г. мировое производство наночастиц ZnO и TiO2 только для косметических целей составляло около 1000 т, а содержание наночастиц ZnO в европейских странах достигало 10 нг/л в природных водах и 430 нг/л в очищенных сточных водах (Gottschalk et al., 2009; Ma et al., 2013). Рост производства и применения наночастиц, несомненно, приведет к увеличению их содержания в окружающей среде. Ежегодный рост производства и использования наноматериалов, а также увеличение поступления наночастиц в окружающую среду определяют необходимость изучения их воздействия на разные компоненты природных экосистем, в том числе на планктонных личинок донных организмов. В результате нашего исследования установлено, что наночастицы оксида цинка оказывали более токсичное воздействие на морского ежа S. mirabilis, чем ионы цинка. Кроме этого, показано, что сперматозоиды S. mirabilis менее чувствительны к действию цинка, чем эмбрионы и личинки. Установлено, что соединения цинка в концентрациях 50–100 мкг/л оказывали токсическое воздействие на развитие S. mirabilis и полностью подавляли его при концентрации 200–400 мкг/л.
Список литературы
Бузников Г.Н., Подмарев В.К. Морские ежи Strongylocentrotus droebachiensis, S. nudus, S. intermedius // Объекты биологии развития. М.: Наука. 1975. С. 179–216.
Качество морских вод по гидрохимическим показателям. Ежегодник. М.: Наука. 2018. 220 с.
Кукла С.П., Слободскова В.В., Челомин В.П. Генотоксические свойства оксидов меди в наноформе для морских организмов на примере тихоокеанской мидии Mytilus trossulus Gould, 1850 (Bivalvia: Mytilidae) // Биол. моря. 2017. Т. 43. № 2. С. 139–143.
Прозоровский В.Б., Прозоровская М.П., Демченко В.М. Экспресс-метод определения средней эффективной дозы и ее ошибки // Фармакол. и токсикол. 1978. Т. 41. № 4. С. 497–502.
Томилина И.И., Гремячих В.А., Мыльников А.П., Комов В.Т. Влияние металлооксидных наночастиц (СеО2, ТiO2, ZnO) на биологические параметры пресноводных нанофлагеллят и ракообразных // Докл. Акад. наук. 2011. Т. 436. № 5. С. 715–717.
Томилина И.И., Гремячих В.А., Гребенюк Л.П., Клевлеева Т.Р. Влияние нано-, микрочастиц и ионов цинка на пресноводных гидробионтов разных трофических уровней // Биол. внутр. вод. 2014. № 1. С. 93–102.
Шулькин В.М. Металлы в экосистемах морских мелководий. Владивосток: Дальнаука. 2004. 279 с.
Chen T.H., Lin C.C., Meng P.J. Zinc oxide nanoparticles alter hatching and larval locomotor activity in zebrafish (Danio rerio) // J. Hazard. Mater. 2014. V. 277. P. 134–140.
Fairbairn E.A., Keller A.A., Mädler L. et al. Metal oxide nanomaterials in seawater: linking physicochemical characteristics with biological response in sea urchin development // J. Hazard. Mater. 2011. V. 192. P. 1565–1571.
Farré M., Gajda-Schrantz K., Kantiani L., Barceló D. Ecotoxicity and analysis of nanomaterials in the aquatic environment // Anal. Bioanal. Chem. 2009. V. 393. P. 81–95.
Franklin N.M., Rogers N.J., Apte S.C. et al. Comparative toxicity of nanoparticulate ZnO, bulk ZnO, and ZnCl2 to a freshwater microalga (Pseudokirchneriella subcapitata): the importance of particle solubility // Environ. Sci. Technol. 2007. V. 41. № 24. P. 8484–8490.
Gottschalk F., Sonderer T., Scholz R.W., Nowack B. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, Fullerenes) for different regions // Environ. Sci. Technol. 2009. V. 43. № 24. P. 9216–9222.
Heinlaan H., Ivask A., Blinova I. et al. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus paltyurus // Chemosphere. 2008. V. 71. P. 1308–1316.
Kobayashi N., Okamura H. Effects of heavy metals on sea urchin embryo development. 1. Tracing the cause by the effects // Chemosphere. 2004. V. 55. P. 1403–1412.
Larrain A., Riveros A., Silva J., Bay-Schmith E. Toxicity of metals and pesticides using the sperm cell bioassay with the sea urchin Arbacia spatuligera // Bull. Environ. Contam. Toxicol. 1999. V. 62. № 6. P. 749–757.
Li J., Chen Z., Huang R. et al. Toxicity assessment and histopathological analysis of nano-ZnO against marine fish (Mugilogobius chulae) embryos // J. Environ. Sci. (China). 2018. V. 73. P. 78–88.
Lopes S., Ribeiro F., Wojnarowicz J. et al. Zinc oxide nanoparticles toxicity to Daphnia magna: size-dependent effects and dissolution // Environ. Toxicol. Chem. 2014. V. 33. P. 190–198.
Ma H., Williams P.L., Diamond S.A. Ecotoxicity of manufactured ZnO nanoparticles – a review // Environ. Pollut. 2013. V. 172. P. 76–85.
Ma L., Liu J., Li N. et al. Oxidative stress in the brain of mice caused by translocated nanoparticulate TiO2 delivered to the abdominal cavity // Biomaterials. 2010. V. 31. P. 99–105.
Magdolenova Z., Collins A.R., Kumar A. et al. Mechanisms of genotoxicity. A review of in vitro and in vivo studies with engineered nanoparticles // Nanotoxicology. 2014. V. 8. № 3. P. 233–278.
Manzo S., Miglietta M., Rametta G. et al. Embryotoxicity and spermiotoxicity of nanosized ZnO for Mediterranean sea urchin Paracentrotus lividus // J. Hazard. Mater. 2013. V. 254–255. P. 1–9.
Manzo S., Miglietta M., Rametta G. et al. Toxic effects of ZnO nanoparticles towards marine algae Dunaliella tertiolecta // Sci. Total. Environ. 2014. V. 445–446. P. 371–376.
Miao A.J., Zhang X.Y., Luo Z. et al. Zinc oxide- engineered nanoparticles: dissolution and toxicity to marine phytoplankton // Environ. Toxicol. Chem. 2010. V. 29. P. 2814–2822.
Miller R.J., Lenihan H.S., Muller E.B. et al. Impacts of metal oxide nanoparticles on marine phytoplankton // Environ. Sci. Technol. 2010. V. 44. P. 7329–7334.
Mukherjee K., Acharya K. Toxicological effect of metal oxide nanoparticles on soil and aquatic habitats // Arch. Environ. Contam. Toxicol. 2018. V. 75. P. 175–186.
Nadella S.R., Tellis M., Diamond R. et al. Toxicity of lead and zinc to developing mussel and sea urchin embryos: critical tissue residues and effects of dissolved organic matter and salinity // Comp. Biochem. Physiol. Part C: Toxicol. Pharmacol. 2013. V. 158. P. 72–83.
Navarro E., Piccapietra F., Wagner B. et al. Toxicity of silver nanoparticles to Chlamydomonas reinhardtii // Environ. Sci. Technol. 2008. V. 42. P. 8959–8964.
Oliviero M., Schiavo S., Dumontet S., Manzo S. DNA damages and offspring quality in sea urchin Paracentrotus lividus sperms exposed to ZnO nanoparticles // Sci. Total. Environ. 2019. V. 651. P. 756–765.
Phillips B.M., Anderson B.S., Hunt J.W. Spatial and temporal variation in results of purple urchin (Strongylocentrotus purpuratus) toxicity tests with zinc // Environ. Toxicol. Chem. 1998. V. 17. P. 453–459.
Tellis M.S., Lauer M.M., Nadella S. et al. Sublethal mechanisms of Pb and Zn toxicity to the purple sea urchin (Strongylocentrotus purpuratus) during early development // Aquat. Toxicol. 2014. V. 146. P. 220–229.
Zhao J., Dong X., Hu X. et al. Zinc levels in seminal plasma and their correlation with male infertility: A systematic review and meta-analysis // Sci. Rep. 2016. V. 6. P. 22386.
Zhao X., Wang S., Wu Y. et al. Acute ZnO nanoparticles exposure induces developmental toxicity, oxidative stress and DNA damage in embryo-larval zebrafish // Aquat. Toxicol. 2013. V. 136–137. P. 49–59.
Zhu X., Zhu L., Duan Z. Comparative toxicity of several metal oxide nanoparticle aqueous suspensions to Zebrafish (Danio rerio) early developmental stage // J. Environ. Sci. Health. Part A. 2008. V. 43. № 3. P. 278–284.
Дополнительные материалы отсутствуют.


