Биология моря, 2020, T. 46, № 2, стр. 85-90
Эколого-темпоральная дифференциация, единицы запаса и сохранение популяционного разнообразия анадромных рыб
В. Н. Иванков 1, *, Е. В. Иванкова 1
1 Дальневосточный федеральный университет
690091 Владивосток, Россия
* E-mail: ivankov-bio@mail.ru
Поступила в редакцию 25.07.2019
После доработки 29.10.2019
Принята к публикации 28.11.2019
Аннотация
Проанализирована экологическая, генетическая и темпоральная внутривидовая дифференциация популяций анадромных лососевых рыб рода Oncorhynchus. Показано, что учет популяционной организации рыб при проведении промысла способствует сохранению структуры эксплуатируемых стад и позволяет поддерживать их численность на оптимально высоком уровне. Промысловый запас анадромных рыб в том или ином районе размножения представлен одним или несколькими локальными стадами. Единицами запаса являются популяции рыб, составляющие локальное стадо.
Изучение внутривидовой организации и популяционного разнообразия гидробионтов, в частности рыб, в настоящее время становится все более актуальным. Это обусловлено необходимостью разработки способов сохранения разнообразия их внутривидовой структуры, а также поддержанием численности популяций на оптимально высоком уровне. В первую очередь данное касается видов, у которых выявлена не только географическая, но и ярко выраженная экологическая и темпоральная внутривидовая дифференциация.
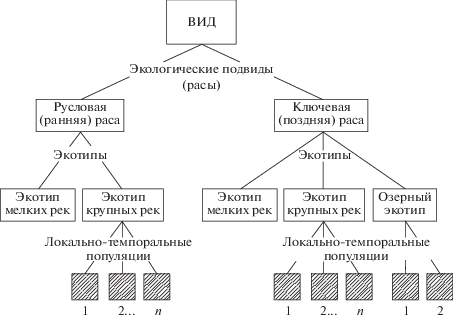
Эколого-морфологический и генетический анализ популяционной организации рыб, в том числе тихоокеанских лососей, показал, что значительные различия, как правило, наблюдаются у лососей локальных стад, наиболее удаленных друг от друга. Однако такая связь прослеживается далеко не всегда. Часто у рыб из географически удаленных популяций отмечается большое фенетическое и генетическое сходство. И наоборот, популяции, расположенные сравнительно близко (например, в бассейне крупной реки или в реках, впадающих в один и тот же залив), генетически существенно различаются (Алтухов и др., 1997). Отмечено также, что гетерогенность популяций внутри одного региона может превышать гетерогенность популяций между регионами (Withler, 1985; Varnavskaya et al., 1994). Каковы же причины подобных различий? Очевидно, это связано с тем, что влияние отбора наблюдается не только при географической, но и при экологической изоляции популяций, которая ярко выражена у анадромных рыб, в частности, у тихоокеанских лососей. Проведенные исследования позволили выявить у них довольно сложную внутривидовую иерархию (рис. 1). У всех видов рода Oncorhynchus выделяют две эколого-темпоральные (сезонные) расы: русловую (размножение происходит в реках на участках с хорошо развитым подрусловым потоком) и ключевую (размножение происходит в водоемах в местах выхода грунтовых вод, в ключах). Эти экологические группировки лососей генетически достаточно хорошо различаются, что убедительно показано в результате многолетних исследований рас кеты (Cronin et al., 1993; Салменкова и др., 1994; Wilmot et al., 1994; Winans et al., 1994; Ivankova, 2001; Иванкова, Борисовец, 2002; Животовский и др., 2017), горбуши (Алтухов и др., 1997) и нерки (Wilmot, Burger, 1985; Пильганчук, 2014).
Ранее было высказано мнение (Берг, 1934; Смирнов, 1975), что различия сезонных рас могут приближаться к различиям подвидового ранга. Сравнительный детальный анализ экологических, генетических и морфофизиологических различий этих рас у ряда тихоокеанских лососей показал, что в данном случае мы имеем дело с хорошо выраженными экологическими подвидами (Иванков, Иванкова, 2013, 2017). Отсюда следует, что при сравнении величин межпопуляционной географической изменчивости лососей необходимо принимать во внимание и экологическую дивергенцию изучаемых популяций, т.е. анализ межпопуляционных различий следует проводить между популяциями, принадлежащими к той или иной эколого-темпоральной расе (Иванков, Иванкова, 2013). В противном случае трудно объяснить иногда наблюдаемое сходство удаленных друг от друга популяций или большое различие сравнительно близко расположенных популяций (Nei, 1978; Алтухов и др., 1997). Учет эколого-темпоральной дифференциации популяций необходим и при выяснении объема, границ, структуры, иерархической организации видов, а также объема и границ единиц промыслового запаса. В настоящее время за единицу запаса, как правило, принимается локальное стадо рыб (состоящее из ряда популяций) того или иного региона. Очевидно, что в районах, где вид представлен двумя эколого-темпоральными расами, присутствуют два запаса. Подобную ситуацию следует учитывать при хозяйственной деятельности человека – при организации промысла, искусственном разведении и интродукции (Иванков, 1968).
Известно, что минимальной самовоспроизводящейся группировкой вида является локальная популяция. В силу своей частичной или даже полной изоляции она представляет собой элементарную эволюционную единицу. Кроме того, локальная популяция обладает способностью к регуляции своей численности и генетической структуры, образуя элементарную гомеостатическую структуру (Дубинин, 1966; Шмальгаузен, 1968; Тимофеев-Ресовский и др., 1969; Шварц, 1969). Расположенные рядом популяции из-за сходного характера воздействия отбора образуют плеяды сходных популяций, отличных от соседних групп. Однако группа соседних популяций не является единой функциональной системой (Шварц, 1969), т.е. не представляет собой большую популяцию. Плеяды популяций, объединяясь по ряду признаков, в свою очередь, могут образовывать комплексы (локальные стада), отличные от других подобных комплексов популяций. Например, такой комплекс составляют популяции кеты мелких рек Калининка, Ясноморка и Заветинка на юго-западе о-ва Сахалин (Алтухов и др., 1997; Иванкова и др., 2000), популяции кеты рек Барабашевка, Рязановка и Нарва в южном Приморье (Животовский, 2016а), а также популяции горбуши рек юго-восточного Сахалина (Иванков и др., 1996; Иванков, 2011). Подобные локальные стада анадромных рыб в репродуктивный период, как правило, привязаны к разным гидрогеологическим районам с характерным для этих районов химическим составом воды в реках и их притоках (Иванков, 1972, 1993; Ресурсы …, 1973; Животовский, 2016а, 2016б). Необходимо отметить, что морфофизиологические и генетические различия существуют не только между выделенными локальными стадами, но и внутри них – между локальными популяциями. Следовательно, промысловый запас обеспечивает плеяда соседних популяций (локальное стадо), а единицами запаса являются популяции, входящие в это локальное стадо. Таким образом, единицей промысла является единица запаса – локальная популяция.
В течение достаточно долгого времени у тихоокеанских лососей рода Oncorhynchus выделяли, как правило, две эколого-темпоральные (сезонные) расы: у кеты и горбуши – летнюю и осеннюю, у нерки в разных районах – весеннюю и летнюю или летнюю и осеннюю. Однако в настоящее время отмечается большое разнообразие в названиях сезонных форм (рас). В частности, у кеты кроме двух рас (летняя и осенняя), обнаруженных Бергом (1934), в последнее время выделяют и другие: весеннюю, летнюю раннюю, летнюю позднюю, раннюю и позднюю (Николаева, Овчинников, 1988; Волобуев и др., 1992, 2005; Заварина, 1995; Кузищин и др., 2010). Гриценко с соавторами (1987) выделили еще четыре сезонные расы кеты: летнюю амурскую, летнюю камчатскую, осеннюю амурскую и осеннюю камчатскую. Всего с учетом последних насчитывается более 10 названий сезонных рас этого лосося. Подобные темпоральные группировки недавно были выделены не только у кеты, но и у других видов тихоокеанских лососей. В р. Большая (Камчатка) у двух видов (чавыча и горбуша) были выделены три расы: у чавычи – весенняя, ранняя летняя и поздняя летняя; у горбуши – ранняя летняя, летняя и поздняя летняя (Запорожец и др., 2017). Отметим, что сезонные расы различаются не только временем захода рыб в реки на нерест и сроками нереста, но и экологией (местами нереста и термическим режимом в период эмбрионально-личиночного развития).
Довольно часто в бассейнах крупных рек наряду с эколого-темпоральными расами встречаются внутрирасовые группировки (локально-темпоральные популяции). Такие популяции обнаружены, например, у кеты в бассейнах рек Амур, Анадырь, Тугур и Камчатка, у горбуши в ряде рек североохотского побережья, а также у симы в реках южного Приморья (Ловецкая, 1948; Световидова, 1961; Бирман, 1977; Иванков и др., 1984; Путивкин, 1999; Марченко, 2004; Иванков и др., 2008; Кульбачный, Иванков, 2011). Группы (плеяды) популяций крупных рек часто представляют собой локальные стада, состоящие из ряда популяций, размножающихся в притоках второго порядка. Они выявляются при анализе колебаний численности и соотношения полов рыб в период их нерестового хода по основному руслу реки. Игнорирование (или отсутствие) сведений об иерархии внутривидовой организации видов при промысле и искусственном разведении может приводить (и, как правило, приводит) к обеднению морфологического, экологофизиологического и генетического разнообразия популяций рыб в разных регионах (Иванков, Иванкова, 2017). Прежде всего это сказывается на расовом составе вида. Наиболее интенсивному прессу промысла лососи подвергаются в начале нерестовой миграции в реки, когда на нерест идут рыбы ранней (русловой) расы.
Как отмечено выше, нерегулируемый по срокам нерестовой миграции промысел может приводить к нарушению естественной структуры популяций лососей в том или ином районе. Это видно, например, при анализе соотношения ранней (русловой) и поздней (ключевой) рас горбуши, размножающейся на о-ве Итуруп (Курильские острова) и в зал. Анива (о-в Сахалин). Соотношение первой и второй рас лососей в период с 1956 по 1966 г. на о-ве Итуруп было практически одинаковым (51.3 и 48.7%), в то время как в 1967–2009 гг. оно заметно изменилось и составляло соответственно 20.1 и 79.9% (Иванков, 1997; Каев, 2010). Подобная ситуация наблюдалась в реках западной Камчатки и р. Амур (Шунтов, Темных, 2008), а также в зал. Анива (Каев, 2010). В большие реки в начале нерестовой миграции, как правило, идут наиболее крупные лососи, мигрирующие на нерест в свои “родные” нерестовые притоки на сотни и даже тысячи километров, как, например, в бассейне р. Амур. Эти рыбы подвергаются наиболее интенсивному отлову. Опубликованы данные, показывающие, что подобный селективный промысел приводит к измельчанию рыб и снижению воспроизводительного потенциала амурской кеты (Рослый, 2002). Аналогичные сведения получены и для кеты бассейна р. Анадырь. В этом районе масса тела лососей с 1984 г. к середине 1990-х гг. снизилась с 3.82 до 2.84 кг, а их плодовитость – с 3573 до 2590 икринок (Путивкин, 1999). При нерегулируемом промысле лососей наблюдается сокращение популяционного разнообразия и значительно снижается численность рыб локально-темпоральных популяций. Например, в бассейне р. Уссури из существовавших ранее 30 популяционных группировок осенней кеты 14 уже практически исчезли, а основной нерест кеты происходит преимущественно в русле притоков р. Уссури – в реках Хор и Бикин (Экосистемы…, 1997). Численность осенней кеты в последние годы здесь поддерживалась лишь за счет рыб, заходивших в р. Уссури в самые поздние сроки – в октябре–декабре, в основном подо льдом (Золотухин, 2007). Эти данные показывают, что отсутствие или игнорирование сведений о популяционной организации видов при промысле анадромных рыб приводит к сокращению их общего запаса в том или ином районе, а также к уменьшению численности и к снижению качества рыб наиболее ценных единиц запаса, которыми являются ранние локально-темпоральные популяции (ходы) в бассейнах крупных рек или популяции (единицы запаса) локальных стад. Отмечено также снижение генетического разнообразия популяций, что было выявлено при проведении популяционно-генетических исследований группировок лососей разных иерархических уровней (Салменкова и др., 1986; Алтухов и др., 1997; Gharrett et al., 2001; Алтухов, 2003).
Проведенный нами анализ структуры промысловых видов анадромных рыб и их популяционной организации, а также последствий негативного влияния нерационального ведения промысла на структуру популяций и биологические показатели лососей позволил сделать вывод о необходимости разработки оптимальной стратегии промысла и рационального освоения запасов. Для этого прежде всего необходимо выяснить внутривидовую иерархическую структуру: наличие или отсутствие эколого-темпоральных (сезонных) рас и локально-темпоральных популяций в том или ином районе обитания видов, сроки нерестовой миграции, места размножения лососей каждой расы и локально-темпоральных популяций, а также популяционную структуру локального стада. Для объективного суждения о популяционной структуре каждого вида рыб в том или ином районе, очевидно, требуется проведение исследований с применением как биогеографических, экологических и морфофизиологических, так и популяционно-генетических методов (Животовский, 2016а).
Учет эколого-темпоральной дифференциации, популяционной организации лососей и рациональное ведение промысла, несомненно, будут способствовать устойчивости экологической и генетической структуры эксплуатируемых стад, поддержанию их популяционного разнообразия и численности на оптимально высоком уровне, а также позволят сохранять наиболее ценные единицы запаса (Алтухов, 2001; Зиничев и др., 2012; Иванков, Иванкова, 2017; Животовский, Смирнов, 2018). Сохранение популяционного внутривидового разнообразия лососей в регионе может быть обеспечено посредством регулирования сроков и интенсивности промысловой нагрузки в разные периоды нерестовой миграции рыб в реки, а поддержание оптимальной численности популяций рыб, являющихся единицами запаса, – их искусственным разведением на рыбоводных заводах и проведением рыбоохранных мероприятий.
Список литературы
Алтухов Ю.П. Генетические последствия селективного промысла и рыбоводства // Вопр. рыболовства. 2001. Т. 2. № 4 (8). С. 562–602.
Алтухов Ю.П. Генетические процессы в популяциях: Учеб. пособие. М.: ИКУ “Академкнига”. 2003. 431 с.
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т. Популяционная генетика лососевых рыб. М.: Наука. 1997. 288 с.
Берг Л.С. Яровые и озимые расы у проходных рыб // Изв. АН СССР. 1934. № 5. С. 711–732.
Бирман И.Б. О внутрипопуляционных группировках амурской осенней кеты Oncorhynchus keta (Walbaum) // Вопр. ихтиологии. 1977. Т. 17. Вып. 5. С. 879–889.
Волобуев В.В., Бачевская Л.Т., Волобуев М.В., Марченко С.Л. Популяционная структура кеты Oncorhynchus keta континентального побережья Охотского моря // Вопр. ихтиологии. 2005. Т. 45. Вып. 4. С. 489–501.
Волобуев В.В., Рогатных А.Ю., Царев Ю.И., Кузищин К.В. Морфо-биологическая дифференциация ранней и поздней кеты Oncorhynchus keta р. Тауй // Популяционная биология лососей Северо-Востока Азии (Биологические проблемы Севера). Владивосток: ДВО АН СССР. 1992. С. 72–80.
Гриценко О.Ф., Ковтун А.А., Косткин В.К. Экология и воспроизводство кеты и горбуши. М.: Агропромиздат. 1987. 168 с.
Дубинин Н.П. Эволюция популяций и радиация. М.: Атомиздат. 1966. 743 с.
Животовский Л.А. Популяционная структура вида: эко-географические единицы и генетическая дифференциация популяций // Биол. моря. 2016а. Т. 42. № 5. С. 323–333.
Животовский Л.А. Провизорное районирование единиц запаса кеты Дальнего Востока России // Бюл. № 11 изучения тихоокеанских лососей на Дальнем Востоке. 2016б. С. 193–198.
Животовский Л.А., Лапшина А.Е., Михеев П.Б. и др. Дивергенция сезонных рас кеты Oncorhynchus keta Walbaum, 1792 рек Амур и Поронай: экология, генетика, морфология // Биол. моря. 2017. Т. 43. № 4. С. 284–292.
Животовский Л.А., Смирнов Б.П. Стратегия воспроизводства тихоокеанских лососей в Сахалинской области // Вопр. рыболовства. 2018. Т. 19. № 3. С. 285–299.
Заварина А.О. Морфобиологическое описание “весенней” формы кеты Oncorhynchus keta (Walbaum) бассейна реки Камчатки // Исследование биологии и динамики численности промысловых рыб западно-камчатского шельфа. Петропавловск-Камчатский: КамчатНИРО. 1995. Вып. 3. С. 120–124.
Запорожец О.М., Запорожец Д.В., Зорбиди Ж.Х. Темпоральные группировки у производителей тихоокеанских лососей реки Большая (Западная Камчатка) // Водные биологические ресурсы России: состояние, мониторинг, управление. Сб. материалов Всерос. науч. конф. с международным участием, посвященной 85-летию Камчатского научно-исследовательского ин-та рыбного хоз-ва и океанографии (3–6 октября 2017 г.). Петропавловск-Камчатский. 2017. С. 182–190.
Зиничев В.В., Леман В.Н., Животовский Л.А., Ставенко Г.А. Теория и практика сохранения биоразнообразия при разведении тихоокеанских лососей. М.: Изд-во ВНИРО. 2012. 238 с.
Золотухин С.Ф. Кета реки Уссури. Владивосток: ТИНРО-центр. 2007. 210 с.
Иванков В.Н. Тихоокеанские лососи острова Итуруп // Изв. ТИНРО. 1968. Т. 65. С. 49–74.
Иванков В.Н. Особенности экологии и структура популяций осенней кеты различных районов Сахалина // Уч. зап. Дальневост. ун-та. 1972. Т. 60. С. 27–35.
Иванков В.Н. Популяционная организация лососей с коротким пресноводным периодом жизни // Вопр. ихтиологии. 1993. Вып. 1. С. 78–83.
Иванков В.Н. Изменчивость и микроэволюция рыб. Владивосток: Изд-во Дальневост. ун-та. 1997. 124 с.
Иванков В.Н. Внутривидовая дифференциация и популяционная организация горбуши Oncorhynchus gorbuscha в различных частях ареала // Изв. ТИНРО. 2011. Т. 167. С. 101–109.
Иванков В.Н., Добрицкий О.Ю., Скуба Н.С., Карпенко А.И. Дифференциация популяций горбуши Oncorhynchus gorbuscha южного Сахалина // Вопр. ихтиологии. 1996. Т. 22. № 3. С. 167–173.
Иванков В.Н., Иванкова Е.В. Внутривидовые репродуктивные стратегии у тихоокеанских лососей рода Oncorhynchus (фундаментальное сходство и видовые различия) // Изв. ТИНРО. 2013. Т. 173. С. 103–118.
Иванков В.Н., Иванкова Е.В. Экологические подвиды и локально-темпоральные популяции анадромных рыб // Вопр. ихтиологии. 2017. Т. 57. № 1. С. 59–65.
Иванков В.Н., Иванкова Е.В., Кульбачный С.Е. Популяционная организация тихоокеанских лососей: иерархия темпоральных рас и популяций // Современное состояние водных биоресурсов: Материалы науч. конф., посвященной 70-летию С.М. Коновалова. Владивосток: ТИНРО-Центр. 2008. С. 366–371.
Иванков В.Н., Падецкий С.Н., Карпенко С.Н., Лукьянов П.Е. Биология проходных рыб южного Приморья // Биология проходных рыб Дальнего Востока. Владивосток: Изд-во Дальневост. ун-та. 1984. С. 10–36.
Иванкова Е.В., Борисовец Е.Э. Морфологический и генетический анализы темпоральных группировок кеты Oncorhynchus keta реки Камчатка // Вопр. ихтиологии. 2002. Т. 43. № 4. С. 489–502.
Иванкова Е.В., Борисовец Е.Э., Карпенко А.И., Хоревин Л.Д. Популяционная структура кеты Oncorhynchus keta острова Сахалин // Вопр. ихтиологии. 2000. Т. 40. № 4. С. 467–476.
Каев А.М. Некоторые вопросы динамики стада горбуши в связи с ее темпоральной структурой // Бюл. № 5 реализации “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. 2010. С. 89–96.
Кузищин К.В., Груздева В.А., Савваитова К.А. и др. Сезонные расы кеты Oncorhynchus keta и их взаимоотношения в реках Камчатки // Вопр. ихтиологии. 2010. Т. 50. № 2. С. 202–215.
Кульбачный С.Е., Иванков В.Н. Темпоральная дифференциация и условия размножения кеты Oncorhynchus keta (Salmoniformes: Salmonidae) бассейна реки Тугур (Хабаровский край) // Вопр. ихтиологии. 2011. Т. 51. № 1. С. 70–79.
Ловецкая Е.А. Материалы по биологии амурской кеты // Изв. ТИНРО. 1948. Т. 27. С. 115–138.
Марченко С.Л. Особенности биологии и популяционная структура горбуши Oncorhynchus gorbuscha (Walbaum) северного побережья Охотского моря: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-Центр. 2004. 24 с.
Николаева Е.Т., Овчинников К.А. О внутривидовой структуре кеты Oncorhynchus keta на Камчатке // Вопр. ихтиологии. 1988. Т. 28. Вып. 3. С. 493–497.
Пильганчук О.А. Генетическая структура нерки Oncorhynchus nerka (Walbaum) полуострова Камчатка: Автореф. дис. … канд. биол. наук. Петропавловск-Камчатский: КамчатНИРО. 2014. 24 с.
Путивкин С.В. Биология и динамика численности анадырской кеты: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-центр. 1999. 24 с.
Ресурсы поверхностных вод СССР // Дальний Восток. Вып. 4. Сахалин и Курилы. Л.: Гидрометиздат. 1973. 264 с.
Рослый Ю.С. Динамика популяций и воспроизводство тихоокеанских лососей в бассейне Амура. Хабаровск: Хабаровск. кн. изд-во. 2002. 212 с.
Салменкова Е.А., Алтухов Ю.П., Викторовский Р.М. и др. Генетическая структура популяций кеты, размножающихся в реках Дальнего Востока и Северо-Востока СССР // Журн. общ. биол. 1986. Т. 47. С. 529–549.
Салменкова Е.А., Омельченко В.Т., Рослый Ю.С. и др. Генетическая дифференциация кеты бассейна Амура // Генетика. 1994. Т. 30. № 4. С. 518–528.
Световидова А.А. Локальные стада летней кеты Oncorhynchus keta (Walbaum) бассейна Амура // Вопр. ихтиологии. 1961. Вып. 17. С. 14–23.
Смирнов А.И. Биология, размножение и развитие тихоокеанских лососей. М.: МГУ. 1975. 336 с.
Тимофеев-Ресовский Н.В., Воронцов Н.Н., Яблоков А.В. Краткий очерк теории эволюции. М.: Наука. 1969. 408 с.
Шварц С.С. Эволюционная экология животных. М.: Наука. 1969. 199 с.
Шмальгаузен И.И. Факторы эволюции: теория стабилизирующего отбора. М.: Наука. 1968. 444 с.
Шунтов В.П., Темных О.С. Тихоокеанские лососи в морских и океанических экосистемах: монография. Владивосток: ТИНРО-Центр. 2008. Т. 1. 481 с.
Экосистемы бассейна реки Бикин: среда, человек, управление / Отв. ред. С.Ф. Золотухин. Владивосток: ДВО РАН. 1997. 176 с.
Cronin M.A., Spearman W.J., Wilmot R.L. et al. Mitochondrial DNA variation in chinook (Oncorhynchus tshawytscha) and chum salmon (O. keta) detected by restriction enzyme analysis of polymerase chain reaction (PCR) products // Can. J. Fish. Aquat. Sci. 1993. V. 50. P. 708–715.
Gharrett A.J., Lane S., McGregor A.J., Taylor S.G. Use of a genetic marker to examine genetic interaction among subpopulations of pink salmon (Oncorhynchus gorbuscha) // Genetica (Dordrecht, Neth.). 2001. V. 111. P. 259–267.
Ivankova E.V. Morphogenetic analysis of temporal populations of chum salmon of Kamchatka River // Proc. Northeast Pacific Pink and Chum Salmon Workshop. Seattle, Wash.: Univ. Washington. 2001. P. 137–146.
Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals // Genetics. 1978. V. 89. № 3. P. 583–590.
Varnavskaya N.V., Wood C.C., Everett R.J. et al. Genetic differentiation of subpopulations of sockeye salmon (Oncorhynchus nerka) within lakes of Alaska, British Columbia, and Kamchatka, Russia // Can. J. Fish. Aquat. Sci. 1994. V. 51. Suppl. 1. P. 147–157.
Wilmot R.L., Burger C.V. Genetic differences among populations of Alaskan sockeye salmon // Trans. Am. Fish. Soc. 1985. V. 114. P. 236–243.
Wilmot R.L., Everett R.J., Spearman W.J. et al. Genetic stock structure of western Alaska chum salmon and a comparison with Russian Far East stocks // Can. J. Fish. Aquat. Sci. 1994. V. 51. Suppl. 1. P. 84–94.
Winans G.A., Aebersold P.B., Urawa S., Varnavskaya N.V. Determining continent of origin of chum salmon (Oncorhynchus keta) using genetic stock identification techniques: Status of allozyme baseline in Asia // Can. J. Fish. Aquat. Sci. 1994. V. 51. Suppl. 1. P. 95–113.
Withler R.E. Ldh-4 allozyme variability in North American sockeye salmon (Oncorhynchus nerka) populations // Can. J. Zool. 1985. V. 63. P. 2924–2932.
Дополнительные материалы отсутствуют.