Биология моря, 2020, T. 46, № 2, стр. 100-106
Распределение взрослых самцов многошипого круглопера Eumicrotremus asperrimus (Tanaka, 1912) (Cyclopteridae) в Японском море у побережья северного Приморья и замечания о размножении данного вида
В. В. Панченко 1, 2, *, А. А. Баланов 2, **
1 Тихоокеанский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
690091 Владивосток, Россия
2 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: vlad-panch@yandex.ru
** E-mail: abalanov@imb.dvo.ru
Поступила в редакцию 07.02.2019
После доработки 10.04.2019
Принята к публикации 30.05.2019
Аннотация
В северном Приморье самцы многошипого круглопера Eumicrotremus asperrimus (Tanaka, 1912) без покровного вооружения или с его сильной редукцией встречаются практически вдоль всего побережья. Отсутствие, или сильная редукция покровного вооружения у самцов этого вида является вторичным половым признаком и указывает на то, что они могут принимать участие в размножении. У самцов E. asperrimus выделяют три основные стадии процесса размножения: захват нерестового субстрата, собственно нерест и охрана икры. В водах северного Приморья нерест многошипого круглопера проходит в шельфовой зоне в весенне-осенний период с пиком весной. Для нереста наиболее благоприятны глубины 60–100 м; в качестве нерестового субстрата используются мертвые раковины крупных брюхоногих моллюсков. Кладки икры охраняют самцы.
Колючие круглоперы рода Eumicrotremus, относящиеся к семейству круглоперовых Cyclopteridae, являются обычными обитателями умеренных и холодных морей Северного полушария (Линдберг, Легеза, 1955; Фадеев, 2005; Соколовский и др., 2007). В российских водах Японского моря встречаются три представителя данного рода: Eumicrotremus asperrimus, E. pacificus и E. taranetzi (см.: Ueno, 1970). Из них относительно высокими биомассой и численностью обладает только многошипый круглопер E. asperrimus (см.: Соломатов, 2004). В этом районе довольно подробно изучено его сезонное пространственное распределение (Антоненко и др., 2009) и отмечена невысокая численность в уловах половозрелых самцов. В результате последующих экспериментальных (Hatano et al., 2015) и генетических (Kai et al., 2015) исследований было установлено, что C. lindbergi Soldatov, 1930 и C. bergi Popov, 1929, считавшиеся самостоятельными видами рода Cyclopteropsis, являются самцами E. asperrimus. Говоря о C. lindbergi, с подобным выводом нельзя не согласиться, так как оба вида (E. asperrimus и C. lindbergi) описаны из Японского моря и их ареалы в пределах этого моря и южной части Охотского моря полностью совпадают. C. bergi описан из северной части Охотского моря, где E. asperrimus никогда не встречался. Можно предположить, что C. bergi является самцом одного из видов рода Eumicrotremus, который обитает в северной части Охотского моря. Очевидно, вид из Японского моря и южной части Охотского моря, подходящий под описание C. bergi, следует рассматривать как C. cf. bergi.
Представители рода Cyclopteropsis были обычными видами в донных тралениях в северной части Японского моря и хорошо идентифицировались (Соломатов, 2004; Соколовский и др., 2007). Примерно 70% рыб, относимых к роду Cyclopteropsis, определяли как C. lindbergi, а остальных – как C. сf. bergi. Данное исследование основано на анализе распространения особей, относимых ранее к C. lindbergi и C. cf. bergi.
Хатано с соавторами (Hatano et al., 2015) отмечали, что при достижении возраста 17 мес. самцы E. asperrimus с полным или частичным отсутствием наружного вооружения длиной 63–85 мм SL (расчетная длина TL = 80–100 мм) не росли, были агрессивными и боролись за нерестовый субстрат (пустые раковины букцинид), т.е. собирались принять участие в размножении. Сведения об экологии самцов E. asperrimus на этом этапе их жизненного цикла отсутствуют.
Цели настоящей работы – описать вертикальное и горизонтальное распределение взрослых самцов E. asperrimus и обсудить некоторые аспекты размножения этого вида.
МАТЕРИАЛ И МЕТОДИКА
К взрослым авторы относят самцов Eumicrotremus asperrimus с полным или почти полным отсутствием наружного вооружения на разных стадиях процесса размножения: захват нерестового субстрата, собственно нерест и охрана икры. Для определения стадий зрелости гонад гистологические исследования и вскрытия не проводились.
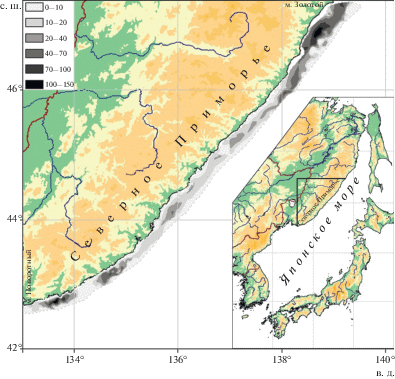
В основу настоящей работы положены материалы, полученные при проведении донных траловых съемок в российских водах Японского моря на судах ТИНРО-Центра. Известно, что E. asperrimus в северо-западной части Японского моря обитает преимущественно у побережья северного Приморья на акватории, ограниченной на юго-западе мысом Поворотный, а на северо-востоке – мысом Золотой (Антоненко и др., 2009). В связи с этим для исследования закономерностей распространения взрослых самцов E. asperrimus анализировали данные, полученные на акватории северного Приморья (рис. 1). В работе использовали результаты донных тралений на шельфе и материковом склоне на глубине от 10 до 935 м в конце марта – в начале декабря в 2004–2018 гг. Ловы производили донным тралом ДТ/ТВ 27.1/24.4 с мягким грунтропом с горизонтальным раскрытием 15–16 м и с мелкоячейной вставкой в кутце 10 мм. Скорость тралений варьировала от 2.2 до 3.5 узла (в среднем составляла 2.8 узла). Проанализированы данные 1919 тралений, большая часть которых (1778) сопровождалась измерением придонной температуры воды. Всего промерено (TL) 463 особи. При проведении массовых промеров точность измерений составляла 1.0 см, при промерах единичных особей – 0.1 см. Частоту встречаемости определяли как отношение числа результативных тралений к их общему числу в определенном батиметрическом интервале и выражали в процентах. Уловы рыб пересчитывали на плотность по формуле:
где P – плотность, экз./км2; B – улов, экз.; S – площадь траления, км2.Рис. 1.
Район работ и пространственное распределение (экз./км2) взрослых самцов Eumicrotremus asperrimus у побережья северного Приморья в весенне-осенний период.
При анализе сезонного распределения E. asperrimus гидрологические сезоны определяли по классификации Зуенко (1994), согласно которой зимний период включал январь и февраль, весенний – март и апрель, летний – июнь–сентябрь, осенний – ноябрь и декабрь. Май являлся переходным месяцем между весенним и летним сезонами, октябрь – между летним и осенним. Поскольку распределение донных рыб у побережья северного Приморья в мае ближе к таковому весной (Соломатов, 2004), этот месяц относили к весеннему сезону. В октябре исследования проводились только во второй половине месяца, что позволило отнести его к осеннему периоду. Согласно данной классификации, большинство положенных в основу работы тралений (1264) было выполнено в весенний период. В летний период проведено 494 траления, в осенний – 161.
Анализ пространственного распределения выполнен с использованием программного пакета CHARTMASTER. Карта распределения построена с помощью метода сплайн-аппроксимации при коэффициенте сглаживания, равном 1.
РЕЗУЛЬТАТЫ
Анализ пространственного распределения взрослых самцов Eumicrotremus asperrimus показал, что места их скоплений довольно стабильны. У побережья северного Приморья такие самцы встречались практически повсеместно, а наиболее высокие концентрации зарегистрированы на северо-востоке и на юго-западе исследованного района. Локальные пятна меньшей плотности отмечены и на некоторых других участках (рис. 1).
Наиболее узким батиметрический диапазон обитания взрослых самцов был в период гидрологического лета. В это время они встречались на глубине от 65 до 128 м. Частота встречаемости рыб была наиболее высокой на глубинах 60–80 и 80–100 м, с увеличением глубины она снижалась (рис. 2а). Подобная закономерность прослеживалась и для средней плотности (рис. 2б). Осенью и весной, как и в летний период, взрослые самцы E. asperrimus концентрировались в основном на глубине 60–100 м, однако батиметрический диапазон их обитания был более широким (рис. 2). Осенью минимальная глубина обнаружения рыб, как и летом, составляла 65 м, а максимальная достигала 241 м. Весной расширение батиметрического диапазона обитания взрослых самцов происходило преимущественно в область малых глубин (до 25 м); максимальная глубина их обитания составляла 162 м. В весенний период плотность и частота встречаемости E. asperrimus были выше, чем в осенний и летний периоды (рис. 2).
Рис. 2.
Частота встречаемости (а) и средняя плотность (б) взрослых самцов Eumicrotremus asperrimus в северном Приморье в весенний, летний и осенний сезоны. Вертикальная линия – ошибка средней.

Температура воды при поимках взрослых самцов многошипого круглопера изменялась от –1.0 до 4.4°С, при этом на глубинах их обитания температура воды в весенний период колебалась от ‒1.2 до 4.6°С, в летний – от 1.1 до 4.9°С, в осенний – от 0.8 до 3.3°С. Весной взрослые самцы встречались при температуре от –0.1 до 3.5°С; при отрицательных значениях температуры отмечена более высокая частота их встречаемости (табл. 1). Летом в результате прогрева воды минимальная температура при поимке взрослых самцов составляла 1.1°С, а максимальная достигала 4.4°С и была приурочена к самой меньшей глубине – 65 м. В остальных тралениях температура воды не превышала 2.6°С. Осенью взрослые самцы концентрировались в узком температурном диапазоне 2.6–3.3°С; зарегистрирована поимка самца на глубине 241 м при температуре 0.9°С (табл. 1).
Таблица 1.
Частота встречаемости (%) взрослых самцов Eumicrotremus asperrimus у побережья северного Приморья в зависимости от придонной температуры воды в разные сезоны
| Сезон | Температура, °С | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| –1…–0.5 | –0.5–0 | 0–0.5 | 0.5–1 | 1–1.5 | 1.5–2 | 2–2.5 | 2.5–3 | 3–3.5 | 3.5–4 | 4–4.4 | |
| Весна | 54.5 | 44.4 | 33.3 | 22.4 | 29.8 | 38.7 | 16.7 | 13.5 | 16.0 | 0 | 0 |
| Лето | – | – | – | – | 33.3 | 7.1 | 8.6 | 33.3 | 0 | 0 | 33.3 |
| Осень | – | – | – | 33.3 | 0 | 0 | 0 | 77.8 | 50.0 | – | – |
Минимальная длина тела взрослых самцов E. asperrimus составляла 5.0 см TL, максимальная – 9.0 см (табл. 2). До настоящего времени считали, что в естественных условиях максимальный размер самцов, относимых ранее к Cyclopteropsis lindbergi и C. cf. bergi, не превышает 7 см TL (Линдберг, Красюкова, 1987; Новиков и др., 2002). Особи с минимальными и максимальными размерами встречались в весенний период. Летом размер рыб варьировал от 5.5 до 7 см, осенью – от 5.2 до 7.5 см TL.
Таблица 2.
Минимальные (min), максимальные (max) и средние (М) размеры (см) взрослых самцов Eumicrotremus asperrimus в уловах донного трала на разной глубине у побережья северного Приморья в исследованные сезоны
| Глубина, м | Весна | Лето | Осень | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| min | max | M | ± | n | min | max | M | ± | n | min | max | M | ± | n | |
| 25–40 | 5.0 | 7.5 | 5.9 | 0.26 | 13 | – | – | – | – | – | – | – | – | – | – |
| 40–60 | 5.0 | 9.0 | 6.9 | 0.21 | 15 | – | – | – | – | – | – | – | – | – | – |
| 60–80 | 5.1 | 9.0 | 6.0 | 0.04 | 205 | 5.5 | 6.8 | 5.8 | 0.18 | 13 | 5.2 | 7.5 | 5.7 | 0.10 | 25 |
| 80–100 | 5.0 | 7.6 | 5.9 | 0.06 | 84 | 5.6 | 7.0 | 6.3 | 0.38 | 4 | 5.3 | 6.7 | 6.0 | 0.20 | 6 |
| 100–150 | 5.2 | 7.7 | 6.1 | 0.07 | 82 | 5.5 | 7.0 | 6.4 | 0.26 | 8 | 5.5 | 6.5 | 6.3 | 0.15 | 6 |
| 150–200 | 8.0 | 8.0 | 8.0 | – | 1 | – | – | – | – | – | – | – | – | – | – |
| 200–250 | – | – | – | – | – | – | – | – | – | – | 6.0 | 6.0 | 6.0 | – | 1 |
Весной самцы с минимальными размерами (около 5 см TL) встречались на всех исследованных глубинах, за исключением глубин более 150 м. Рыбы с максимальными размерами были пойманы на глубинах 40–60 и 60–80 м (табл. 2), причем в первом диапазоне глубины средний размер пойманных рыб был выше. При уменьшении или увеличении глубины прослеживалась тенденция к снижению среднего размера рыб, однако на глубине 100–150 м длина рыб увеличивалась. Длина пойманной на глубине 200–250 м особи составляла около 8 см. Летом во всех трех диапазонах глубин, где встречались взрослые самцы E. asperrimus, их минимальный и максимальный размеры были схожими, а средняя длина рыб с глубиной несколько увеличивалась (табл. 2). В осенний период самые мелко- и крупноразмерные особи были пойманы на глубине 60–80 м; средний размер рыб до 150-метровой изобаты возрастал. Длина пойманной на глубине 200–250 м особи составляла 6 см (табл. 2).
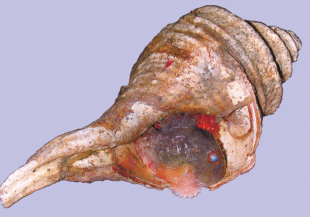
Самки многошипого круглопера откладывали икру в полость пустых раковин букцинид. Взрослые самцы, охранявшие кладки икры, встречались во все сезоны. Так, например, 9 апреля 2007 г. на глубине 100 м был пойман самец без покровного вооружения длиной 67 мм TL (52 мм SL). Он прочно присосался к устью пустой раковины брюхоногого моллюска Neptunea lyrata (Gmelin, 1979), закрыв собой находящуюся внутри кладку развивающейся икры (рис. 3). Следует отметить, что самец остался “на посту” и после вытряхивания улова на палубу. Однако, по-видимому, не всем самцам удается удержаться в раковине после захвата их тралом. Например, 5 апреля 2009 г. при разборе тралового улова с глубины 36 м была найдена раковина с кладкой развивающейся икры без самца. Взрослые самцы встречались и в пустых раковинах без икры. Так, 4 июля 2007 г. при разборе тралового улова с глубины 128 м были обнаружены три взрослых самца E. asperrimus 6–7 см TL, один из которых находился в раковине с кладкой икры, второй – в пустой раковине, а третий – без раковины; 4 ноября 2010 г. на глубине 75 м в раковинах букцинид с отложенной икрой было обна-ружено несколько самцов длиной 5–6 см TL.
ОБСУЖДЕНИЕ
Полученные сведения о пространственном распределении и температурных условиях обитания взрослых самцов Eumicrotremus asperrimus у побережья северного Приморья в общем совпадают с опубликованными данными (Антоненко и др., 2009), за исключением информации о глубинах его наиболее плотных скоплений. По данным Антоненко с соавторами (2009) основные концентрации E. asperrimus были приурочены к глубинам 100–300 м. Между тем нами показано, что в летне-осенний период взрослые самцы концентрировались на глубинах 60–100 м. Необходимо отметить, что Антоненко с соавторами (2009) как E. asperrimus определяли только полностью ошипленных особей. Признак сильного и плотного ошипления является одним из характерных для этого вида (Линдберг, Легеза, 1955; Ueno, 1970; Линдберг, Красюкова, 1987). Экспериментальные данные Хатано с соавторами (Hatano et al., 2015) позволили понять, что материал, использованный в работе Антоненко с соавторами (2009), состоял из самок всех возрастов и неполовозрелых самцов. Весной в траловых уловах самок было больше, чем самцов, и практически все самцы были незрелыми. Сходная картина наблюдалась и в северной Атлантике у Eumicrotremus spinosus, когда самок в траловых уловах было больше, чем самцов (Berge, Nahrgang, 2013). Очевидно, это различие в распределении связано с тем, что взрослые самцы концентрируются в районах, где будет проходить размножение, которые не совпадают с районами нагула самок и незрелых самцов.
Биология E. asperrimus изучена очень слабо. Сообщалось, что в северной части Японского моря у этого вида нерест летний (Новиков и др., 2002) или весенне-летний (Ueno, 1979; Антоненко и др., 2009). Анализ информации о пространственном и сезонном распределении взрослых самцов E. asperrimus позволяет высказать предположение об основных районах, о сезоне и глубинах нереста данного вида. Известно, что самцы E. asperrimus с частичной или полной потерей ошипления готовятся к размножению и могут принять участие в нересте (Hatano et al., 2015). Среди внешне неразличимых взрослых самцов могут быть самцы, захватывающие нерестовый субстрат (пойманные в пустых раковинах самцы явно занимали нерестовые участки в ожидании подхода самок), нерестящиеся и охраняющие икру.
На основе данных о распространении взрослых самцов сложно судить о том, какие из них находятся в нерестовом состоянии, поскольку занимать нерестовые участки (и попадать в тралы) они могут задолго до нереста. Например, самцы атлантического пинагора Cyclopterus lumpus приходят в районы нерестилищ на месяц раньше самок (Goulet et al., 1986; Кудрявцева, 2008). Однако, судя по тому, что охранявшие кладки самцы E. asperrimus встречались в весенний, летний и осенний сезоны, нерест у этого вида с различной интенсивностью проходит в весенне-осенний период. Уточнить сведения о продолжительности нерестового периода и его интенсивности в разные месяцы могли бы данные о преднерестовых и нерестовых самках. Данных о конкретном периоде поимки нерестовых самок E. asperrimus (диаметр икры 3–4 мм, высокий гонадосоматический индекс) в Японском море (да и на всем ареале) очень мало. Уэно (Ueno, 1970) сообщал о поимке в середине мая в районе прол. Лаперуза четырех крупных самок со зрелыми ооцитами; максимальный диаметр (4 мм) был определен у самки 89 мм SL. В Татарском проливе в апреле–мае 2007 г. были пойманы самки в преднерестовом состоянии с диаметром икры до 3 мм и с гонадосоматическим индексом до 90% (Антоненко и др., 2009). Об одной половозрелой (?) самке 80 мм SL, пойманной 29 июня 1932 г., сообщали Линдберг и Легеза (1955). Информация об обнаружении самок E. asperrimus со зрелой икрой в осенний и зимний периоды отсутствует.
В северо-западном районе Японского моря гидрологической весной (март–май) уловы взрослых самцов E. asperrimus были максимальными (рис. 2), а их размерный состав самым широким (табл. 2). В этот же период встречались наиболее зрелые самки данного вида. Полученные сведения позволяют предположить, что основной нерест E. asperrimus в этом районе, по-видимому, проходит в марте–мае преимущественно на глубине 60–100 м. Анализ пространственного распределения взрослых самцов E. asperrimus свидетельствует о том, что у побережья Приморья имеется два основных нерестилища: севернее мыса Поворотный и южнее мыса Золотой (рис. 1).
При массовом нересте в весенний период логично предположить, что созревание и, соответственно, утрата наружного вооружения у самцов E. asperrimus происходят преимущественно в предшествующий холодный период, т.е. осенью и зимой. В пользу этого предположения свидетельствует информация о сезонной динамике размерного состава, встречаемости и уловах. Характерен “провал” данных о встречаемости и плотности уловов взрослых самцов E. asperrimus в летний период, когда эти показатели были минимальными (рис. 2). При основном весеннем нересте такая ситуация могла сложиться только при гибели нерестовых самцов после вылупления мальков и при слабом или остаточном (самец начал охранять икру еще весной) нересте летом. В этом случае относительно высокие уловы взрослых самцов E. asperrimus в ноябре–декабре можно объяснить подходом созревающих рыб следующего года нереста. В осенний период отдельные взрослые самцы были обнаружены на глубине 200–250 м, что, возможно, показывает, откуда подходят к нерестилищам созревающие особи.
По результатам аквариальных наблюдений, у самцов E. asperrimus метаморфоз завершается (после этого прекращается их рост) приблизительно в возрасте полутора лет (Hatano et al., 2015). Минимальная длина особей к этому времени составляет 6.3 см SL, максимальная – 8.5 см SL, что по расчетным данным соответствует 8 и более 10 см TL. Однако при содержании в аквариуме из-за равномерного кормления и более высокой температуры воды (6–10°C) рыбы растут быстрее, чем в природных условиях. Минимальный и максимальный размер взрослых самцов E. asperrimus в естественных условиях гораздо меньше (табл. 2).
Самцы с максимальными размерами (до 9 см) встречались в весенний период, их отсутствие в другие сезоны можно объяснить гибелью после нереста. Гибель большинства самцов после нереста описана для Aptocyclus ventricosus (Ульченко, Орлов, 2001; Zhukova et al., 2018). Невысокий уровень посленерестового возврата меток (всего 10%) C. lumpus в водах Исландии может быть вызван высокой смертностью особей обоих полов после нереста (Kasper et al., 2014). Исходя из опубликованных данных, смертность самок E. asperrimus также может быть высокой. Вероятно, именно этим обусловлена низкая численность самок E. asperrimus старших возрастов (Антоненко и др., 2009).
В юго-восточной части Японского моря у побережья о-ва Хонсю (Япония) нерест E. asperrimus зарегистрирован и в глубоководной зоне. В октябре с глубины 340 м были подняты три кладки этого вида (диаметр икринок 4.3–4.7 мм), из которых после инкубации было получено потомство (Hatano et al., 2015). Глубоководный нерест E. asperrimus, вероятно, связан с особенностями гидрологии в этой части Японского моря. В данном районе на глубинах до 200 м температура воды слишком высокая (Лучин, 2007), поэтому виды бореального комплекса опускаются на бóльшие глубины, чем в северной части моря (Nishimura, 1966, 1968; Савельев и др., 2014).
Известно, что в качестве нерестового субстрата E. asperrimus использует пустые раковины букцинид (Hatano et al., 2015). Нами также были обнаружены самцы E. asperrimus, охранявшие кладки икры, отложенные в раковины крупных букцинид, в частности, Neptunea lyrata (рис. 3). Судя по распределению живых моллюсков (Репина и др., 2011), в северной части исследованного района многошипый круглопер в качестве нерестового субстрата должен использовать преимущественно раковины Buccinum bayani (Jousseam, 1883), а в южной части – раковины массовых видов рода Neptunea.
ЗАКЛЮЧЕНИЕ
В заключение отметим, что принимающие участие в размножении самцы Eumicrotremus asperrimus в северном Приморье встречаются практически вдоль всего побережья, а их наиболее высокие концентрации формируются на северо-востоке и на юго-западе исследованного района. В летне-осенний период скопления самцов этого вида зарегистрированы на глубинах 60–100 м.
Отсутствие покровного вооружения или его сильная редукция у самцов E. asperrimus являются вторичным половым признаком, указывающим на то, что самцы могут принять участие в размножении. Выделены следующие стадии процесса размножения у самцов E. asperrimus: захват нерестового субстрата, собственно нерест и охрана икры. У побережья северного Приморья имеется два основных нерестилища многошипого круглопера: севернее мыса Поворотный и южнее мыса Золотой. Нерест E. asperrimus проходит в шельфовой зоне в весенне-осенний период с пиком весной; время икрометания связано с наличием слабоположительной температуры воды. Для нереста E. asperrimus наиболее благоприятны глубины около 60–100 м; в качестве нерестового субстрата рыбы используют мертвые раковины крупных брюхоногих моллюсков. Кладки оплодотворенной икры охраняют самцы.
Список литературы
Антоненко Д.В., Пущина О.И., Соломатов С.Ф. Сезонное распределение и некоторые черты биологии многошипого круглопера Eumicrotremus asperrimus (Cyclopteridae, Scorpaeniformes) в северо-западной части Японского моря // Вопр. ихтиологии. 2009. Т. 49. № 5. С. 693–700.
Зуенко Ю.И. Типы термической стратификации вод на шельфе Приморья // Комплексные исследования морских гидробионтов и условий их обитания. Владивосток: ТИНРО. 1994. С. 20–39.
Кудрявцева О.Ю. Пинагор Баренцева моря и сопредельных вод. М.: Наука. 2008. 164 с.
Линдберг Г.У., Красюкова З.В. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Л.: Наука. 1987. Ч. 5. 526 с.
Линдберг Г.У., Легеза М.И. Обзор родов и видов рыб подсемейства Cyclopterinae (Pisces) // Тр. ЗИН АН СССР. 1955. Т. 18. С. 389–458.
Лучин В.А. Сезонная изменчивость температуры воды в деятельном слое дальневосточных морей // Дальневосточные моря России. Кн. 1: Океанологические исследования. М.: Наука. 2007. С. 232–252.
Новиков Н.П., Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. Рыбы Приморья. Владивосток: Дальрыбвтуз. 2002. 552 с.
Репина Е.М., Зуенко Ю.И., Седова Л.Г. Распределение брюхоногих моллюсков сем. Buccinidae на шельфе и в верхней батиали вод Приморья (Японское море) // Изв. ТИНРО. 2011. Т. 165. С. 74–88.
Савельев П.А., Баланов А.А., Калчугин П.В. и др. Пространственное распределение и термический режим обитания двух представителей рода Lycodes (Perciformes, Zoarcidae) в российских водах Японского моря // Вопр. ихтиологии. 2014. Т. 54. № 1. С. 32–42.
Соколовский А.С., Дударев В.А., Соколовская Т.Г., Соломатов С.Ф. Рыбы российских вод Японского моря: аннотированный и иллюстрированный каталог. Владивосток: Дальнаука. 2007. 200 с.
Соломатов С.Ф. Характеристика ихтиофауны морских вод северного Приморья Японское море // Изв. ТИНРО. 2004. Т. 138. С. 205–219.
Ульченко В.А., Орлов А.М. Ихтиофауна литорали охотоморского побережья о. Уруп (Курильские острова) // Тез. международ. конф. по биологическим основам устойчивого развития прибрежных морских экосистем. Мурманск: ПИНРО. 2001. С. 245–247.
Фадеев Н.С. Справочник по биологии и промыслу рыб северо-западной части Тихого океана. Владивосток: ТИНРО-Центр. 2005. 366 с.
Berge J., Nahrgang J. The Atlantic spiny lumpsucker Eumicrotremus spinosus: life history traits and the seemingly unlikely interaction with the pelagic amphipod Themisto libellula // Pol. Polar Res. 2013. V. 34. № 3. P. 279–287.
Goulet D., Green J.M., Shear T.H. Courtship, spawning, and parental care behavior of the lumpfish, Cyclopterus lumpus L., in Newfoundland // Can. J. Zool. 1986. V. 64. № 6. P.1320–1325.
Hatano M., Abe T., Wada T., Munehara H. Ontogenetic metamorphosis and extreme sexual dimorphism in lumpsuckers: Eumicrotremus asperrimus, Cyclopteropsis bergi and Cyclopteropsis lindbergi, may be synonymous // J. Fish Biol. 2015. V. 86. № 3. P. 1121–1128.
Kai Y., Stevenson D.E., Ueda Y. et al. Molecular insights into geographic and morphological variation within the Eumicrotremus asperrimus species complex (Cottoidei: Cyclopteridae) // Ichthyol. Res. 2015. V. 62. № 4. P. 396–408.
Kasper J.M., Bertelsen B., Ólafsson H.G. et al. Observations of growth and postspawning survival of lumpfish Cyclopterus lumpus from mark-recapture studies // J. Fish Biol. 2014. V. 84. № 6. P. 1958–1963.
Nishimura S. The zoogeographical aspects of the Japan Sea. Part III // Publ. Seto Mar. Biol. Lab. 1966. V. 13. № 5. P. 365–384.
Nishimura S. The zoogeographical aspects of the Japan Sea. Part IV // Publ. Seto Mar. Biol. Lab. 1968. V. 15. № 5. P. 329–352.
Zhukova K., Maznikova O.A., Orlov A.M. Gonadal maturation of the female smooth lumpsucker (Aptocyclus ventricosus) // Fish. Bull. 2018. V. 116. № 2. P. 153–160.
Ueno T. Fauna Japonica: Cyclopteridae (Pisces). Tokyo: Acad. Press Japan. 1970. 233 p.
Дополнительные материалы отсутствуют.