Биология моря, 2020, T. 46, № 2, стр. 135-141
Поглощение и преобразование дизельного топлива водорослью Palmaria palmata (Linnaeus) F. Weber et D. Mohr, 1805 (Rhodophyta) и ее возможная роль в биоремедиации морской воды
Г. М. Воскобойников 1, *, И. В. Рыжик 1, Д. О. Салахов 1, Л. О. Метелькова 2, З. А. Жаковская 2, Е. М. Лопушанская 3
1 Мурманский морской биологический институт КНЦ РАН
183010 Мурманск, Россия
2 Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
197110 Санкт-Петербург, Россия
3 Всероссийский научно-исследовательский институт метрологии им. Д.И. Менделеева
190005 Санкт-Петербург, Россия
* E-mail: grvosk@mail.ru
Поступила в редакцию 12.08.2019
После доработки 21.10.2019
Принята к публикации 28.11.2019
Аннотация
Впервые показано, что красная водоросль Palmaria palmata (Linnaeus) F. Weber et D. Mohr, 1805 в условиях умеренного загрязнения дизельным топливом (ДТ) морской воды не только сохраняла физиологическую активность, но и проявляла выраженную способность к сорбции и деструкции нефтепродуктов (НП). Установлено, что содержание компонентов ДТ в воде снижалось одновременно с их накоплением в водоросли. По-видимому, весь таллом пальмарии способствовал деструкции ДТ, которая начиналась на поверхности водоросли в результате деятельности эпифитных углеводородокисляющих бактерий, обеспечивающих перевод НП в доступную для макрофитов форму. В дальнейшем НП нейтрализовались клетками водоросли. Сохранение жизнеспособности водоросли Р. palmata под влиянием ДТ на протяжении всего эксперимента (21 сут) подтверждено стабильно высокой метаболической активностью клеток. Участие макроводоросли в биоремедиации, очевидно, обусловлено возможностью образовывать симбиотические ассоциации с углеводородокисляющими микроорганизмами.
В арктической зоне существует проблема хронического загрязнения прибрежных акваторий нефтепродуктами (НП). Это связано с увеличением объема транспортировки углеводородов от мест добычи на шельфе, со строительством на побережье предприятий по их перегрузке и переработке, а также с замедленными процессами деградации нефти и НП в условиях низких температур.
В литературе рассмотрены варианты решения проблемы ремедиации морской среды от НП с помощью диспергентов, сорбентов или путем размещения в зонах постоянного загрязнения искусственных рифов. К сожалению, диспергенты токсичны и наносят биоте бóльший вред, чем НП. Сорбенты в арктических морях сложны в использовании из-за частых штормов, а постоянные искусственные рифы осложняют мореплавание в прибрежной зоне. В последние годы высказывалось предположение о возможности применения для очистки моря от НП морских водорослей-макрофитов (Семенов и др., 2014; Пуговкин и др., 2016; Воскобойников и др., 2017; Wrabel, Peckol, 2000). Наиболее часто на морском транспорте используется дизельное топливо (ДТ). У макроводорослей Fucus vesiculosus (Phaeophyta) и Ulvaria obscura (Chlorophyta) выявлена сорбционная способность в отношении данного НП (Pilatti et al., 2016; Воскобойников и др., 2017, 2018). Экспериментально было показано, что уменьшение содержания ДТ в морской воде происходило одновременно с его накоплением в растениях. При этом в деструкции НП у ульварии и фукуса был задействован весь таллом; она начиналась на поверхности водоросли с помощью эпифитных углеводородокисляющих бактерий (УОБ), что обеспечивало поглощение и нейтрализацию НП клетками макрофитов (Воскобойников и др., 2017, 2018). Известно, что УОБ, образующие с водорослями-макрофитами взаимовыгодную симбиотическую ассоциацию, способны окислять почти все нефтепродукты (Atlas et al., 1978; Семенова и др., 2009). Эти сведения подтвердили высказанные ранее предположения о том, что водоросли не только служат субстратом для УОБ, но с их помощью могут осуществлять деструкцию НП, поглощать и включать в метаболизм компоненты НП (Семенов и др., 2014; Воскобойников и др., 2017, 2018).
Цель данного исследования − определить, обладают ли такой способностью водоросли, отличающиеся от изученных ранее систематической принадлежностью и морфологией. В настоящей работе проанализированы морфофункциональные изменения под влиянием НП у широко распространенной на литорали арктических морей красной водоросли Palmaria palmata (Linnaeus) F. Weber et D. Mohr, 1805 (Rhodophyta), а также определена ее роль в очистке морской среды от НП.
МАТЕРИАЛ И МЕТОДИКА
Вегетативные талломы Palmaria palmata, приблизительно равные по размеру и массе, отбирали на побережье губы Зеленецкая Баренцева моря (69°07′09″ с.ш., 36°05′35″ в.д.), очищали от обрастателей и помещали в стеклянные емкости с морской водой объемом 1.3 л.
Морскую воду соленостью 33‰ предварительно фильтровали через ватно-марлевый фильтр и добавляли в нее летнее ДТ в количестве 1 мг/л, что составляет 20 ПДК для воды по валовому содержанию НП. Морскую воду и ДТ не стерилизовали.
Опыт проводили в термостатируемом боксе при температуре 7–8°C, освещении 16–18 Вт/м2 и постоянной аэрации воды. Общая продолжительность эксперимента составила 21 сут. Каждые 7 сут образцы воды и водоросли отбирали и анализировали. У водоросли исследовали изменение морфологии и фотосинтеза; в воде и в талломах определяли содержание 17 индивидуальных алканов ДТ (включая изопреноиды пристан и фитан) и валовое содержание НП. В течение опыта изменение состояния и морфологии таллома пальмарии контролировали визуально и с помощью светооптических методов с использованием микроскопа МИКМЕД-6.
Интенсивность видимого фотосинтеза (ИФ) пальмарии определяли по изменению содержания кислорода в воде до и после инкубации талломов с помощью оксиметра HANNA HI 9141 (Германия) и йодометрическим методом Винклера. Интенсивность фотосинтеза рассчитывали в микрограммах О2 на 1 г сырой массы таллома в час (Вознесенский и др., 1965). Активность фермента каталазы (АК) анализировали с помощью спектрофотометрического метода (Королюк, 1988). Измерения проводили на спектрофотометре JENWAY 6305 UV/VIS.
Фотосинтетические пигменты экстрагировали по общепринятым методикам (Ли, 1978). Спектры поглощения экстрактов регистрировали спектрофотометрически; концентрации пигментов рассчитывали по формулам (Seely et al., 1972; Rosenberg, 1981).
Валовое содержание НП и концентрации алканов в воде и в талломах определяли методом газовой хроматографии/масс-спектрометрии (ГХ/МС).
Пробоподготовку и инструментальный анализ выполняли на основе методики ЕРА 8270 (Semivolatile Organic Compounds by GC/MS). Для подготовки проб воды применяли жидкостно-жидкостную экстракцию при нейтральном значении показателя кислотности среды. Образцы водоросли экстрагировали в ультразвуковой установке. Раствор внутреннего стандарта (2-фторнафталин) вводили в пробы воды и водоросли непосредственно перед экстракцией. Экстракты анализировали с использованием хроматомасс-спектрометра единичного разрешения DSQII фирмы “Thermo Finnigan” (Германия). Массовую долю содержания компонентов ДТ рассчитывали c помощью метода внутреннего стандарта. Результаты представлены в микрограммах на литр (мкг/л) для воды и в микрограммах на грамм (мкг/г) сухой массы для водорослей. При расчете концентрации учитывали коэффициент чувствительности масс-спектрометрического детектора в пáрах 2-фторнафталин/дейтерированный пентадекан (D32) и 2-фторнафталин/дейтерированный эйкозан (D42).
Для оценки фонового уровня НП анализировали пробы воды и P. palmata из губы Зеленецкая.
РЕЗУЛЬТАТЫ
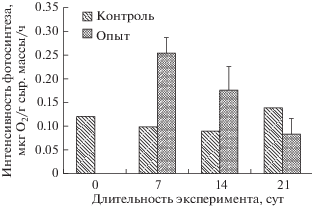
В течение эксперимента морфологических различий у контрольных и опытных растений не наблюдали. Интенсивность фотосинтеза (ИФ) у контрольных растений в течение всего эксперимента сохранялась приблизительно на одном уровне и составляла 0.09−0.13 мкг О2/г сыр. массы/ч. У опытных растений после 7 сут воздействия ДТ зарегистрировано значительное повышение ИФ, которая снижалась к 21 сут эксперимента (рис. 1). За время исследования концентрация хлорофилла a и каротиноидов у Palmaria palmata снизилась с 0.15 до 0.04 и с 0.05 до 0.01 мкг/г сыр. массы соответственно.
Рис. 1.
Изменение интенсивности фотосинтеза у Palmaria palmata в течение эксперимента. Вертикальные линии − границы стандартного отклонения.
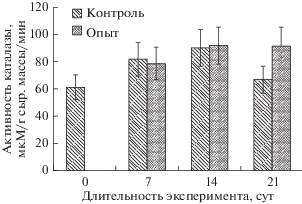
Активность каталазы у контрольных образцов пальмарии в течение опыта изменялась незначительно: отмечено ее постепенное повышение до 14 сут эксперимента, но на 21-е сут она снизилась до начального уровня. У опытных образцов активность каталазы не изменялась и была выше начального уровня (рис. 2).
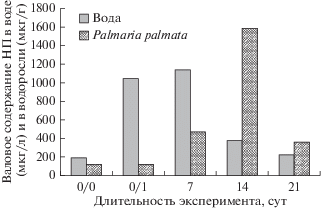
Валовое содержание НП в природной воде губы Зеленецкая составляло 192 мкг/л (около 4 ПДК), т.е. анализируемые нами водоросли обитали в слабо загрязненной НП среде. Качественный состав НП был представлен в основном н-алканами С11–С25, концентрация которых составляла 0.1−5.3 мкг/л. Углеводородная “гребенка” на хроматограммах при этом характеризовалась монотонным распределением гомологов. Дополнительно для выявления их генезиса использовали следующие соотношения: С17/С18, пристан/фитан (Pr/Ph), СРI (отношение нечетных к четным гомологам) в области C13–C22, а также показатель биогенности (С15 + С17)/2С16 (Немировская, 2013). Расчетные данные показали низкие значения (<1) соотношений С17/С18, Pr/Ph и СРI (C13–C22). После внесения в морскую воду 1 мг/л ДТ (0 сут, начало эксперимента) валовое содержание НП составило 1049 мкг/л, а сумма 17 алканов достигла 386 мкг/л. В присутствии пальмарии валовое содержание НП и сумма алканов в воде на 21-е сут эксперимента снизились в несколько раз по сравнению с таковыми в начале опыта и составили соответственно 226 и 35 мкг/л, что практически соответствует показателям контрольного образца до внесения ДТ (рис. 3).
Рис. 3.
Изменение валового содержания нефтепродуктов (НП) в воде и в Palmaria palmata в течение эксперимента. Длительность эксперимента, сут: 0/0 − образцы до внесения дизельного топлива (ДТ); 0/1 − начало эксперимента, внесение ДТ в воду; 7, 14 и 21 cут − время от начала эксперимента.
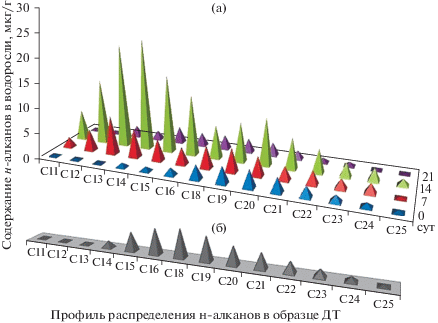
Результаты исследования индивидуальных соединений в образцах воды демонстрировали активный процесс трансформации алканов при увеличении времени. На хроматограммах наблюдалось постепенное смещение максимума углеводородного “горба” в сторону более “легких” соединений, а также увеличение относительного содержания разветвленных алканов (рис. 4). Результаты анализа также показали отсутствие в воде и в талломах окисленных структур (альдегидов, кетонов); это позволяет предположить, что деструкция внесенных НП происходила преимущественно за счет уменьшения длины алкильной цепочки.
Рис. 4.
Масс-хроматограммы проб воды на начальной 0 сут (а) и конечной 21 сут (б) стадиях эксперимента в режиме регистрации характеристичного для алканов иона.
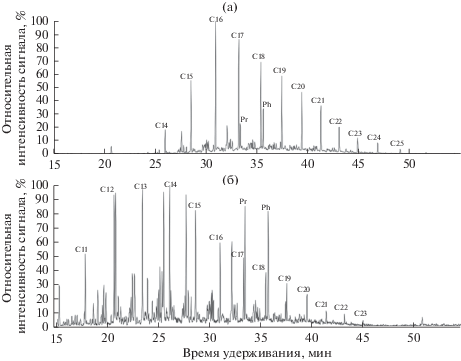
В контрольном образце водоросли (без внесения ДТ) валовое содержание НП составляло 124 мкг/г, а сумма 17 алканов не превышала 30 мкг/г. В эксперименте максимальные значения валового содержания НП и суммы алканов в водоросли отмечены на 14-е сут – 1586 и 249 мкг/г соответственно. На 21-е сут концентрации анализируемых показателей в P. palmata значительно снизились (рис. 3−5). Исключение составлял н-гептадекан, который, будучи эндогенным соединением, накапливался в тканях водоросли. В ходе эксперимента наряду с изменением концентрации н-алканов изменялся профиль их распределения (рис. 5; для сравнения отдельно приведен характерный профиль распределения алканов ДТ). Это может свидетельствовать не только о накоплении НП талломом водоросли, но и об их деструкции.
ОБСУЖДЕНИЕ
Обитание Palmaria palmata в природной среде (губа Зеленецкая) с незначительным загрязнением (4 ПДК), по-видимому, способствовало выработке у водоросли определенного диапазона толерантности к НП. Именно этим можно объяснить сохранение функциональной активности у пальмарии в течение всего эксперимента при концентрации НП 20 ПДК. При длительном пребывании (21 сут) водоросли под влиянием НП отмечено незначительное снижение фотосинтеза. У “контрольных” растений, которые росли в воде без добавления НП, интенсивность фотосинтеза к концу опыта повысилась, что свидетельствует о влиянии на их функциональное состояние именно НП. Аналогичный эффект наблюдался в опытах на ульварии (Воскобойников и др., 2018). Полученные результаты согласуются с опубликованными данными (Степаньян, 2008) о возможном стимулирующем действии низких концентраций ДТ на фотосинтез морских макрофитов. Повышение содержания кислорода в воде, отмеченное на 7-е сут опыта (рис. 1), по-видимому, обеспечивали и цианобактерии. Увеличение выделяемого ими кислорода в ответ на повышение в воде содержания НП наблюдали и ранее (Гусев и др., 1981).
В исследованиях, посвященных определению активности каталазы у водорослей-макрофитов, отмечено, что этот фермент реагирует на комплексное загрязнение, в том числе органикой (Мильчакова, Шахматова, 2007). Его активность выше в условиях загрязнения. В экспериментах на микроводорослях было показано, что каталаза реагирует на более высокие концентрации дизельного топлива в среде по сравнению с другими ферментами антиоксидантной системы, например, с супероксиддисмутазой (Ramadass et al., 2017).
Можно предположить, что используемая в эксперименте добавка ДТ вызывала окислительный стресс в клетках водорослей, что подтверждено повышением активности каталазы. Однако значительного усиления/подавления активности фермента не происходило, что также свидетельствует о толерантности пальмарии к содержанию НП в воде на уровне 20 ПДК. Синтез антиоксидантных ферментов находится в обратной зависимости от концентрации хлорофиллов. Такие данные получены для микроводорослей (Ramadass et al., 2017). В нашей работе под действием ДТ концентрации хлорофилла a и каротиноидов снизились в 3−4 раза по сравнению с контролем. Это может свидетельствовать о более активной выработке антиоксидантных ферментов, в частности супероксиддисмутазы, у растений в опыте.
Установлено, что у пальмарии, так же как у фукуса и ульварии (Воскобойников и др., 2017, 2018), накопление НП происходило одновременно с уменьшением их содержания в воде (рис. 3). Проведенный качественный анализ выявленных НП в морской воде показал преимущественно нефтяной источник поступления алканов. Можно предположить, что превышение ПДК по содержанию НП в воде в губе Зеленецкая связано с работой в июле−августе маломерного флота, используемого дайвинг-клубом, расположенным на побережье губы. Однако было показано, что часть алканов имеет биогенную природу. Анализ углеводородов, содержавшихся в пальмарии, указал на нефтяное происхождение алканов, сорбированных водорослью из водной среды. Выявленный н-гептадекан (С17), по-видимому, продуцируется самой водорослью (Миронов, 1985; Немировская, 2013). Повышенное содержание н-С17 типично для природных сред с автохтонным (морским) биогенным составом углеводородов (Немировская, 2013).
Таким образом, в эксперименте P. palmata продемонстрировала выраженную способность к постепенной очистке воды от внесенных НП. В условиях умеренного загрязнения нефтепродуктами пальмария сохраняла физиологическую активность, проявляла выраженную способность к сорбции и деструкции НП. При этом уменьшение содержания компонентов ДТ в воде происходило одновременно с их накоплением в талломах водоросли. В деструкции ДТ у пальмарии, как и у исследованных ранее водорослей (ульварии и фукуса), по-видимому, задействован весь таллом. Она начинается на поверхности водоросли с помощью эпифитных УОБ, что обеспечивает поглощение и нейтрализацию НП клетками растения. Об этом свидетельствовала стабильная метаболическая активность клеток Р. palmata под влиянием ДТ в течение всего эксперимента (21 сут). Данное предположение подтверждено увеличением численности эпифитных УОБ на поверхности нескольких видов водорослей в условиях загрязнения НП среды обитания (Пуговкин и др., 2016; Воскобойников и др., 2017). Результаты проведенного исследования и полученные ранее данные позволяют говорить о способности большой группы макроводорослей к очистке морской среды от НП независимо от строения и систематической принадлежности водорослей. Предполагается, что основным фактором участия макроводорослей в биоремедиации является возможность образовывать симбиотические ассоциации с углеводородокисляющими микроорганизмами.
Список литературы
Вознесенский В.Л., Заленский О.В., Семихатова О.А. Методы исследования фотосинтеза и дыхания растений. Л.: Наука. 1965. 305 с.
Воскобойников Г.М., Ильинский В.В., Лопушанская Е.М. и др. Санитарная водорослевая плантация для очистки прибрежных акваторий от нефтепродуктов: от теории к практике // Вопр. соврем. альгологии. 2017. № 3 (15). http://algology.ru/1184
Воскобойников Г.М., Матишов Г.Г., Метелькова Л.O. и др. Об участии зеленой водоросли Ulvaria obscura в биоремедиации морской среды от нефтепродуктов // Докл. РАН. 2018. Т. 481. № 1. С. 139−141.
Гусев М.В., Коронелли Т.В., Линькова М.А., Ильинский В.В. Изучение ассоциации цианобактерий и нефтеокисляющих бактерий в условиях нефтяного загрязнения // Микробиология. 1981. Т. 50. № 6. С. 1092−1097.
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы // Лаб. дело. 1988. № 1. С. 16−19.
Ли Б.Д. Разделение, идентификация и количественное определение фотосинтетических пигментов макробентосных водорослей // Экологические аспекты фотосинтеза морских макроводорослей. Владивосток: Изд-во ДВНЦ АН СССР. 1978. С. 38−54.
Мильчакова Н.А., Шахматова О.А. Каталазная активность наиболее массовых видов черноморских водорослей-макрофитов в градиенте хозяйственно-бытового загрязнения // Мор. экол. журн. 2007. Т. 6. № 2. С. 44−57.
Миронов О.Г. Взаимодействие организмов с нефтяными углеводородами. Л.: Гидрометеоиздат. 1985. 127 с.
Немировская И.А. Нефть в океане (загрязнение и природные потоки). М.: Научный мир. 2013. 432 с.
Пуговкин Д.В., Ляймер А.В., Йенсен Дж.Б. Эпифитные бактериальные сообщества водорослей Fucus vesiculosus в разных по степени загрязнения нефтепродуктами акваториях Баренцева моря // Докл. РАН. 2016. Т. 471. № 3. С. 371−373.
Семенов А.М., Федоренко В.Н., Семенова Е.В. Микроорганизмы на поверхности морских макрофитов в северных морях России и их возможное практическое использование // Биосфера. 2014. Т. 6. № 1. С. 60−76.
Семенова Е.В., Семенов А.М., Иванов М.Н. и др. Роль микроорганизмов – эпифитов фукусовых водорослей в деградации углеводородных загрязнений акваторий северных морей // Экология и пром-ть. 2009. № 3. С. 16–18.
Степаньян О.В. Влияние сырой нефти на основные функциональные параметры макроводорослей Баренцева моря // Биол. моря. 2008. Т. 34. № 2. С. 144–147.
Atlas R.M., Horowitz A., Busdosh M. Prudhoe crude oil in Arctic marine ice, water and sediment ecosystems: Degradation and interaction with microbial and benthic communities // J. Fish. Res. Board Can. 1978. V. 35. № 5. P. 585−590.
Pilatti F.K., Ramlo F., Schmidt E.C. et al. In vitro exposure of Ulva lactuca Linnaeus (Chlorophyta) to gasoline − Biochemical and morphological alterations // Chemosphere. 2016. № 156. P. 428–437.
Ramadass K., Megharaj M., Venkateswarlu K., Naidu R. Toxicity of diesel water accommodated fraction toward microalgae, Pseudokirchneriella subcapitata and Chlorella sp. MM3 // Ecotoxicol. Environ. Saf. 2017. V. 142. P. 538−543. https://doi.org/10.1016/j.ecoenv.2017.04.052
Rosenberg G. Ecological growth strategies in the seaweeds Gracilaria folifera (Rhodopyceae) and Ulva sp. (Chlorophyceae) // PhD Thesis, New Haven, Connecticut: Yale University. 1981. 163 p.
Seely G.R., Duncan M.J., Vidaver W.E. Preparation and analytical extraction of pigments from brown algae with dimethyl sulfoxide // Mar. Biol. 1972. V. 12. P. 184–188.
Wrabel M.L., Peckol P. Effects of bioremediation on toxicity and chemical composition of № 2 fuel oil: growth responses of the brown alga Fucus vesiculosus // Mar. Pollut. Bull. 2000. V. 40. № 2. P. 135–139.
Дополнительные материалы отсутствуют.