Биология моря, 2020, T. 46, № 2, стр. 126-134
Влияние света разного спектрального состава на фотосинтетические характеристики С-фикоцианинсодержащей цианобактерии Synechococcus sp. WH5701
Т. В. Ефимова 1, *, Т. Я. Чурилова 1, В. С. Муханов 1
1 Институт биологии южных морей имени А.О. Ковалевского РАН
299011 Севастополь, Россия
* E-mail: tatyana-iefimova@yandex.ru
Поступила в редакцию 12.03.2019
После доработки 09.07.2019
Принята к публикации 03.10.2019
Аннотация
Объемы клеток штамма цианобактерии Synechococcus sp. WH5701, а также внутриклеточное содержание хлорофилла а и С-фикоцианина не зависели от спектрального состава света. Удельные (нормированные на содержание хлорофилла а) показатели поглощения света пигментами на длинах волн 438 и 678 нм у клеток, адаптированных к синему свету, были выше, чем у клеток, адаптированных к белому свету, на 20 и 50% соответственно. Установлена зависимость квантового выхода и скорости роста клеток Synechococcus sp. WH5701 от спектрального состава света. Максимальный квантовый выход роста был наименьшим при адаптации к синему свету и наибольшим при адаптации к красному свету. Выявлена обратная связь между удельным поглощением света пигментами клеток и квантовым выходом роста, обусловленная тем, что у цианобактерий в отличие от эукариотических микроводорослей фотосинтез и рост зависят от квантов, поглощенных только фикобилиновыми пигментами, а не всеми пигментами. Это связано с особенностью строения и функционирования фотосинтетического аппарата цианобактерий.
Цианобактерии обладают способностью к комплементарной хроматической адаптации (КХА), которая заключается в увеличении в клетках водорослей количества фикобилипротеинов (ФБП), полоса поглощения которых совпадает со спектром света в среде, и в уменьшении количества ФБП, не поглощающих свет в заданном волновом диапазоне (Kirk, 2011). По современной классификации различают четыре группы цианобактерий в зависимости от изменений в пигментном составе при адаптации к свету разного спектрального состава (СРСС) (Everroad et al., 2006). В первую группу входят цианобактерии, не обладающие способностью к КХА – это цианобактерии, фикобилисомы (ФБС) которых содержат С-фикоцианин (ФЦ), но не содержат С-фикоэритрин (ФЭ), и некоторые ФЭ-содержащие цианобактерии. Ко второй группе относят цианобактерии, у которых при адаптации к зеленому свету увеличивается доля ФЭ в ФБС, а количество ФЦ не изменяется. В третью группу объединены цианобактерии, у которых увеличивается доля ФЭ в ФБС при адаптации к зеленому свету или доля ФЦ при адаптации к красному свету. Цианобактерии четвертой группы способны изменять отношение между хромофорами фикоэритробилином (ФЭБ) и фикоуробилином (ФУБ) в ФЭ в зависимости от спектрального состава света (Everroad et al., 2006).
В Мировом океане пикоцианобактерии Synechococcus spp. встречаются почти повсеместно и являются доминирующими фотоавтотрофами, на долю которых приходится значительная часть первичной продукции (Waterbury et al., 1986). Штаммы Synechococcus spp. по составу ФБП разделяют на три основных типа (Six et al., 2007). Представители типа 1 содержат только ФЦ (не способны к КХА), а пигментный комплекс видов, отнесенных к типам 2 и 3, включает ФЦ и ФЭ. В олиготрофных водах океана в нижнюю часть освещенного слоя проникает в основном синяя часть видимого излучения. В этих световых условиях в большом количестве развиваются ФЭ-содержащие штаммы Synechococcus, содержащие в основном ФУБ. В мезотрофных и прибрежных водах с преимущественным проникновением сине-зеленого и зеленого света доминируют штаммы, содержащие в основном ФЭБ (Waterbury et al., 1986; Six et al., 2004). Штаммы Synechococcus типа 1 (ФЦ-содержащие) доминируют в мутных поверхностных водах и/или в акваториях, подверженных влиянию стока рек (Uysal, 2000; Jiang et al., 2016; Xia et al., 2017), что, вероятно, связано с влиянием спектрального состава света. В отличие от прозрачных вод, в нижнюю часть освещенного слоя которых проникает синий или сине-зеленый свет, в более мутные водоемы проникает красное излучение (~600 нм), комплементарное полосе поглощения ФЦ. Из-за низкой прозрачности таких вод и более интенсивного поглощения света взвешенным и растворенным органическим веществом в коротковолновой части спектра (Kirk, 2011) фитопланктон уже в подповерхностном слое существует при доминирующем красном излучении.
В прибрежные воды Мирового океана в связи с изменением климата и усилением антропогенного воздействия увеличивается поступление взвешенного и растворенного неорганического и органического вещества терригенной природы (Oguz, 2008; Патин, 2015). Вследствие этого повышается их трофность и снижается прозрачность, соответственно, изменяется спектральный состав света (максимум проникающего излучения смещается в более длинноволновую область). Такие изменения в среде могут приводить к изменению видового состава фитопланктона и “цветению” воды, вызванному развитием нетипичных видов. В условиях высокой трофности/мутности часто наблюдается “цветение” ФЦ-содержащих цианобактерий (Александров и др., 2012; Карабашев, Евдошенко, 2015). Для понимания и прогнозирования последствий повышения мутности прибрежных вод на уровне первично-продукционного звена необходимы сведения о фотосинтетических и ростовых характеристиках ФЦ-содержащих цианобактерий.
В связи с этим определена цель настоящей работы – изучение влияния света разного спектрального состава (синего, зеленого, красного, белого) на фотосинтетические характеристики С-фикоцианинсодержащей цианобактерии Synechococcus sp. WH5701, по составу ФБП относящейся к типу 1 (Six et al., 2007).
МАТЕРИАЛ И МЕТОДИКА
Объектом исследования послужил С-фикоцианинсодержащий штамм морской цианобактерии Synechococcus sp. WH5701, полученный из коллекции Отдела экологической физиологии водорослей ФГБУН ФИЦ Института биологии южных морей имени А.О. Ковалевского РАН.
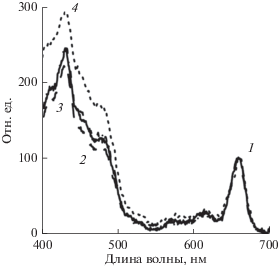
Synechococcus sp. WH5701 выращивали на питательной среде f/2 (Andersen, 2005) при температуре 18–20°С и постоянном освещении, используя лампы дневного света ЛДЦ-30 (Айзенберг, 1995) и цветные фильтры (красный, зеленый, синий) (рис. 1). Культуру Synechococcus sp. WH5701 адаптировали к СРСС с одинаковым количеством квантов света, поглощенных пигментами клеток в расчете на единичную концентрацию хлорофилла а (Хл а) (PUR*). В экспериментах использовали PUR*, равную 0.050 мкмоль фотонов/(мг Хл а с). Такое количество квантов должно поглощаться клетками при облучении белым светом с плотностью потока квантов 3 мкмоль/(м2 с). Выбор данной плотности светового потока обусловлен тем, что на участке лимитирующих интенсивностей света скорость роста и фотосинтеза зависит только от скорости световых реакций. В условиях светового лимитирования все физиологические процессы в клетках микроводорослей направлены на повышение способности клеток поглощать кванты энергии и на увеличение квантовой эффективности использования поглощенной энергии в процессе синтеза органического вещества. В условиях светового лимитирования квантовый выход роста является максимальным и характеризует способность клеток использовать поглощенные кванты света на рост. При этом необходимо иметь в виду, что квантовый выход роста при интенсивности света выше насыщающей будет зависеть от максимального (потенциального) квантового выхода и величины облученности. Таким образом, различия в квантовой эффективности роста можно выявить только при освещенности ниже насыщающей.
Рис. 1.
Спектральная характеристика источников освещения. 1 – белый свет, 2 – красный свет, 3 – зеленый свет, 4 – синий свет.

Световые условия измеряли непосредственно в экспериментальной емкости с помощью лабораторного квантометра QSL2101 (Biospherical Instruments Inc) с погружным сенсором сферической формы (4π). Адаптацию клеток считали завершенной, когда внутриклеточное содержание пигментов переставало изменяться и выходило на постоянный уровень (“плато”).
Численность клеток Synechococcus sp., их линейный размер и содержание Хл а (Ca) в клетках определяли с помощью проточного цитометра “CytomicsTMFC 500” (Beckman Coulter, США), оборудованного 488-нанометровым однофазным аргоновым лазером, и программного обеспечения CXP. Качество измерений контролировали с помощью калибровочных флуоросфер “Flow-CheckTM” (Beckman Coulter) с известными размерами и концентрацией в пробе. Цитометрические данные обрабатывали с помощью программы “Flowing Software v. 2.5.0” (Perttu Terho, Turku Centre for Biotechnology, University of Turku, Finland, www.flowingsoftware.com).
Концентрацию клеток (N) определяли в неокрашенных пробах с помощью выделения популяции клеток на 2-параметрических цитограммах показателя рассеяния света клетками вперед (FS) и измерения автофлуоресценции Хл а (FL4) в красной (675 нм) области спектра. Концентрацию клеток рассчитывали по скорости протока пробы и количеству клеток (более 10 тыс. клеток), зарегистрированных в определенный промежуток времени.
Скорость деления клеток рассчитывали по общепринятой формуле Андерсена (Andersen, 2005):
Линейный размер клеток (L, мкм) оценивали на основе данных канала FS как величину диаметра эквивалентной сферы (ДЭС), объем которой равен объему клетки независимо от ее морфологии.
Ca и содержание суммарных каротиноидов (КР) в клетках определяли спектрофотометрическим методом (Strickland, Parsons, 1972; ГОСТ 17.1.4.02-90).
Спектры показателей поглощения света пигментами культуры измеряли по методике “количественного определения на увлажненных фильтрах” (Mitchell, Kiefer, 1988). Клетки Synechococcus sp. WH5701 собирали на стекловолокнистые фильтры (Whatman GF/F) путем фильтрации аликвоты культуры при вакууме не более 0.2 атм. Оптические измерения проводили на двулучевом спектрофотометре “Specord UV-VIS” (Karl Zeiss Jena, ГДР) при длине волны 400–750 нм. Общее поглощение света взвешенным веществом (ap(λ)) разделяли на поглощение света пигментами клеток (aph(λ)) и обесцвеченными клетками (aNAP(λ)) (Tassan, Ferrari, 1995). Была выполнена поправка (β-коррекция) на изменение показателей поглощения света при концентрации взвеси на фильтре по сравнению с показателями для частиц во взвешенном состоянии (Moore et al., 1995).
Квантовый выход роста (ϕ) определяли на основе µ и PUR* по формуле (Nielsen, 1993):
Величину С рассчитывали по формуле (Menden-Deuer, Lessard, 2000): C = 0.216V0.939, где V – объем клеток.
Величину PUR* рассчитывали по формуле: PUR* = $a_{{{{{\text{рh}}} \mathord{\left/ {\vphantom {{{\text{рh}}} {{\text{chl}}}}} \right. \kern-0em} {{\text{chl}}}}}}^{*} \times {\text{PAR}}$, где $a_{{{{{\text{рh}}} \mathord{\left/ {\vphantom {{{\text{рh}}} {{\text{chl}}}}} \right. \kern-0em} {{\text{chl}}}}}}^{*}$ – эффективность поглощения света пигментами микроводорослей в расчете на единичную концентрацию Хл а, м2/мг Хл а; PAR –фотосинтетически активная радиация, мкмоль/(м2 с). Параметр $a_{{{{{\text{рh}}} \mathord{\left/ {\vphantom {{{\text{рh}}} {{\text{chl}}}}} \right. \kern-0em} {{\text{chl}}}}}}^{*}$, учитывающий спектральные характеристики фотосинтетически активной радиации в диапазоне длин волн (λ) от 400 до 700 нм (E(λ)), а также величину удельного [нормированного на содержание Хл а (Ca)] показателя поглощения света пигментами фитопланктона (aph/chl(λ)), рассчитан по формуле:
РЕЗУЛЬТАТЫ
На цитограмме штамма Synechococcus sp. WH5701 (рис. 2) кластер имеет вытянутую форму, что, вероятно, связано с присутствием в культуре как одиночных клеток, так и групп преимущественно парных клеток. Кластер, представленный одиночными клетками, можно условно выделить в область данных R-1, а кластер парных клеток – в область данных R-2 (рис. 2). Анализ численности клеток для областей данных R-1 и R-2 проводили отдельно. Причем значения, полученные для кластера R-2, удваивали для оценки общего количества одиночных клеток и скорости их деления. Отмечено однотипное изменение концентрации одиночных и удвоенных клеток в зависимости от условий адаптации (рис. 3).
Рис. 2.
Зависимость автофлуоресценции хлорофилла а (FL4) в красной области спектра (675 нм) от светорассеяния вперед (FS) клетками цианобактерии Synechococcus sp. WH5701, адаптированной к белому свету. Выделенные области данных R-1 и R-2 соответствуют одиночным и парными клеткам.
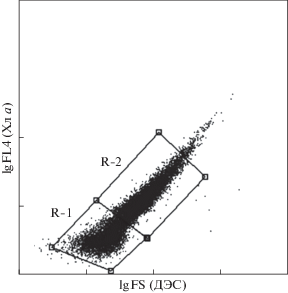
Рис. 3.
Динамика концентрации клеток (N) в культуре Synechococcus sp. WH5701 (на 4–6-е сут хроматической адаптации) при свете разного спектрального состава. 1 – белый свет, 2 – красный свет, 3 – синий свет, 4 – зеленый свет.

Максимальная величина µ зарегистрирована при адаптации к красному свету, комплементарному полосе поглощения вспомогательного пигмента С-фикоцианина. При красном свете µ была приблизительно на 30% больше, чем при белом (табл. 1). Медленнее всего клетки росли при синем свете: величина µ была на 40–50% меньше значений, полученных при белом свете. При зеленом свете клетки делились со скоростью, незначительно отличающейся от µ, отмеченной при белом свете (табл. 1).
Таблица 1.
Скорость деления клеток (µ, число делений/сутки) цианобактерии Synechococcus sp. WH5701 при адаптации к свету разного спектрального состава
| Длительность адаптации, сут | Свет | |||
|---|---|---|---|---|
| белый | красный | синий | зеленый | |
| Область данных R-1 | ||||
| 5 | 1.0 ± 0.1 | 1.3 ± 0.1 | 0.5 ± 0.05 | 1.0 ± 0.1 |
| 6 | 0.4 ± 0.04 | 0.6 ± 0.1 | 0.1 ± 0.01 | 0.2 ± 0.02 |
| Область данных R-2 | ||||
| 5 | 0.2 ± 0.02 | 0.3 ± 0.03 | 0 | 0.2 ± 0.02 |
| 6 | 0.1 ± 0.01 | 0.2 ± 0.02 | 0 | 0 |
Несмотря на различия в скорости роста, зависимости внутриклеточного Ca от СРСС не наблюдалось. Так, величина оцениваемого по уровню автофлуоресценции внутриклеточного Ca на 6-е сут адаптации в среднем составляла 36 ± 2 отн. ед. (рис. 4). При этом внутриклеточное Ca, определенное спектрофотометрическим методом, составляло (4.2 ± 0.31) × 10–14 г/кл. В отличие от внутриклеточного Ca, содержание каротиноидов (КР) в клетках изменялось в зависимости от СРСС. Концентрация КР в клетках, адаптированных к белому, красному и зеленому свету, составляла (1.8 ± 0.14) × 10–14 г/кл, что практически в 2 раза меньше величин, полученных при адаптации к синему свету (3.1 × 10–14 г/кл).
Рис. 4.
Динамика содержания хлорофилла а (Хл а) (в относительных единицах автофлуоресценции, отн. ед.) в клетках Synechococcus sp. WH5701 при адаптации к свету разного спектрального состава. 1 – белый свет, 2 – красный свет, 3 – синий свет, 4 – зеленый свет.

Изменение внутриклеточного содержания пигментов проявилось на спектрах оптической плотности (OD) ацетоновых экстрактов пигментов, нормированных на величину OD на длине волны 664 нм, соответствующей полосе поглощения света Хл а (рис. 5). Величина отношения OD на длинах волн ~430 и 664 нм, соответствующих максимумам спектра (Rac), увеличилась на 20% при адаптации клеток к синему свету по сравнению с таковой при адаптации к белому свету (рис. 5). Величина Rac отражает изменение соотношения между количеством Хл а и КР, так как пик на длине волны ~430 нм связан с поглощением света Хл а и КР, а пик на длине волны 664 нм – лишь Хл а.
Рис. 5.
Спектры поглощения света пигментами культуры Synechococcus sp. WH5701 в ацетоновом экстракте (OD(λ)), нормированные к OD(λ) на 664 нм (OD(664)), при адаптации к свету разного спектрального состава. Обозначения, как на рис. 1.
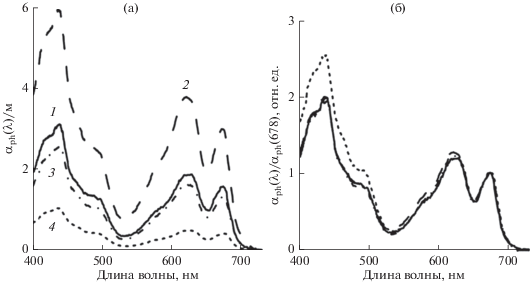
Объемы клеток не изменялись и составляли 1.3 ± ± 0.081 мкм3. Рассчитанное на основании объема клеток содержание углерода составляло (2.7 ± ± 0.093) × 10–13 г/кл. Таким образом, отношение С/Хл а в клетках, адаптированных к разному спектральному составу света, составляло 6.5 ± 0.44, что соответствует значениям, полученным для адаптированных к темноте клеток (Finenko et al., 2003). Однако светопоглощающие характеристики Synechococcus sp. различались. Так, для клеток, адаптированных к красному свету, были получены наибольшие показатели поглощения света пигментами (aph(λ)), а для клеток, адаптированных к синему свету, – наименьшие (рис. 6а). Для клеток, адаптированных к зеленому и белому свету, получены приблизительно одинаковые величины aph(λ) – промежуточные между значениями, полученными при адаптации к красному и синему свету.
Рис. 6.
Спектры поглощения света пигментами (aph(λ)) Synechococcus sp. WH5701: а – при адаптации к свету разного спектрального состава; б – нормированные на поглощение света на длине волны 678 нм (aph(λ)/aph(678)). Обозначения, как на рис. 1.
При этом концентрация Хл а в культуре клеток, адаптированных к красному свету, составляла 190 мг/м3, к синему – 20 мг/м3, к зеленому – 67 мг/м3, к белому – 95 мг/м3. В результате для клеток, адаптированных к синему свету, были получены наибольшие значения арh/chl(λ) на длинах волн ~438, 620 и 678 нм, соответствующих основным пикам поглощения света пигментами КР (438 нм), ФЦ (620 нм) и Хл а (678 нм), по сравнению с клетками, адаптированными к свету другого спектрального состава (табл. 2). При этом фактическая величина PUR* [мкмоль фотонов/(мг Хл а с)] для белого света составила 0.039, для зеленого – 0.044, для красного – 0.036 и для синего – 0.073. Таким образом, величина ϕ при адаптации Synechococcus sp. WH5701 к синему свету была наименьшей (0.012 моль С/моль квантов), а при адаптации клеток к красном свету – наибольшей (0.11 моль С/моль квантов). При адаптации этой цианобактерии к зеленому и белому свету величина ϕ составляла 0.025 и 0.059 моль С/моль квантов соответственно.
Таблица 2.
Показатели поглощения света пигментами цианобактерии Synechococcus sp. WH5701, нормированные на содержание хлорофилла а (Хл а), при адаптации к свету разного спектрального состава
| Параметр | Свет | |||
|---|---|---|---|---|
| белый | красный | синий | зеленый | |
| арh/chl(438), м2/мг Хл а | 0.033 ± 0.003 | 0.031 ± 0.002 | 0.052 ± 0.005 | 0.035 ± 0.003 |
| арh/chl(678), м2/мг Хл а | 0.017 ± 0.002 | 0.016 ± 0.002 | 0.020 ± 0.002 | 0.018 ± 0.002 |
| арh(438)/арh(678) | 2.0 ± 0.2 | 2.0 ± 0.1 | 2.6 ± 0.2 | 2.0 ± 0.1 |
| арh/chl(620), м2/мг Хл а | 0.020 ± 0.002 | 0.020 ± 0.002 | 0.024 ± 0.002 | 0.022 ± 0.002 |
| арh(620)/арh(678) | 1.2 ± 0.1 | 1.3 ± 0.1 | 1.2 ± 0.1 | 1.2 ± 0.1 |
Чтобы оценить изменение формы спектров в результате адаптации к СРСС, спектры арh(λ) были нормированы на величину показателя на длине волны 678 нм (aph(λ)/aph(678)) (рис. 6б). В качестве показателей формы спектра можно рассматривать соотношение на отдельных длинах волн. Соотношение показателей поглощения света в синем и красном максимумах спектра aph(438)/aph(678) при белом, зеленом и красном свете в среднем составляло 2.0, а при синем свете – 2.6, что связано с увеличением внутриклеточного содержания КР при синем освещении (табл. 2). В пиках, соответствующих поглощению света ФЦ и Хл а, соотношение показателей поглощения света (aph(620)/aph(678)) составляло 1.2, что отражает неизменность содержания ФЦ в клетках. Таким образом, отмечено увеличение внутриклеточного содержания КР при адаптации к синему свету при отсутствии влияния СРСС на содержание ФЦ.
ОБСУЖДЕНИЕ
В результате проведенного исследования установлено, что штамм цианобактерии Synechococcus sp. WH5701 быстрее рос при красном свете, комплементарном полосе поглощения ФЦ, и медленнее при синем свете, который не поглощается ФЦ, несмотря на увеличение концентрации КР в клетках при адаптации к синему свету. Следует отметить, что литературные данные по влиянию СРСС на скорость роста ФЦ-содержащих цианобактерий неоднозначны. Так, в экспериментах с пресноводными Oscillatoria bourrellyi (Ojala, 1993) и Synechocystis sp. (Hauschild et al., 1991) величина µ не зависела от СРСС. Более низкие значения µ при адаптации к синему свету, чем при адаптации к белому, были получены для Oscillatoria agardhii (см.: Millie et al., 1990). В опытах на культуре Synechococcus leopoliensis получены минимальные значения µ при освещении зеленым светом (Hauschild et al., 1991). В нашем исследовании показано, что скорость роста цианобактерий зависела от спектральных условий освещения. Отмеченное нами влияние спектрального состава света на скорость роста Synechococcus sp. WH5701 согласуется с результатами ранее проведенного исследования (Hauschild et al., 1991), в котором показано, что скорость роста клеток морского штамма Synechococcus sp. WH5701 снижалась при зеленом свете и увеличивалась при красном свете.
Скорость роста клеток пропорциональна Ca в клетках, удельному показателю поглощения света арh/chl(λ) и максимальному квантовому выходу роста (Kirk, 2011). В эксперименте величина арh/chl(λ) увеличилась примерно на 50% при выращивании культуры при синем свете по сравнению с таковой культуры, содержавшейся при белом свете, но скорость роста при этом изменялась в обратном направлении (табл. 2). Следовательно, отмеченное увеличение (уменьшение) скорости роста клеток Synechococcus sp. WH5701 обусловлено увеличением (уменьшением) квантового выхода роста клеток. Причем степень изменчивости квантового выхода превышала степень изменчивости арh/chl(λ), это и обусловило изменение скорости роста клеток. Следует отметить, что в условиях светового лимитирования величина квантового выхода максимальна (MacIntyre et al., 2002).
В настоящем исследовании отмечено снижение ϕ с 0.11 моль С/моль квантов при красном свете до 0.012 моль С/моль квантов при синем свете. Это связано с тем, что в спектральной области, где большая часть падающего света поглощается ФЦ (красный свет), энергия возбуждения используется на фотосинтез и скорость роста с наибольшим квантовым выходом, который снижается с уменьшением доли поглощения света ФЦ в общем поглощении света всеми пигментами (от белого к синему свету) (рис. 7).
Рис. 7.
Спектры поглощения квантов света пигментами Synechococcus sp. WH5701 при адаптации к свету разного спектрального состава. Обозначения, как на рис. 1.

Полученные результаты согласуются с литературными данными о влиянии типа пигмента (ФЭ или ФЦ) на избирательность Synechococcus к качеству света (Stomp et al., 2004). При выращивании в хемостате смеси штаммов цианобактерий Synechococcus с разным набором пигментов фикобилинов результат конкуренции определялся спектральным составом используемого света: при освещении красным светом доминировал штамм с ФЦ, зеленым – штамм с ФЭ, а при освещении белым светом эти штаммы росли примерно с одинаковой скоростью (Stomp et al., 2004).
Изменение скорости роста клеток С-фикоцианинсодержащего штамма Synechococcus sp. WH5701 в зависимости от спектральных условий освещения связано с особенностью строения и функционирования фотосинтетического аппарата цианобактерий. Известно, что в растительных клетках ФС II, окисляя воду, поставляет электроны в электрон-транспортную цепь хлоропласта, откуда они затем используются ФС I. Каждая ФС включает внутренние (коровые) и внешние светособирающие комплексы (ССК), а также фотохимический реакционный центр (РЦ) (Kirk, 2011). ССК высших растений и водорослей (эукариотов) расположены в мембранах тилакоидов и содержат ХЛ и КР. Внешние антенны поглощают кванты света и передают энергию возбуждения к внутренним кор-комплексам, которые затем передают ее специальным хлорофиллам РЦ, непосредственно включенным в фотосинтетический транспорт электронов. У цианобактерий в отличие от эукариотов весь Хл а сосредоточен в кор-комплексах (Golbeck, 1994), а роль основного светосборщика выполняют ФБС, примыкающие к комплексам ФС и находящиеся на поверхности тилакоидной мембраны. Общее число ФБС хромофоров в несколько раз превышает количество молекул Хл.
В настоящем исследовании при выращивании клеток цианобактерии при синем свете фикобилиновые пигменты не участвовали в его поглощении. В диапазоне синего излучения (рис. 6) доступные кванты света поглощались КР и хлорофиллами. В связи с тем, что у ФБП-содержащих водорослей Хл а сосредоточен в основном в фотосистеме ФС I (Стадничук и др., 2015), а фикобилины являются светособирающими пигментами для обеих фотосистем (Rakhimberdieva et al., 2001), на синем свету, где фикобилины не работают, возникает дефицит энергии, передаваемой на реакционный центр ФС II. В результате этого уменьшается линейный транспорт электронов от ФС II к ФС I, что лимитирует эффективность использования поглощенных синих квантов в фотосинтезе и росте цианобактерий, и, как следствие, приводит к снижению квантового выхода при синем свете. Ранее было показано, что квантовый выход фотосинтеза ФЭ- и ФЦ-содержащих цианобактерий WH7803 и WH5701 снижался на свету, поглощаемом только ФС I (<525 нм, >625 нм) (Lewis et al., 1986). Это видно по спектрам действия фотосинтеза [спектры, полученные в результате умножения aph(λ) на квантовый выход фотосинтеза] цианобактерий WH7803 и WH5701, отражающим слабую или полностью отсутствующую фотосинтетическую активность Хл а, несмотря на поглощение света Хл а (Lewis et al., 1986).
Таким образом, в результате проведенных исследований установлена зависимость квантового выхода и скорости роста клеток Synechococcus sp. WH5701 от спектрального состава света. Выявлена обратная связь между удельным поглощением света пигментами клеток и квантовым выходом роста, обусловленная тем, что у цианобактерий в отличие от эукариотических микроводорослей фотосинтез и рост зависят от квантов, поглощенных только фикобилиновыми пигментами, а не от общего количества квантов, поглощенных всеми пигментами. Это связано с особенностью строения и функционирования фотосинтетического аппарата цианобактерий. Низкая эффективность использования ФЦ-содержащими цианобактериями при фотосинтезе квантов синего света, недоступных для поглощения ФЦ, возможно, определяет их слабую конкурентную способность к росту в воде с преимущественным проникновением синего или сине-зеленого излучения.
Список литературы
Айзенберг Ю.Б. Справочная книга по светотехнике / 2-е изд., перераб. и доп. М.: Энергоатомиздат. 1995. 526 с.
Александров Б.Г., Теренько Л.М., Нестерова Д.А. Первый случай “цветения” воды в Черном море водорослью Nodularia spumigena Mert. ex Bornet et Flahault (Cyanoprokaryota) // Альгология. 2012. Т. 22. Вып. 2. С. 152–165.
ГОСТ 17.1.4.02-90. Вода. Методика спектрофотометрического определения хлорофилла а. M.: ИПК Издательство стандартов. 1999. 14 с.
Карабашев Г.С., Евдошенко М.А. Спектральные признаки цветения цианобактерий в Балтийском море по данным сканера MODIS // Соврем. пробл. дистанционного зондирования Земли из космоса. 2015. Т. 12. Вып. 3. С. 158–170.
Патин С.А. Антропогенное воздействие на морские экосистемы и биоресурсы: источники, последствия, проблемы // Тр. ВНИРО. 2015. Т. 154. С. 85–104.
Стадничук И.Н., Красильников П.М., Зленко Д.В. Фикобилисомы и фикобилипротеины цианобактерий // Микробиология. 2015. Т. 84. Вып. 2. С. 131–143.
Andersen R.A. Algal culturing techniques. Burlington, Mass.: Elsevier Academic Press. 2005. 578 p.
Everroad C., Six C., Partensky F. et al. Biochemical bases of type IV chromatic adaptation in marine Synechococcus spp. // J. Bacteriol. 2006. V. 188. P. 3345–3356.
Finenko Z.Z., Hoepffner N., Williams R., Piontkovski S.A. Phytoplankton carbon to chlorophyll a ratio: response to light, temperature and nutrient limitation // Morsk. Ekol. Zh. 2003. T. 2. № 2. C. 40–64.
Golbeck J.H. Photosystem I in cyanobacteria // The Molecular Biology of Cyanobacteria / Eds. Bryant D.A. Dordrecht: Springer-Verlag. 1994. Ch. 10. P. 319–360.
Hauschild C.A., McMurter H.J.G., Pick F.R. Effect of spectral quality on growth and pigmentation of picocyanobacteria // J. Phycol. 1991. V. 27. P. 698–702.
Jiang T., Chai C., Wang J. et al. Temporal and spatial variations of abundance of phycocyanin- and phycoerythrin-rich Synechococcus in Pearl River Estuary and adjacent coastal area // J. Ocean Univ. China. 2016. V. 15. P. 897–904.
Kirk J.T.O. Light and photosynthesis in aquatic ecosystems. 3rd edition. Cambridge: Cambridge Univ. Press. 2011. 649 p.
Lewis M.R., Warnock R.E., Platt T. Photosynthetic Response of Marine Picoplankton at Low Photon Flux // Photosynthetic Picoplankton / Eds. Platt T., Li W.K.W. Ottawa: Can. Dep. Fish. Oceans. 1986. P. 235–250.
MacIntyre H.L., Kana T.M., Anning T., Geider R.J. Photoacclimation of photosynthesis irradiance response curves and photosynthetic pigments in microalgae and cyanobacteria // J. Phycol. 2002. V. 38. P. 17–38.
Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms and other protist plankton // Limnol. Oceanogr. 2000. V. 45. № 3. P. 569–579.
Millie D.F., Ingram D.A., Dionigi C.P. Pigment and photosynthetic responses of Oscillatoria agardhii (Cyanophyta) to photon flux density and spectral quality // J. Phycol. 1990. V. 26. P. 660–666.
Mitchell B.G., Kiefer D.A. Chlorophyll a specific absorption and fluorescence excitation spectra for light-limited phytoplankton // Deep-Sea Res. 1988. V. 35. № 5. P. 639–663.
Moore L.R., Goericke R., Chisholm S.W. Comparative physiology of Synechococcus and Prochlorococcus: influence of light and temperature on growth, pigments, fluorescence and absorptive properties // Mar. Ecol.: Prog. Ser. 1995. V. 116. P. 259–275.
Nielsen M.V. Photobiological studies of Skeletonema costatum adapted to spectrally different light regimes // Limnol. Oceanogr. 1993. V. 38. № 7. P. 1576–1581.
Oguz T. State of the Environment of the Black Sea (2001–2006/7) / Publications of the Commission on the Protection of the Black Sea against Pollution (BSC). № 2008-3. Istanbul: Referans Çeviri Hizmetleri. 2008. 448 p.
Ojala A. The influence of light quality on growth and phycobiliprotein/chlorophyll a fluorescence quotients of some species of freshwater algae in culture // Phycologia. 1993. V. 32. № 1. P. 22–28.
Rakhimberdieva M.G., Boichenko V.A., Karapetyan N.V., Stadnichuk I.N. Interaction of phycobilisomes with photosystem II dimers and photosystem I monomers and trimers in the cyanobacterium Spirulina platensis // Biochemistry. 2001. V. 40. № 51. P. 15780–15788.
Six C., Thomas J.-C., Brahamsha B. et al. Photophysiology of the marine cyanobacterium Synechococcus sp. WH8102, a new model organism // Aquat. Microb. Ecol. 2004. V. 35. P. 17–29.
Six C., Thomas J.-C., Garczarek L. et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: a comparative genomics study // Genome Biol. 2007. V. 8. № 12. Art. ID R259. https://doi.org/10.1186/gb-2007-8-12-r259
Stomp M., Huisman J., de Jong F. et al. Adaptive divergence in pigment composition promotes phytoplankton biodiversity // Nature. 2004. V. 432. P. 104–107.
Strickland J.D.H., Parsons T.R. Pigment analysis: spectrophotometric determination of chlorophylls and total carotenoids // A Practical Handbook of Seawater Analysis / 2nd edition. Fisheries Research Board of Canada Bulletin 167. Ottawa: Fish. Res. Board Can. 1972. Part IV. Section 3.1.
Tassan S., Ferrari G.M. An alternative approach to absorption measurements of aquatic particles retained on filters // Limnol. Oceanogr. 1995. V. 40. № 8. P. 1358–1368.
Uysal Z. Pigments, size and distribution of Synechococcus spp. in the Black Sea // J. Mar. Syst. 2000. V. 24. № 3–4. P. 313–326.
Waterbury J.B., Watson F.W., Valois F.W., Franks D.G. Biological and ecological characterization of the marine unicellular cyanobacterium Synechococcus // In T. Platt and W.K.W. Li (ed.) / Photosynthetic Picoplankton. Ottawa: Can. Dep. Fish. Oceans. 1986. P. 71–120.
Xia X., Guo W., Tan S., Liu H. Synechococcus assemblages across the salinity gradient in a salt wedge estuary // Front. Microbiol. 2017. V. 8. Art. ID 1254. https://dx.doi.org/10.3389%2Ffmicb.2017.01254
Дополнительные материалы отсутствуют.


