Биология моря, 2020, T. 46, № 2, стр. 117-125
Иммуноцитохимическая идентификация PIWI-позитивных клеток в ходе восстановления популяции целомоцитов после эвисцерации у голотурии Eupentacta fraudatrix (Djakonov et Baranova, 1958) (Holothuroidea: Dendrochirota)
Е. Г. Завальная 1, 2, Е. В. Шамшурина 1, М. Г. Елисейкина 1, *
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
2 Дальневосточный федеральный университет
690950 Владивосток, Россия
* E-mail: meliseikina@yandex.ru
Поступила в редакцию 10.06.2019
После доработки 22.11.2019
Принята к публикации 28.11.2019
Аннотация
С использованием метода проточной цитометрии исследовали количественную динамику клеток целомической жидкости (ЦЖ) у голотурии Eupentacta fraudatrix (Djakonov et Baranova, 1958) в течение суток после эвисцерации. Отмечен разнонаправленный характер динамики групп низкодифференцированных ювенильных и дифференцированных клеток в регенерации: увеличение содержания ювенильных целомоцитов сопровождалось снижением содержания дифференцированных клеток и наоборот. Использование в качестве маркера плюрипотентных стволовых клеток белка PIWI позволило выявить среди ювенильных целомоцитов субпопуляцию PIWI-позитивных клеток. Их содержание в ЦЖ было максимальным на начальных этапах регенерации – через 1 и 4 ч после эвисцерации и снижалось через 24 ч после эвисцерации.
Ген piwi (P-element-induced wimpy testis) был впервые обнаружен и охарактеризован как ген, необходимый для пролиферации зародышевых клеток Drosophila melanogaster (см.: Lin, Spradling, 1997). Он кодирует эволюционно консервативный белок PIWI, представляющий кладу семейства Argonaute (см.: Cox et al., 1998). Характерной особенностью семейства является наличие функциональных доменов: N-концевого домена, PAZ, MID и PIWI, образующих единый структурно-функциональный комплекс связывания малых некодирующих РНК и гидролиза нуклеиновых кислот посредством эндонуклеазной активности каталитического сайта PIWI домена (Cerutti et al., 2000; Song et al., 2004; Schirle, MacRae, 2012; Kuhn, Joshua-Tor, 2013).
Белки PIWI и связанный с ними особый класс малых некодирующих РНК – piРНК обнаруживаются в линии первичных половых клеток Metazoa, где необходимы для поддержания их плюрипотентности и осуществляют сайленсинг транспозонов, эпигенетическую и посттранскрипционную регуляцию экспрессии генов (Vagin et al., 2006; Brennecke et al., 2008; Kuramochi-Miyagawa et al., 2008; Thomson, Lin, 2009; Juliano et al., 2011).
У некоторых животных экспрессия гена piwi не ограничивается клетками зародышевой линии. Ген экспрессируется в плюрипотентных и мультипотентных соматических стволовых клетках у представителей разных типов беспозвоночных и позвоночных и, как правило, связан с регенерацией. Наличие транскриптов piwi характерно для необластов плоских червей (Reddien, 2005; Palakodeti et al., 2008), циркулирующих стволовых клеток оболочников (Rinkevich et al., 2010), археоцитов губок (Funayama, 2010), интерстициальных клеток книдарий (Juliano et al., 2014), мультипотентных стволовых клеток бесчерепных (Zhang et al., 2013) и гребневиков (Alié et al., 2011), а также для дедифференцированных клеток аксолотля (Zhu et al., 2012). Ингибирование экспрессии piwi в этих клетках приводит к дефектам регенерации или ее полной остановке и, как следствие, к гибели организма. Таким образом, присутствие белков PIWI в соматических стволовых клетках, вовлеченных в регенерацию, вероятно, характерно для многих стволовых систем Metazoa. Этот факт в дополнение к известной эволюционной консервативности белков (Cox et al., 1998) позволяет рассматривать ген piwi наряду с некоторыми другими генами (vasa, nanos) как фактор, определяющий “стволовость” клетки, и применять его в качестве молекулярного маркера мульти- и плюрипотентных стволовых клеток (Seipel et al., 2004; Rosner et al., 2009; Juliano et al., 2010; Alié et al., 2011; Kawamura, Sunanaga, 2011; Plickert et al., 2012).
Использование белка PIWI как молекулярного маркера плюрипотентности может способствовать решению вопроса о наличии стволовых клеток-предшественников иммуноцитов у голотурии Eupentacta fraudatrix. Этот представитель иглокожих, способный к эвисцерации и последующему восстановлению комплекса внутренних органов, является перспективным модельным объектом для исследования процессов регенерации и клеточной дифференцировки (Долматов, Машанов, 2007). Восстановление клеточного состава целомической жидкости (ЦЖ) после эвисцерации происходит при отсутствии пролиферации оставшейся части целомоцитов, что позволяет предположить наличие у E. fraudatrix внешней резервной субпопуляции клеток-предшественниц целомоцитов. Использование белка PIWI позволит идентифицировать и всесторонне охарактеризовать данные клетки у голотурии E. fraudatrix.
Выявление иммунопозитивных по отношению к белку PIWI клеток в ЦЖ у голотурии E. fraudatrix, определение их морфотипической принадлежности и исследование количественной динамики в ходе восстановления ЦЖ после эвисцерации является целью настоящей работы.
МАТЕРИАЛ И МЕТОДИКА
Объектом исследования послужила голотурия Eupentacta fraudatrix (Holothuroidea: Dendrochirota). Животных отлавливали в Амурском заливе Японского моря и содержали в аквариумах с охлажденной до 15°C аэрируемой проточной морской водой.
Поликлональные кроличьи анти-PIWI антитела получали путем иммунизации пептидом, который включал высоко консервативный участок, отвечающий за связывание 5′-конца piРНК, расположенный в MID домене (VATKVAMQLNCKLGG). Последовательность пептида получена на основании данных транскриптомного анализа (ncbi tsa GHCL00000000), проведенного ранее (Boyko et al., в печати). Синтез пептида и получение к нему первичных антител осуществляли в компании АЛМАБИОН (Россия).
Детекцию PIWI-позитивных клеток и анализ их количественной динамики проводили на мазках клеток ЦЖ. В эксперименте использовали пять голотурий массой от 4.5 до 5.5 г. Эвисцерацию у голотурий стимулировали введением в целомическую полость подопытным животным 0.5 мл 1% KCl. Для приготовления мазков шприцем отбирали по 200 мкл ЦЖ у каждого животного на разных этапах эксперимента: интактные животные (0), 1, 4 и 24 ч после эвисцерации. ЦЖ помещали на стекла, обработанные полилизином, и инкубировали 15 мин во влажной камере при температуре 18°C, после этого препарат фиксировали в течение 15 мин 4% параформальдегидом, приготовленным на фосфатно-солевом буфере (PBS), рН 7.4 (AMRESCO, USA), и промывали в трех порциях PBS в течение суток. Для предотвращения неспецифического связывания первичных антител мазки обрабатывали 2 ч блокирующим буфером (3% рыбный желатин – Teleostean gelatin, SIGMA; 0.3 М глицин; 0.5% Тритон X 100 на PBS), инкубировали с первичными иммунными анти-PIWI антителами, разведенными 1% БСА на PBS в соотношении 1 : 300 в течение суток при температуре 4°C, затем промывали 1% БСА на PBS, содержащем 0.02% TWEEN 20 (3 раза по 10 мин), инкубировали 1 ч при комнатной температуре со вторичными антикроличьими антителами, меченными Alexa 546 (Molecular Probs), разведенными 1% БСА на PBS в соотношении 1 : 750. После промывки в трех порциях PBS препараты заключали в специальную среду, содержавшую DAPI для окраски ядерной ДНК (Vectashield, Vector Laboratories). Материал анализировали с использованием лазерного конфокального сканирующего микроскопа LSM 780 (Carl Zeiss, Германия). Подсчитывали количество меченных антителами клеток на 1000 целомоцитов; полученные данные выражали в процентах.
Количественную динамику целомоцитов анализировали с использованием проточного цитометра Cytoflex (Beckman Coulter, USA). У пяти подопытных животных перед эвисцерацией и через 1, 4 и 24 ч после начала эксперимента шприцем отбирали по 300 мкл ЦЖ. Для предотвращения образования агрегатов в образцы добавляли по 10 мкл 0.3 М ЭДТА. Образцы фиксировали в течение 1 ч добавлением в ЦЖ 25% глутарового альдегида, чтобы конечная концентрация фиксатора в образце составляла 2.5%. После этого их центрифугировали до образования осадка клеток, удаляли фиксатор и промывали в 1 мл PBS, затем добавляли 0.5 мл PBS и ресуспендировали осадок. Для окраски ядерной ДНК использовали DAPI в соотношении 1 : 4000. В каждом образце оценивали не менее 30 тыс. событий. Позитивные по DAPI клетки детектировали при экстинкции 405 нм, эмиссию измеряли с помощью полосового фильтра 450/45 BP. Приблизительный размер клеток в образцах определяли с использованием калибровочных частиц для проточной цитофотометрии размером 2, 4, 6, 10 и 15 мкм на FSC-A графике (F13838, Molecular Probes, Eugene, OR, USA). Параллельно на этих же образцах ЦЖ исследовали микроморфологию целомоцитов, размеры которых соответствовали размерам использованных калибровочных частиц. По 100 мкл суспензии клеток анализировали с использованием лазерного конфокального микроскопа LSM 780 (Carl Zeiss). Размеры клеток определяли в программе ZEN.
Статистический анализ проводили при помощи программы Statistica 6.0. Данные представлены как среднее значение ± стандартное отклонение. Полученные данные подвергали дисперсионному анализу (ANOVA) с последующим использованием LSD теста; статистически достоверными отличиями считались значения при р < 0.05.
РЕЗУЛЬТАТЫ
Клеточный состав трех групп целомоцитов
На основании показателей прямого и бокового светорассеяния среди клеток целомической жидкости выделены три основные группы, которые различались по степени структурированности цитоплазмы и линейным размерам: 2–6, 6–10, 10 мкм и более. По данным микроструктурного анализа охарактеризован клеточный состав выделенных нами групп.
Клетки диаметром 2–6 мкм с высоким ядерно-цитоплазматическим отношением и неразвитой цитоплазмой считали низкодифференцированными ювенильными клетками (рис. 1а), клетки диаметром 6–10 мкм с увеличенным объемом цитоплазмы – среднедифференцированными. Обнаружены клетки с цитоплазмой, содержавшей немногочисленные секреторные гранулы, что указывает на начальные этапы дифференцировки морулоподобных клеток, а также клетки, способные формировать небольшие псевдоподии, – признак, характерный для амебоцитарного пути дифференцировки (рис. 1б). Дифференцированные клетки диаметром 10–20 мкм (рис. 1в–1д) были представлены либо округлыми клетками с развитой цитоплазмой, заполненной секреторными гранулами (морулоподобные целомоциты), либо полиморфными клетками, способными образовывать псевдоподии разной формы (петаллоидные и филоподиальные амебоциты). Наряду с преобладающими в ЦЖ амебоцитами и морулоподобными целомоцитами среди дифференцированных клеток обнаружены гемоциты, содержавшие дыхательный пигмент гемоглобин (рис. 1е), а также редко встречавшиеся кристаллические клетки (не представлены).
Рис. 1.
Морфология целомоцитов основных размерных групп голотурии Eupentacta fraudatrix. а – ювенильные клетки диаметром 3–5 мкм; б – среднедифференцированные клетки диаметром 6–10 мкм; в, г, д – дифференцированные клетки диаметром от 11 до 20 мкм: амебоциты (в, д) и морулоподобные клетки (г, д); е – гемоциты.

Количественная динамика клеток ЦЖ после эвисцерации
Количество целомоцитов в ЦЖ у интактных животных составляло 7.5 × 106 ± 1.5 × 106 кл./мл. После эвисцерации оно резко и статистически достоверно снижалось и через 1 ч составляло 0. 87 × × 106 ± 0.22 × 106 кл./мл, а через 4 ч – 0.32 × 106 ± ± 0.57 × 105 кл./мл. Через 24 ч после начала эксперимента количество целомоцитов в ЦЖ возрастало до 2.5 × 106 ± 2.9 × 105 кл./мл (рис. 2).
Рис 2.
Количество клеток в целомической жидкости (ЦЖ) Eupentacta fraudatrix у интактных животных и после эвисцерации. Одинаковые буквенные индексы над столбцами показывают отсутствие статистически значимых различий между значениями при р < 0.05 и n = 5. По оси абсцисс – время после эвисцерации (0 – интактные животные; 1, 4 и 24 ч); по оси ординат – количество клеток в 1 мл ЦЖ.

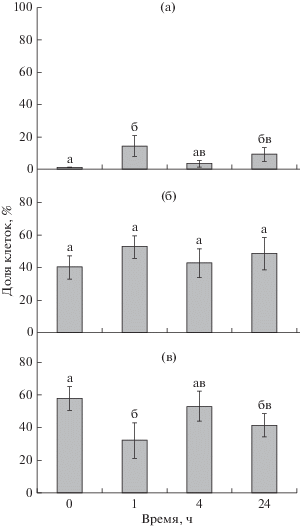
В ходе регенерации изменялось не только суммарное количество целомоцитов в ЦЖ, но и соотношение содержавшихся в ней размерно-функциональных групп клеток (рис. 3). У интактных животных наиболее многочисленными были дифференцированные клетки диаметром 10–20 мкм (58.2 ± 7.4%). Вторыми по представленности были среднедифференцированные клетки диаметром 6–10 мкм (40.7 ± 7.04%). “Минорную” группу формировали низкодифференцированные ювенильные клетки диаметром 2–6 мкм (1.09 ± 0.37%). Через 1 ч после эвисцерации в ЦЖ увеличивалась доля ювенильных клеток (14.6 ± 6%), а содержание дифференцированных клеток снижалось до 32.5 ± 4.3%. Через 4 ч после эвисцерации содержание ювенильных клеток снижалось до 3.7 ± 2.1%, а доля дифференцированных клеток, напротив, возрастала до 53.3 ± 7.5% и приближалась к значениям, характерным для интактных животных. Через 24 ч после начала эксперимента отмечена тенденция к увеличению доли ювенильных клеток (9.5 ± 4%) и к снижению содержания дифференцированных целомоцитов (41.8 ± 7.1%). Содержание среднедифференцированных клеток во время эксперимента изменялось незначительно; эти изменения статистически недостоверны.
Рис. 3.
Изменение содержания целомоцитов трех размерных групп в целомической жидкости Eupentacta fraudatrix после эвисцерации. а – ювенильные клетки, б – среднедифференцированные клетки, в – дифференцированные клетки. По оси абсцисс – время после эвисцерации (0 – интактные животные; 1, 4 и 24 ч); по оси ординат – доля клеток каждой группы (%) от общего количества целомоцитов. Одинаковые буквенные индексы над столбцами показывают отсутствие статистически значимых различий между значениями при р < 0.05 и n = 5.
Иммуноцитохимическая идентификация и анализ численности PIWI-позитивных клеток в ЦЖ Eupentacta fraudatrix в ходе регенерации
При иммуноцитохимическом окрашивании целомоцитов поликлональными кроличьими антителами на белок PIWI выявлено наличие меченых клеток в ЦЖ у интактных животных (рис. 4а) и у животных на разных сроках регенерации после эвисцерации (рис. 4б–4г).
Рис. 4.
Иммунофлуоресцентное окрашивание PIWI-позитивных клеток в целомической жидкости голотурии Eupentacta fraudatrix. а – интактные животные, б – 1 ч после эвисцерации, в – 4 ч после эвисцерации, г – 24 ч после эвисцерации. Иммуноцитохимическое окрашивание антителами к белку PIWI – выделенный канал а2, б2, в2, г2; ядерная ДНК окрашена DAPI – выделенный канал а1, б1, в1, г1.

Диаметр клеток, содержавших белок PIWI, как правило, составлял около 5 мкм; они характеризовались высоким ядерно-цитоплазматическим отношением и относились к группе низкодифференцированных ювенильных клеток. Очень редко встречались клетки с более развитой цитоплазмой, попадавшие в группу среднедифференцированных (рис. 4а). Ядра меченых клеток округлой формы содержали глыбки гетерохроматина. Иммунопозитивные структуры располагались преимущественно в цитоплазме – диффузно либо в виде гранул. Редко встречались слабо меченные ядра.
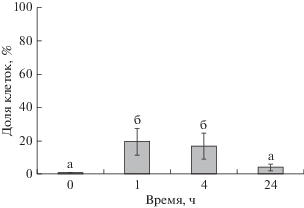
У интактных животных в ЦЖ обнаружены лишь единичные меченые клетки (0.3 ± 0.3%). После эвисцерации через 1 и 4 ч их содержание в ЦЖ резко возрастало и достигало максимальных за весь период наблюдений значений (соответственно 20 ± 8 и 17 ± 8% от общего числа целомоцитов); через 24 ч этот показатель снижался до 3 ± 2% (рис. 5).
Рис. 5.
Содержание PIWI-позитивных клеток в целомической жидкости голотурии Eupentacta fraudatrix в норме и после эвисцерации. По оси абсцисс – время после эвисцерации (0 – интактные животные; 1, 4 и 24 ч), по оси ординат – доля иммунопозитивных клеток, %. Одинаковые буквенные индексы над столбцами показывают отсутствие статистически значимых различий между значениями при р < 0.05 и n = 5.
ОБСУЖДЕНИЕ
Клетки ЦЖ иглокожих – это гетерогенная и многофункциональная популяция свободноподвижных клеток, присутствующих во всех целомических полостях (Smith et al., 2010). Несмотря на то, что клеточный состав ЦЖ существенно варьирует у разных систематических групп, у всех представителей иглокожих имеются иммунокомпетентные целомоциты – фагоцитирующие амебоциты и гранулосодержащие морулоподобные клетки, ответственные за выработку гуморальных факторов иммунитета. Кроме этого, в ЦЖ могут присутствовать жгутиковые клетки, участвующие в тромбообразовании и создающие ток целомической жидкости, а также кристаллические клетки, осуществляющие осморегуляцию, и гемоциты, содержащие гемоглобин (Chia, Xing, 1996; Елисейкина, Магарламов, 2002; Ramírez-Gómez, García-Arrarás, 2010). Помимо перечисленных типов клеток в ЦЖ иглокожих выделяется субпопуляция мелких лимфоцитоподобных или ювенильных клеток, которые рассматриваются как низкодифференцированные предшественники остальных типов целомоцитов (Rinkevich, Matranga, 2009).
Хорошие способности к регенерации позволяют широко использовать иглокожих для исследования восстановительных морфогенезов (Долматов, 1999; Candia Carnevali, 2006), в частности, для изучения источников и механизмов восстановления целомоцитов после эвисцерации или экспериментального удаления части ЦЖ. Процесс восстановления клеточного состава ЦЖ не сопровождается ростом пролиферативной активности оставшейся части целомоцитов, таким образом, можно предположить, что на первых этапах регенерации происходит выселение клеток-предшественниц из внешних депо (Козлова и др., 2006; Sharlaimova et al., 2010; Li et al., 2018). Однако отсутствие морфологических признаков, отличающих плюрипотентные клетки от ювенильных целомоцитов, обуславливает необходимость поиска маркеров, позволяющих детектировать данные клетки. Использование белка PIWI – молекулярного маркера стволовых клеток, может способствовать решению вопроса об источниках и механизмах восстановления пула клеток ЦЖ у представителей иглокожих в условиях стресса.
Голотурия Eupentacta fraudatrix, обладающая способностью к эвисцерации и последующему восстановлению комплекса внутренних органов, активно используется для исследования механизмов восстановительных морфогенезов (Долматов, Машанов, 2007). В настоящее время накоплена обширная информация о клеточных и молекулярных механизмах восстановления тканей и органов у E. fraudatrix. Транскриптомный анализ показал наличие экспрессии гена piwi в регенерирующих тканях этого вида голотурий, что позволяет использовать белок PIWI для идентификации клеток-предшественниц целомоцитов (Boyko et al., 2020).
Клеточный состав ЦЖ E. fraudatrix охарактеризован ранее с привлечением данных ультраструктурного анализа (Долматов, Машанов, 2007; Eliseikina et al., 2010). Среди целомоцитов выделены следующие типы: амебоциты, морулоподобные клетки, гемоциты, кристаллические клетки, а также ювенильные клетки с высоким ядерно-цитоплазматическим отношением и неразвитым гетеросинтетическим аппаратом. Таким образом, целомоциты E. fraudatrix различаются не только функционально, но и по степени дифференцированности, что выражено, в частности, в изменении их линейных размеров и структуры цитоплазмы. На основании этих показателей среди клеток ЦЖ нами выделены три группы целомоцитов: низкодифференцированные ювенильные клетки, средне- и высокодифференцированные целомоциты – амебоциты, морулоподобные клетки, гемоциты и кристаллические клетки.
При эвисцерации комплекса внутренних органов у E. fraudatrix содержание целомоцитов в ЦЖ снижалось на порядок по сравнению с интактными животными. Это обусловлено потерей значительного объема ЦЖ, а также участием оставшихся в ЦЖ клеток в защитных реакциях – тромбообразовании и удалении клеточных остатков в области повреждения тканей после эвисцерации (Долматов, Машанов, 2007). Восстановление численности клеток в ЦЖ E. fraudatrix до значений, близких к таковым у интактных животных, происходило в течение первых суток после эвисцерации. При этом, как показано ранее, пролиферативная активность оставшейся части целомоцитов не усиливалась (см.: Долматов, Машанов, 2007; Eliseikina et al., 2010). Сходная динамика описана при восстановлении состава ЦЖ у голотурии Apostichopus japonicus после эвисцерации (Li et al., 2018) и у морской звезды Asterias rubens после удаления существенной части ЦЖ (Козлова и др., 2006). На примере A. japonicus показано, что на более поздних этапах регенерации вплоть до завершения органогенеза колебание численности клеток ЦЖ происходило уже за счет пролиферации и последующей дифференцировки циркулирующих целомоцитов (Li et al., 2018).
Анализ изменений соотношения дифференцированных и ювенильных групп клеток в ходе регенерации клеточного состава ЦЖ у E. fraudatrix показал, что снижение доли дифференцированных целомоцитов через 1 ч после эвисцерации и в меньшей степени через 24 ч после начала эксперимента сопровождалось увеличением содержания ювенильных клеток. Напротив, снижение доли ювенильных клеток в ЦЖ через 4 ч после эвисцерации сопровождалось ростом содержания в ней дифференцированных форм. Отмеченная разнонаправленная динамика целомоцитов разных размерно-функциональных групп свидетельствует в пользу идущих в ЦЖ процессов дифференцировки ювенильных клеток в функционально активные целомоциты. Отсутствие пролиферации целомоцитов на начальных этапах регенерации предполагает наличие внешней резервной субпопуляции клеток-предшественниц, ответственных за быстрое восстановление клеточного состава ЦЖ.
Обнаружение среди целомоцитов у E. fraudatrix клеток, содержавших белок PIWI, подтверждает это предположение. Причем, если у интактных животных в ЦЖ PIWI-позитивные клетки были крайне редки, то через 1 и 4 ч после эвисцерации их количество значительно возрастало, что, вероятно, связано с выселением пула резервных клеток из тканей стенки тела или других соматических тканей. Предполагается, что “нишами” стволовых клеток у иглокожих могут являться эпителиальные, соединительные и нервные ткани (Chia, Xing, 1996; Morrison, Spradling, 2008; Rinkevich, Matranga, 2009). Однако отсутствие специфических для стволовых клеток морфологических маркеров не позволяет идентифицировать и проследить их цикл в ходе морфогенезов. На примере процесса восстановления клеточного состава ЦЖ E. fraudatrix в течение первых суток после эвисцерации показано, что использование белка PIWI для детекции резервных плюрипотентных клеток может способствовать решению этой задачи. В частности, идентификация PIWI-позитивных клеток в ЦЖ и динамика их численности на начальных этапах регенерации могут рассматриваться как свидетельство участия плюрипотентных клеток в восстановлении популяции клеток ЦЖ у голотурии E. fraudatrix.
Список литературы
Долматов И.Ю. Регенерация у иглокожих // Биол. моря. 1999. Т. 25. № 3. С. 191–200.
Долматов И.Ю., Машанов В.С. Регенерация у голотурий. Владивосток: Дальнаука. 2007. 206 с.
Елисейкина М.Г., Магарламов Т.Ю. Морфология целомоцитов голотурий Apostichopus japonicus (Aspidochirota: Stichopodidae) и Cucumaria japonica (Dendrochirota: Cucumariidae) // Биол. моря. 2002. Т. 28. № 3. С. 214–219.
Козлова А.Б., Петухова О.А., Пинаев Г.П. Анализ клеточных элементов целомической жидкости на ранних сроках регенерации морской звезды Asterias rubens L. // Цитология. 2006. Т. 48. № 3. С. 175–183.
Alié A., Leclère L., Jager M. et al. Somatic stem cells express Piwi and Vasa genes in an adult ctenophore: ancient association of “germline genes” with stemness // Dev. Biol. 2011. V. 350. № 1. P. 183–197.
Boyko A.V., Girich A.S., Tkacheva E.S., Dolmatov I.Yu. The Eupentacta fraudatrix transcriptome provides insights into regulation of cell transdifferentiation // Sci. Rep. 2020. V. 10. 1522. https://doi.org/10.1038/s41598-020-58470-0
Brennecke J., Malone C.D., Aravin A.A. et al. An epigenetic role for maternally inherited piRNAs in transposon silencing // Science. 2008. V. 322. P. 1387–1392.
Candia Carnevali M.D. Regeneration in echinoderms: repair, regrowth, cloning // Invertebr. Survival J. 2006. V. 3. P. 64–76.
Cerutti L., Mian N., Bateman A. Domains in gene silencing and cell differentiation proteins: the novel PAZ domain and redefinition of the Piwi domain // Trends Biochem. Sci. 2000. V. 25. № 10. P. 481–482.
Chia F.-S., Xing J. Echinoderm coelomocytes // Zool. Stud. 1996. V. 35. № 4. P. 231–254.
Cox D.N., Chao A., Baker J. et al. A novel class of evolutionarily conserved genes defined by piwi are essential for stem cell self-renewal // Genes Dev. 1998. V. 12. № 23. P. 3715–3727.
Eliseikina M.G., Magarlamov T.Yu., Dolmatov I.Yu. Stem cells of holothuroid coelomocytes // Echinoderms: Durham. Proc. 12th Int. Echinoderm Conf. Boca Raton: CRC Press. 2010. P. 163–166.
Funayama N. The stem cell system in demosponges: insights into the origin of somatic stem cells // Dev. Growth Differ. 2010. V. 52. № 1. P. 1–14.
Juliano C.E., Reich A., Liu N. et al. PIWI proteins and PIWI-interacting RNAs function in Hydra somatic stem cells // Proc. Natl. Acad. Sci. U.S.A. 2014. V. 111. № 1. P. 337–342.
Juliano C.E., Swartz S.Z., Wessel G.M. A conserved germline multipotency program // Development. 2010. V. 137. P. 4113–4126.
Juliano C., Wang J., Lin H. Uniting germline and stem cells: the function of piwi proteins and the piRNA pathway in diverse organisms // Annu. Rev. Genet. 2011. V. 45. P. 447–469.
Kawamura K., Sunanaga T. Role of Vasa, Piwi, and Myc-expressing coelomic cells in gonad regeneration of the colonial tunicate, Botryllus primigenus // Mech. Dev. 2011. V. 128. P. 457–470.
Kuhn C.-D., Joshua-Tor L. Eukaryotic Argonautes come into focus // Trends Biochem. Sci. 2013. V. 38. № 5. P. 263–271.
Kuramochi-Miyagawa S., Watanabe T., Gotoh K. et al. DNA methylation of retrotransposon genes is regulated by Piwi family members MILI and MIWI2 in murine fetal testes // Genes Dev. 2008. V. 22. P. 908–917.
Li Q., Ren Y., Liang C. et al. Regeneration of coelomocytes after evisceration in the sea cucumber, Apostichopus japonicus // Fish Shellfish Immunol. 2018. V. 76. P. 266–271.
Lin H., Spradling A.C. A novel group of pumilio mutations affects the asymmetric division of germline stem cells in the Drosophila ovary // Development. 1997. V. 124. № 12. P. 2463–2476.
Morrison S.J., Spradling A.C. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life // Cell. 2008. V. 132. № 4. P. 598–611.
Palakodeti D., Smielewska M., Lu Y.-C. et al. The PIWI proteins SMEDWI-2 and SMEDWI-3 are required for stem cell function and piRNA expression in planarians // RNA. 2008. V. 14. № 6. P. 1174–1186.
Plickert G., Frank U., Müller W.A. Hydractinia, a pioneering model for stem cell biology and reprogramming somatic cells to pluripotency // Dev. Biol. 2012. V. 56. P. 519–534.
Ramírez-Gómez F., García-Arrarás J.E. Echinoderm immunity // Invertebr. Survival J. 2010. V. 7. P. 211–220.
Reddien P.W., Oviedo N.J., Jennings J.R. et al. SMEDWI-2 is a PIWI-like protein that regulates planarian stem cells // Science. 2005. V. 310. № 5752. P. 1327–1330.
Rinkevich B., Matranga V. Stem cells in marine organisms. London: Springer-Verlag. 2009. 367 p.
Rinkevich Y., Rosner A., Rabinowitz C. et al. Piwi positive cells that line the vasculature epithelium, underlie whole body regeneration in a basal chordate // Dev. Biol. 2010. V. 345. № 1. P. 94–104.
Rosner A., Moiseeva E., Rinkevich Y. et al. Vasa and the germ line lineage in a colonial urochordate // Dev. Biol. 2009. V. 331. P. 113–128.
Schirle N.T., MacRae I.J. Structure and mechanism of Argonaute proteins // Enzymes. 2012. V. 32. P. 83–100.
Seipel K., Yanze N., Schmid V. The germ line and somatic stem cell gene Cniwi in the jellyfish Podocoryne carnea // Int. J. Dev. Biol. 2004. V. 48. P. 1–7.
Sharlaimova N.S., Pinaev G.P., Petukhova O.A. Comparative analysis of behavior and proliferative activity in culture of cells of coelomic fluid and of cells of various tissues of the sea star Asterias rubens L. isolated from normal and injured animals // Cell Tissue Biol. 2010. V. 4. № 3. P. 280–288.
Smith L. C., Ghosh J., Buckley K.M. et al. Echinoderm immunity // Adv. Exp. Med. Biol. 2010. P. 260–301.
Song J.-J., Smith S.K., Hannon G.J., Joshua-Tor L. Crystal structure of Argonaute and its implications for RISC slicer activity // Science. 2004. V. 305. № 5689. P. 1434–1437.
Thomson T., Lin H. The biogenesis and function of PIWI proteins and piRNAs: progress and prospect // Annu. Rev. Cell Dev. Biol. 2009. V. 25. P. 355–376.
Vagin V.V., Sigova A., Li C. et al. A distinct small RNA pathway silences selfish genetic elements in the germline // Science. 2006. V. 313. № 5785. P. 320–324.
Zhang Q.J., Luo Y.J., Wu H.R. et al. Expression of germline markers in three species of amphioxus supports a preformation mechanism of germ cell development in cephalochordates // EvoDevo. 2013. V. 4. № 1. P. 17.
Zhu W., Pao G.M., Satoh A. et al. Activation of germline-specific genes is required for limb regeneration in the Mexican axolotl // Dev. Biol. 2012. V. 370. № 1. P. 42–51.
Дополнительные материалы отсутствуют.


