Биология моря, 2020, T. 46, № 3, стр. 174-181
Влияние условий среды на распределение и размерный состав брюхоногого моллюска Boreotrophon candelabrum (Reeve, 1848) (Muricidae) в заливе Восток Японского моря
Н. И. Селин *
Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: nikselin@yandex.ru
Поступила в редакцию 28.08.2019
После доработки 01.10.2019
Принята к публикации 03.10.2019
Аннотация
Исследованы особенности распределения и размерный состав брюхоногого моллюска Boreotrophon candelabrum в зал. Восток Японского моря в 2014–2019 гг. Установлено, что моллюски обитают на разных грунтах и биогенных субстратах, исключая чистые промытые пески открытых бухт и прибойные скально-валунные побережья. Наиболее обильными животные были в кутовой части залива, где плотность поселения достигала 5 экз/м2, а биомасса составляла около 30 г/м2. Эти значения соответствуют величинам, полученным при первой количественной оценке макробентоса зал. Восток в 1971–1975 гг. (Погребов, Кашенко, 1976). Показано, что летом в заливе встречались моллюски с высотой раковины от 10 до 62 мм. Размерный состав B. candelabrum в разных районах залива значимо различался: в кутовой части на заиленном дне и на прибойном участке он характеризовался сравнительно узким диапазоном, низкой численностью или отсутствием особей крупнее 44–50 мм. С 2014 по 2017 г. в поселениях B. candelabrum наблюдалась тенденция к увеличению доли крупных особей с высотой раковины более 40 мм, а в последующие годы – к снижению. Причины отмеченных колебаний состава поселения обсуждаются.
Брюхоногие моллюски-мурициды рода Boreotrophon составляют многочисленную группу морских донных обитателей Северного полушария, видовое богатство которой постоянно растет за счет обнаружения новых видов (Egorov, 1993; Houart et al., 2019). Они заселяют значительную площадь дна от прибрежных мелководий до абиссали и как хищники играют важную роль в трансформации органических веществ. К данной группе относится Boreotrophon candelabrum (Reeve, 1848) – тихоокеанский приазиатский низкобореальный вид, распространенный в Японском море у берегов Кореи, России, Японии (о-ва Хонсю и Хоккайдо, включая тихоокеанское побережье), на Южно-Курильском мелководье и у южного Сахалина (Голиков, Кусакин, 1978; Higo et al., 1999; Min, 2004; Кантор, Сысоев, 2005; Gulbin, 2009). Биология этого вида, как и большинства других представителей рода, почти не изучена. Сведения по экологии B. candelabrum ограничены краткой информацией в разделах по распространению и описанию представителей рода (Голиков, Кусакин, 1978; Egorov, 1992, 1993), а также в результатах исследований биоты зал. Посьета Японского моря сотрудниками ЗИН РАН в 1962 г. (Голиков, Скарлато, 1967; Скарлато и др., 1967). Отсутствуют какие-либо данные о популяционной структуре моллюска, позволяющие судить об особенностях его воспроизводства и жизнедеятельности в изменчивых условиях среды обитания. В связи с этим цель настоящей работы заключалась в изучении пространственно-временной изменчивости обилия и состава населения B. candelabrum в зал. Восток – одном из типичных районов зал. Петра Великого Японского моря.
МАТЕРИАЛ И МЕТОДИКА
Материалом для данного исследования послужил брюхоногий моллюск Boreotrophon candelabrum, обитающий в зал. Восток Японского моря. При изучении пространственной изменчивости обилия и состава локальных скоплений этого моллюска в июне 2014 г. оценивали плотность поселений на трех участках дна, которые различались удаленностью от открытой части моря, прибойностью, типом грунта и составом донного населения. Первый участок (станция 1) располагался в кутовой части зал. Восток в закрытой бухте Тихая Заводь. Он характеризуется мелководностью (глубина не более 6 м), сильным заилением грунта и типичным для удаленных от открытого моря частей зал. Петра Великого составом населения, доминирующей формой которого обычно является двустворчатый моллюск Arca boucardi (см.: Голиков, Скарлато, 1967; Скарлато и др., 1967; Скарлато, 1981).
Второй участок (станция 2) находился в районе биостанции “Восток” ННЦМБ на удалении около 1 км от первого участка и представлял собой подводный склон, простиравшийся до глубины 11–12 м. Как и кут залива, этот участок защищен от открытого моря, но подвержен периодическому воздействию отраженных волн, существенному во время прохождения тайфунов. Население склона характеризуется высоким видовым разнообразием и обилием, что в значительной мере обусловлено пышным развитием агрегаций мидии Грея Crenomytilus grayanus и модиолуса Modiolus kurilensis (см.: Погребов, Кашенко, 1967; Селин, 2011, 2014, 2018, и др.).
Третий участок (станция 3) располагался в средней части зал. Восток, не защищенной от волн открытой части зал. Петра Великого, которые из-за мелководности прилежащей акватории докатываются до прибрежного участка (глубина менее 2 м) сильно ослабленными. Здесь на гравийно-галечном с окатанными валунами и скалами дне встречаются щетки двустворчатого моллюска септифера Septifer keenae, а также небольшие друзы модиолуса и мидии Грея (Селин, 1999). Для учета численности (плотности поселения) B. candelabrum использовали рамку площадью 1 м2, которую на каждой станции 30 раз случайным образом помещали на дно.
При изучении временнóй изменчивости обилия и состава населения B. candelabrum исследования проводили в районе станции 2 в июле 2015–2019 гг. В этом случае по изобате 9 м располагали размеченную через 1 м трансекту длиной 70 м. На следующий день вдоль трансекты собирали всех моллюсков в полосе шириной 2 м на глубине 8–10 м с площади 140 м2. Выбор изобаты 9 м для мониторинга межгодовых флуктуаций размерного состава бореотрофона обусловлен тем, что на глубине 8–10 м в 2014 г. была зарегистрирована наибольшая регулярность попадания моллюсков в учетную рамку.
У моллюсков, собранных из рамок, а иногда безвыборочно с прилежащих участков дна (для массовости материала), штангенциркулем с точностью до 0.1 мм измеряли высоту раковины (Н) и с точностью до 0.01 г оценивали прижизненную массу тела (W). После измерения и взвешивания животных возвращали в море. Результаты измерений использовали для построения гистограмм размерного состава скоплений, сведения о массе тела – для оценки биомассы.
Статистическая обработка данных включала расчет средней плотности поселения, биомассы моллюсков и стандартного отклонения средней, а также процедуру множественного сравнения размерных распределений с использованием стандартных параметрических и непараметрических критериев. В случаях, когда данные не соответствовали характеристикам нормального распределения признака (скопления B. candelabrum из разных районов залива), при сравнительном анализе размерного состава рассчитывали Н-критерий Крускала−Уоллиса (ANCOVA), в частных случаях – U-критерий Манна−Уитни. О достоверности различий судили с учетом поправки Бонферрони. Множественное сравнение размерного состава моллюсков за 2015–2019 гг. проводили с помощью дисперсионного анализа (ANOVA); в качестве апостериорного критерия использовали критерий Дункана. Все расчеты выполнены на ПК по алгоритмам прикладных программ пакета SPSS17.
При обсуждении результатов исследования использовали неопубликованные данные автора, полученные в 1980–2019 гг. при изучении распределения, обилия и биологии морских беспозвоночных в зал. Восток Японского моря.
РЕЗУЛЬТАТЫ
Пространственное распределение и обилие моллюсков
В кутовой части зал. Восток (станция 1) в летнее время Boreotrophon candelabrum встречался на глубине от 0.5–0.7 м до максимальной для этой части залива глубины 6 м. Недалеко от береговой черты в поясе макрофитов на мелком гравии с песком и ракушей были отмечены единичные особи бореотрофона. На горизонте 1.5–3.0 м на заиленных валунах, на щетках двустворчатого моллюска Arca boucardi и небольших друзах мидии Грея и модиолуса бореотрофон встречался регулярно, иногда группами из 3–5 животных (рис. 1а). Довольно часто особи B. candelabrum были почти полностью погружены в мягкий осадок (рис. 1б), под которым находился твердый субстрат. Плотность поселения бореотрофона составляла 1.8 ± 1.8 экз/м2, биомасса – 5.99 ± 6.98 г/м2 (максимальные величины – соответственно 5 экз/м2 и около 30 г/м2).
Рис. 1.
Внешний вид поселений Boreotrophon candelabrum в зал. Восток Японского моря: а – кутовая часть залива, скопления Arca boucardi (станция 1); б – одно из обычных состояний B. candelabrum, моллюск почти полностью погружен в мягкий осадок; в – моллюски на друзах мидии Грея и модиолуса (станция 2); г – прибойный участок дна, скопления Septifer keenae (станция 3).

На склоне в районе станции 2 бореотрофон также встречался почти от уреза воды и до максимальных глубин. На не припорошенном илистым осадком гравийно-галечном с ракушей и валунами прибрежном участке до глубины 3–4 м моллюски сначала попадались эпизодически, затем с заметно большей регулярностью встречались на многочисленных друзах митилид, в той или иной степени погруженных в ил; изредка животных находили на поверхности заиленного дна между друзами (рис. 1в). Плотность поселения бореотрофона составляла 0.9 ± 0.8 экз/м2, биомасса – 2.94 ± 3.61 г/м2. На горизонте 8–10 м в течение периода исследований (2014–2019 гг.) эти показатели значимо не изменялись и в среднем составляли соответственно 0.8–1.1 экз/м2 и 2.72–3.66 г/м2; наибольшие величины биомассы отмечены в 2017 г.
На участке дна в районе станции 3 плотность поселения и биомасса B. candelabrum в 2014 г. характеризовались наименьшими величинами – 0.4 ± 0.2 экз/м2 и 1.53 ± 1.12 г/м2 соответственно. Моллюски обнаружены на глубине 0.5–2.0 м на щетках Septifer keenae, модиолуса и мидии Грея, в расщелинах и с подветренной стороны валунов; часто они были припорошены мелкообломочным материалом из материковых пород и раковин как местных, так и привнесенных волновым течением моллюсков (рис. 1г).
Пространственная изменчивость состава населения
В 2014 г. в кутовой части залива на станции 1 скопление B. candelabrum было представлено моллюсками с высотой раковины от 24.5 до 44.5 мм (рис. 2) (среднее значение − 34.6 ± 4.1 мм). Основная часть населения (87.5%) была представлена моллюсками размером 30–40 мм. В скоплении на станции 3 зарегистрированы особи с высотой раковины от 28.2 до 50.0 мм (среднее значение − 38.1 ± 3.6 мм). Основную часть населения (62.5%) составляли моллюски размером 37–43 мм. В районе станции 2 отмечены особи с высотой раковины от 22.5 до 60.2 мм (среднее значение − 37.8 ± 8.5 мм). Преимущественно (72.4%) здесь обитали моллюски размером 28–44 мм.
Рис. 2.
Размерный состав поселений Boreotrophon candelabrum в разных частях зал. Восток в июне 2014 г.
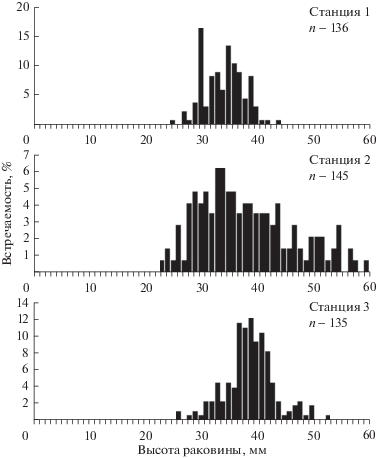
При множественном сравнении выборок моллюсков из разных районов залива с использованием критерия Крускала−Уоллиса зарегистрировано значимое различие размерного состава населения (χ2 = 38.3; Р < 0.001). Парное сравнение выборок с привлечением критерия Манна–Уитни и учетом поправки Бонферрони (Р = 0.017) свидетельствовало об отсутствии значимого различия размерного состава моллюсков в районе станций 2 и 3 при групповой вероятности ошибки менее 0.05.
Временнáя изменчивость состава населения
Размерный состав B. candelabrum в районе станции 2 в 2014–2019 гг. характеризовался наличием моллюсков с высотой раковины от 10 до 62 мм, относительно высокой численностью особей среднего размера и низкой численностью самых крупных и наиболее мелких особей (рис. 2, 3). От года к году он изменялся, колебались размерный диапазон, минимальные и максимальные размеры особей, соотношение численности особей разных размеров. Показательно, что с 2014 по 2017 г. прослеживалась тенденция к увеличению в скоплении доли относительно крупных моллюсков с высотой раковины более 40 мм, а в последующие годы наблюдалось ее снижение:
Рис. 3.
Изменение размерного состава поселения Boreotrophon candelabrum в зал. Восток на горизонте 8–10 м.

Множественное сравнение выборок моллюсков с использованием апостериорного критерия Дункана выявило три однородных подмножества (Р = 0.05), позволяющих сделать вывод об отсутствии значимых различий между размерным составом B. candelabrum в 2015 и 2016 гг., в 2018 и 2019 гг., а также о наличии таковых между размерным составом 2017 г. и всех других лет исследования.
ОБСУЖДЕНИЕ
Многолетние наблюдения за распределением донных животных показали, что в зал. Восток Boreotrophon candelabrum обитает на разных грунтах и биогенных субстратах (металлических сваях и бетонных конструкциях пирсов, установках марикультуры, заборниках воды для аквариального зала и т.д.). Исключением являются чистые пески прибойных бухт и ил, характерный для некоторых глубинных участков дна залива. Не обнаружены моллюски и на обширных участках дна в устьевой зоне рек Волчанка и Литовка, хотя известно, что этот вид переносит весеннее опреснение воды до 15‰ (Голиков, Кусакин, 1978). Согласно нашим наблюдениям, при градиенте глубин даже в пределах сравнительно небольших участков дна грунт существенно изменяется. Часто участки скально-валунного грунта с линзами мелкообломочного материала и крупного песка переходят в гравийно-галечные с прогрессирующим увеличением мягкого осадка. B. candelabrum встречался на всех этих грунтах, но с разной плотностью. Наиболее обильные его скопления отмечены на смешанных грунтах в местах развития поселений крупных двустворчатых моллюсков модиолуса, мидии Грея и арки Боукарда, которые приурочены к защищенным от волнобоя участкам залива на сравнительно небольшой глубине 2–5 м. Здесь плотность поселения бореотрофона достигала 5 экз/м2, а биомасса составляла около 30 г/м2.
При увеличении глубины и с продвижением от внутренней части залива к открытому морю сокращались площадь субстрата, благоприятного для обитания B. candelabrum, а также обилие предпочитаемых им объектов питания – закапывающихся двустворчатых моллюсков и беспозвоночных, приуроченных к друзам митилид и скоплениям арки Боукарда (Погребов, Кашенко, 1976; Голиков, Кусакин, 1978; Селин и др., 1986; Селин, 2009, и др.). В результате снижалась численность бореотрофона. Следует отметить, что за долгие годы работы автору изредка встречались единичные особи B. candelabrum вблизи выходных мысов на глубине более 20 м на мелком гравийно-галечном грунте, но никогда не встречались на скалах и валунах у уреза воды в зоне волнобоя. Крупная высокая и тяжелая раковина бореотрофона с многочисленными волнистыми выростами создает большую парусность и чрезмерное сопротивление потокам воды. Как и у других подобных видов гастропод (Boulding et al., 1999; Preston, Roberts, 2007, и др.), в периоды повышенной волновой активности это приводит к смыву моллюсков и селекции видового состава литорального населения прибойных участков морских побережий.
Наши данные согласуются с количественными оценками, полученными в 1971–1975 гг., когда в кутовой части зал. Восток на глубине 2–4 м в сообществе модиолуса и арки Боукарда плотность поселения бореотрофона составляла 2.5 экз/м2, а биомасса − 28 г/м2 (Погребов, Кашенко, 1976). Литературные данные свидетельствуют о том, что такое пространственное распределение B. candelabrum характерно не только для зал. Восток, но и для других частей ареала этого вида, в частности, для зал. Посьета и прибрежья о-ва Сахалин (Скарлато и др., 1967; Голиков и др., 1985). Известно, что плотность поселения бореотрофона в зал. Посьета достигала 3–20 экз/м2, а биомасса − 3.2–15.0 г/м2 (Голиков, Скарлато, 1967; Скарлато и др., 1967).
Вместе с тем необходимо отметить, что за все время исследований в литоральной зоне зал. Восток найдены лишь единичные особи B. candelabrum. В более ранних целенаправленных исследованиях литорали залива данный вид не обнаружен (Костина и др., 1996). Эти сведения не совпадают с литературными данными, в соответствии с которыми литораль – обычное место обитания бореотрофона (Голиков, Скарлато, 1967; Скарлато и др., 1967; Голиков, Кусакин, 1978). Отмечено, что в июле в зал. Посьета бореотрофон обитает на каменисто-галечном грунте не только у нижней границы литорали, но и в верхнем ее горизонте, где, не образуя больших скоплений со значительной биомассой, является обычной формой в доминирующей группе брюхоногих моллюсков (Скарлато и др., 1967).
Результаты проведенного исследования и литературные данные свидетельствуют о том, что B. candelabrum – эвритопный организм. Это проявляется и при исследовании состава локальных поселений, отражающего процессы пополнения донного населения молодью и убыль животных. Анализ размерного состава трех рассматриваемых скоплений показал, что их пополнение молодью происходило регулярно. Однако выживаемость моллюсков в условиях сильного заиления грунта в кутовой части залива и при периодическом воздействии даже небольшого прибоя была довольно низкой. Это выразилось в незначительном содержании в поселениях на станциях 1 и 3 крупных особей с высотой раковины более 40 мм (5.1 и 15.0% соответственно), довольно многочисленных (26%) на станции 2. Полученные данные позволяют заключить, что в районе станции 2 моллюски обитают в благоприятных для их жизнедеятельности условиях. Они достигают значительно бóльших размеров и, по-видимому, имеют бóльшую, чем в других районах, продолжительность жизни, которая у крупных особей зал. Посьета составляет 10–12 лет (Голиков, Скарлато, 1967). Это заключение подтверждают и результаты анализа состояния раковин моллюсков из разных локальных местообитаний: на станции 2 раковины имели хорошую сохранность, на станции 1 в куту залива они были в большей или меньшей степени эродированы, а на станции 3 часто покрыты известковыми водорослями.
Результаты исследования межгодовой изменчивости размерного состава B. candelabrum свидетельствуют о том, что в поселении происходят изменения. Они не всегда заметны при сравнении состава двух смежных лет исследования, но в большем масштабе времени проявляются в виде определенных тенденций. Установлено, что с 2014 по 2017 г. в поселении при регулярном поступлении молоди, росте животных и относительно низкой их смертности происходило накопление крупных особей с высотой раковины более 40 мм, т.е. поселение “старело”. В последующие годы наблюдалась обратная тенденция: доля наиболее крупных (старых) особей постепенно уменьшалась из-за их отмирания. Поселение B. candelabrum приурочено к приглубому участку берега с довольно стабильными условиями среды, характеризующимися отсутствием резких значительных перепадов гидродинамической активности, температуры, солености и других факторов (Степанов, 1976). Благодаря сбалансированности процесса возникновения новых агрегаций митилид и их отмирания (Селин, 2018), за последние годы здесь не наблюдалось сколько-нибудь заметного сокращения или увеличения площади субстрата, благоприятного для обитания B. candelabrum. Следовательно, неизменным или почти неизменным оставался и его пищевой ресурс. Таким образом, можно заключить, что в данном случае изменение состава населения этого вида связано не столько с локальными условиями, сколько с медленно текущими глобальными климатическими колебаниями физико-химических факторов среды.
Таким образом, в зал. Восток B. candelabrum представлен почти повсеместно, что отражает хорошую адаптацию моллюска к условиям, характерным для этой части ареала вида. Обилие животных и их размерный состав изменяются от биотопа к биотопу и с течением времени в пределах одного биотопа демонстрируют изменчивость интенсивности процессов пополнения и убыли населения, контролируемых локальными колебаниями условий среды и изменением климата.
Список литературы
Голиков А.Н., Кусакин О.Г. Раковинные брюхоногие моллюски литорали морей СССР. Л.: Наука. 1978. 292 с.
Голиков А.Н., Скарлато О.А. Моллюски залива Посьет (Японское море) и их экология // Тр. ЗИН АН СССР. 1967. Т. 42. С. 5–152.
Голиков А.Н., Скарлато О.А., Табунков В.Д. Состав биоценозов верхних отделов шельфа южного Сахалина (приложение к статье) // Биоценозы и фауна шельфа южного Сахалина: Исслед. фауны морей. 1985. Т. 30 (38). 64 с.
Кантор Ю.И., Сысоев А.В. Каталог моллюсков России и сопредельных стран. М.: Товарищество науч. изд. КМК. 2005. 627 с.
Костина Е.Е., Спирина И.С., Янкина Т.А. Распределение макробентоса на литорали залива Восток Японского моря // Биол. моря. 1996. Т. 22. № 2. С. 81–88.
Погребов В.Б., Кашенко В.П. Донные сообщества твердых грунтов залива Восток Японского моря // Биологические исследования залива Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 63−82.
Селин Н.И. Распределение, состав поселений и рост двустворчатого моллюска Septifer keenae у северной границы ареала // Биол. моря. 1999. Т. 25. № 4. С. 321–323.
Селин Н.И. Влияние условий среды на распределение, рост и продолжительность жизни Protothaca euglypta (Mollusca: Bivalvia) // Биол. моря. 2009. Т. 35. № 1. С. 9–13.
Селин Н.И. Использование фотометода в исследованиях состава и обилия гидробионтов, обитающих на мягких грунтах // Биол. моря. 2011. Т. 37. № 3. С. 222–228.
Селин Н.И. Некоторые черты биологии рака-крота Upogebia issaeffi (Balss, 1913) (Decapoda: Upogebiidae) из сублиторали залива Восток Японского моря // Биол. моря. 2014. Т. 40. № 1. С. 26–31.
Селин Н.И. Состав и структура смешанных поселений Crenomytilus grayanus (Dunker, 1853) и Modiolus kurilensis F.R. Bernard, 1983 (Bivalvia: Mytilidae) в заливе Петра Великого Японского моря // Биол. моря. 2018. Т. 44. № 5. С. 307–316.
Селин Н.И., Понуровский С.К., Черняев М.Ж. Влияние хищной гастроподы Cryptonatica janthostoma на структуру популяции двустворчатого моллюска Ruditapes philippinarum // Биол. моря. 1986. № 5. С. 72–74.
Скарлато О.А. Двустворчатые моллюски умеренных широт западной части Тихого океана. Л.: Наука. 1981. 479 с.
Скарлато О.А., Голиков А.Н., Василенко С.В. и др. Состав, структура и распределение донных биоценозов в прибрежных водах залива Посьет (Японское море) // Исслед. фауны морей. 1967. Т. 5(13). С. 5–61.
Степанов В.В. Характеристика температуры и солености вод залива Восток Японского моря // Биологические исследования залива Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 12–22.
Boulding E.G., Holst M., Pilon V. Changes in selection on gastropod shell size and thickness with wave-exposure on northeastern Pacific shores // J. Exp. Mar. Biol. Ecol. 1999. V. 232. P. 217–239.
Egorov R.V. Guide to Recent molluscs of northern Eurasia. 1. Gastropods of the families Muricidae and Thaididae from the seas of Russia // Ruthenica. 1992. V. 2. № 1. P. 63–75.
Egorov R.V. Trophoninae (Muricidae) of Russian and adjacent waters // Ruthenica. 1993. Suppl. 1. 48 p.
Gulbin V.V. Review of the shell-bearing gastropods in the Russian waters of the East Sea (Sea of Japan). III. Caenogastropoda: Neogastropoda // Korean J. Malacol. 2009. V. 25. № 1. P. 51–70.
Higo S., Callomon P., Goto Y. Catalogue and bibliography of the marine shell-bearing Mollusca of Japan. Gastropoda. Bivalvia. Polyplacophora. Scaphopoda. Elle Sci. Publ. 1999. 748 p.
Houart R., Vermeij G., Wiedrick S. New taxa and new synonymy in Muricidae (Neogastropoda: Pagodulinae, Trophoninae, Ocenebrinae) from the Northeast Pacific // Zoosymposia. 2019. V. 13. P. 184–241.
Min D.-K. Mollusks in Korea. Seoul: Min Molluscan Research Institute. 2004. 566 p.
Preston S.J., Roberts D. Variation in shell morphology of Calliostoma zizyphinum (Gastropoda: Trochidae) // J. Molluscan Stud. 2007. V. 73. P. 101–104.
Дополнительные материалы отсутствуют.


