Биология моря, 2020, T. 46, № 4, стр. 261-268
Особенности восстановления гликогена в мышцах и печени у рыб разной плавательной способности после вылова донным тралом
Е. Н. Силкина 1, *, Ю. А. Силкин 1, М. Ю. Силкин 1
1 Карадагская научная станция им. Т.И. Вяземского – природный заповедник РАН
298100 Феодосия, Россия
* E-mail: ysilkin@mail.ru
Поступила в редакцию 22.05.2019
После доработки 10.10.2019
Принята к публикации 12.10.2019
Аннотация
Исследовали динамику восстановления гликогена в мышцах и печени камбалы Plathichthys flesus (Linnaeus, 1758) и шпрота Sprattus sprattus (Linnaeus, 1758) после воздействия тралового лова. Показано, что при стрессовом воздействии лова содержание гликогена в органах у малоподвижной камбалы мало изменялось, а у активно плавающего шпрота оно снижалось в белых, красных мышцах и печени. Динамика восстановления гликогена в органах камбалы после воздействия лова имела волновой характер, в результате этого полное восстановление гликогена происходило через 12 ч и сопровождалось 100% выживаемостью рыб. Предполагается, что ресинтез гликогена в органах камбалы происходил за счет активизации метаболизма углеводов в печени. У шпрота, помещенного после лова для восстановления гликогена в тканях в 100-литровый аквариум, через 3 ч “отдыха” наблюдалось увеличение в 4.5 раза уровня полисахарида в белых мышцах при низком содержании гликогена в печени. Компенсация гликогена у шпрота происходила, очевидно, за счет реверсного вовлечения лактата в ресинтез полисахарида в белых мышцах. Последующие 3 ч “отдыха” характеризовались значительным снижением уровня гликогена в белых мышцах (в 1.7 раза) по сравнению с его концентрацией в предыдущий восстановительный период. За весь период “отдыха” восстановления гликогена в печени шпрота не происходило. По-видимому, данный орган не участвовал в процессах восстановления полисахарида. Низкая выживаемость шпрота (30%) обусловлена длительным стрессовым воздействием, вызванным как поимкой, так и аквариумным содержанием этого “возбудимого” вида рыб.
В обменных процессах в тканях рыб гликоген является важным энергетическим субстратом, так как окисляется с выделением энергии без использования кислорода. В многочисленных исследованиях было показано, что при интенсивных мышечных нагрузках гликоген служит “запальным топливом”, обеспечивающим мгновенное включение двигательной активности рыб. В этих условиях запасы гликогена в мышцах истощаются (Black et al., 1962; Морозова и др., 1978; Силкина, 1991). Пути его восстановления до сих пор обсуждаются в литературе и до настоящего времени являются сложным, а также малоизученным направлением исследований физиологии и биохимии (West T.G. et al., 1994; Weber et al., 2016).
В мышцах высших позвоночных гликоген, использованный при гипоксии, обычно окисляется до лактата, который поступает в печень и восстанавливается до глюкозы. Образующаяся глюкоза поступает в мышцы при активации гликогенсинтетазы и превращается в гликоген (Кухта и др., 2008). У рыб эти процессы выражены не так ярко и имеют особенности. Было показано, что мышцы рыб слабо используют глюкозу крови и она не является основным субстратом для восстановления гликогена (Frolow, Milligan, 2004). Другие исследователи установили, что только 10% лактата, образующегося в мышцах, выделяется в кровь у форели и 3% у камбалы (Pagnotta, Milligan, 1991). Таким образом, у рыб использование лактата печенью для превращения его в глюкозу, а затем в гликоген представляется маловероятным процессом. Регуляция восстановления гликогена в мышцах рыб тоже имеет особенности. Канадские ученые установили, что не только гормоны стресса оказывают влияние на гликогенез, но и количество остаточного гликогена в мышцах является регулятором синтеза данного полисахарида в локомоторном органе (Frolow, Milligan, 2004).
Для рыб попадание в трал – это большое стрессовое воздействие. Кроме того, в процессе траления рыба, пытаясь покинуть трал, совершает броски и расходует значительное количество мышечного гликогена. Ответная реакция на стресс и мышечную нагрузку у разных видов рыб существенно различается. Это обусловлено особенностями их стрессоустойчивости и локомоторными возможностями. К рыбам, имеющим разную реакцию на стресс и плавательную активность, относятся черноморская речная камбала Plathichthys flesus (Linnaeus, 1758) и шпрот Sprattus sprattus (Linnaeus, 1758).
Шпрот в Черном море встречается повсеместно, в наибольшем количестве у юго-восточных берегов Крыма и в северо-восточной части кавказского побережья. Это холодолюбивый вид. Рыба довольно быстрая, постоянно находится в движении, не наделена стрессоустойчивостью и может образовывать большие скопления. Длительных миграций не совершает (Световидов, 1964). Шпрот считается “жирной” рыбой, содержание жира в его органах в некоторые периоды года превышает 12%. Основные запасы липидов сосредоточены в белых мышцах, что отличает шпрота от так называемых тощих рыб (скорпена, налим и т.д.), у которых основные жировые запасы накапливаются в печени (Шульман, 1972; Минюк и др., 1997).
Речная камбала по образу жизни отличается от шпрота. Она относится к донным малоподвижным хищным рыбам; приспособлена к резким колебаниям солености, температуры и гипоксии, т.е. это стрессоустойчивый вид. Больших миграций камбала не совершает и является промысловым видом (Световидов, 1964).
Цель настоящей работы – изучение динамики восстановления гликогена в мышцах и печени камбалы P. flesus и шпрота S. sprattus после стрессового воздействия, вызванного попаданием в донный трал.
МАТЕРИАЛ И МЕТОДИКА
Рыбы были отловлены у кавказского и крымского побережий Черного моря в июне 2013 г. при температуре воды от 12 до 15°С. Придонное траление происходило со скоростью 6.5–8.5 км/ч в течение 30 мин на глубине 35–40 м. Часть рыб, взятых из трала, сразу подвергали биохимическому анализу, других рыб помещали в емкости с проточной морской водой объемом 100 л для “отдыха”. Исследовано 27 экз. камбалы и 42 экз. шпрота. Камбала была представлена только самками с гонадами на III–IV стадиях зрелости. Масса тела рыб составляла 131.0 ± 12.0 г, длина тела – 23.6 ± 1.7 см. У шпрота это также были самки с массой тела 7.4 ± 0.7 г и длиной 10.8 ± 0.7 см, имевшие гонады на IV стадии зрелости.
Содержание гликогена в тканях рыб определяли по общепринятой методике, основанной на цветной реакции с антроном (Seifter et al., 1950). У шпрота концентрацию гликогена определяли в белых и красных мышцах, а также в печени. У камбалы анализировали только белые мышцы и печень, так как красные мышцы у этого вида камбалы почти отсутствовали (менее 1%). Навески тканей (белые мышцы – 100 мг, красные мышцы – 50 мг, печень – 20 мг) брали у рыб, находившихся в холодильной камере при температуре ‒17°С. Содержание гликогена в тканях оценивали у рыб разного физиологического состояния: а) стрессовое состояние после трала, б) состояние восстановления (“отдых”) в течение 1, 3, 6 и 12 ч. Полученные результаты выражали в мг% сырой массы тканей, динамику изменения концентрации гликогена (∆Сгл. = Сгл. ”отдых” – Сгл. трал) в тканях рыб – в процентах. Рассчитывали среднее арифметическое ± стандартное отклонение этих показателей. Все результаты получены при проведении 6–11 независимых экспериментов. Значимость различий оценивали с использованием критерия Стьюдента; различия считали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ
Колебание уровня гликогена в органах рыб после воздействия тралового лова и в период восстановления имело тканевые и видовые особенности. Содержание гликогена в печени и белых мышцах камбалы после пребывания рыб в трале было высоким. В печени камбалы оно было в 6 раз выше, чем в мышцах, и составляло 3025.0 и 486.0 мг% соответственно (табл. 1). В первый час “отдыха” после траления содержание гликогена в белых мышцах камбалы увеличилось на 38%. В печени, напротив, было отмечено снижение концентрации гликогена на 63% по сравнению с таковой у рыб, извлеченных из трала (рис. 1).
Таблица 1.
Содержание гликогена в белых мышцах и печени камбалы
| Показатель | Камбала | |||||||
|---|---|---|---|---|---|---|---|---|
| из трала | в состоянии “отдыха” | |||||||
| 1 ч | 3 ч | 12 ч | ||||||
| мышцы | печень | мышцы | печень | мышцы | печень | мышцы | печень | |
| Среднее значение, мг% | 486 | 3205 | 670* | 1187* | 200** | 2487 | 543 | 3731 |
| Стандартное отклонение | 50 | 381 | 53 | 101 | 24 | 250 | 60 | 402 |
| Объем выборки, экз. | 12 | 13 | 7 | 9 | 7 | 7 | 6 | 6 |
Рис. 1.
Динамика изменения концентрации гликогена в белых мышцах и печени камбалы в процессе “отдыха” через 1, 3 и 12 ч. Здесь и на рис. 2: концентрация гликогена у рыб, взятых на анализ при подъеме трала, принята за 100% как нулевой уровень.
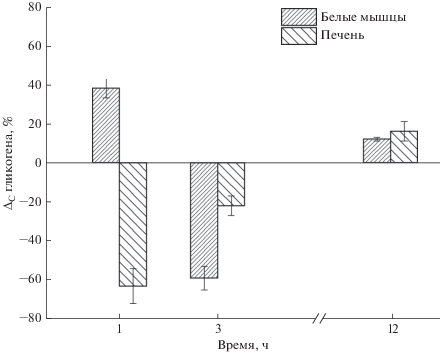
В последующие 3 ч “отдыха” динамика тканевого содержания гликогена (∆Сгл.) у камбалы сильно изменилась. В белых мышцах она стремительно снизилась и была в 3.3 раза ниже, чем после первого часа “отдыха”. Концентрация гликогена в белых мышцах камбалы за 3 ч “отдыха” снизилась на 59% по сравнению с таковой после поимки. В печени наблюдалось такое же быстрое восстановление концентрации гликогена, которая в 2 раза превышала его содержание после первого часа “отдыха”, но была на 22% ниже, чем сразу после траления. Последующее время “отдыха” характеризовалось продолжением восстановления уровня гликогена в мышцах и печени камбалы: в белых мышцах в этот период гликогена было в 1.1 раза, а в печени – в 1.2 раза больше, чем у рыб, извлеченных из трала (табл. 1, рис. 1). В экспериментах все подопытные особи Plathichthys flesus остались живыми в течение периода “отдыха”.
После траления в мышцах и печени шпрота концентрация гликогена была низкой и на порядок отличалась от таковой в тканях камбалы. В мышцах шпрота гликогена было в 3–3.5 раза меньше, чем в печени. Различий в уровне остаточного гликогена между белыми и красными мышцами у шпрота не выявлено. У большинства рыб в состоянии относительного покоя уровень гликогена в красных мышцах был в 3–5 раз выше, чем в белых (табл. 2).
Таблица 2.
Содержание гликогена в мышцах и печени шпрота
| Показатель | Шпрот | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| из трала | в состоянии “отдыха” | ||||||||
| 3 ч | 6 ч | ||||||||
| б. м. | кр. м. | печ. | б. м. | кр. м. | печ. | б. м. | кр. м. | печ. | |
| Среднее значение, мг% | 65 | 71 | 243 | 305* | 120* | 259 | 178** | 150** | 247 |
| Стандартное отклонение | 7 | 8 | 25 | 7 | 5 | 30 | 19 | 5 | 29 |
| Объем выборки, экз. | 10 | 10 | 11 | 7 | 7 | 9 | 6 | 6 | 7 |
В восстановительный период в мышцах и печени шпрота, в отличие от таковых камбалы, не было отмечено дальнейшего снижения концентрации гликогена ниже уровня, характерного для рыб сразу после вылова (табл. 2). Через 3 ч содержания рыб в искусственных условиях покоя в белых мышцах наблюдали самый высокий прирост концентрации гликогена, которая почти в 5 раз превышала ее начальное значение. В красных мышцах концентрация гликогена увеличилась в меньшей степени и составляла 69% (рис. 2). На этом этапе “отдыха” рыб соотношение концентрации гликогена в двух типах мышц было нестандартным: в белых мышцах концентрация гликогена была в 2.5 раза выше, чем в красных (табл. 2). В дальнейшем отмечено снижение концентрации гликогена в белых мышцах; к концу шестого часа эксперимента она была почти в 2 раза ниже, чем через 3 ч “отдыха”, но на 174% превышала уровень гликогена, зарегистрированный у рыб сразу после поимки. В красных мышцах шпрота в последующие 3 ч “отдыха” концентрация гликогена увеличилась на 42% по сравнению с таковой в первые 3 ч наблюдений (рис. 2) и была на 211% выше, чем у рыб сразу после поимки (табл. 2). Содержание гликогена в печени шпрота оставалось неизменным в течение всего эксперимента (табл. 2, рис. 2).
Рис. 2.
Динамика изменения концентрации гликогена в тканях шпрота в процессе 3- и 6-часового “отдыха”.

В процессе экспериментов в течение периода “отдыха” живыми остались 30% подопытных особей Sprattus sprattus.
ОБСУЖДЕНИЕ
Гликоген как энергетический субстрат, обладающий легкой мобилизуемостью, высокой степенью восстанавливаемости и способностью освобождать энергию в анаэробных условиях, играет важную роль в метаболизме рыб. Как известно, это основной источник энергии при анаэробном состоянии организма. В теле рыб гликоген в основном локализован в печени и мышцах. Его содержание в скелетных мышцах у активных форм (в нашем случае – это шпрот) ниже, чем у малоактивных форм (оседлые формы рыб, в нашем случае – камбала). Содержание гликогена в печени, мозге и сердце также выше у малоподвижных рыб по сравнению с таковым у активно плавающих видов (Плисецкая, 1972; Морозова и др., 1978). Эти особенности в содержании гликогена в тканях рыб, различающихся уровнем естественной подвижности, несомненно, связаны с повышенной ролью гликолитического пути мобилизации энергии у малоподвижных форм по сравнению с таковой у активных видов рыб. Тем не менее, значение углеводов в метаболизме активных видов рыб тоже очень важно (Шульман, 1972; Эмеретли, Русинова, 2001).
Проведенные исследования по влиянию траления на содержание гликогена в тканях рыб выявили различия в их ответе на стрессовую нагрузку. В тканях шпрота уровень гликогена снизился почти до нулевых отметок, тогда как в тканях камбалы в течение 30 мин поимки и траления он сохранялся на довольно высоком уровне (табл. 1, 2). На наш взгляд, решающую роль играет видовая стрессоустойчивость рыб.
Камбала – стрессоустойчивый вид, который не относится к активно плавающим рыбам. Попав в трал, она не может совершать интенсивные движения из-за своей плоскотелой формы и ограниченного пространства. Эти условия, по-видимому, способствовали минимизации энергетических затрат, а также наблюдаемому отсутствию снижения уровня гликогена в мышцах и печени рыб сразу после траловой поимки. Однако стрессовое воздействие лова на организм рыб, как известно, сопровождается выбросом гормонов тревоги – катехоламинов (адреналин, норадреналин) и пептидного гормона глюкагона (Плисецкая, 1972), которые способны вызвать активацию гликогенолиза уже после поимки, в период так называемого отдыха рыб. В первый час “отдыха” особенно интенсивный гликогенолиз наблюдался в печени камбалы; по-видимому, он необходим для регенерационной компенсации последствий стресса в тканях и для поддержания углеводного баланса гликогена, а также для стабилизации уровня глюкозы в крови рыб. После трех часов относительного покоя на фоне роста глюконеогенеза в печени за счет увеличения двигательной активности рыб в аквариумах, а также, по-видимому, из-за влияния еще довольно высокого уровня стрессовых гормонов наблюдалось более чем двукратное снижение концентрации гликогена в белых мышцах рыб.
Как показали недавно проведенные исследования, мышцы рыб обладают определенным свойством в отношении расхода или накопления гликогена под действием гормонов (Frolow, Milligan, 2004). При высоком содержании гликогена в мышцах (более 5 мкмоль/г, что соответствует 90 мг%) гормоны стресса стимулируют активность гликогенфосфорилазы и активизируют гликогенолиз. Колебания уровня содержания гликогена в мышцах рыб в первые 3 ч “отдыха” соответствовали установленным нами закономерностям (табл. 1, рис. 1). При более длительном 12-часовом “отдыхе” рыб наблюдалось полное восстановление запасов гликогена в мышцах и печени камбалы, что свидетельствовало о преодолении рыбами стрессовых последствий траловой поимки. Выживаемость камбалы в этих условиях составила 100%.
Таких рыб, как хамса, сельдь, ставрида, сарган и шпрот, многие исследователи относят к “легковозбудимым” рыбам (Шульман и др., 1978; Минюк и др., 1997). Для этих рыб характерно высокое содержание катехоламинов в крови (адреналин, норадреналин), а также пептидного гормона глюкагона и стероидного гомона кортизола в ответ на стресс от поимки и транспортировки (Плисецкая, 1975). В данных условиях гормоны стресса сложным опосредованным путем вызывают стимуляцию в тканях гликогенфосфорилазы – регуляторного фермента, который мобилизует гликоген в мышцах и других тканях для компенсации энергетических издержек в ответ на внешние воздействия. Гликогенфосфорилаза является регуляторным ферментом гликогенолиза, интенсивность которого за считанные секунды может более чем в 10 раз увеличиваться под действием этого энзима (Хочачка, Сомеро, 1977). Траление по своему физиологическому воздействию на шпрота можно приравнять к плаванию с максимальной скоростью. Как было установлено ранее (Силкина, 1991), после такого режима нагрузки падение уровня гликогена в мышцах рыб приобретало драматический характер.
Базовый (контрольный) уровень гликогена в тканях шпрота нам неизвестен. Можно полагать, что шпрот, будучи холодолюбивым оксифильным видом, относится к рыбам с активным липидным обменом и, возможно, поэтому изначально не имеет больших запасов полисахарида в организме. Тем не менее, можно приблизительно оценить концентрацию гликогена до траления, сравнив ее с таковой в мышцах и печени другого “жирного” черноморского вида со сходными физиолого-биохимическими характеристиками – барабули Mullus barbatus ponticus. Это придонная рыба, имеющая активный липидный метаболизм (Шульман и др., 1978). Более ранние исследования, проведенные нами, показали, что в белых и красных мышцах барабули уровень гликогена в покое составлял соответственно 134.0 и 371.0 мг%. Содержание гликогена в печени этой рыбы не превышало 1665.0 мг%, что является довольно низким показателем по сравнению c таковым у других видов (Силкина, 1991). Таким образом, уровень гликогена в белых мышцах шпрота в состоянии покоя мог колебаться в пределах 120–150.0 мг%, в красных мышцах ~300–350.0 мг%, а в печени ~1300–1700.0 мг%.
Траловую поимку для шпрота можно считать стрессом антропогенной природы, которая, по-видимому, соответствует пределу адаптационных возможностей данного вида. Подтверждением этому служит низкая (30%) выживаемость шпрота в процессе “отдыха”. Динамика быстрого восстановления гликогена в мышцах шпрота после трех часов “отдыха” и его снижение в белых мышцах через 6 ч свидетельствовали о противоречивом характере данного процесса. Четырехкратное увеличение содержания гликогена в белых мышцах и почти двукратное – в красных мышцах шпрота через 3 ч “отдыха” стимулировали интерес к рассмотрению вопроса о метаболитах и механизмах, обеспечивающих такую впечатляющую динамику восстановления резервов мышечного гликогена. Можно предположить, что для восстановления мышечного гликогена задействована глюкоза, которую легко доставить в мышцы по транспортной системе крови. Однако наши данные свидетельствуют о том, что у шпрота после траления в основном “депо” резервного гликогена (в печени) данного субстрата почти нет. Это полностью исключает глюкозу из процесса мышечного глюконеогенеза в восстановительном периоде. Кроме того, при изучении роли глюкозы крови рыб в восстановлении мышечного гликогена после изнурительных нагрузок получен отрицательный ответ. В экспериментах, проведенных на форели Oncorhynchus mykiss и зимней камбале Pseudopleuronectes americanus, было убедительно показано, что глюкоза крови рыб не вносит значительного вклада в восстановление мышечного гликогена. Поэтому, в отличие от млекопитающих, у рыб цикл Кори не играет заметной роли в тканевом обмене глюкозы и гликогена (Pagnotta, Milligan, 1991). Однако быстрое восстановление гликогена в мышцах шпрота в период “отдыха” показывает, что в мышцах рыб существует мощная регенерационная система глюконеогенеза, позволяющая быстро восстанавливать израсходованные запасы гликогена. Недавние исследования свидетельствуют о том, что восстановление гликогена в мышцах рыб осуществляется путем реверсивного использования лактата, накопленного в процессе гипоксии и физической нагрузки (Weber et al., 2016).
Высокая гликолитическая способность мышц рыб известна давно, как и способность накапливать и переносить большие концентрации молочной кислоты (Хочачка, Сомеро, 1977). Лактат играет важную роль в углеводном метаболизме рыб не только как конечный продукт гликолиза, но и как субстрат для глюконеогенеза и внутриклеточной сигнализации (Philp et al., 2005). Показано, что накопленный в белых мышцах рыб лактат выделяется в кровь в 10 раз медленнее, чем из мышц у млекопитающих (Wang et al., 1997). Это обусловлено малым числом транспортеров в мембранах мышечных клеток рыб по сравнению с таковым у млекопитающих (Omlin, Weber, 2013). Поэтому мышцы рыб в отношении превращений гликогена ведут себя как квазизакрытая система, распад и ресинтез которого осуществляются по внутриклеточному замкнутому циклу (Weber et al., 2016). Глюконеогенезу из лактата в мышцах рыб после поимки должен способствовать и низкий уровень гликогена. Как показали Фролов и Миллиган (Frolow, Milligan, 2004), на фоне низкой концентрации гликогена и высокого уровня мышечного лактата у рыб происходит резкая активация глюконеогенеза. Скорее всего, низкий уровень гликогена и, возможно, накопление высоких концентраций лактата в мышечных клетках у шпрота после поимки и обеспечивали быстрое реверсное превращение лактата в гликоген у этого вида во время 3-часового “отдыха”.
Через 6 ч восстановительного периода реверсное накопление гликогена было отмечено только в красных мышцах шпрота. В белых мышцах наблюдалось снижение концентрации гликогена, а в печени после траления уровень гликогена не изменялся в течение всего восстановительного периода (табл. 2, рис. 2). Отсутствие положительной динамики в восстановлении гликогена в белых мышцах и печени шпрота можно объяснить неспособностью этого вида рыб преодолеть последствия гормональной “бури” в организме, вызванной поимкой. Хотя аквариумы для рыб значительно лучше, чем трал, но шпрот, по-видимому, в этих условиях также переживает стресс неволи, активно передвигаясь. Исследования показывают, что гормоны стресса (адреналин, норадреналин, кортизол) в крови вызывают изменение микровязкости плазматических мембран эритроцитов, что может приводить к катастрофическим последствиям для организма. Структурные переходы с повышением микровязкости в области липид-липидных и белок-липидных взаимодействий приводят к затруднению передвижения эритроцитов рыб в капиллярах и способствуют развитию диффузионной гипоксии. Особенно опасны эти процессы в сердечной мышце, так как диффузионная гипоксия способна вызвать ее остановку. У теплокровных животных и человека данное явление получило название коронарного синдрома Х и проявляется внезапной остановкой сердца у спортсменов на ответственных соревнованиях (Панин и др., 2012). Необходимо отметить, что мы неоднократно наблюдали большую смертность “возбудимых” рыб (ставрида, барабуля, сельдь, сарган, хамса) при транспортировке их с места вылова в море до аквариального комплекса. При этом транспортируемые рыбы не испытывали недостатка в кислороде и не подвергались воздействию неблагоприятных температурных условий, кроме стресс-фактора беспокойства процесса поимки и самой транспортировки в аквариумы. Можно полагать, что в данном случае гибель рыб была обусловлена нарушениями, связанными с коронарным синдромом Х. Низкая выживаемость шпрота (30%), по нашему мнению, также связана с нарушением гормонами “стресса” вязкостных характеристик крови, что приводит к гибели рыб.
Список литературы
Кухта В.К., Морозкина Т.Е., Олецкий З.И., Таганович А.Д. Биологическая химия: учебник. Минск: Асар. М.: Изд-во БИНОМ. 2008. 688 с.
Минюк Г.С., Шульман Г.Е., Щепкин В.Я., Юнева Т.В. Черноморский шпрот (связь динамики липидов с биологией и промыслом). Севастополь: ЭКОСИ-Гидрофизика. 1997. 137 с.
Морозова А.Л., Астахова Л.П., Силкина Е.Н. Углеводный обмен при плавании рыб, глава VII // Элементы физиологии и биохимии общего и активного обмена у рыб. Киев: Наукова думка. 1978. С. 122–143.
Панин Л.Е., Мокрушников П.В., Князев Р.А. и др. Гормоны стресса и коронарный синдром Х (экспериментальные исследования) // Атеросклероз. 2012. Т. 8. № 2. С. 5–13.
Плисецкая Э.М. О гормональной регуляции углеводного обмена у низших позвоночных (круглоротых и рыб): Автореф. дис. … докт. биол. наук. Ленинград. 1972. 38 с.
Плисецкая Э.М. Гормональная регуляция углеводного обмена у низших позвоночных. Л.: Наука. 1975. 215 с.
Световидов А.Н. Рыбы Черного моря. М.; Л.: Наука. 1964. 551 с.
Силкина Е.Н. Особенности углеводного обмена в скелетных мышцах и печени рыб различной естественной подвижности: Дис. … канд. биол. наук. Ленинград. 1991. 139 с.
Хочачка П., Сомеро Д. Стратегия биохимической адаптации. М.: Мир. 1977. 398 с.
Шульман Г.Е. Физиолого-биохимические особенности годовых циклов рыб. М.: Пищ. пром-сть. 1972. 336 с.
Шульман Г.Е., Щепкин В.Я., Яковлева К.К., Хоткевич Т.В. Липиды и их использование при плавании рыб // Элементы физиологии и биохимии общего и активного обмена у рыб. Киев: Наукова думка. 1978. С. 100–121.
Эмеретли И.В., Русинова О.С. Активность ферментов основных путей окисления углеводов в тканях рыб // Гидробиол. журн. 2001. Т. 37. № 1. С. 79–81.
Black E.C., Connor A.R., Lam K.-C. et al. Changes in glycogen, pyruvate and lactate in rainbow trout (Salmo gairdneri) during and following muscular activity // J. Fish. Res. Board. Can. 1962. V. 19. P. 409–436.
Frolow J., Milligan C.L. Hormonal regulation of glycogen metabolism in white muscle slices from rainbow trout (Oncorhynchus mykiss Walbaum) // Am. J. Physiol.: Regul., Integr. Comp. Physiol. 2004. 287. P. R1344–R1353.
Omlin T., Weber J.-M. Exhausting exercise and tissue-specific expression of monocarboxylate transporters in rainbow trout // Am. J. Physiol.: Regul., Integr. Comp. Physiol. 2013. V. 304. P. R1036–R1043.
Pagnotta A., Milligan C.L. The role of blood glucose in the restoration of muscle glycogen during recovery from exhaustive exercise in rainbow trout (Oncorhynchus mykiss) and winter flounder (Pseudopleuronectes americanus) // J. Exp. Biol. 1991. V. 161. P. 489–508.
Philp A., Macdonald A.L., Watt P.W. Lactate – a signal coordinating cell and systemic function // J. Exp. Biol. 2005. V. 208. P. 4561–4575.
Seifter S., Dayton S., Novic B., Muntwyler E. The estimation of glycogen with the anthrone reagent // Arch. Biochem. Biophys. 1950. V. 25. № 1. P. 191–200.
West T.G., Schulte P.M., Hochachka P.W. Implications of hyperglycemia for post-exercise resynthesis of glycogen in trout skeletal muscle // J. Exp. Biol. 1994. V. 189. P. 69–84.
Wang Y., Wright P.M., Heigenhauser G.J., Wood C.M. Lactate transport by rainbow trout white muscle: kinetic characteristics and sensitivity to inhibitors // Am. J. Physiol.: Regul., Integr. Comp. Physiol. 1997. V. 272. P. R1577–R1587.
Weber J.-M., Choi K., Gonzalez A., Omlin T. Metabolic fuel kinetics in fish: swimming, hypoxia and muscle membranes // J. Exp. Biol. 2016. V. 219. P. 250–258.
Дополнительные материалы отсутствуют.


