Биология моря, 2020, T. 46, № 4, стр. 247-260
Морфология мандибул личинок и взрослых роющих креветок Boasaxius princeps и Leonardsaxius amurensis (Decapoda: Axiidea: Axiidae)
Е. С. Корниенко 1, *, Д. Д. Голубинская 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: kornielena@mail.ru
Поступила в редакцию 09.09.2019
После доработки 09.12.2019
Принята к публикации 19.03.2020
Аннотация
Представлено описание морфологии мандибул роющих креветок Boasaxius princeps (Boas, 1880) и Leonardsaxius amurensis (Kobjakova, 1937) на разных этапах онтогенеза. Резцовый отросток мандибул зоэа аксиид уплощен в передне-заднем направлении, несет 3 терминальных зуба; молярный отросток широкий, жевательная поверхность образована поперечными кутикулярными гребнями и имеет кайму из кистевидных выростов на переднем крае левой мандибулы, а также на заднем крае правой; между терминальной частью резцового отростка и молярным отростком расположен ряд шипов. Основной план строения мандибул сохраняется на всех стадиях зоэа, по мере развития личинок увеличивается количество поперечных гребней на молярном отростке и групп в ряду шипов. На стадии мегалопы форма мандибул изменяется: резцовый отросток становится широким и вогнутым, молярный отросток располагается перпендикулярно к нему; шипы и гребни на жевательной поверхности молярного отростка редуцируются, на резцовом отростке сохраняются мелкие шипы на режущем крае. У взрослых особей кутикулярные образования на жевательной поверхности отсутствуют. Несмотря на заметные различия в морфологии мандибул взрослых особей, отмечено сходство мандибул зоэа Axiidea и некоторых каридных креветок.
Мандибулы – ротовые придатки, участвующие в первичной обработке пищи и выполняющие механическую и сенсорную функции. У десятиногих ракообразных они расположены между лабрумом и максиллулой, состоят из латеральной, гнатальной долей и мандибулярной пальпы; наличие последней не является обязательным. Гнатальная доля представлена резцовым и молярным отростками, степень развития которых может значительно варьировать до полного отсутствия одного из них (Felgenhauer, Abele, 1985; Буруковский, 2009; Tudge et al., 2012; Ashelby et al., 2015, и др.). Морфология мандибул взрослых декапод детально описана у некоторых видов Caridea (Felgenhauer, Abele, 1985; Storch et al., 2001; Ashelby et al., 2015), Brachyura (Factor, 1982; Carvalho et al., 2017), Anomura (Garm, Høeg, 2000; Garm, 2004a; Jaszkowiak et al., 2015), Astacidea и Achelata (Sahlmann et al., 2011), Gebiidea и Axiidea (Nickell et al., 1998; Pinn et al., 1999).
Бентосные десятиногие ракообразные в онтогенезе проходят несколько пелагических стадий зоэа и стадию мегалопы, на которой происходит оседание. При светооптических исследованиях небольшие размеры и сложная трехмерная конфигурация мандибул личинок декапод не позволяли выявить отдельные детали их строения. Описания мандибулы зоэа I, полученные с помощью сканирующего электронного микроскопа (СЭМ), известны для нескольких видов Brachyura (Greenwood, Fielder, 1979; Factor, 1982; Minagawa, Takashima, 1994; Meyer et al., 2006; Lumasag et al., 2007), Anomura (Geiselbrecht, Melzer, 2010), Caridea (Geiselbrecht, Melzer, 2010; Tziouveli et al., 2011; Batel et al., 2014), Astacidea и Achelata (Factor, 1978; Wolfe, Felgenhauer, 1991; Lavalli, Factor, 1992; Johnston et al., 2008). У краба Menippe mercenaria (Brachyura) описана морфология мандибул нескольких стадий зоэа, мегалопы, ювенильной и взрослой особей (Factor, 1982). Результаты изучения мандибул зоэа и мегалопы приведены в работе, посвященной исследованию развития пищеварительной системы у краба Scylla serrata (Brachyura, Portunidae) (см.: Lumasag et al., 2007). Среди Caridea мандибулы описаны у зоэа I–V двух видов креветок-палемонид (Batel et al., 2014), у первой и последней стадий зоэа креветки Lysmata amboinensis (Lysmatidae) (см.: Tziouveli et al., 2011). В той или иной степени изучена морфология мандибул на разных стадиях развития Achelata (Wolfe, Felgenhauer, 1991; Johnston, Ritar, 2001) и Astacidea (Factor, 1978; Lavalli, Factor, 1992).
Данные о морфологии мандибул востребованы в таксономии ракообразных и в филогенетических построениях, хотя существует мнение, что форма мандибулы взрослой особи дает представление в первую очередь о рационе и способе питания вида. В тоже время на ранних этапах развития декапод отмечено значительное сходство морфологии мандибул у близкородственных видов, а различия, обнаруженные с помощью СЭМ, служат ценными видоспецифическими или диагностическими признаками (Geiselbrecht, Melzer, 2010).
Инфраотряды Axiidea и Gebiidea выделены относительно недавно на основании молекулярно-генетических исследований (Bracken et al., 2009; Robles et al., 2009, и др.). В настоящее время этой классификации придерживается большинство карцинологов (Poore et al., 2014). Однако положение Gebiidea и Axiidea среди Reptantia остается плохо разрешенным (Lin et al., 2012) и дополнительная информация, в том числе о морфологии личинок этих групп, может оказаться полезной применительно к филогении.
Роющие креветки инфраотрядов Axiidea и Gebiidea по способу питания относятся к грунтоедам, фильтраторам или падальщикам, но в зависимости от доступности пищи могут изменять пищевые предпочтения (Griffis, Suchanek, 1991; Nickell, Atkinson, 1995; Nickell et al., 1998; Pinn et al., 1999). Общий план строения мандибул взрослых Gebiidea и Axiidea совпадает, незначительные различия касаются количества зубцов на резцовом отростке и вооружения пальпы (Nickell et al., 1998; Stamhuis et al., 1998; Pinn et al., 1999). Однако исследование мандибул зоэа I трех видов Upogebia (Gebiidea: Upogebiidae) и двух видов Nihonotrypaea (Axiidea: Callianassidae) показало, что у них заметно различаются не только вооружение резцового и молярного отростков, но и общая форма мандибул, которая у первых ближе к таковой у Anomura, а у вторых – к Caridea (Корниенко, Голубинская, 2018). Семейство Axiidae, к которому относятся Boasaxius princeps и Leonardsaxius amurensis, считается наиболее древней группой Axiidea (Lin et al., 2012; Hyžný, Klompmaker, 2015). Сравнительный анализ морфологии мандибул зоэа у этих видов и у изученных ранее представителей семейства Callianassidae (Корниенко, Голубинская, 2018) позволит выявить различия на уровне родов и семейств.
Цель настоящего исследования – описание морфологии гнатальной части мандибул у двух представителей семейства Axiidae на разных этапах онтогенеза и оценка полученных данных с точки зрения применения в филогенетических построениях.
МАТЕРИАЛ И МЕТОДИКА
Зоэа I роющих креветок Boasaxius princeps и Leonardsaxius amurensis семейства Axiidae выделены из планктонных проб, взятых в районе биостанции “Восток” ННЦМБ ДВО РАН (зал. Восток, Японское море) в июле 2017 и 2018 гг. Отловленных здесь же взрослых креветок (по одной особи каждого вида) фиксировали и хранили в 70% этаноле. Зоэа I B. princeps и L. amurensis идентифицировали до вида с помощью определительного ключа, основанного на морфологических признаках (Корн и др., 2017). Личинок фиксировали по предложенной ранее методике (Meyer, Melzer, 2004) и хранили в 70% этаноле. У 20–25 экз. зоэа I каждого вида извлекали отдельно левую и правую мандибулы. Для описания морфологии мандибул на старших стадиях развития использовали личинок, выращенных ранее в лабораторных условиях и фиксированных 4% раствором формальдегида на морской воде (Kornienko et al., 2014, 2018). Для анализа выбраны стадии зоэа, на которых мандибулы уже имели хорошо заметную почку пальпы (L. amurensis – зоэа III, B. princeps – зоэа V), и заключительные стадии зоэа (L. amurensis – зоэа V, B. princeps – зоэа VIII). Препарировали по 5–6 зоэа каждой стадии и по 3 мегалопы каждого вида; левую и правую мандибулы извлекали отдельно.
Мандибулы зоэа I и взрослых особей обезвоживали в серии этанола (70, 90, две смены 95% – по 10 мин в каждой) и ацетона (этанол : ацетон – 3 : 1, 1 : 1, 1 : 3, две смены ацетона по 10 мин в каждой). Фиксированные в формальдегиде образцы зоэа старших стадий и мегалоп отмывали в двух порциях дистиллированной воды и обезвоживали в серии этанола (15, 30, 50, 70%). Затем мандибулы препарировали и окончательно обезвоживали, как описано выше. К сожалению, фиксированные в формальдегиде мандибулы мегалоп L. amurensis стали очень хрупкими и были утрачены в процессе обработки.
Высушенные в двуокиси углерода до критической точки образцы монтировали на SEM-столики с самоклеящимися углеродными наклейками, мандибулы личинок напыляли хромом, мандибулы взрослых особей – золотом. Фотографии делали на СЭМ Zeiss Sigma 300VP в Дальневосточном центре электронной микроскопии ННЦМБ ДВО РАН.
Для обозначения выростов кутикулы с крепким основанием и несколькими зубцами на вершине, расположенных по краям жевательной поверхности молярного отростка мандибул зоэа, использовали термин “кистевидные выросты”. В литературе эти образования известны как прочные шипы с маленькими зубчиками на дистальном конце (stout spines with small denticles on its distal end, см.: Richter et al., 2002), кистевидные выросты (brush-like protrusions, см.: Tziouveli et al., 2011) или пальцевидные отростки (finger-like projections, см.: Ashelby et al., 2015). Расположенные на боковой поверхности мандибул мелкие кутикулярные выросты, похожие на щетинки, мы называем зубчиками (denticles), так как у их основания нет базального кольца (Garm, 2004b). Сторону мандибул, обращенную к лабруму, указываем как внешнюю (вид спереди), противоположную ей – как внутреннюю (вид сзади). При описании гнатальной части мандибул старших стадий зоэа отмечали только изменения в морфологии (Clark et al., 1998). Видовые названия приведены в соответствии с последними переописаниями (Sakai, 2011, 2017; Marin, 2015).
РЕЗУЛЬТАТЫ
Мандибулы зоэа роющих креветок
Основная форма мандибул зоэа Boasaxius princeps и Leonardsaxius amurensis (рис. 1) – толстая изогнутая овальная трубка. Молярный и резцовый отростки хорошо отделены друг от друга. В дистальной части форма поперечного сечения мандибулы в виде запятой. Резцовый отросток расположен вентрально, заметно уплощен в передне-заднем направлении и вооружен тремя мощными терминальными зубами разного размера. На левой мандибуле резцовый отросток сдвинут к ее внешней боковой поверхности, на правой мандибуле – к внутренней. На левой мандибуле к основанию одного из терминальных зубов резцового отростка с внутренней стороны плотно прилегает плоский шип; на правой мандибуле этот шип расположен с внешней стороны. Широкий молярный отросток находится дорсальнее резца. В молярной части левой мандибулы с внутренней стороны хорошо виден расположенный за пределами жевательной поверхности крупный гладкий шип, который отсутствует на правой мандибуле. Форма жевательной поверхности левой мандибулы близка к треугольной, правой – к овальной. На дорсальной и латеральных поверхностях молярного отростка расположены группы плоских зубчиков длиной от 2 до 8 мкм (рис. 2ж). На резцовом отростке между его терминальной частью и молярным отростком находится ряд шипов (далее – промежуточный ряд), состоящий из нескольких групп шипов. У зоэа I мандибулярная пальпа отсутствует, у старших стадий несегментированная пальпа расположена дорсолатерально на внешней стороне молярного отростка.
Рис. 1.
Вентральный вид препарированных зоэа I Boasaxius princeps (а) и Leonardsaxius amurensus (б). Обозначения: an – антенна, lab – лабрум, mbl – левая мандибула, mbr – правая мандибула. Масштаб: 100 мкм.

Рис. 2.
Морфология левой (а–в, з–к) и правой (г–е, л, м) мандибул зоэа I Boasaxius princeps и кутикулярные выросты на боковой поверхности мандибул (ж). а, г – вид со стороны жевательной поверхности; б, д – вид спереди; в, е – вид сзади; з, л – дорсальная часть молярного отростка; и, к, м – ряд шипов между резцовым и молярным отростками мандибул (и – вид шипов с внешней, к – с внутренней стороны). Обозначения здесь и далее: bp – кистевидный вырост; fs – плоский шип; ip – резцовый отросток; mp – молярный отросток; s – шип за пределами жевательной поверхности молярного отростка. Масштаб: а–е, м – 10 мкм; ж–л – 4 мкм.

Boasaxius princeps (рис. 2, 3)
Рис. 3.
Морфология мандибул зоэа V (а–е) и зоэа VIII (ж–м) Boasaxius princeps. а, в, и, л – вид со стороны жевательной поверхности (здесь и далее mlp – мандибулярная пальпа); б, г, к, м – ряд шипов между резцовым и молярным отростками мандибул; д–з – дорсальная часть молярного отростка. Масштаб: а–г, и–м – 20 мкм; д–з – 10 мкм.

Зоэа I (рис. 2)
Левая мандибула (рис. 2а–2в, 2з–2к). Дорсальная часть молярного отростка узкая, немного приподнята и несет несколько небольших шипов, отделена от жевательной поверхности заметным гребнем с мелкими шипами на вершине (рис. 2з). В вентральной части молярного отростка жевательную поверхность ограничивает гребень с одним рядом мелких шипов на вершине. Рельеф центральной части образован четырьмя поперечными гребнями, на их вершинах два ряда мелких шипов. На внешнем крае жевательной поверхности 3 гребня начинаются с кистевидных выростов. Похожим выростом гребни могут заканчиваться и на внутреннем крае. Промежуточный ряд состоит из двух групп шипов (рис. 2в). Первая группа – мелкие шипы, основания которых сливаются, высота этого образования около 4 мкм; вторая группа – два уплощенных шипа длиной около 10 мкм, их поверхность с внутренней стороны гладкая, а с внешней стороны покрыта небольшими зубчиками (рис. 2и, 2к). Наиболее крупные поры находятся между гребнями молярного отростка, на основании первой группы шипов и на одном из терминальных шипов резцового отростка.
Правая мандибула (рис. 2г–2е, 2л, 2м). Дорсальная часть молярного отростка немного приподнята и состоит из двух лопастей, вооруженных небольшими шипами (рис. 2л). Рельеф жевательной поверхности в нижней части образован группами мелких шипов, имеющих общее основание. В центральной части жевательной поверхности расположены 5 поперечных гребней с рядами мелких шипов на вершине. Высота гребней увеличивается от внешнего к внутреннему краю жевательной поверхности. Четыре гребня на внутреннем крае заканчиваются кистевидными выростами. Гребень, отделяющий дорсальную часть молярного отростка, такого выроста не имеет. Промежуточный ряд состоит из двух групп шипов, основания которых сливаются (рис. 2м). У первой группы шипов общее основание округлое, у второй группы оно вытянуто вдоль оси; внутренняя сторона шипов гладкая, внешняя сторона покрыта мелкими зубчиками. На поверхности резцового и молярного отростков отмечены поры, наиболее крупные находятся между гребнями жевательной поверхности.
Зоэа V (рис. 3а–3е)
Левая мандибула (рис. 3а, 3б, 3д). На внутреннем и внешнем краях дорсальной части молярного отростка расположено по 2–3 кистевидных выроста. Один кистевидный вырост виден на внешнем крае гребня, отделяющего дорсальную часть от жевательной поверхности (рис. 3д). У внутреннего края жевательной поверхности располагаются отдельные шипы с заостренными вершинами. От середины жевательной поверхности начинаются 7–8 поперечных гребней, которые состоят из отдельных шипов с 2–4 острыми вершинами и заканчиваются на внешнем крае двумя кистевидными выростами. Промежуточный ряд из пяти групп шипов (рис. 3б).
Правая мандибула (рис. 3в, 3г, 3е). На внутреннем и внешнем краях приподнятой дорсальной части молярного отростка по 2–3 кистевидных выроста (рис. 3е). Рельеф жевательной поверхности образуют 11–12 поперечных гребней, которые прослеживаются от центральной части до внутреннего края и заканчиваются двумя кистевидными выростами. Остальная поверхность покрыта небольшими шипами с 1–4 заостренными вершинами. Промежуточный ряд из шести групп шипов (рис. 3г).
Зоэа VIII (рис. 3ж–3м)
Левая мандибула (рис. 3ж, 3и, 3к). На внешнем крае дорсальной части молярного отростка расположено 3–4 кистевидных выроста (рис. 3ж). На жевательной поверхности 8–9 гребней с 2–3 кистевидными выростами у внешнего края. Промежуточный ряд из семи групп шипов (рис. 3к).
Правая мандибула (рис. 3з, 3л, 3м). На внутреннем и внешнем краях приподнятой дорсальной части молярного отростка по 3–4 кистевидных выроста (рис. 3з). Рельеф жевательной поверхности молярного отростка образован 12–14 гребнями с кистевидными выростами. Количество групп шипов в промежуточном ряду увеличивается до восьми (рис. 3м).
Leonardsaxius amurensis (рис. 4, 5)
Рис. 4.
Морфология левой (а–в, ж–и) и правой (г–е, к–м) мандибул зоэа I Leonardsaxius amurensis. а, г – вид со стороны жевательной поверхности; б, д – вид спереди; в, е – вид сзади; ж, к – дорсальная часть молярного отростка; з, и, л – ряд шипов между резцовым и молярным отростками мандибул (з – вид шипов с внешней, и – с внутренней стороны); м – край жевательной поверхности с кистевидными выростами. Масштаб: а–е – 20 мкм; ж–и, м – 4 мкм; л – 10 мкм.

Рис. 5.
Морфология мандибул зоэа III (а–е) и зоэа V (ж–м) Leonardsaxius amurensus. а, в, и, л – вид со стороны жевательной поверхности; б, г, к, м – ряд шипов между резцовым и молярным отростками мандибул; д–з – дорсальная часть молярного отростка. Масштаб: а–г, и–м – 20 мкм; д–з – 10 мкм.

Зоэа I (рис. 4)
Левая мандибула (рис. 4а–4в, 4ж–4и). Дорсальная часть молярного отростка узкая, заметно приподнятая, гладкая; у ее основания многочисленные мелкие шипики; от жевательной поверхности отделена небольшим гребнем (рис. 4ж). Жевательную поверхность с внутренней стороны окаймляют 5–6 плоских шипов; рельеф в центральной части представлен расположенными в виде чешуек уплощенными шипами с одной или несколькими заостренными вершинами. По направлению к внешнему краю шипы объединяются в 6–8 рядов, которые заканчиваются кистевидными выростами. Промежуточный ряд из двух групп шипов (рис. 4з, 4и, 4л). В первой группе шипы сливаются, образуя единый вырост длиной 7–9 мм с несколькими вершинами. Вторая группа состоит из двух уплощенных шипов длиной около 18 мкм. С внутренней стороны шипы гладкие, а с внешней стороны покрыты небольшими зубчиками. На поверхности молярного и резцового отростков видны поры, наиболее крупные находятся в дорсальной части молярного отростка, между гребнями жевательной поверхности и на одном из терминальных шипов резца.
Правая мандибула (рис. 4г–4е, 4к–4м). Дорсальная часть молярного отростка широкая, немного приподнята; состоит из двух лопастей, вооруженных небольшими шипами (рис. 4к). Жевательная поверхность овальной формы, в нижней части ее ограничивает гребень с мелкими шипами на вершине, центральная часть покрыта шипами с одной или несколькими вершинами. Вдоль внутреннего края жевательной поверхности шипы образуют 9–11 коротких поперечных рядов, которые завершаются кистевидными выростами (рис. 4м). Промежуточный ряд состоит из двух групп шипов (рис. 4л). Собранные компактно шипы первой группы имеют общее основание округлой формы. У второй группы шипов общее основание вытянутое; внутренняя сторона шипов гладкая, а внешняя покрыта мелкими зубчиками. На поверхности резцового и молярного отростков видны поры, наиболее крупные находятся между гребнями и в дорсальной части жевательной поверхности.
Зоэа III (рис. 5а–5е)
Левая мандибула (рис. 5а, 5б, 5д). Дорсальная часть молярного отростка представляет собой узкий выступ, отделенный от жевательной поверхности небольшим плато с мелкими шипами и гребнем; несколько кистевидных выростов наиболее отчетливо видны на внешнем крае. Рельеф жевательной поверхности образован 8–9 гребнями с мелкими шипами на вершинах. Каждый гребень начинается на внешнем крае двумя кистевидными выростами и заканчивается примерно посередине поверхности. У внутреннего края расположены уплощенные шипы в виде чешуек. Вентральной границей жевательной поверхности служит заметный гребень с рядом шипов на вершине. Количество групп шипов в промежуточном ряду увеличивается до четырех (рис. 5б).
Правая мандибула (рис. 5в, 5г, 5е). Дорсальная часть молярного отростка широкая, приподнятая, покрыта небольшими шипами; на внутреннем и внешнем краях расположено по 2 кистевидных выроста (рис. 5е). От внешнего края к центру жевательная поверхность покрыта небольшими шипами с 1–4 заостренными вершинами. От центра поверхности начинаются 12–13 поперечных гребней с мелкими шипами на вершинах. На внутреннем крае гребни заканчиваются 1–2 кистевидными выростами. Промежуточный ряд из пяти групп шипов (рис. 5г).
Зоэа V (рис. 5ж–5м)
Левая мандибула (рис. 5ж, 5и, 5к). Количество поперечных гребней с кистевидными выростами у внешнего края жевательной поверхности увеличивается до 11–12. Промежуточный ряд из шести групп шипов (рис. 5к).
Правая мандибула (рис. 5з, 5л, 5м). Рельеф жевательной поверхности молярного отростка образован 12–13 гребнями с кистевидными выростами. Количество групп шипов в промежуточном ряду увеличивается до восьми (рис. 5м).
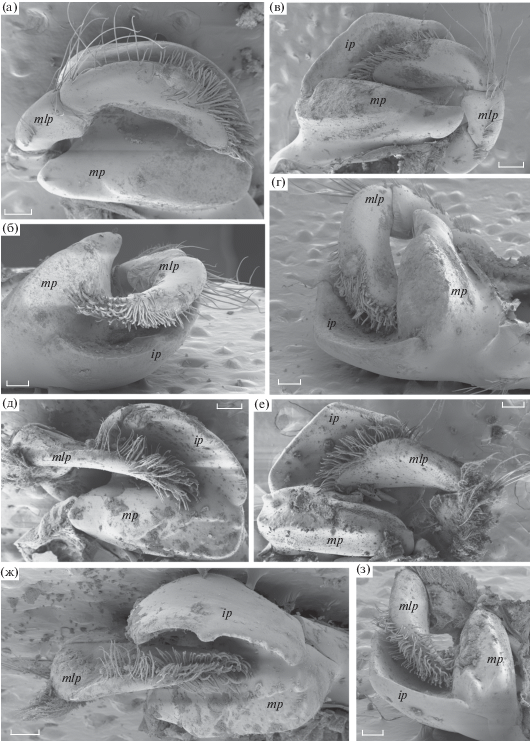
Мандибулы мегалопы Boasaxius princeps (рис. 6)
Мандибулы ложковидной формы, резцовый и молярный отростки расположены перпендикулярно друг к другу. Уплощенный слабовогнутый резцовый отросток направлен антеровентрально. Резцовый отросток левой мандибулы округлой формы, на его внутренней стороне в центральной части небольшое утолщение, вдоль режущего края видны небольшие шипы. На резцовом отростке правой мандибулы в центральной части режущего края заметный зубообразный выступ; шипы на внутренней стороне режущего края редкие и малозаметные. Молярный отросток широкий, его боковая поверхность с внутренней стороны покрыта группами мелких плоских зубчиков. В месте соединения с резцом расположен тупой шип. Жевательная поверхность ограничена небольшим кутикулярным валиком, который прерывается на внутренней стороне молярного отростка. Мандибулярная пальпа трехчлениковая, на дистальном членике многочисленные перисто-зубчатые и перистые щетинки разной длины.
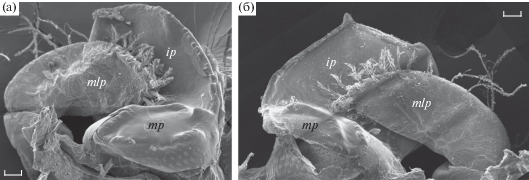
Мандибулы взрослых Boasaxius princeps (рис. 7а–7г) и Leonardsaxius amurensis (рис. 7д–7з)
Рис. 7.
Морфология мандибул взрослых особей Boasaxius princeps (а–г) и Leonardsaxius amurensus (д–з). а, б, д, ж – левая мандибула; в, г, е, з – правая мандибула. Масштаб: 200 мкм.
Резцовый и молярный отростки сильно склеротизированные. Резцовый отросток мощный, внутренне-вогнутый, вентральная (внешняя) поверхность гладкая. Край резцового отростка левой мандибулы скругленный (рис. 7а, 7д), правой – тупозаостренный (рис. 7в, 7е). На левой мандибуле с внутренней стороны резца небольшое утолщение, которое заканчивается тупым выступом на режущем крае, более заметным у L. amurensis. Режущий край левой мандибулы B. princeps гладкий; у L. amurensis на нем видны тонкие поперечные складки кутикулы и несколько мелких зубцов. Широкий сплюснутый молярный отросток расположен дорсально и кзади от резца, заострен с внешней стороны и слегка расширяется в медиальном направлении; рельеф жевательной поверхности состоит из небольших впадин и бугорков. У L. amurensis на медиальном крае жевательной поверхности обеих мандибул видны 1–2 небольших тупых шипа, которые не обнаружены у B. princeps. Внутренняя боковая поверхность молярного отростка покрыта группами мелких зубчиков. Пальпа прикрепляется на дорсолатеральной стороне мандибулы. Уплощенный дистальный членик мандибулярной пальпы, вооруженный многочисленными перисто-зубчатыми щетинками, лежит в борозде, образованной молярным и резцовым отростками. У обоих видов щетинки присутствуют и на двух других члениках пальпы. У B. princeps их вооружение состоит из редких простых и перистых щетинок, наиболее длинные из них расположены в дистальной части среднего и в проксимальной части дистального члеников. У L. amurensis на этих члениках перистые щетинки образуют густую бахрому.
ОБСУЖДЕНИЕ
О биологии включенных в исследование видов аксиид известно немного. Тело Boasaxius princeps хорошо склеротизировано, покрыто пучками перистых щетинок; общая длина (TL) может достигать 200 мм, длина карапакса (СL) – 70–80 мм. У Leonardsaxius amurensis TL достигает 80 мм, СL – 30 мм; карапакс гладкий, с простыми щетинками на дорсальной поверхности. Известно, что L. amurensis строит норы на песчано-илистых или илистых грунтах, B. princeps – на песчаных, каменистых, гравийных или ракушечно-известняковых субстратах как под большими камнями, так и у основания валунов или камней, редко – на илистом дне (Marin, 2015). Сведения о пищевых предпочтениях видов отсутствуют. В процессе развития B. princeps проходит 8, а L. amurensis – 5 стадий зоэа и стадию мегалопы (Kornienko et al., 2014, 2018).
Исследование мандибул L. amurensis и B. princeps на разных стадиях развития показало, что у зоэа они обладают набором общих характеристик. Гнатальная часть мандибулы зоэа состоит из широкого молярного и уплощенного в передне-заднем направлении резцового отростков. Левый резцовый отросток сдвинут к передней (внешней) поверхности мандибулы, правый – к задней (внутренней). Жевательная поверхность молярного отростка, образованная поперечными кутикулярными гребнями с рядами мелких шипов на вершинах, на правой мандибуле овальной формы, на левой – почти треугольной. Для обоих видов характерно присутствие на молярном отростке кистевидных выростов – кутикулярных образований с крепким основанием и 3–7 зубцами на дистальном конце. Кистевидные выросты образуют по краям жевательной поверхности бахрому с открытыми промежутками (Edgecombe et al., 2003). У исследованных видов на левой мандибуле бахрома находится на внешнем крае молярного отростка, на правой мандибуле – на внутреннем. Между дистальными зубами резцового отростка и молярным отростком расположен промежуточный ряд шипов (Richter et al., 2002); форма, размер и количество шипов, составляющих этот ряд, на правой и левой мандибулах различаются. Асимметрию правой и левой мандибул усиливает присутствие на молярном отростке левой мандибулы крупного гладкого шипа, лежащего за пределами жевательной поверхности. Поскольку мандибулы исследованных ранее зоэа I Nihonotrypaea japonica и N. makarovi (Callianassidae) обладают всеми перечисленными выше признаками (Корниенко, Голубинская, 2018), эти характеристики могут оказаться общими для представителей инфраотряда Axiidea.
В результате проведенного ранее исследования строения мандибул зоэа I N. japonica и N. makarovi видоспецифических характеристик не обнаружено (Корниенко, Голубинская, 2018). В настоящей работе показано, что виды, принадлежащие к разным родам, различаются строением дорсальной части молярного отростка мандибул и количеством гребней на жевательной поверхности. Различие на уровне семейств – вооружение резцового отростка, в дистальной части которого у Leonardsaxius и Boasaxius (семейство Axiidae) расположены 3 зуба, а у Nihonotrypaea (семейство Callianassidae) – 2 (Корниенко, Голубинская, 2018). Основной план строения мандибул сохраняется на всех стадиях зоэа, но от стадии к стадии увеличивается количество гребней на жевательной поверхности молярного отростка и число групп в промежуточном ряду шипов.
Сравнительный анализ собственных и литературных данных показал, что мандибулы зоэа исследованных нами видов Axiidea и личинок некоторых Caridea и Achelata обладают общими характеристиками. Если сходство с мандибулами зоэа креветок-палемонид (Geiselbrecht, Melzer, 2010; Batel et al., 2014) ограничено общей формой и строением резца, то у личинок каридной креветки Lysmata amboinensis (Lysmatidae), как и у зоэа B. princeps и L. amurensis, на молярном отростке присутствуют гребни и кистевидные выросты; между дистальными зубами резцового отростка и моляром расположен ряд шипов, количество которых в ряду, как и гребней на молярном отростке, увеличивается по мере развития зоэа (Tziouveli et al., 2011). У филосом Palinuridae стройный резцовый отросток мандибул также сильно уплощен в передне-заднем направлении и несет несколько крупных мощных терминальных зубов, между ними и молярным отростком находится ряд шипов (Wolfe, Felgenhauer, 1991; Johnston, Ritar, 2001). У отдельных видов, например, у лангуста Jasus edwardsii, на молярном отростке мандибулы филосом видны кистевидные выросты (Wolfe, Felgenhauer, 1991, см. рис. 6).
Известно, что в процессе развития декапод кардинальные изменения в строении мандибул происходят на стадии мегалопы при переходе к бентосному образу жизни (Factor, 1982; Minagawa, Takashima, 1994; Lumasag et al., 2007). Полученные нами результаты подтверждают справедливость этого и в отношении аксиид. На стадии мегалопы меняется взаимоположение резцового и молярного отростков, ширина резцового отростка заметно увеличивается, асимметрия правой и левой мандибул мегалопы ограничивается формой резцовых отростков и присутствием срединного зубца на режущем крае правой мандибулы. Кутикулярные образования на поверхности отростков почти полностью отсутствуют, мандибулярная пальпа становится трехчлениковой, на ее дистальном членике появляются щетинки. Общий план строения, характерный для мандибул мегалоп, сохраняется у взрослых особей, но мандибулы становятся более мощными, срединный зубец на правой мандибуле редуцируется, утолщение на внутренней стороне левого резцового отростка более заметно. Кутикулярные образования представлены мелкими зубчиками на внутренней боковой поверхности молярного отростка и щетинками на члениках пальпы. Форма и строение мандибул взрослых особей B. princeps и L. amurensis в целом соответствуют описанию этих придатков у декапод из инфраотрядов Axiidea и Gebiidea (Dworschak et al., 2012).
В немногочисленных исследованиях с помощью СЭМ мандибул взрослых бентосных Brachyura (Factor, 1982; Carvalho et al., 2017), Anomura (Garm, Høeg, 2000; Garm, 2004a; Jaszkowiak et al., 2015), Astacidea и Achelata (Sahlmann et al., 2011) кутикулярные выросты на молярном и резцовом отростках также не обнаружены. В то же время внутри инфраотряда Caridea строение мандибул у видов различается не только наличием или отсутствием пальпы, разной формой и степенью развития молярного и резцового отростков (Felgenhauer, Abele, 1985; Storch et al., 2001; Буруковский, 2009; Ashelby et al., 2015), но и разнообразием типов кутикулярных образований на поверхности молярного отростка (Ashelby et al., 2015).
Изучение мандибул зоэа I девяти видов декапод, принадлежащих к разным инфраотрядам, показало, что в их строении присутствуют филогенетически важные признаки; предложен основной эволюционный тренд от стройной мандибулы, как у Caridea, к массивной и толстой мандибуле, как у Brachyura (Geiselbrecht, Melzer, 2010). Согласно нашим данным, у зоэа Gebiidea строение мандибул ближе к Anomura, а у Axiidea – к каридным креветкам (Корниенко, Голубинская, 2018).
В отличие от мандибул взрослых Reptantia, у которых, как отмечено выше, гнатальная часть мандибул не вооружена, у зоэа Brachyura, Anomura, Gebiidea, Axiidea и филосом Achelata на мандибулах присутствуют разнообразные кутикулярные выросты. У зоэа первых трех инфраотрядов они представлены отдельными мелкими зубцами, бугорками и шипами, которые в основном вооружают внешние края (Greenwood, Fielder, 1979; Factor, 1982; Minagawa, Takashima, 1994; Meyer et al., 2006; Lumasag et al., 2007; Geiselbrecht, Melzer, 2010; Корниенко, Голубинская, 2018). У всех исследованных видов Axiidea вооружение гнатальной доли мандибул зоэа состоит из кутикулярных выростов разных типов, которые на жевательной поверхности организованы в ряды и гребни, присутствует ряд шипов между резцовым отростком и жевательной поверхностью молярного отростка. И хотя описанные нами мандибулы взрослых Axiidea заметно отличаются от мандибул каридной креветки Lysmata amboinensis, состоящих только из молярного отростка с отчетливыми зубцами (Hayashi, 1975), строение мандибул зоэа L. amboinensis (см.: Tziouveli et al., 2011) демонстрирует сходство морфологии с мандибулами Axiidea не только в основной форме, но и в деталях строения гнатальной доли.
Наши исследования показали, что морфология мандибул зоэа Axiidea соответствует базальной модели строения мандибул ракообразных: гнатальная доля мандибулы состоит из молярного и резцового отростков; поверхность молярного отростка формируют поперечные гребни с кистевидными выростами, которые на внешнем (левая мандибула) или внутреннем (правая мандибула) крае жевательной поверхности образуют открытую бахрому; между дистальными шипами резцового отростка и молярным отростком располагается ряд шипов, состоящий из нескольких групп шипов. Асимметрию правой и левой мандибул усиливает присутствие на молярном отростке левой мандибулы крупного гладкого шипа, лежащего за пределами жевательной поверхности. На стадии мегалопы при переходе от пелагического образа жизни к бентосному радикально изменяется форма мандибул, кутикулярные образования на поверхности молярного и резцового отростков редуцируются и у взрослых особей исчезают. Различия в строении мандибул зоэа, незаметные у близкородственных видов (например, у N. japonica и N. makarovi), на уровне родов проявляются в разном количестве гребней на поверхности и в строении дорсальной части молярного отростка. Виды, принадлежащие к разным семействам, различаются по количеству терминальных зубцов на резцовом отростке. Несмотря на различия в морфологии мандибул взрослых особей, мандибулы зоэа Axiidea демонстрируют заметное сходство с мандибулами личинок каридных креветок семейства Lysmatidae.
Список литературы
Буруковский Р.Н. Питание и пищевые взаимоотношения креветок. Калининград: Изд-во ФГОУ ВПО “КГТУ”. 2009. 409 с.
Корн О.М., Голубинская Д.Д., Корниенко Е.С. Ключ для определения зоэа роющих креветок инфраотрядов Gebiidea и Axiidea из залива Петра Великого Японского моря // Биол. моря. 2017. Т. 43. № 5. P. 341–348.
Корниенко Е.С., Голубинская Д.Д. Морфология мандибул зоэа I роющих креветок родов Upogebia (Gebiidea) и Nihonotrypaea (Axiidea) // Биол. моря. 2018. Т. 44. № 4. С. 243–254.
Ashelby C.W., De Grave S., Johnson M.L. Preliminary observations on the mandibles of palaemonoid shrimp (Crustacea: Decapoda: Caridea: Palaemonoidea) // PeerJ. 2015. V. 3. P. e846.
Batel A., Melzer R.R., Anger K., Geiselbrecht H. Heterochrony in mandible development of larval shrimp (Decapoda: Caridea) – a comparative morphological SEM study of two carideans // J. Morphol. 2014. V. 275. P. 1258–1272.
Bracken H.D., Toon A., Felder D.L. et al. The decapod tree of life: compiling the data and moving toward a consensus of decapod evolution // Arthropod Syst. Phyl. 2009. V. 67. P. 99–116.
Carvalho D.A., Viozzi M.F., Collins P.A., Williner V. Functional morphology of comminuting feeding structures of Trichodactylus borellianus (Brachyura, Decapoda, Trichodactylidae), an omnivorous freshwater crab // Arthropod Struct. Dev. 2017. V. 46. P. 472–482.
Clark P.F., Calazans D.K., Pohle G.W. Accuracy and standardization of brachyuran larval descriptions // Inverteb. Reprod. Dev. 1998. V. 33. P. 127–144.
Dworschak P.R.C., Felder D., Tudge C.C. Infraorders Axiidea de Saint Laurent, 1979 and Gebiidea de Saint Laurent, 1979 (formerly known collectively as Thalassinidea) // The Crustacea. Leiden; Boston: Brill. 2012. V. 9B. P. 109–220.
Edgecombe G.D., Richter S., Wilson G.D.F. The mandibular gnathal edges: Homologous structures throughout Mandibulata? // Afr. Invertebr. 2003. V. 44. P. 115–135.
Factor J.R. Morphology of the mouthparts of larval lobsters, Homarus americanus (Decapoda: Nephropidae), with special emphasis on their setae // Biol. Bull. 1978. V. 154. P. 383–408.
Factor J.R. Development and metamorphosis of the feeding apparatus of the stone crab, Menippe mercenaria (Brachyura, Xanthidae) // J. Morphol. 1982. V. 172. P. 299–312.
Felgenhauer B.E., Abele L.G. Feeding structures of two atyid shrimps, with comments on caridean phylogeny // J. Crustacean. Biol. 1985. V. 5. P. 397–419.
Garm A. Mechanical functions of setae from the mouth apparatus of seven species of decapod crustaceans mandible // J. Morphol. 2004a. V. 260. P. 85–100.
Garm A. Revising the definition of the crustacean seta and setal classification systems based on examinations of the mouthpart setae of seven species of decapods // Zool. J. Linn. Soc. Lond. 2004b. V. 142. P. 233–252.
Garm A., Høeg J.T. Functional mouthpart morphology of the squat lobster Munida sarsi, with comparison to other anomurans // Mar. Biol. 2000. V. 137. P. 123–138.
Geiselbrecht H., Melzer R.R. Mandibles of zoea I larvae of nine decapod species: a scanning EM analysis (Crustacea, Decapoda) // Spixiana. 2010. V. 33. P. 27–47.
Griffis R.B., Suchanek T.H. A model of burrow architecture and trophic modes in thalassinidean shrimp (Decapoda: Thalassinidea) // Mar. Ecol.: Prog. Ser. 1991. V. 79. P. 171–183.
Greenwood J.G., Fielder D.R. The zoeal stages and megalopa of Portunus rubromarginatus (Lanchester) (Decapoda: Portunidae), reared in the laboratory // J. Plankton Res. 1979. V. 1. P. 191–205.
Hayashi K.-I. Hippolysmata grabhami Gordon, a synonym of Lysmata amboinensis (De Man) (Decapoda, Caridea, Hippolytidae) // Publ. Seto Mar. Biol. Lab. 1975. V. 22. P. 285–296.
Hyžný M., Klompmaker A.A. Systematics, phylogeny, and taphonomy of ghost shrimps (Decapoda): a perspective from the fossil record // Arthropod Syst. Phylog. 2015. V. 73. P. 401–437.
Jaszkowiak K., Keiler J., Wirkner C.S., Richter S. The mouth apparatus of Lithodes maja (Crustacea: Decapoda) – form, function and biological role // Acta Zool. 2015. V. 96. P. 401–417.
Johnston D.J., Ritar A. Mouthpart and foregut ontogeny in phyllosoma larvae of the spiny lobster Jasus edwardsii (Decapoda: Palinuridae) // Mar. Freshwater Res. 2001. V. 52. P. 1375–1386.
Johnston M., Johnston D., Knott B. Ontogenetic changes in the structure and function of the mouthparts and foregut of early and late stage Panulirus ornatus (Fabricius, 1798) phyllosomata (Decapoda: Palinuridae) // J. Crustacean Biol. 2008. V. 28. P. 46–56.
Kornienko E.S., Korn O.M., Golubinskaya D.D. The complete larval development of the lobster shrimp Boasaxius princeps Boas, 1880 (Decapoda: Axiidea: Axiidae) obtained in the laboratory // J. Nat. Hist. 2014. V. 48. P. 1737–1769.
Kornienko E.S., Golubinskaya D.D., Korn O.M., Sharina S.N. The complete description of larval stages of the lobster shrimp Leonardsaxius amurensis (Kobjakova, 1937) (Decapoda: Axiidea: Axiidae) identified by DNA barcoding // J. Mar. Biol. Assoc. U.K. 2018. V. 98. P. 1435–1453.
Lavalli K.L., Factor J.R. Functional morphology of the mouthparts of juvenile lobsters, Homarus americanus (Decapoda: Nephropidae), and comparison with the larval stages // J. Crustacean Biol. 1992. V. 12. P. 467–510.
Lin F.-J., Liu Y., Sha Z. et al. Evolution and phylogeny of the mud shrimps (Crustacea: Decapoda) revealed from complete mitochondrial genomes // BMC Genomics. 2012. V. 13. P. 631.
Lumasag G.J., Quinitio E.T., Aguilar R.O. et al. Ontogeny of feeding apparatus and foregut of mud crab Scylla serrata Forsskål larvae // Aquacult. Res. 2007. V. 38. P. 1500–1511.
Marin I. Complete morphological re-description of mud-dwelling axiid Leonardsaxius amurensis (Kobjakova, 1937) with remarks on Axiidae (Crustacea: Decapoda: Axiidea) from the Russian coast of the Sea of Japan // Zootaxa. 2015. V. 3937. P. 549–563.
Meyer R., Melzer R.R. Scanning EM diagnosis of marine Decapoda larvae: a comparison of preparation techniques // Crustaceana. 2004. V. 77. P. 883–886.
Meyer R., Wehrtmann I.S., Melzer R.R. Morphology of the first zoeal stage of Portunus acuminatus Stimpson, 1871 (Decapoda: Portunidae: Portuninae) reared in the laboratory // Sci. Mar. 2006. V. 70. P. 261–270.
Minagawa M., Takashima F. Developmental changes in larval mouthparts and foregut in the red frog crab, Ranina ranina (Decapoda: Raninidae) // Aquaculture. 1994. V. 126. P. 61–71.
Nickell L.A., Atkinson R.J.A. Functional morphology of burrows and trophic modes of three thalassinidean shrimp species, and a new approach to the classification of thalassinidean burrow morphology // Mar. Ecol.: Prog. Ser. 1995. V. 128. P. 181–197.
Nickell L.A., Atkinson R.J.A., Pinn E.H. Morphology of thalassinidean (Crustacea: Decapoda) mouthparts and pereiopods in relation to feeding, ecology and grooming // J. Nat. Hist. 1998. V. 32. P. 733–761.
Pinn E.H., Nickell L.A., Rogerson A., Atkinson R.J.A. Comparison of the mouthpart setal fringes of seven species of mud-shrimp (Crustacea: Decapoda: Thalassinidea) // J. Nat. Hist. 1999. V. 33. P. 1461–1485.
Poore G.C.B., Ahyong S.T., Bracken-Grissom H.D. et al. On stabilising the names of the infraorders of thalassinidean shrimps, Axiidea de Saint Laurent, 1979 and Gebiidea de Saint Laurent, 1979 (Decapoda) // Crustaceana. 2014. V. 87. P. 1258–1272.
Richter S., Edgecombe G.D., Wilson G.D.F. The lacinia mobilis and similar structures – a valuable character in Arthropod phylogenetics? // Zool. Anz. 2002. V. 241. P. 339–361.
Robles R., Tudge C.C., Dworschak P.C. et al. Molecular phylogeny of the Thalassinidea based on nuclear and mitochondrial genes // Decapod crustacean phylogenetics (Crustacean Issues). London; New York: CRC Press. 2009. V. 18. P. 309–326.
Sahlmann C., Chan T.-Y., Chan B.K.K. Feeding modes of deep-sea lobsters (Crustacea: Decapoda: Nephropidae and Palinuridae) in Northwest Pacific waters: Functional morphology of mouthparts, feeding behaviour and gut content analysis // Zool. Anz. 2011. V. 250. P. 55–66.
Sakai K. Axioidea of the world and a reconsideration of the Callianassoidea (Decapoda, Thalassinidea, Callianassida) // Crustaceana Monographs. Leiden: Brill. 2011. V. 13. 520 p.
Sakai K. Descriptions of eight species from the superfamilies Axioidea Huxley, 1879 and Callianassoidea Dana, 1852, with a revised key to the species of the genus Acanthaxius Sakai & De Saint Laurent, 1989 (Decapoda, Callianassidea) // Crustaceana. 2017. V. 90. P. 177–197.
Stamhuis E.J., Dauwe B., Videler J.J. How to bite the dust: morphology, motion pattern and function of the feeding appendages of the deposit-feeding thalassinid shrimp Callianassa subterranea // Mar. Biol. 1998. V. 132. P. 43–58.
Storch V., Bluhm B.A., Arntz W.E. Microscopic anatomy and ultrastructure of the digestive system of three Antarctic shrimps (Crustacea: Decapoda: Caridea) // Polar Biol. 2001. V. 24. P. 604–614.
Tudge C.C., Asakura A., Ahyong S.T. Infraorder Anomura MacLeay, 1838 // The Crustacea. Leiden; Boston: Brill. 2012. V. 9B. P. 221–335.
Tziouveli V., Bastos-Gomez G., Bellwood O. Functional morphology of mouthparts and digestive system during larval development of the cleaner shrimp Lysmata amboinensis (de Man, 1888) // J. Morphol. 2011. V. 272. P. 1080–1091.
Wolfe S.H., Felgenhauer B.E. Mouthpart and foregut ontogeny in larval, postlarval, and juvenile spiny lobster, Panulirus argus Latreille (Decapoda, Palinuridae) // Zool. Scr. 1991. V. 20. P. 51–75.
Дополнительные материалы отсутствуют.