Биология моря, 2021, T. 47, № 1, стр. 23-33
Половое воспроизведение и жизненный цикл пеннатной диатомовой водоросли Entomoneis cf. paludosa (W. Smith) Reimer (Bacillariophyta)
Ю. А. Подунай 1, *, Н. А. Давидович 1, 2, О. И. Давидович 1, А. Витковский 2, Р. Гастиньо 2, Ч. Н. Солак 3
1 Карадагская научная станция им. Т.И. Вяземского – природный заповедник РАН, филиал Института биологии южных морей им. А.О. Ковалевского РАН
298188 Феодосия, Россия
2 Институт морских и экологических наук, Щецинский университет
70-383 Щецин, Польша
3 Университет Думлупинар, биологический факультет
43000 Кютахья, Турция
* E-mail: grab-ua@yandex.ru
Поступила в редакцию 15.04.2019
После доработки 10.08.2020
Принята к публикации 24.09.2020
Аннотация
Впервые описаны половое воспроизведение и жизненный цикл морской пеннатной диатомовой водоросли Entomoneis cf. paludosa. Установлено, что в половом процессе участвуют два гаметангия, каждый производит по две гаметы. Для этого вида характерна морфологическая и поведенческая изогамия. Система скрещивания включает гетероталлический способ воспроизведения; случаи гомоталлизма не отмечены. Тип полового процесса близок к категории IC в системе Гайтлера.
Изначально под названием Entomoneis Эренберг описал подрод (Ehrenberg, 1845a), который затем повысил до уровня рода (Ehrenberg, 1845b). Типовым видом нового рода стал Entomoneis alata Ehrenberg (ранее Navicula alata Ehrenberg). В настоящее время семейство Entomoneidaceae состоит из двух родов – Entomoneis и Platichthys ( Lange-Bertalot et al., 2015). Раунд с соавторами (Round et al., 1990) определили Entomoneis как род каналошовных пеннатных диатомовых водорослей, обитающих преимущественно в морских и солоноватых водоемах, изредка в пресных водах. Современные исследования показывают, что видовое разнообразие рода Entomoneis недооценено (Clavero et al., 1999; Paillès et al., 2014; Mejdandžić et al., 2017; Liu et al., 2018, и др.), а диапазон ареалов, в которых можно найти его представителей, гораздо шире: E. vertebralis E. Clavero, J.O. Grimalt & M. Hernández-Mariné и E. reimeri D.C. Reinke & Wujek встречаются в естественных соляных болотах (Clavero et al., 1999); E. gigantea (Grunow) Nizamuddin и E. kjellmanii (Cleve) Poulin & Cardinal обитают в морских льдах (Poulin et al., 2011; Kudryavtseva et al., 2017); E. triundulata Bing Liu & D.M. Williams описан из пресноводного озера (Liu et al., 2018).
Entomoneis paludosa (W. Smith) Reimer – эпипелический вид диатомей, обитающий в морских и солоноватоводных водоемах (Dalu et al., 2015). Голотип E. paludosa в оригинальной публикации Смита (Smith, 1853) описан как Amphiprora paludosa, а в 1975 г. переведен Реймером (Guiry, Guiry, 2020) в род Entomoneis. К настоящему времени сведения об этом виде дополнены описанием его морфологии и распространения в водах африканского континента (Dalu et al., 2015). Изучено влияние на рост и биохимический состав культур E. paludosa некоторых бактерий (Jauffrais et al., 2017), а также добавления цинка (Nguyen-Deroche et al., 2012).
Ауксоспорообразование у Amphiprora alata (в настоящее время Entomoneis alata) впервые отмечено Карстеном (Karsten, 1899), который привел рисунок пары инициальных клеток внутри оболочек ауксоспор, окруженных пустыми теками родительских клеток. Однако изменение размеров в жизненном цикле вида и особенности полового воспроизведения на этапах гаметогенеза и сингамии до сих пор не описаны.
Диатомовые водоросли отличаются от других одноклеточных водорослей не только наличием кремниевого панциря, но и уникальным изменением его размеров в жизненном цикле. С каждым вегетативным делением длина клеток прогрессивно уменьшается и возникает необходимость восстановления первоначальных размеров. Реституция обычно достигается в процессе полового размножения. Переход от вегетативного размножения к половому происходит после достижения клеткой определенной длины, которая у большинства видов составляет 45–55% от максимального видоспецифического размера (Davidovich, 2001). Таким образом, половое воспроизведение у диатомей – это обязательная жизненная стадия, необходимая для появления поколения с новыми генетическими комбинациями и для восстановления максимального видоспецифического размера клеток (Round et al., 1990; Edlund, Stoermer, 1997; Mann, 2011).
Представители рода Entomoneis широко распространены, встречаются постоянно, иногда достигают значительной численности и играют далеко не последнюю роль в морских экосистемах. Благодаря крупным размерам и необычной форме клеток, виды этого рода легко отличить в пробах. Однако данных о их биологии, как и сведений об этапе жизненного цикла, связанном с появлением новых поколений, крайне мало. Цель настоящей работы состояла в описании полового воспроизведения, жизненного цикла и системы скрещивания черноморского представителя рода Entomoneis.
МАТЕРИАЛ И МЕТОДИКА
Виды рода Entomoneis обнаружены в эпилитоне и перифитоне Чёрного моря и изолированы из проб, собранных у побережья Крымского полуострова (клоны 7.0525-A, 7.0525-B, 7.0525-C – в Двуякорной бухте; клон 7.0428-B – в Карадагской бухте около насосной станции; клоны 8.0727-A и 8.0727-В – на глубине 17 м у п-ва Тарханкут), а также у берега на набережной г. Сочи (клоны 7.0601-A, 7.0601-B, 7.0601-C, 7.0601-D) и около г. Акчакоча, провинция Дюзжде (Düzce Akçakoca) на северо-западе Турции (клон 7.0906-D).
Клоны культивировали в среде, по составу близкой к среде ESAW (Andersen et al., 2005), модифицированной (Полякова и др., 2018) и разбавленной дистиллированной водой до необходимой солености (20‰). Клетки для клоновых культур выделяли микропипеточным методом (Andersen, Kawachi, 2005) под микроскопом МБС-9 (ЛОМО, СССР) и очищали путем многократного пересева в свежую среду. Культивирование проводили в стеклянных чашках Петри диаметром 5–9 см и высотой 0.9–1.4 см при наполнении средой от 8 до 45 мл в соответствии с размером чашки. Экспоненциальную фазу роста поддерживали, еженедельно пересевая культуры в свежую питательную среду. Чашки находились в изолированной комнате с постоянной температурой 20 ± 2°С на полках у окон, обращенных на север, что обеспечивало естественные периодичность и уровень освещения.
Монокультуры регулярно просматривали под микроскопом для обнаружения случаев гомоталлического воспроизведения. Каждую неделю экспоненциально растущие культуры попарно смешивали для инициирования гетероталлического полового размножения; смешанные культуры в течение недели ежедневно просматривали под микроскопом, контролируя начало гаметогенеза и появление половых клеток. Обильность воспроизведения оценивали в баллах: 0 – случаи полового размножения не отмечены; 1 – наблюдаются единичные случаи гаметогенеза/ауксоспорообразования; 2 – случаи гаметогенеза/ауксоспорообразования встречаются часто, но их нельзя назвать массовыми; 3 – наблюдается массовое ауксоспорообразование.
Для исследования с помощью сканирующего электронного микроскопа (СЭМ) клетки диатомовых водорослей очищали от органического материала кипячением в 35% перекиси водорода (H2O2) в течение 6 ч. Затем клеточную суспензию центрифугировали и 7–8 раз промывали дистиллированной водой. Несколько капель полученной суспензии помещали на алюминиевые столики, высушивали на воздухе и напыляли золотом. Препараты просматривали и фотографировали на СЭМ Hitachi SU8020.
За живыми клетками наблюдали под микроскопом Biolar PI (PZO, Польша), настроенным по методам дифференциально-интерференционного контраста и освещения по Кёлеру (Федин, Барский, 1971). Клетки фотографировали с помощью цифровой фотокамеры Canon PowerShort A640. Размеры клеток определяли, используя окулярную линейку, калиброванную по объект-микрометру.
Для филогенетического анализа полные кодирующие области rbcL (рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы большой субъединицы рРНК) получали из предварительных сборок полного пластидного генома. Все анализы выполнены на платформе MEGAX (Kumar et al., 2018). С помощью программы ClustalW полученные последовательности гена rbcL выравнивали с 48 последовательностями, доступными в базе данных BLAST для разных видов Entomoneis/Amphiprora. В качестве внешней группы использовали Rhopalodia gibba (Ehrenberg) O. Müller и Epithemia parallela (Grunow) Ruck & Nakov. Последовательности “обрезали” до конечной длины 1081 пара нуклеотидов. Филогенетическое дерево строили по методу максимального правдоподобия на основе модели GTR+I+G, используя 1000 повторностей бутстрепа для определения поддержки ветвей.
Последовательности гена rbcL клонов, использованных в данной работе, депонированы в базе данных GenBank под номерами MT424815 (клон 7.0525-A), MT424816 (клон 7.0428-B) и MT424817 (клон 7.0906-D).
РЕЗУЛЬТАТЫ
Таксономическая характеристика
Клетки в выделенных клонах одиночные, с пояска прямоугольные или гитаровидные, перетянутые в средней части и скрученные по продольной оси (рис. 1). Клетка содержит один хлоропласт, образующий две лопасти. Створки линейно-ланцетные с перетяжкой, несущие узкий киль, уменьшающийся или исчезающий в центре створки и уменьшающийся у ее концов. Штрихи двухрядные и многорядные; образованы небольшими круглыми ареолами, закрытыми гименом снаружи и открытыми внутри. Шов S-образный, на проксимальном и дистальном концах клетки, как правило, прямой; расположен в трубчатом канале, перфорированном небольшими ареолами. Фибулы присутствуют. Вставочные ободки многочисленные, перфорированные.
Рис. 1.
Микрофотографии клеток морской пеннатной диатомовой водоросли Entomoneis cf. paludosa (СЭМ). Стрелками обозначена разделительная линия между килем и лицевой поверхностью створки.

Изолированные в культуру клетки имели ряд признаков, характерных для Entomoneis paludosa. Сравнение характеристик клонов с результатами исследования голотипа E. paludosa (W. Smith) Reimer (Dalu et al., 2015) показало, что клоны из культуры соответствовали голотипу E. paludosa по длине створки (41–63.5 мкм) и плотности штрихов (20–23 в 10 мкм) (рис. 1в–1г). Однако клетки выделенных нами штаммов имели гладкую (плавную) разделительную линию между килем и лицевой поверхностью створки (рис. 1в), тогда как у всех проиллюстрированных образцов голотипа линия разделения имела отчетливую выпуклость (Dalu et al., 2015).
Молекулярно-филогенетический анализ, выполненный с использованием гена rbcL, показал, что клоны, изолированные из проб с крымского и турецкого побережья Черного моря, образуют единый кластер внутри большой клады рода Entomoneis (рис. 2). При этом клоны, определенные разными авторами как E. paludosa, рассеяны по всему дереву и не образуют единой клады. Подобное положение штаммов свидетельствует о том, что под названием “paludosa” скрывается комплекс видов.
Рис. 2.
Филогенетическое дерево пеннатных диатомовых водорослей рода Entomoneis, построенное методом максимального правдоподобия на основе нуклеотидных последовательностей гена rbcL. Значение над ветвями – байесовские апостериорные вероятности. Подчеркиванием отмечены клоны, последовательности нуклеотидов которых получены нами. Звездочкой отмечены штаммы из базы данных GenBank, которые другие исследователи определили как Entomoneis paludosa.

Размер вегетативных клеток E. cf. paludosa, содержавшихся в культуре, варьировал от 18 до 128 мкм (табл. 1). Между размером родительских клеток, участвовавших в половом процессе, и размером образовавшихся инициальных клеток корреляция не отмечена (R2 = 0.114). Для клонов E. cf. paludosa, содержавшихся в культуре, скорость уменьшения размеров составила 3.4 ± 0.4 мкм/мес.
Таблица 1.
Апикальная длина клеток пеннатной диатомовой водоросли Entomoneis cf. paludosa
| Стадия жизненного цикла | Длина клеток, мкм | N | |
|---|---|---|---|
| Min | Max | ||
| Вегетативные клетки | 18 | 128 | 522 |
| Гаметангии | 18 | 64 | 290 |
| Инициальные клетки | 88 | 128 | 171 |
При длительном (более 10 сут) содержании клонов без пересева в свежую среду в культуре, находившейся в стационарной фазе или в фазе деградации, появлялись шарообразные образования (рис. 3), которые с первого взгляда можно было принять за гаметы или зиготы. Однако они имели разные размеры и иногда “неровную” форму. Раскрывшихся створок гаметангиев возле них не отмечено. Наблюдение за дальнейшими превращениями этих шаровидных образований показало, что в течение первых 3 сут они в разной степени увеличивались в диаметре, а через 5 сут начали разрушаться.
Половое воспроизведение
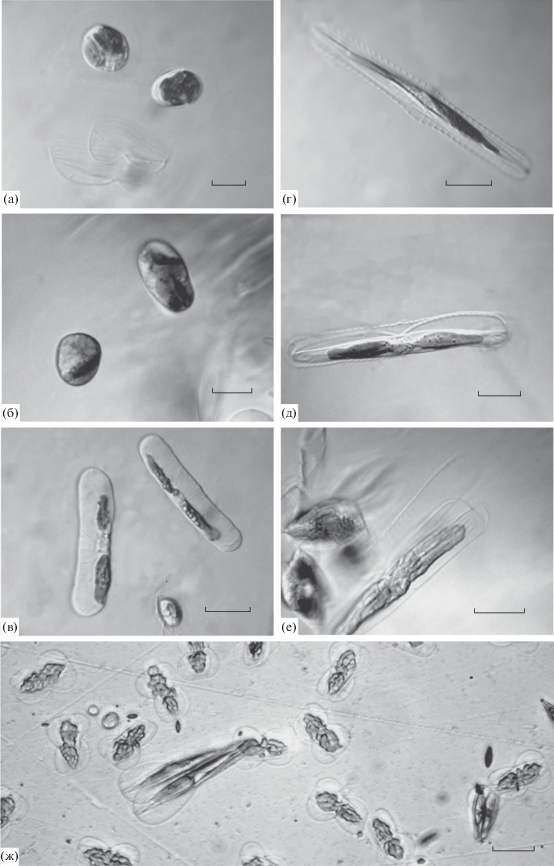
В смешанных посевах в гетероталлическом половом процессе сначала участвует небольшое количество гаметангиев. В парах клонов аллогамный половой процесс можно наблюдать в разных местах чашки Петри на вторые-третьи сутки после скрещивания. На начало полового воспроизведения указывает появление в чашке групп клеток, находящихся в движении (рис. 4а). Деление содержимого гаметангиев проходит в трансапикальной плоскости (рис. 4б, 4в). В каждом гаметангии образуются две гаметы. Гаметы, округляясь и слегка увеличиваясь в размерах, раздвигают створки гаметангия и выходят в среду. Каждая гамета содержит по одному хлоропласту и окружена слабозаметной слизистой оболочкой (рис. 4г). Процесс копуляции гамет отследить сложно. Как только в одной из клеток начинается гаметогенез, к ней подползают клетки (иногда несколько десятков) обоих клонов, постепенно образуя подвижную и все увеличивающуюся группу, в которой кроме клеток на разных этапах гаметогенеза могут находиться гаметы и уже образовавшиеся зиготы.
Рис. 4.
Гаметогенез пеннатной диатомовой водоросли Entomoneis cf. paludosa. а – группа клеток в начале процесса гаметогенеза; б – клетки на разных этапах деления содержимого гаметангиев и образования гамет; в – сформировавшиеся гаметы готовы к выходу из гаметангия; г – сферические гаметы после выхода из гаметангия. Шкала 20 мкм.

Образовавшиеся после сингамии сферические зиготы содержат 2 хлоропласта и располагаются рядом со створками гаметангия, но не имеют с ними тесной связи (рис. 5а). Через некоторое время зиготы биполярно удлиняются (рис. 5а–5в), превращаясь в ауксоспору. Ауксоспоры формируются как вблизи створок одного из гаметангиев, так и поодаль. Перизониум ауксоспоры хорошо развит, с различимыми в световой микроскоп поперечными полосами (рис. 5г). У ауксоспоры, завершившей рост, внутри перизониума откладываются створки инициальной клетки, форма которых не повторяет форму ауксоспоры и характерна для вегетативных клеток (рис. 5д). Когда инициальная клетка выходит из перизониума, его хорошо видно в световой микроскоп (рис. 5е). Инициальные клетки заметно больше материнских клеток (рис. 5ж).
Рис. 5.
Стадии формирования ауксоспоры у Entomoneis cf. paludosa. а, б – образовавшиеся зиготы содержат два хлоропласта и начинают удлиняться; в – ауксоспоры; г, д – внутри перизониума откладываются створки инициальной клетки; е – пустой перизониум и вышедшая из него инициальная клетка; ж – инициальные клетки по длине сильно отличаются от окружающих родительских клеток. Шкала 40 мкм.
Система скрещивания
За два года наблюдений и экспериментов по скрещиванию ни у одного клона E. cf. paludosa не обнаружен гомоталлический способ воспроизведения, тогда как во всех парах клонов (репродуктивно совместимых, подходящих по размеру и находящихся в экспоненциальной фазе роста) на вторые-третьи сутки начинался активный половой процесс. Все черноморские популяции, в том числе удаленные друг от друга популяции с крымского и турецкого побережья, оказались репродуктивно совместимыми. Клоны свободно скрещивались между собой в соответствии с условно выделенными типами спаривания (mt1 и mt2) (табл. 2). Были изолированы инициальные клетки – потомки первого поколения (F1), образовавшиеся в результате гетероталлического воспроизведения клонов из двух популяций. Они оказались жизнеспособными и фертильными, и после достижения необходимого размера при содержании в культуре проявили способность к возвратному скрещиванию.
Таблица 2.
Гетероталлическое воспроизведение черноморских клонов пеннатной диатомовой водоросли Entomoneis cf. paludosa
| Клоны | Место отбора проб | Происхождение клонов | Тип спаривания | Клоны | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 7.0525-A | 7.0525-B | 7.0525-С | 7.0601-A | 7.0601-B | 7.0601-C | 7.0601-D | 7.0906-D | 8.0727-A | 8.0727-B | 8.0228-А | 8.0228-B | ||||
| 7.0525-A | Крым | w | mt1 | ||||||||||||
| 7.0525-B | Крым | w | mt2 | 3 | |||||||||||
| 7.0525-С | Крым | w | mt1 | 0 | 3 | ||||||||||
| 7.0601-A | Крым | w | mt1 | 0 | 3 | 0 | |||||||||
| 7.0601-B | Крым | w | mt2 | 2 | 0 | 3 | 2 | ||||||||
| 7.0601-C | Крым | w | mt2 | 2 | 0 | 3 | 3 | 0 | |||||||
| 7.0601-D | Крым | w | mt2 | 3 | 0 | 3 | 2 | 0 | 0 | ||||||
| 7.0906-D | Турция | w | mt2 | 3 | 0 | 3 | 3 | 0 | 0 | 0 | |||||
| 8.0727-A | Крым | w | mt2 | 2 | 0 | 3 | – | – | – | – | 0 | ||||
| 8.0727-B | Крым | w | mt1 | 0 | – | 0 | – | – | 2 | – | 3 | – | |||
| 8.0228-А | F1 | mt1 | 0 | 2 | 0 | 0 | – | 3 | – | 3 | – | – | |||
| 8.0228-B | F1 | mt1 | 0 | 3 | 0 | 0 | – | 2 | – | 3 | – | – | – | ||
Примечание. Балльная шкала обильности воспроизведения: 0 – случаи полового размножения не отмечены; 1 – наблюдаются единичные случаи гаметогенеза/ауксоспорообразования (не отмечены); 2 – случаи гаметогенеза/ауксоспорообразования встречаются часто, но их нельзя назвать массовыми; 3 – наблюдается массовое ауксоспорообразование; ”−” – клоны не проверяли на наличие полового воспроизводства; w – клоны, выделенные из природной популяции; F1 – потомки первого поколения; mt1 и mt2 – условные типы спаривания; клоны 8.0228-А и 8.0228-B – потомки от скрещивания клонов из разных популяций (7.0525-A и 7.0906-D).
ОБСУЖДЕНИЕ
В диатомологии установление видовой принадлежности зачастую представляет собой довольно сложную задачу ввиду ограниченного набора критериев, наличия видовых комплексов и внутривидового варьирования. Исследователи указывают видовую принадлежность, опираясь, как правило, на собственный опыт, а также на имеющиеся в литературе описания и иллюстрации. В большинстве случаев типовое описание вида само по себе не является достаточным для верной идентификации. Вид Entomoneis paludosa отмечен во многих районах Мирового океана, иногда значительно удаленных. Места обитания популяций различаются по экологическим характеристикам. Основанная на едином подходе верификация принадлежности всех отмеченных представителей к виду E. paludosa не проводилась. Вместе с тем, как показано выше, при сравнении популяций и типового материала (Dalu et al., 2015) могут быть обнаружены определенные морфологические различия.
Сопоставление генетических последовательностей также не дает ответа на вопрос о видовой принадлежности исследуемых клонов. Выделенные нами клоны принадлежат одному кластеру с высокой поддержкой. Эта клада оказалась родственной для Entomoneis sp. из Красного моря (штамм SA18 Ento-B1, инвентарный номер GenBank: MH064089.1). Однако другие ранее исследованные клоны E. paludosa не объединяются в единый кластер, а представлены в разных частях построенного филогенетического дерева (см. рис. 2).
Впервые образование ауксоспор у представителя рода Entomoneis отмечено в конце XIX века (Karsten, 1899). В соответствии со своей классификацией Карстен отнес половой процесс у Amphiprora alata (= E. alata) к типу II: в размножении участвуют две материнские клетки, при этом образуются четыре гаметы и две ауксоспоры. К такому же типу Карстен относил половое воспроизведение у Achnanthes longipes C. Agardh, Amphora cymbelloides Grunow, Nitzschia hybrida Grunow и у ряда других диатомей (Karsten, 1899). По системе Карстена половой процесс, характерный для E. paludosa, также можно отнести к типу II. Согласно современным представлениям, воспроизведение, при котором в разных гаметангиях образуются одинаковые по морфологии и поведению гаметы, называется изогамией (Mann, 1993) и можно отнести к категории IC в системе Гайтлера (Geitler, 1973). Такой тип полового процесса ранее описан, например, у Nitzschia reversa W. Smith sensu Krammer & Lange-Bertalot (Mann, 1993), Achnanthes longipes (Chepurnov, Mann, 1997), Navicula protracta Grunow (Mann, 1988) и у ряда других видов шовных диатомей.
Клетки E. cf. paludosa приобретают способность воспроизводиться половым путем при апикальной длине 64 мкм, что составляет 50% от максимального видоспецифического размера (128 мкм) и соответствует тенденции, характерной для большинства пеннатных диатомей (Davidovich, 2001). Для сравнения, у бесшовной Ulnaria ulna (Nitzsch) Compère этот показатель составляет около 40% от максимального видоспецифического размера (Podunay et al., 2014), у шовных Haslea karadagensis Davidovich, Gastineau & Mouget и Pseudo-nitzschia multiseries (Hasle) Hasle − соответственно 54% (Davidovich et al., 2012) и 63% (Bates, Davidovich, 2002).
Гаметы, продуцируемые как женскими, так и мужскими клонами E. cf. paludosa, изогамны морфологически (имеют сферическую форму) и поведенчески (не проявляют способности к движению). Полная изогамия характерна также для Amphora arcus Gregory (Mann, 1994; Sabbe et al., 2004), Achnanthes longipes (Chepurnov, Mann, 1997) и Haslea ostrearia (Bory) Simonsen (Davidovich et al., 2009). У представителей рода Nitzschia встречаются полная изогамия, как, например, у N. reversa (Mann, 1993), поведенческая анизогамия при морфологической изогамии, как у N. recta Hantzsch ex Rabenh (Mann, 1986), а также сочетание морфологической и поведенческой анизогамии, как у N. longissima (Brébisson ex Kützing) Grunow (Davidovich et al., 2006). У планктонных P. multiseries и P. pseudodelicatissima (Hasle) Hasle отмечена морфологическая изогамия, однако подвижность гамет, относящихся к клонам разных полов, была разной, что указывает на поведенческую анизогамию (Davidovich, Bates, 1998).
В связи с полной изогамией и неподвижностью гамет, а также из-за специфической формы створки, которая не позволяет гаметангиям приблизиться друг к другу вплотную, у E. cf. paludosa возникает проблема доставки гамет к месту сингамии. У гамет E. cf. paludosa не отмечено образования псевдоподиальных выростов, характерных для некоторых бесшовных диатомей, таких как Tabularia fasciculata (C. Agardh) D.M. Williams & Round, T. tabulata (C. Agardh) Snoeijs (Davidovich et al., 2012), Pseudostaurosira trainorii E.A. Morales (Sato et al., 2011) и Ulnaria ulna (см.: Podunay et al., 2014). Гаметы этой водоросли не обладают амебоидным движением, при котором активная пара гамет движется к пассивной, как, например, у представителей Pseudo-nitzschia (Davidovich, Bates, 1998).
Для облегчения копуляции гаметы E. cf. paludosa после выхода из гаметангиев увеличиваются в размерах в 1.5 раза. Увеличение размера гамет как фактор, способствующий облегчению сингамии, описан у Schizostauron Grunow (Davidovich et al., 2017). Вторым механизмом, обеспечивающим сингамию у E. cf. paludosa, является сбор гаметангиев в подвижные группы. Поступательное движение клеток группы и их обороты вокруг своей оси облегчают сближение и слияние гамет.
Гаметангии E. cf. paludosa, как и гаметангии Haslea ostrearia (Davidovich et al., 2009), Navicula directa var. directa (W. Smith) Ralf in Pritchard (Mizuno, 2000) и ряда других диатомей, при копуляции не образуют заметной слизистой оболочки в отличие, например, от A. arcus, вокруг гаметангиальной пары которой видна хорошо развитая слизистая оболочка (Mann, 1994).
Ауксоспоры E. cf. paludosa имеют перизониум с хорошо различимыми в световом микроскопе поперечными полосами. Внутри полностью сформировавшегося перизониума откладывается инициальная клетка, створки которой уже имеют характерную для вегетативной клетки форму. Хорошо видимый перизониум формируют многие представители пеннатных диатомей, в том числе каналошовные Pseudo-nitzschia (Davidovich, Bates, 1998) и Nitzschia (Mann, 1986; Davidovich et al., 2006).
Система скрещивания E. cf. paludosa гетероталлическая, ни в одном из исследованных клонов не отмечено случаев гомоталлического воспроизведения. Гетероталлизм характерен для многих диатомей, как шовных, например, Pinnularia cf. gibba (Poulíčková et al., 2007), так и бесшовных, например, U. acus (Kützing) M. Aboal (Подунай и др., 2018). У некоторых видов (A. longipes, N. longissima и др.) наряду с гетеро- может происходить и гомоталлический половой процесс (Chepurnov, Mann, 1997; Davidovich et al., 2006).
Таким образом, получены данные о половом воспроизведении и жизненном цикле представителя рода Entomoneis, важныe не только для установления видовых границ с использованием биологического критерия вида, но и для успешного его культивирования и использования в биотехнологии.
Список литературы
Подунай Ю.А., Давидович Н.А., Куликовский М.С., Гусев Е.С. Особенности полового воспроизведения и система скрещивания Ulnaria acus (Bacillariophyta) // Журн. Сиб. фед. ун-та. Биология. 2018. С. 1–13.
Полякова С.Л., Давидович О.И., Подунай Ю.А., Давидович Н.А. Модификация среды ESAW, используемой для культивирования морских диатомовых водорослей // Мор. биол. журн. 2018. Т. 3. № 2. С. 73–80.
Федин Л.А., Баpский И.Я. Микpофотогpафия. Л.: Наука. 1971. 220 с.
Andersen R.A., Berges J.A., Harrison P.J., Watanabe M.M. Recipes for freshwater and seawater media // Algal culturing techniques. Amsterdam: Elsevier Acad. Press. 2005. P. 429–538.
Andersen R.A., Kawachi M. Traditional microalgae isolation techniques // Algal culturing techniques. Amsterdam: Elsevier Acad. Press. 2005. P. 83–100.
Bates S.S., Davidovich N.A. Factors affecting the sexual reproduction of diatoms, with emphasis on Pseudo-nitzschia spp. // LIFEHAB: Life histories of microalgal species causing harmful blooms. Luxembourg: Office for Official Publications of the European Communities. 2002. P. 31–36. (Research in Enclosed Seas Series; № 12. Eur 20361).
Chepurnov V.A., Mann D.G. Variation in the sexual behaviour of natural clones of Achnanthes longipes (Bacillariophyta) // Eur. J. Phycol. 1997. V. 32. № 2. P. 147–154.
Clavero E., Grimalt J.O., Hernández–Mariné M. Entomoneis vertebralis sp. nov. (Bacillariophyceae); a new species from hypersaline environments // Cryptogam.: Algol. 1999. V. 20. P. 223–234.
Dalu T., Taylor J.C., Richoux N.B., Froneman W. A re-examination of the type material of Entomoneis paludosa (W. Smith) Reimer and its morphology and distribution in African waters // Fottea. 2015. V. 15. P. 11–25.
Davidovich N.A. Species specific sizes and size range of sexual reproduction in diatoms // Proc. 16th Int. Diatom Symp. (25 Aug.–1 Sept. 2000). Athens: University of Athens. 2001. P. 191–196.
Davidovich N.A., Bates S.S. Sexual reproduction in the pennate diatoms Pseudo-nitzschia multiseries and P. pseudodelicatissima (Bacillariophyceae) // J. Phycol. 1998. V. 34. № 1. P. 126–137.
Davidovich N.A., Davidovich O.I., Witkowski A. et al. Sexual reproduction in Schizostauron (Bacillariophyta) and a preliminary phylogeny of the genus // Phycologia. 2017. V. 56. № 1. P. 77–93.
Davidovich N.A., Kaczmarska I., Ehrman J.M. The sexual structure of a natural population of the diatom Nitzschia longissima (Bréb.) Ralfs // Proc. 18th Int. Diatom Symp. (Miedzyzdroje, Poland. 2–7 September, 2004). Bristol: Biopress Ltd. 2006. P. 27–40.
Davidovich N.A., Kaczmarska I., Karpov S.A. et al. Mechanism of male gamete motility in araphid pennate diatoms from the genus Tabularia (Bacillariophyta) // Protist. 2012. V. 163. № 3. P. 480–494.
Davidovich N.A., Mouget J.-L., Gaudin P. Heterothallism in the pennate diatom Haslea ostrearia (Bacillariophyta) // Eur. J. Phycol. 2009. V. 44. № 2. P. 251–261.
Edlund M.B., Stoermer E.F. Ecological, evolutionary, and systematic significance of diatom life histories // J. Phycol. 1997. V. 33. P. 897–918.
Ehrenberg C.G. Neue Untersuchungen über das kleinste Leben als geologisches Moment. Bericht über die zur Bekanntmachung geeigneten Verhandlungen der Königlich-Preussischen Akademie der Wissenschaften zu Berlin. 1845a. P. 53–88.
Ehrenberg C.G. Vorläufige zweite Mettheilung über die weitere Erkenntnifs der Beziehungen des kleinsten organischen Lebens zu den vulkanischen Massen der Erde. Bericht über die zur Bekanntmachung geeigneten Verhandlungen der Königlich-Preussischen Akademie der Wissenschaften zu Berlin. 1845b. P. 133–157.
Geitler L. Auxosporenbildung und Systematik bei pennaten Diatomeen und die Cytologie von Cocconeis-Sippen // Österr. Bot. Z. 1973. V. 122. P. 299–321.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Nat. Univ. Ireland. Galway. 2020. http://www.algaebase.org; searched on 28 May 2020.
Jauffrais Th., Agogué H., Gemin M. et al. Effect of bacteria on growth and biochemical composition of two benthic diatoms Halamphora coffeaeformis and Entomoneis paludosa // J. Exp. Mar. Biol. Ecol. 2017. V. 495. P. 65–74.
Karsten G. Die Diatomeen der Kieler Bucht // Wiss. Meeresunters. (Kiel). New Ser. 1899. V. 4. P. 17–205.
Kudryavtseva V.A., Belevich T.A., Zhitina L.S. Diatoms in the ice of Velikaya Salma strait, the White Sea, before the spring algal bloom // Moscow Univ. Biol. Sci. Bull. 2017. V. 72. № 2. P. 52–58.
Kumar S., Stecher G., Li M. et al. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547–1549.
Lange-Bertalot H., Witkowski A., Kulikovskiy M. et al. Taxonomy, frustular morphology and systematics of Platichthys, a new genus of canal raphe bearing diatoms within the Entomoneidaceae // Phytotaxa. 2015. V. 236. № 2. P. 135–149.
Liu B., Williams D.M., Ector L. Entomoneis triundulata sp. nov. (Bacillariophyta), a new freshwater diatom species from Dongting Lake, China // Cryptogam.: Algol. 2018. V. 39. № 2. P. 239–253.
Mann D.G. Methods of sexual reproduction in Nitzschia: systematic and evolutionary implications. (Notes for a monograph of the Bacillariaceae) // Diatom Res. 1986. V. 1. № 2. P. 193–203.
Mann D.G. Sexual reproduction and systematics of Navicula protracta // Diatom Res. 1988. V. 3. № 2. P. 227–236.
Mann D.G. Patterns of sexual reproduction in diatoms // Hydrobiologia. 1993. V. 269/270. P. 11–20.
Mann D.G. The systematics of amphoroid diatoms: the life history of Amphora arcus // Nova Hedwigia. 1994. V. 58. № 3–4. P. 335–352.
Mann D.G. Size and sex // The diatom world. Dordrecht: Springer. 2011. P. 145–166. (Cellular Origin, Life in Extreme Habitats and Astrobiology; V. 19. Part 2).
Mejdandžić M., Bosak S., Orlić S. et al. Entomoneis tenera sp. nov., a new marine planktonic diatom (Entomoneidaceae, Bacillariophyta) from the Adriatic Sea // Phytotaxa. 2017. V. 292. P. 1–18.
Mizuno M. Sexual auxosporulation of the marine diatom Navicula directa var. directa // Phycol. Res. 2000. V. 48. P. 103–106.
Nguyen-Deroche T.L.N., Caruso A., Trung Le T. et al. Zinc affects differently growth, photosynthesis, antioxidant enzyme activities and phytochelatin synthase expression of four marine diatoms // Sci. World J. 2012. V. 2012. Artic. ID 982957.
Paillès C., Blanc-Valleron M.M., Poulin M. et al. Entomoneis calixasini sp. nov., a new fossil diatom from the Turkish Marmara Sea sediments // Diatom Res. 2014. V. 29. P. 411–422.
Podunay Yu.A., Davidovich O.I., Davidovich N.A. Mating system and two types of gametogenesis in the fresh water diatom Ulnaria ulna (Bacillariophyta) // Algologia. 2014. V. 24. № 1. P. 3–19.
Poulíčková A., Mayama S., Chepurnov V.A., Mann D.G. Heterothallic auxosporulation, incunabula and perizonium in Pinnularia (Bacillariophyceae) // Eur. J. Phycol. 2007. V. 42. № 4. P. 367–390.
Poulin M., Daugbjerg N., Gradinger R. et al. The pan-Arctic biodiversity of marine pelagic and sea-ice unicellular eukaryotes: a first-attempt assessment // Mar. Biodiversity. 2011. V. 41. P. 13–28.
Round F.E., Crawford R.M., Mann D.G. The diatoms. Biology and morphology of the genera. Cambridge: Cambridge Univ. Press. 1990. 747 p.
Sabbe K., Chepurnov V.A., Mann D.G., Vyverman W. Sexual behaviour, auxosporulation and chloroplast dynamics in a marine Amphora (Bacillariophyceae) studied in culture // Bot. Mar. 2004. V. 47. № 1. P. 53–63.
Sato S., Beakes G., Idei M. et al. Novel sex cells and evidence for sex pheromones in diatoms // PLoS One. 2011. V. 6. № 10. e26923.
Smith W. Synopsis of British Diatomaceae. London: John Van Voorst. 1853. 89 p.
Дополнительные материалы отсутствуют.



