Биология моря, 2021, T. 47, № 2, стр. 86-94
Особенности размножения, рост и форма раковины у брюхоногого моллюска Boreotrophon candelabrum (Reeve, 1848) (Muricidae) из залива Петра Великого Японского моря
Н. И. Селин *
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: nikselin@yandex.ru
Поступила в редакцию 21.05.2020
После доработки 20.07.2020
Принята к публикации 29.09.2020
Аннотация
Исследованы особенности размножения, рост и изменчивость формы раковины у брюхоногого моллюска Boreotrophon candelabrum (Reeve, 1848) из зал. Петра Великого Японского моря. При содержании в аквариальных условиях моллюски начинали откладывать прозрачные полусферические яйцевые капсулы в конце апреля при температуре воды более 5.6°С. Особи с высотой раковины 38–51 мм откладывали по 13–46 яйцевых капсул, диаметр основания которых составлял от 6.0 до 10.1 мм. В каждой капсуле находилось от 411 до 1710 яиц диаметром 0.204 ± 0.024 мм. В природных условиях яйцевые капсулы появлялись в первой половине мая, были обычны в мае – в первой половине июня и единично встречались до конца лета. Выход личинок из яйцевых капсул в море наблюдали с середины мая. Установлено, что наиболее интенсивно моллюски росли в первые два года жизни; высота раковины у двухлетних особей составляла около 35 мм. Затем ежегодные приросты раковины снижались, и в возрасте шести лет моллюски почти достигали максимального размера, зарегистрированного в природе и полученного расчетным путем для уравнения Берталанфи, которое имеет вид: Lt = 61.2 [1 – e–0.5572(t– 0.4672)]. Форма раковины моллюсков существенно варьировала в зависимости от условий обитания; габитус, приводимый при описании видовых характеристик B. candelabrum (см.: Голиков, Кусакин, 1978), был характерен лишь для 17% особей популяции залива.
Брюхоногий моллюск Boreotrophon candelabrum (Reeve, 1848) является представителем семейства Muricidae, необыкновенно обильного видами в тропических морях и довольно скромно представленного в умеренной зоне (Egorov, 1992, 1993; Houart et al., 2019). Он распространен в Японском море у берегов Кореи, России, Японии (о-ва Хонсю и Хоккайдо, включая тихоокеанское побережье), на Южно-Курильском мелководье и у южного Сахалина (Голиков, Кусакин, 1978; Higo et al., 1999; Гульбин, 2004; Min, 2004; Кантор, Сысоев, 2005; Gulbin, 2009). Биология бореотрофона почти не изучена; сведения по экологии вида ограничены краткой информацией, полученной более 50 лет назад для обитателей прибрежных вод Южных Курил и зал. Посьета (Голиков, Скарлато, 1967; Скарлато и др., 1967; Голиков, Кусакин, 1978), которую с большей или меньшей полнотой цитируют разные исследователи. Известно, что B. candelabrum является активным хищником, рацион которого составляют в основном сравнительно мелкие двустворчатые и брюхоногие моллюски (Голиков, Кусакин, 1978; Селин и др., 1986). Недавно были оценены обилие и популяционная структура B. candelabrum в зал. Восток Японского моря (Селин, 2020) с целью изучения современного состояния популяции в этой части ареала. Настоящая работа является фрагментом данного исследования и посвящена описанию особенностей размножения, роста и изменчивости формы раковины у B. candelabrum.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили в зал. Восток (зал. Петра Великого Японского моря); использовали возможности материально-технической базы Морской биологической станции “Восток” Национального научного центра морской биологии ДВО РАН. Изучали изменчивость формы раковины у Boreotrophon candelabrum в зависимости от условий обитания моллюсков, безвыборочно собранных в 2014 г. на трех участках побережья залива, которые различались удаленностью от открытой части моря, прибойностью, типом грунта и составом донного населения. Станция 1 располагалась в кутовой части залива; она характеризуется мелководностью (глубина 1–6 м), сильным заилением грунта и отсутствием прибоя. Станция 2 – это приглубый (8–10 м) слегка заиленный участок дна с обильным развитием друз мидии Грея Crenomytilus grayanus и модиолуса Modiolus kurilensis и отсутствием прибоя. Станция 3 – прибойный мелководный (глубина 1–2 м) гравийно-галечный с валунами участок дна (подробнее см.: Селин, 2020). В каждой выборке оценивали численность особей с целой раковиной (в соответствии с описанием: Голиков, Кусакин, 1978), с поврежденной раковиной (отсутствовала часть оборотов раковины, осевых ребер и др.), а также с раковинами с эрозией и/или эпибионтами. У целых раковин (не менее шести оборотов, при этом наличие зародышевой раковины не учитывали) штангенциркулем с точностью до 0.1 мм измеряли высоту (Н) и диаметр последнего оборота (D) без учета осевых ребер. Данные использовали для расчета уравнений линейной зависимости D от H.
При экспериментальном изучении особенностей размножения B. candelabrum в декабре 2019 г. 100 экз. этого вида, отловленных в море, поместили в эмалированную ванну, где содержали при постоянном протоке морской воды вместе с двустворчатым моллюском Ruditapes philippinarum, который является одним из предпочитаемых объектов питания бореотрофона (Голиков, Кусакин, 1978). В марте–апреле при медленном повышении температуры воды моллюски приступили к оплодотворению, образуя скученные группы из двух–трех особей. Часть предположительно самок с высотой раковины 38–51 мм рассадили в 5 аквариумов (размер 40 × 25 × 20 см) из оргстекла по 3 экз. разного размера в каждый. За этими и оставшимися в ванной животными наблюдали до октября. Затем их выпустили в море. На дно аквариумов в качестве дополнительного субстрата были помещены по два–три небольших валуна, несколько створок раковин двустворчатых моллюсков и живые особи R. philippinarum в качестве пищи. Отмечали начало откладки капсул каждой особью и определяли количество капсул (Ncap.). У моллюсков разного размера произвольно брали по 10 капсул и под бинокуляром измеряли их диаметр (d, мм). Подсчитывали количество яиц в каждой капсуле (Negg) и определяли диаметр у 30 яиц; рассчитывали средний диаметр капсулы и яиц, а также среднее количество последних. Перед вылуплением личинок, находившихся на стадии велигера, подсчитали их численность в 22 капсулах диаметром 7.0–9.2 мм. Данные использовали для расчета уравнения линейной зависимости между этими показателями и высотой раковины B. candelabrum. Отмечали время опустошения капсул от личинок. В период частых погружений в районе исследований в легководолазном снаряжении визуально оценивали встречаемость яйцевых капсул бореотрофона в весенне-осеннее время.
Для оценки роста использовали моллюсков, собранных на станции 2. С марта 2017 г. по январь 2018 г. ежемесячно безвыборочно отбирали 5–7 особей B. candelabrum разного размера, у которых анализировали динамику формирования светлых и темных полос на крышечке раковины (оперкулюме). В мае 2018 г. взяли массовую выборку моллюсков. У всех особей измерили высоту раковины и подсчитали число темных полос на оперкулюме, принимая их за годовые метки, по аналогии с определением возраста у других брюхоногих моллюсков, имеющих крышечку раковины с ядром и концентрическими линиями нарастания (Голиков, Кусакин, 1978; Голиков, 1980; Kideys, 1996; Селин, 2003). Моллюски с наиболее отчетливыми метками служили основой для построения кривой группового линейного роста по конечным размерам. Возрастные изменения высоты раковины аппроксимировали уравнением Берталанфи, которое часто используется при изучении роста брюхоногих и двустворчатых моллюсков, а также других животных (Мина, Клевезаль, 1976; Селин, 1990а; Selin, 2008; Cob et al., 2009; Zotin, 2018, и др.). Оно имеет вид: ${{L}_{t}} = {{L}_{\infty }}[1{\text{ }}--{{e}^{{--k(t--{{t}_{0}}}}}^{)}],$ где Lt – высота раковины в возрасте t лет; L∞ – физиологически возможная предельная высота раковины, мм; k – коэффициент затухания процесса роста; t0 – возраст, при котором Lt = 0.
Статистическая обработка данных выполнена с использованием обычных приемов корреляционно-регрессионного и ковариационного (ANCOVA) анализов, представленных в пакете прикладных компьютерных программ SPSS17.
РЕЗУЛЬТАТЫ
Особенности размножения
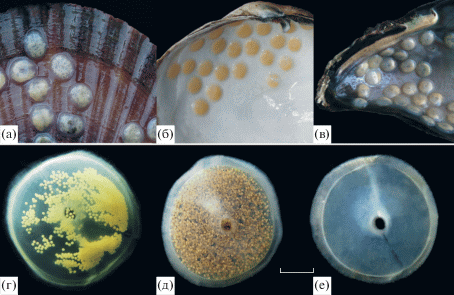
В аквариальных условиях в зимний период моллюски были довольно инертными, совершали кратковременные хаотичные перемещения, долго оставались неподвижными и не питались. Первые яйцевые капсулы самки откладывали в конце третьей декады апреля, когда температура воды в аквариумах составляла 5.6°С. Субстратом служили оргстекло стенок аквариумов и раковины двустворчатых моллюсков (рис. 1), на валунах капсул не отмечено. Массовую откладку капсул моллюсками наблюдали во второй половине мая, когда температура воды превысила 8°С. С июня и до конца лета образования новых капсул не отмечено. Пустые капсулы, свидетельствовавшие о выходе личинок в воду, наблюдали с середины мая, но наиболее активным этот процесс был в конце мая – в первых числах июня при температуре воды 12–17°С. К июлю, когда температура воды в море в дневное время достигала 18–19°С, в аквариальных условиях все капсулы были пустыми, однако в природе за много лет наблюдений они были отмечены как единичные несколько раз вплоть до сентября на створках и живых митилидах, на крупных балянусах и в других местах обычного обитания взрослых особей.
Рис. 1.
Яйцевые капсулы Boreotrophon candelabrum на створке раковины двустворчатых моллюсков Mizuhopecteh yessoensis (а), Callista brevisiphonata (б) и Crenomytilus grayanus (в); вид капсулы с яйцами (г), капсула перед выпуском личинок в море (д) и после их выпуска (е). Масштаб: г–е – 2 мм.
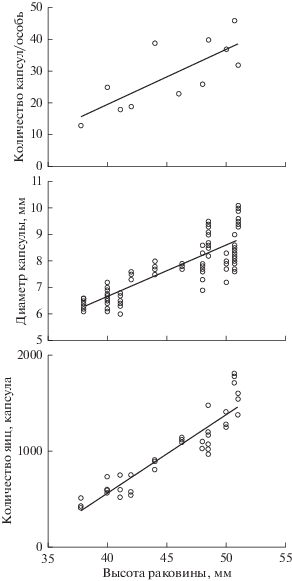
Самка размером 38–51 мм откладывала от 13 до 46 яйцевых капсул. Наблюдалась положительная корреляция (коэффициент детерминации r2 = 58.6%) между размером моллюска и количеством произведенных капсул (рис. 2, табл. 1). Отдельная капсула представляла собой прозрачное полусферическое образование с плотной и прочной оболочкой. Диаметр капсулы положительно коррелировал с высотой раковины моллюска (r2 = 67.4%). Например, моллюски размером 40 и 50 мм откладывали капсулы, диаметр которых в среднем составлял соответственно около 6.7 и 8.6 мм. В капсуле находились яйца желтого цвета с диаметром 0.204 ± 0.024 мм. Численность яиц колебалась от 411 до 1710 экз. и положительно коррелировала с высотой раковины моллюска (r2 = 85%). Значимых различий между численностью яиц в капсуле и личинок, выходящих из капсулы в воду на стадии велигера, не зарегистрировано (ANCOVA; P > 0.069).
Таблица 1.
Параметры уравнений, описывающих взаимосвязь высоты раковины и показателей репродукции Boreotrophon candelabrum
| Зависимость | Коэффициент | SEa | SEb | r2 | n | |
|---|---|---|---|---|---|---|
| a | b | |||||
| Ncap. = a + bH | –0.1605 | 1.7427 | 22.2625 | 0.4883 | 58.6 | 11 |
| d = a + bН | –1.1200 | 0.1947 | 0.5618 | 0.0121 | 67.4 | 128 |
| Negg = a + bН | –2871.2 | 85.1307 | 7.2160 | 334.7720 | 82.3 | 31 |
Примечание. Н – высота раковины, мм; Ncap. – количество яйцевых капсул, приходящихся на одну самку; d – диаметр яйцевой капсулы, мм; Negg – количество яиц в капсуле. Здесь и в табл. 2: SEa – стандартная ошибка коэффициента а; SEb – стандартная ошибка коэффициента b; r2 – коэффициент детерминации, %; n – объем выборки, экз.
Рост моллюсков
Размерно-частотное распределение B. candelabrum по массовой выборке с глубины 8–10 м свидетельствует о том, что с некоторой долей условности в скоплении можно выделить лишь три размерно-возрастные группы (рис. 3а). В первую группу входили самые мелкие особи с высотой раковины менее 20 мм. На довольно светлой зеленовато-желтой крышечке раковины данных моллюсков слегка выделялся лишь немного затемненный участок ядра. Это была молодь, пополнившая донное население в прошедший летний сезон; ее абсолютный возраст составлял полгода (0+). Вторую группу составляли моллюски размером 25–40 мм, имевшие на крышечке раковины затемненный участок ядра и одну или (реже) две темные концентрические линии, свидетельствовавшие о задержке роста моллюска в зимнее время при низкой температуре воды. Возраст этих особей составлял соответственно полтора года (1+) и более двух лет (2+). Третья группа была представлена остальными моллюсками размером до 62 мм, имевшими на крышечке от двух до семи концентрических линий.
Рис. 3.
Размерный состав скопления (а) и рост (б) Boreotrophon candelabrum. 1 – возрастные изменения высоты раковины, 2 – возрастные изменения прижизненной массы тела. Вертикальные линии – стандартная ошибка.

В первые два весенне-осенних сезона моллюски росли наиболее интенсивно. В это время их ежегодный прирост в среднем составлял 15.4 и 20.5 мм, а высота раковины к третьему сезону в среднем достигала 35 мм (рис. 3б). В дальнейшем рост моллюсков постепенно замедлялся и у моллюсков старше шести лет ежегодный прирост раковины не превышал 1 мм. В этом возрасте высота раковины у моллюсков в среднем составляла около 60 мм, что лишь немного меньше зарегистрированной в природе и расчетной предельной величины L∞ в уравнении Берталанфи, имеющем для данных условий обитания следующий вид: Lt = 61.2 [1 – e–0.5572(t– 0.4672)] (стандартная ошибка L∞ равна 1.5, стандартная ошибка коэффициента е – 0.4446, коэффициента t0 – 0.3712; коэффициент детерминации r2 равен 94.4%). Возрастные изменения массы тела моллюсков соответствовали S-образной кривой: до 4-летнего возраста ежегодный прирост массы тела увеличивался, а затем снижался и у животных старше шести лет не превышал 1 г.
Исследование пропорций тела у бореотрофона из зал. Восток показало, что у моллюсков из разных мест обитания в онтогенезе диаметр последнего оборота раковины изменялся относительно ее высоты с разной интенсивностью (рис. 4, табл. 2). При равной высоте раковины у моллюсков, обитавших в районе станции 3 у относительно открытого побережья, диаметр последнего оборота был значимо больше, чем у моллюсков из других районов (ANCOVA; Р < 0.001; коэффициент частичной регрессии r2 для размера составляет 95.9%, для станций – 68.3%). Чем ближе располагалось скопление моллюсков к кутовой части залива, тем меньше у особей был диаметр последнего оборота раковины.
Рис. 4.
Изменение в онтогенезе пропорций раковины у Boreotrophon candelabrum из разных мест обитания. 1–3 – станции.
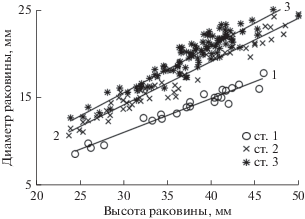
Таблица 2.
Параметры уравнений, описывающих взаимосвязь высоты (Н) раковины с диаметром последнего оборота (D) у Boreotrophon candelabrum из разных мест обитания
| Район | Коэффициент | SEa | SEb | r2 | n | |
|---|---|---|---|---|---|---|
| a | b | |||||
| Станция 1 | –0.5319 | 0.3857 | 0.6993 | 0.0186 | 95.1 | 23 |
| Станция 2 | –0.6622 | 0.4938 | 0.5046 | 0.0136 | 95.5 | 64 |
| Станция 3 | –0.3301 | 0.5285 | 0.7608 | 0.0200 | 87.5 | 101 |
Форма раковины
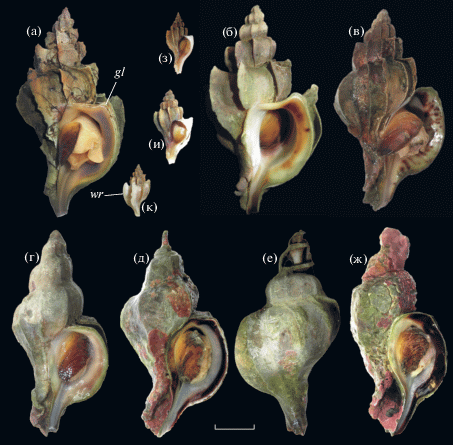
Для B. candelabrum из популяции зал. Восток характерна стройная веретеновидная раковина высотой до 62 мм. Она имеет семь оборотов; иногда на верхнем обороте видны остатки зародышевой раковинки, почти в сохранности отмеченной только у нескольких годовалых особей. Осевая скульптура раковины, придающая моллюскам необыкновенно экзотический вид, представлена едва видимыми тонкими линиями нарастания и широкими (до 12 мм) вогнутыми пластинками, в большей или меньшей степени угловатыми на плече оборотов. Осевые пластинки характерны для моллюсков разного размера (возраста) и наиболее хорошо выражены на последнем обороте раковины (рис. 5). У относительно молодых особей одна–три крайние пластинки, прилегающие к устью, обычно тонкие и ломкие, часто окрашены в молочно-белый с фиолетовыми вкраплениями цвет, контрастирующий с серо-зеленым или серо-бурым фоном раковины (рис. 5з–5к, wr). У старых особей приустьевая осевая пластинка, как правило, самая толстая, ее край образует ребро из нескольких приростов (слоев) (рис. 5а, gl). Количество пластинок на последнем завитке раковины колеблется от 6 до 12 и не зависит от ее размера.
Рис. 5.
Изменчивость формы раковины у Boreotrophon candelabrum из зал. Восток. Взрослые моллюски: а, б – отмечены только на друзах митилид в местах, защищенных от волн (станция 2); в–е – встречаются в кутовой мелководной части залива и у открытых прибойных берегов (станции 1 и 3); ж – характерны для илисто-валунного мелководья (станция 1); з–к – молодь, встречается во всех биотопах. Условные обозначения: gl – линии нарастания на плече раковины; wr – белые тонкие осевые пластинки. Масштаб – 10 мм.
Моллюски с такими “эталонными” характеристиками раковины в природе немногочисленны. В частности, в популяции B. candelabrum в зал. Восток доля особей с раковиной из семи оборотов составляла лишь около 1.5%. Чаще встречались моллюски с раковиной из шести оборотов (15.3%), а доля моллюсков с раковиной из пяти оборотов достигала 56.5%. Почти четвертую часть населения составляли моллюски с раковиной из четырех оборотов, и очень редко встречались особи с раковиной из трех оборотов (2%). Раковина моллюсков из пяти, четырех и трех оборотов обычно имела остатки утраченной верхней части. Еще значительнее были различия между моллюсками с разных станций. Достаточно отметить, что на станциях 1 и 3 не обнаружены моллюски с раковиной из семи оборотов, особи с раковиной из трех оборотов составляли соответственно 7.3 и 8.8%. На станции 2 раковина с семью оборотами отмечена почти у 5% моллюсков, с шестью – у 30%, а моллюски с раковиной с тремя оборотами не найдены.
На станциях 1 и 3 раковины моллюсков сохранились хуже, чем на станции 2 (рис. 5в–5ж). Осевые пластинки раковин были небольшими или отсутствовали, место положения пластинок можно было определить лишь по характерной волнистости поверхности раковины. Большинство относительно крупных раковин в большей или меньшей степени были покрыты известковыми водорослями, домиками полихет и источены сверлильщиками.
ОБСУЖДЕНИЕ
Сроки размножения гидробионтов обычно обусловлены зоогеографической принадлежностью и/или комплексом физиологических адаптаций вида, а также динамикой локальных условий среды. В умеренных широтах, для которых характерны значительные сезонные колебания температуры, благоприятные для размножения условия наступают с приходом теплого времени года и связаны с положительными значениями температуры воды. В Северном полушарии весной при незначительном прогреве воды начинают нереститься широко распространенные арктические и бореально-арктические по происхождению виды животных, затем по мере повышения температуры размножаются бореальные виды, а позднее и субтропические. Данную последовательность неоднократно отмечали для брюхоногих и двустворчатых моллюсков, иглокожих и других животных (Матвеева, 1974а, 1974б; Касьянов и др., 1976; Голиков, Кусакин, 1978, и др.). Для низкобореальных моллюсков, к которым относится и Boreotrophon candelabrum, характерно размножение весной – в начале лета; благоприятной является температура воды 6–14°С (Голиков, 1980; Скарлато, 1981). Минимальная температура, при которой начинается размножение, у разных видов различается, нередко ниже указанных величин, но укладывается в диапазон 1.5–6.0°С (Селин, 1990б; Боруля, 2000; Колбин, Куликова, 2008; Куликова и др., 2009, и др.). В аквариальных условиях откладка капсул у бореотрофона началась при температуре 5.6°С. В зал. Петра Великого Японского моря такие температурные условия наблюдаются в конце апреля и осенью, но в последнем случае повторного размножения не отмечено.
Результаты проведенного исследования свидетельствуют о том, что B. candelabrum размножается один раз в год в весенне-летнее время, откладывая на субстрат характерные полусферические яйцевые капсулы с прочной оболочкой. Они обеспечивают защиту развивающихся яиц от неблагоприятного воздействия среды и являются ярким свидетельством заботы родителей о потомстве, как и необыкновенно разнообразные по размеру, форме и пространственной организации кладки многих других брюхоногих моллюсков (Thorson, 1946; Fretter, Graham, 1962; Кауфман, 1977; Голиков, Кусакин, 1978; Чухчин, 1984, и др.). В яйцевой капсуле B. candelabrum с высотой раковины 40–50 мм содержится от 400 до 1700 довольно мелких яиц диаметром 0.204 ± 0.024 мм. Каждая особь бореотрофона в зависимости от индивидуальных особенностей и размера тела откладывает по 13–46 яйцевых капсул, следовательно, плодовитость B. candelabrum колеблется в широком диапазоне – от 5.2 до 680 тыс. яиц (в среднем 26 598 яиц). Эти характеристики свидетельствуют о том, что данный вид обладает сравнительно высокой плодовитостью, хотя известно, что у брюхоногих моллюсков в целом в зависимости от типа развития индивидуальная плодовитость варьирует в еще большем диапазоне – от нескольких десятков до нескольких сотен тысяч яиц (Jablonski, Lutz, 1983).
Температура воды выше 6°С является благоприятной для размножения и оптимальной для обитания бореотрофона (Golikov, Scarlato, 1973; Голиков, 1980, и др.). В частности, это проявляется в интенсивном росте моллюсков в весенне-осеннее время, особенно в первые годы их жизни. Отметим, что летом встречаются молодые моллюски с высотой раковинки 1.8–10 мм, т.е. недавно пополнившие поселение взрослых особей (Голиков, Скарлато, 1967; Селин, 2020), а к зиме размер их раковины составляет 16–17 мм. Интенсивный рост этих особей весной следующего года приводит к тому, что ко времени появления в поселении нового спата в июне–июле высота раковины даже самых мелких особей в зависимости от условий обитания достигает 22–25 мм (Селин, 2020).
Условия обитания отражаются не только на темпах роста, но и на форме раковины бореотрофона. Анализ изменения в онтогенезе пропорций раковины у моллюсков из трех районов залива, различающихся по физико-химическим параметрам среды, показал значимые различия в соотношении высота раковины – диаметр последнего оборота. В районе станции 2 на глубине 8–10 м моллюски локализованы преимущественно над поверхностью дна на друзах мидии Грея и модиолуса, где омываются потоками слабого приливо-отливного течения. Как правило, они имеют элегантную раковину с четко выраженными морфологическими признаками, перечисляемыми при характеристике вида (Голиков, Кусакин, 1978). При равной высоте раковины у моллюсков этого поселения диаметр последнего оборота меньше, чем у обитателей относительно открытого и прибойного участка в районе станции 3 на глубине 1–2 м. Обычно такую зависимость связывают с бóльшим развитием ноги у моллюсков из прибойных мест обитания, полагая, что, чем больше нога, тем выше вероятность удержаться от смыва с грунта в периоды активной гидродинамики (Crothers, 1981, 1983; Cambridge, Kitching, 1982; Селин, 1994, и др.). Адаптивную природу такой морфологической изменчивости формы раковины у брюхоногих моллюсков подтверждает и тот факт, что особи B. candelabrum из кутовой части залива, где отсутствует какое-либо волновое воздействие, характеризуются наименьшим диаметром последнего оборота раковины.
Форма и внешний вид раковины моллюсков в значительной мере зависят от конкретных условий жизни и биотических взаимодействий в донном сообществе. Важным является механическое воздействие среды в периоды активной гидродинамики, проявляющееся в виде больших или небольших нарушений целостности раковины и истирания структурных элементов (осевых пластинок, стенок раковины отдельных оборотов, сифонального участка и т.д.). Значительные изменения габитуса бореотрофона вызывают и эпибионты, в частности, известковые водоросли, особенно мощно и регулярно покрывающие скально-валунный субстрат и раковины моллюсков, обитающих в районе станции 3, но отсутствующие у особей на станции 2. В кутовой части залива изъяны раковин моллюсков обычно выражены в виде эрозии, распространяющейся от верхних оборотов раковины к нижним, особенно в области швов. Это связано с тем, что здесь моллюски обитают на заиленном дне в условиях интенсивного осадконакопления, обусловленного береговым стоком и отмиранием обильных макрофитов. Часто моллюски погружены в осадок (Селин, 2020), для которого характерно высокое содержание гуминовых соединений, обеспечивающих формирование слабокислой среды (Даувальтер, 2006), деструктивно воздействующей на кальцитовую раковину. Разрушению раковины способствует и активная деятельность организмов-сверлильщиков (микроводоросли, полихеты спиониды и т.д.). С возрастом все эти изменения раковины у моллюска проявляются ярче.
Таким образом, в зал. Петра Великого B. candelabrum, как и многие другие низкобореальные моллюски, размножается в апреле–мае, а в отдельные годы, по-видимому, и в начале июня при температуре воды 5.6°С и выше. Оплодотворение внутреннее; многочисленные яйца развиваются в полусферических прочных капсулах, которые самки откладывают в местах зимовки и обычного летнего пребывания на валунных и смешанных грунтах защищенных и умеренно прибойных мелководий заливов и бухт. С середины лета наблюдается пополнение донного населения молодью, которое, как показывают результаты наших более ранних исследований (Селин, 2020), происходит регулярно и обильно. Комплекс адаптаций, присущих виду, обеспечивает широкое расселение бореотрофона и быстрый рост, проявляется в значительной морфологической изменчивости раковины. Необыкновенная вариабельность габитуса моллюсков зависит также от степени сохранности раковины и обилия эпибионтов.
Список литературы
Боруля Е.М. Некоторые особенности строения кладок и эмбрионального развития четырех видов промысловых гастропод сем. Buccinidae зал. Петра Великого // Изв. ТИНРО. 2000. Т. 127. С. 524–535.
Голиков А.Н. Моллюски Buccininae Мирового океана. Л.: Наука. 1980. 508 с. (Фауна СССР. Моллюски; Т. 5. Вып. 2).
Голиков А.Н., Кусакин О.Г. Раковинные брюхоногие моллюски литорали морей СССР. Л.: Наука. 1978. 292 с.
Голиков А.Н., Скарлато О.А. Моллюски залива Посьет (Японское море) и их экология // Тр. ЗИН АН СССР. 1967. Т. 42. С. 5–152.
Гульбин В.В. Фауна брюхоногих переднежаберных моллюсков залива Петра Великого Японского моря и ее биогеографический состав // Биол. моря. 2004. Т. 30. № 1. С. 20–29.
Даувальтер В.А. Исследование физического и химического состава донных отложений при оценке экологического состояния водоемов: учеб. пособ. по дисциплине “Геохимия окружающей среды” для направления 511100 “Экология и природопользование” и специальности 013600 “Геоэкология”. Мурманск: Изд-во МГТУ. 2006. 84 с.
Кантор Ю.И., Сысоев А.В. Каталог моллюсков России и сопредельных стран. М.: Товарищество науч. изд. КМК. 2005. 627 с.
Касьянов В.Л., Кукин А.Ф., Медведева Л.А., Яковлев Ю.М. Сроки размножения и состояние гонад в нерестовый период у массовых видов двустворчатых моллюсков и иглокожих залива Восток Японского моря // Биол. исслед. залива Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 156–167.
Кауфман З.С. Особенности половых циклов беломорских беспозвоночных. Л.: Наука. 1977. 265 с.
Колбин К.Г., Куликова В.А. Личиночное развитие брюхоногого моллюска Epheria turrita (Gastropoda: Littorinidae) // Биол. моря. 2008. Т. 34. № 5. С. 374–376.
Куликова В.А., Колбин К.Г., Ярославцева Л.М. Размножение и развитие брюхоногих моллюсков рода Littorina (Gastropoda: Littorinidae) в заливе Петра Великого Японского моря // Бюл. Дальневост. малакол. о-ва. 2009. Вып. 13. С. 5–16.
Матвеева Т.А. Особенности цикла размножения у некоторых двустворчатых моллюсков залива Посьета (Японское море) // Гидробиол. и биогеог. шельфов холодных и умеренных вод Мирового океана. Л.: Наука. 1974а. С. 64–65.
Матвеева Т.А. Экология и жизненные циклы массовых видов брюхоногих моллюсков Баренцева и Белого морей // Сезонные явления в жизни Белого и Баренцева морей. Л.: Наука. 1974б. С. 65–190.
Мина М.В., Клевезаль Г.А. Рост животных. М.: Наука. 1976. 291 с.
Селин Н.И. Распределение и рост двустворчатых моллюсков списулы и мактры в заливе Петра Великого // Биол. моря. 1990а. № 3. С. 28–38.
Селин Н.И. Биология брюхоногого моллюска Cryptonatica janthostoma из Японского моря // Биол. моря. 1990б. № 2. С. 28–34.
Селин Н.И. Распределение, морфология и продукционные показатели брюхоногого моллюска Littorina kurila в районе вулканогенных проявлений (Курильские острова) // Биол. моря. 1994. Т. 20. № 2. С. 126–136.
Селин Н.И. Рост и продолжительность жизни брюхоногого моллюска Nucella heyseana (Gastropoda) из залива Петра Великого Японского моря // Биол. моря. 2003. Т. 29. № 2. С. 115–119.
Селин Н.И. Влияние условий среды на распределение и размерный состав брюхоногого моллюска Boreotrophon candelabrum (Reeve, 1848) (Muricidae) в заливе Восток Японского моря // Биол. моря. 2020. Т. 46. № 3. С. 174–181.
Селин Н.И., Понуровский С.К., Черняев М.Ж. Влияние хищной гастроподы Cryptonatica janthostoma на структуру популяции двустворчатого моллюска Ruditapes philippinarum // Биол. моря. 1986. № 5. С. 72–74.
Скарлато О.А. Двустворчатые моллюски умеренных широт западной части Тихого океана. Л.: Наука. 1981. 479 с.
Скарлато О.А., Голиков А.Н., Василенко С.В. и др. Состав, структура и распределение донных биоценозов в прибрежных водах залива Посьет (Японское море) // Исслед. фауны морей. 1967. Т. 5(13). С. 5–61.
Чухчин В.Д. Экология брюхоногих моллюсков Черного моря. Киев: Наукова думка. 1984. 176 с.
Cambridge P.G., Kitching J.A. Shell shape in living and fossil (Norwich Crag) Nucella lapillus (L.) in relation to habitat // J. Conchol. 1982. V. 31. P. 31–38.
Cob Z.C., Arshad A., Bujang J.S., Ghaffar M.A. Age, growth, mortality and population structure of Strombus canarium (Gastropoda: Strombidae): variations in male and female sub-populations // J. Appl. Sci. 2009. V. 9. № 18. P. 3287–3297.
Crothers J.H. Shell-shape variation in Faroese dog-whelks (Nucella lapillus (L.)) // Biol. J. Linn. Soc. 1981. V. 15. № 4. P. 327–337.
Crothers J.H. Some observations on shell-shape variation in North American populations of Nucella lapillus (L.) // Biol. J. Linn. Soc. 1983. V. 19. № 3. P. 237–274.
Egorov R.V. Guide to Recent molluscs of northern Eurasia. 1. Gastropods of the families Muricidae and Thaididae from the seas of Russia // Ruthenica. 1992. V. 2. № 1. P. 63–75.
Egorov R.V. Trophoninae (Muricidae) of Russian and adjacent waters // Ruthenica. 1993. Suppl. 1. 48 p.
Fretter V., Graham A. British Prosobranch Molluscs. Their functional anatomy and ecology. Ray Soc. Publ. № 114. London: Ray Soc. 1962. 755 p.
Golikov A.N., Scarlato O.A. Method for indirectly defining optimum temperatures of inhabitancy for marine cold-blooded animals // Mar. Biol. 1973. V. 20. P. 1–5.
Gulbin V.V. Review of the shell-bearing gastropods in the Russian waters of the East Sea (Sea of Japan). III. Caenogastropoda: Neogastropoda // Korean J. Malacol. 2009. V. 25. № 1. P. 51–70.
Higo S., Callomon P., Goto Y. Catalogue and bibliography of the marine shell-bearing Mollusca of Japan: Gastropoda, Bivalvia, Polyplacophora. Scaphopoda. Elle Sci. Publ. 1999. 748 p.
Houart R., Vermeij G., Wiedrick S. New taxa and new synonymy in Muricidae (Neogastropoda: Pagodulinae, Trophoninae, Ocenebrinae) from the Northeast Pacific // Zoosymposia. 2019. V. 13. P. 184–241.
Jablonski D., Lutz R.A. Larval ecology of marine benthic invertebrates: paleobiological implications // Biol. Rev. 1983. V. 58. P. 21–89.
Kideys A.E. Determination of age and growth of Buccinum undatum L. (Gastropoda) off Douglas, Isle of Man // Helgol. Meeresunters. 1996. V. 50. P. 353–368.
Min D.-K. Mollusks in Korea. Seoul: Min Molluscan Research Institute. 2004. 566 p.
Selin N.I. Distribution, population structure and growth of Protothaca euglypta (Sowerby, 1914) (Bivalvia: Veneridae) from the Northwestern Part of the East Sea of Russia // Korean J. Malacol. 2008. V. 24. № 2. P. 81–87.
Thorson G. Reproduction and larval development of Danish marine bottom invertebrates, with special reference to the planktonic larvae in the Sound (Øresund) // Medd. Komm. Dan. Fisk. Havunders. Ser. Plankton. 1946. V. 4. № 1. 529 p.
Zotin A.A. Individual growth of Planorbarius corneus (Planorbidae, Gastropoda) in postlarval ontogenesis // Russ. J. Dev. Biol. 2018. V. 49. № 6. P. 371–378.
Дополнительные материалы отсутствуют.