Биология моря, 2021, T. 47, № 4, стр. 270-280
Влияние полифенольных примесей, содержащихся в образцах фукоидана из бурой водоросли Fucus distichus Subsp. evanescens (C. Agardh) H.T. Powell, 1957, на эмбриогенез морского ежа Strongylocentrotus intermedius (A. Agassiz, 1864) и эмбриотоксическое действие кукумариозида
М. И. Киселева 1, *, Т. И. Имбс 1, С. А. Авилов 1, И. Ю. Бакунина 1
1 Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН
690022 Владивосток, Россия
* E-mail: mikiseleva@mail.ru
Поступила в редакцию 24.03.2020
После доработки 18.08.2020
Принята к публикации 05.10.2020
Аннотация
На модели развивающихся эмбрионов морского ежа Strongylocentrotus intermedius изучено влияние полифенольных примесей на биологическую активность образцов фукоидана из бурой водоросли Fucus distichus subsp. evanescens. Определена эмбриотоксическая активность фукофлоретола из F. evanescens (ИК50 = 96.90 ± 12.20 мкмоль/л) и тритерпенового гликозида кукумариозида А7 из кукумарии Cucumaria frondosa subsp. japonica (ИК50 = 0.39 ± 0.01 мкмоль/л). Показана способность фукоиданов с разным содержанием полифенольных примесей частично или полностью снижать эмбриотоксическую активность тритерпенового гликозида кукумариозида А7 из C. japonica.
Фукоиданы представляют собой структурно разнообразное семейство сульфатированных, а иногда ацетилированных гомо- и гетерополисахаридов с остатками сульфатированной α-L-фукозы в основной цепи. Источником фукоидана являются преимущественно бурые водоросли. В последнее время фукоиданы стали объектом повышенного внимания и интенсивного исследования (Menshova et al., 2016). Практический интерес к этим полисахаридам можно объяснить их разнообразной биологической активностью и низкой токсичностью (Kusaykin et al., 2008; Luthuli et al., 2019). Многообразие структур фукоиданов является специфичным по отношению к виду водоросли и обусловлено различным соотношением типов О-гликозидных связей между остатками α-L-фукозы, количеством и расположением сульфатных и ацетатных групп, а также природой и расположением разветвлений (Li et al., 2008).
Помимо фукоиданов бурые водоросли синтезируют ряд уникальных вторичных метаболитов, в том числе полифенолы, которые также проявляют широкий спектр биологической активности и действуют в малых концентрациях (Имбс, Звягинцева, 2018). Эти вещества часто экстрагируются вместе с фукоиданами, и не всегда удается освободиться от них во время процедуры очистки (Ragan, Glombitza, 1986). Присутствие примесей влияет на биологические свойства фукоидана и затрудняет оценку его биологической активности. Ранее нами было показано, что примесные фенолы играют ключевую роль в антиоксидантной активности, проявляемой фукоиданом из бурой водоросли Fucus evanescens (см.: Imbs et al., 2015).
Эмбрионы морского ежа являются удобной и чувствительной моделью для токсикологических, фармакологических и других биологических исследований (Бузников, Подмарев, 1975; Kobayashy, 1984). Цель настоящей работы – изучение влияния полифенольных примесей, содержащихся в образцах фукоидана бурой водоросли Fucus distichus subsp. evanescens, на развивающиеся эмбрионы морского ежа Strongylocentrotus intermedius и на способность фукоиданов с разной степенью очистки от полифенольных примесей снижать эмбриотоксическую активность тритерпенового гликозида кукумариозида А7 из Cucumaria frondosa subsp. japonica.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследований послужили образцы фукоиданов и фукофлоретол, выделенные из бурой водоросли фукуса, а также тритерпеновый гликозид кукумариозид А7, выделенный из кукумарии. Во всех экспериментах использовали фильтрованную морскую воду.
Морских ежей собирали в б. Троицы (зал. Петра Великого Японского моря). Эксперименты проводили на Морской экспериментальной станции Тихоокеанского института биоорганической химии им. Г.Б. Елякова ДВО РАН (Хасанский район, Приморский край, Россия). Бурые водоросли собирали в июле 2011 г. у западного побережья о-ва Итуруп (Охотское море; 44°45′8″ с.ш., 147°10′5″ в.д.) во время экспедиции на НИС “Академик Опарин”.
Свежий образец фукуса (800 г) промывали водой; затем удаляли механические примеси, обезжиривали, выдерживая в 1 л 96% этанола (V/V) в течение 24 ч при температуре 40°С, и сушили в вакууме. В результате было получено 80 г сухой обезжиренной водоросли. Фукоидан экстрагировали из 40 г этой водоросли водным раствором 0.1 М HCl (pH 2–3) при температуре 60°C в течение 3 ч; экстракт центрифугировали, нейтрализовали и диализовали через мембрану “Thermo Scientific” (США), отсекая фракцию с молекулярной массой 3.5 кДа. Полисахарид осаждали из экстракта этанолом; выход полисахарида (F0) составил 3.6 г.
Полисахарид F0 делили на две порции. Первую порцию растворяли в воде (25 мг/мл), 60 мл загружали на колонку (3.0 × 14 см) с анионообменным носителем ДЭАЭ-целлюлоза в форме Cl–. Нейтральные вещества элюировали водой, а затем линейным градиентом H2O/2М NaCl (250/250 мл). Фракцию фукоидана, элюированную 2М раствором NaCl, диализовали и лиофильно сушили. В результате получили 330 мг полисахарида F1. Вторую порцию полисахарида F0 обрабатывали 5%-ным водным раствором Н2О2 и 10%-ным водным раствором NH3 доводили до рН 8.5, как описано ранее (Урванцева и др., 2004). Смесь оставляли в темноте на 17 ч при комнатной температуре. Нерастворимый осадок удаляли центрифугированием. Супернатант диализовали против воды и дважды осаждали этиловым спиртом, осадок центрифугировали и сушили сначала ацетоном, затем эфиром на воздухе. Полученный полисахарид F хроматографировали, как описано выше. Фракцию фукоидана, элюированную 2М раствором NaCl, диализовали и лиофильно сушили. В результате было получено 300 мг фукоидана F2.
В эксперименте использовали полифенольное соединение фукофлоретол, ранее выделенное нами из водно-этанольного экстракта бурой водоросли последовательно жидкостной экстракцией органическими растворителями и хроматографией на носителях: силикагель 100, полихром 1 и С-18. Соединение характеризовали методами ЯМР-спектроскопии и масс-спектрометрии. Молекулярная масса фукофлоретола (C18H14O9) составила 374 Да, что соответствует трем единицам флороглюцина в полимерной молекуле (Silchenko et al., 2017; Imbs et al., 2018).
Подфракцию полярных кукумариозидов группы А7 из кукумарии получали методом тонкослойной хроматографии суммы гликозидов на силикагеле. Затем проводили разделение данной фракции методом обращенно-фазовой хроматографии на жидкостном хроматографе высокого давления. В работе использовали смесь гликозидов А7-1, А7-2 и А7-3 в соотношении 53.6, 6.4 и 21.3% соответственно (Дроздова и др., 1993).
Выход полисахаридов после хроматографии и содержание общих углеводов в образцах фукоидана, а также моносахаридный состав и количество сульфатных групп в образцах полисахарида определяли, как описано ранее (Урванцева и др., 2004). Общее содержание полифенолов определяли по методу Фолина–Чокальтеу (Kuda, Ikemori, 2009) с использованием флороглюцина (“Merck”, США) в качестве стандарта. Содержание фенола выражали в миллиграммах эквивалента флороглюцина на 1 г сухого вещества (мгPGEq/гDW).
Оптическое вращение водных растворов полисахаридов ($[\alpha ]_{{\text{D}}}^{{20^\circ }}$, 1 мг/мл) измеряли на поляриметре “Perkin-Elmer 141” (Германия) на натриевой лампе при длине волны 580 нм. УФ-спектры поглощения образцов фукоидана регистрировали на спектрофотометре Cecil CE 7200 “Hitachi” (США).
Спектры флуоресценции образцов фукоидана регистрировали на спектрофлуориметре “Hitachi-850” (Япония) в диапазоне от 380 до 600 нм, используя возбуждение при 366 нм, в кварцевой кювете с толщиной слоя 1 см. Спектры корректировали по родамину В и записывали в режиме интеграции. Площади под спектрами флуоресценции образцов полисахарида рассчитывали, вычитая площадь под спектром буферного раствора из общей площади спектра. Ширина щели на монохроматорах возбуждения и излучения составляла 5 нм, скорость записи спектров – 100 нм/мин.
13С ЯМР-спектры полисахаридов регистрировали на ЯМР-спектрометре “Avance DPX-700” (Bruker, Германия) (60°C, D2O). ЯМР-спектры полифенольных соединений регистрировали на ЯМР-спектрометре “Avance-III 500 HD” (Bruker, Германия) при температуре 35°С в дейтерированном метаноле (MeOD). В качестве внутреннего стандарта в обоих случаях использовали тетраметилсилан.
Мужские и женские гаметы морского ежа получали, а также проводили оплодотворение особей морского ежа в соответствии с известными методиками с некоторыми модификациями (Бузников, Подмарев, 1975; Киселева и др., 2005, 2015). Свежевыловленных морских ежей при помощи механического встряхивания разделяли на самцов и самок, которых содержали в отдельных емкостях. Яйцеклетки и спермии собирали в разные стаканы с морской водой, пропускали через сита (размер ячеи 100 × 100 мкм), давали осесть на дно заполненной емкости и дважды промывали морской водой, чтобы смыть желеобразное покрытие яйца. Перед началом опытов проводили пробное оплодотворение. В экспериментах использовали яйцеклетки со степенью оплодотворения не менее 98%. Время от получения яйцеклеток до их осеменения не превышало 1 ч. Все опыты проводили одновременно в 12-луночных планшетах компании ООО “БиолоТ” (Россия) на одних и тех же партиях эмбрионов при температуре 20 ± 0.5°C.
При оценке влияния фукоиданов F0, F1 и F2 на эмбриогенез морского ежа к 0.9 мл суспензии (2500/мл) яйцеклеток через 3–5 мин после оплодотворения добавляли 0.1 мл раствора испытуемых веществ в морской воде. Конечная концентрация фукоиданов в инкубационной смеси составляла 10, 50, 100, 250, 500 и 1000 мкг/мл. Через каждые трое суток инкубации ко всем пробам добавляли по 0.5 мл морской воды для поддержания необходимого уровня кислорода.
В параллельных экспериментах к яйцеклеткам через 3–5 мин после оплодотворения добавляли кукумариозид А7 и фукофлоретол в исследуемых концентрациях. Конечная концентрация кукумариозида А7 в инкубационной смеси составляла 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 1.2, 2.5, 5.0 и 10.0 мкг/мл, а фукофлоретола – 10, 20, 30, 40 и 50 мкг/мл. Инкубационная смесь содержала 0.1 мл раствора фукофлоретола (не более 10% метанола в морской воде) или 0.1 мл раствора гликозида (не более 10% этанола в морской воде) и 0.9 мл суспензии оплодотворенных яйцеклеток (2500/мл). Оплодотворенные яйцеклетки с испытуемыми веществами инкубировали в течение 48 ч до стадии плутеуса – 24–25-я стадии (по: Бузников, Подмарев, 1975).
При изучении совместного действия фукоиданов F1, F2 и кукумариозида А7 на эмбриогенез морского ежа исследуемые образцы добавляли на стадии зиготы к суспензии оплодотворенных яйцеклеток (2500/мл) последовательно: фукоидан – через 3–5 мин после оплодотворения, кукумариозид А7 – через 30 мин инкубации оплодотворенных яйцеклеток с фукоиданом. Инкубационная смесь состояла из 0.8 мл суспензии яйцеклеток и из растворов фукоидана и кукумариозида А7 (по 0.1 мл).
За развитием эмбрионов во всех экспериментах наблюдали в микроскоп “Motic AE 21” (Китай), визуально определяя основные признаки и стадию развития (по: Бузников, Подмарев, 1975), вплоть до гибели всех эмбрионов. В качестве контроля использовали эмбрионы в морской воде. Стандартными критериями для положительной оценки действия веществ были синхронность деления яйцеклеток, нормальное функционирование эмбрионов, а также их подвижность и жизнеспособность. Цитотоксическое действие соединений оценивали по их способности вызывать блокаду или тормозить деление оплодотворенных яйцеклеток. Кроме этого на стадиях эмбрионального развития морских ежей регистрировали различные аномалии, замедленное или вращательное движение эмбрионов (Kobayashi, 1984; Kobayashi, Okamura, 2002), а также определяли концентрацию, вызывающую гибель 50% эмбрионов (ИК50). Выживаемость эмбрионов оценивали как отношение времени их жизни под действием веществ (сут) ко времени жизни в контрольном эксперименте (сут), выраженное в процентах. Все эксперименты выполняли одновременно в одинаковых условиях с использованием одной партии эмбрионов в 5–10 параллельных опытах с тремя повторами для каждой концентрации веществ.
Достоверность результатов в условиях заданной доверительной вероятности p ≤ 0.05 оценивали с помощью методов дисперсионного анализа ANOVA в пакете прикладных программ Origin 8.1; анализировали кривые доз-зависимости и выбирали модели для определения ИК50 также с помощью программного обеспечения Origin 8.1 (“OriginLab”, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика образцов фукоидана
Образец фукоидана F0 имел УФ-спектр поглощения с максимумом при 268 нм (рис. 1, спектр 1), что характерно для ароматических соединений. Максимум спектра возбуждения образца фукоидана F0 располагался при 366 нм (рис. 1, спектр 2). Спектр флуоресценции этого образца имел широкий максимум в диапазоне 450–455 нм и плечо в диапазоне 530–550 нм (рис. 1, спектр 3). По данным метода Фолина–Чокальтеу (Kuda, Ikemori, 2009), этот образец содержал 33.3 мгPGEq/гDW полифенольных соединений (табл. 1). Степень очистки образца F0m = 0 (табл. 2).
Рис. 1.
Спектры поглощения (1), возбуждения (2) и флуоресценции (3) фукоидана F0; спектры флуоресценции фукоиданов разной степени очистки от полифенольных примесей: F1 (4), F (5) и F2 (6). Концентрация образцов 5 мг/мл, 0.1 М Na+-фосфатный буфер, рН 8.5; кювета 1 см, возбуждение светом с длиной волны 366 нм, ширина щели на монохроматорах возбуждения и излучения – 5 нм.

Таблица 1.
Основные характеристики образцов полисахарида разной степени очистки
| Образец | Выход, % | Фолин–Чокальтеу, мгPGEq/гDW | Сульфатные группы, % | Состав нейтральных моносахаридов, % | ||||
|---|---|---|---|---|---|---|---|---|
| Fuc | Man | Gal | Glc | Xyl | ||||
| F0 | 100 | 33.3 | 14.3 | 59.4 | 3.2 | 7.2 | 25.0 | 5.7 |
| F1 | Не определяли | 20.0 | 28.0 | 91.5 | 0 | 3.0 | 0 | 0.5 |
| F2 | 38 | 0 | 31.4 | 94.6 | 0.3 | 4.2 | 0 | 0.9 |
Таблица 2.
Спектральные характеристики образцов фукоидана
| Образец | ОП366* | $[\alpha ]_{{\text{D}}}^{{20^\circ }}$, Н2О | m = 1 − S/S0 |
|---|---|---|---|
| F0 | 0.285 | –114.8 | 0 |
| F1 | 0.114 | – | 0.60 |
| F2 | 0.015 | –173.0 | 0.98 |
* Кювета – 1 см, концентрация полисахарида 2 мг/мл. Примечание. S – площадь под спектром флуоресценции исследуемых образцов очищенного фукоидана; S0 – площадь под спектром флуоресценции исходного образца фукоидана F0; ОП366 – оптическая плотность раствора полисахарида при 366 нм; m – степень очистки.
Фукоидан F1, полученный после анионообменной хроматографии исходного полисахарида F0, также имел спектр флуоресценции (рис. 1, спектр 4), но его интенсивность была меньше. Этот образец содержал 20 мгPGEq/гDW полифенольных соединений (табл. 1). Степень очистки образца F1m = 0.60 (табл. 2).
Фукоидан F0 был обработан 5%-ным водным раствором Н2О2, и была получена фракция полисахарида F, в которой еще сохранялась флуоресценция (рис. 1, спектр 5). В результате хроматографии фукоидана F на анионообменном носителе получен фукоидан F2 с нулевой флуоресценцией (рис. 1, спектр 6). Согласно данным метода Фолина–Чокальтеу (Kuda, Ikemori, 2009), фукоидан F2 не содержал полифенольные примеси (табл. 1). Степень очистки образца F2m = 0.98 (табл. 2).
По данным ЯМР спектроскопии структуры фукоиданов F1 и F2 были подобны и представляли собой сульфатированный α-L-фукан, имеющий линейную цепь чередующихся (1 → 3)- и (1 → 4)-связанных остатков α-L-фукопиранозы, сульфатированных по С2 и С4 (1 → 3)-α-L-фукопиранозных остатков (спектры не приводятся) (Урванцева и др., 2004). Фукоидан F2 был освобожден от примесей полифенольных соединений (m = 0.98), показатель оптического угла вращения $[\alpha ]_{{\text{D}}}^{{20^\circ }}$ (–173.0) соответствовал таковому ранее охарактеризованного фукоидана из F. evanescens (табл. 2) (Bilan et al., 2002).
Влияние образцов фукоидана F0, F1 и F2 на эмбриогенез морского ежа
При низкой концентрации фукоидана F0 (10–50 мкг/мл) выживаемость эмбрионов морского ежа по сравнению с таковой в контроле (рис. 2а; табл. 3) увеличивалась. При повышении концентрации этого фукоидана наблюдались асинхронное деление, аномалии и частичная гибель эмбрионов, что сопровождалось лизисом бластомеров. Через 0.5 сут инкубации фукоидан F0 в концентрации 500 мкг/мл вызывал гибель и лизис 30% эмбрионов, а в концентрации 1000 мкг/мл – гибель 80% эмбрионов (табл. 3; рис. 2) на стадии одного бластомера (рис. 3Аа), часть которых была лизирована.
Рис. 2.
Влияние фукоиданов с разной степенью очистки от полифенолов на эмбриогенез морского ежа: а – F0; б – F1; в – F2. Результаты представлены в виде графиков зависимости средних значений выживаемости эмбрионов от концентраций полисахаридов ± стандартная ошибка среднего (вертикальные линии) при доверительной вероятности p ≤ 0.05.

Таблица 3.
Влияние образцов фукоидана разной степени очистки на развивающиеся эмбрионы морского ежа
| Образец фукоидана | Концентрация, мкг/мл | Время инкубации после оплодотворения, сут | ||||
|---|---|---|---|---|---|---|
| 0.5 | 1.5 | 3 | 4 | 8 | ||
| стадии развития | ||||||
| контроль | 0 | 10–11 | 22–23 | 24–25, ан. (д, е) 10%, | 24–25, ан. (е, ж) 10%, д.з. Г 50% | Г 100% |
| F0 | 10–50* | 10–11 | 22–23, ан. (в) 20% | 24–25, ан. (д, е) 20%, д.з. 50% |
25, ан. (е, ж), д.з., крут. 50%, Г 5% | 25–26, ан. (ж, з), д.з., крут. 50%, Г 30% |
| 100–250 | 9 < 10 > 11 | 22–23, ан. (в) 30%, Г 30% |
24–25, ан. (д, е), д.з. 50%, Г 30% | 25, ан. (е, ж), д.з., крут. 50%, Г 45% | Г | |
| 500 | 3–4 < 8–10 > 11–12, ан. 30%, Г, Л 30% | 19–23, д.з. ан. (а, б, г), Г, Л 60% |
Г | |||
| 1000 | 3–4, ан., Г 80% (1 бл.), Л (черный) 30% | Г | ||||
| F1 | 10–50 | 10–11 > 12 | 22–23 | 24–25, Г 10% | 25, ан. (д, е, ж), д.з. 70%, крут. 30%, Г 5% | 25–26, ан. (д, е, ж, з) 70%, д.з., Г 30% |
| 100 | 10–11 > 12 | 22–23 | 24–25, ан. (д, е), д.з. 20%, Г 10% | 24–25, ан. (д, е, ж), д.з., 70%, крут. 30%, Г 10% | 25–26, ан. (д, е, ж, з) 70%, д.з., Г 30% | |
| 250 | 10–11 > 12 | 22–23 | 23–25, ан. (г, д), д.з., Г 10% | 24–25, ан. (д, е, ж), д.з., крут. 30%, Г 10% | 25, ан. (д, е, ж, з), д.з., Г 40% |
|
| 500 | 9 < 10–11 > 12 | 19–23, ан. (а, б), д.з. 20% | 23–24, ан. (г, д), д.з., Г 20% |
24–25, ан. (д, е, ж), д.з., 70%, крут. 30%, Г 30% | 25, ан. (д, е, ж, з), д.з., Г 40% |
|
| 1000 | 9 < 10–11 > 12 | 18–22, ан. (а, б), д.з. 30% | 22–24, ан. (б, г, д), д.з., Г 30% | 22–24, ан. (б, г, д, е, ж), д.з., Г 40% | 25, ан. (д, е, ж, з), д.з., Г 50% |
|
| F2 | 10–50 | 10–11 > 12 | 23–24 | 24–25 | 25, ан. (е, ж), д.з. 50%, крут. 10% | 25–26, ан. (е, ж, з) 50%, д.з., Г 30% |
| 100–250 | 11–12 | 22–24 | 24–25 | 25–26, ан. (е, ж), д.з. 30%, крут. 15% | 25–26, ан. (е, ж, з) 50%, д.з., Г 30% | |
| 500 | 10–11 > 12 | 22–23, ан. (в), д.з. 10% | 23–25, ан. (в), д.з. 10%, Г 10% | 24–25, ан. (е, ж), д.з. 30%, крут. 15%, Г 10% | 25–26, ан. (е, ж, з) 50%, д.з., Г 30% | |
| 1000 | 10–11 > 12 | 21–22, ан. (в), д.з. 20% | 22–25, ан. (в), д.з. 25%, Г 15% | 24–25, ан. (е, ж), д.з. 40%, крут. 15%, Г 15% | 25, ан. (е, ж, з) 50%, д.з., Г 30% | |
* В пределах обозначенного диапазона концентраций результаты действия фукоиданов не изменялись. Примечание. Контроль – эмбрионы в морской воде; F0 – образец фукоидана в природном комплексе с полифенолами; F1 – образец фукоидана в природном комплексе с полифенолами, прошедший стадию анионообменной хроматографии; F2 – образец фукоидана, освобожденный от полифенольных примесей. Стадии развития: 3 – 2 бластомера, 4 – 4 бластомера; 8, 9 – ранняя бластула 1 и 2 соответственно; 10, 11 – средняя бластула 1 и 2 (вылупление) соответственно; 12 – поздняя бластула 1; 15 – ранняя гаструла 2; 18, 19 – поздняя гаструла 1 и 2 соответственно; 20, 21 – призма 1 и 2 соответственно; 22, 23, 24 – ранний плутеус 1, 2 и 3 соответственно; 25, 26 – средний плутеус 1 и 2 соответственно (Бузников, Подмарев, 1975); Г – гибель яйцеклеток; Л – лизис яйцеклеток. Условные обозначения: ан. – аномальное развитие эмбрионов; а, б, в, г, д, е, ж, з – аномальные стадии, как на рис. 3; бл. − бластомер; д.з. – движение эмбрионов замедленное; крут. – крутящиеся эмбрионы. Приведены результаты пяти экспериментов, доверительный интервал р ≤ 0.05.
Рис. 3.
Эмбрионы морского ежа Strongylocentrotus intermedius на разных стадиях развития. А – нормальное развитие эмбрионов: а – оплодотворенная яйцеклетка (1 бластомер), б – бластула (10-я стадия), в – призма (21-я стадия), г и д – ранний и средний плутеус (23-я и 25-я стадии соответственно). Б – аномалии в развитии эмбрионов, отмеченные на стадиях: а, б – гаструлы (16–19-я стадии), в – призмы (21-я стадия) и г, д, е, ж, з – раннего и среднего плутеуса (22–26-я стадии); номер стадии по: Бузников, Подмарев (1975). Ув. ×40.

При действии фукоидана F1 (степень очистки m = 0.60) в концентрации 500–1000 мкг/мл через 0.5 сут инкубации эмбрионы начинали делиться асинхронно, а через 1.5 сут появились эмбрионы с морфологическими аномалиями, отстававшие в развитии (табл. 3; рис. 2б и рис. 3Б: а, б).
Фукоидан F2 через 0.5 сут инкубации во всех исследованных концентрациях оказывал положительное влияние на развивающиеся эмбрионы. При его действии в концентрации 100–250 мкг/мл наблюдалось как опережение в развитии, так и увеличение продолжительности жизни эмбрионов на 30–50% относительно контрольных зародышей (табл. 3; рис. 2в). Однако при концентрации фукоидана F2 500–1000 мкг/мл появлялись аномалии в развитии эмбрионов на стадии раннего плутеуса (рис. 3Б: г), что соответствует 22–23-й стадиям (по: Бузников, Подмарев, 1975) (табл. 3; рис. 3А: в, г).
Фукоиданы F0 и F1 с разной степенью загрязнения полифенолами, а также образец F2, очищенный от полифенолов, в низких концентрациях (10–50 мкг/мл) повышали выживаемость эмбрионов. Различие наблюдалось при более высоком содержании этих полисахаридов. Так, при концентрации фукоидана F0 100–1000 мкг/мл отмечена частичная или полная гибель эмбрионов. Фукоиданы F1 и F2 в этой же концентрации не оказывали губительного действия на жизнеспособность эмбрионов (рис. 2). Однако в присутствии фукоидана F1 увеличилось число аномальных эмбрионов на всех стадиях развития (табл. 3; рис. 3Б), что наглядно представлено на фотографиях эмбрионов через 3 сут инкубации (рис. 4). При концентрации фукоидана F2 100 мкг/мл эмбрионы развивались без морфологических нарушений (рис. 4). Действие фукоидана F1 в этой же концентрации проявлялось как аномалии в развитии эмбрионов, а при концентрации 1000 мкг/мл через 3 сут инкубации отмечено отставание в развитии эмбрионов и увеличение числа аномалий. При этой же концентрации фукоидана F2 аномалий в развитии эмбрионов не наблюдалось, но отмечено отставание в их развитии (табл. 3; рис. 4).
Действие фукофлоретола и кукумариозида А7 на эмбриогенез морского ежа
В концентрации ≥50 мкг/мл полифенол блокировал деление и вызывал лизис яйцеклеток на стадии 1 бластомера. В концентрации <50 мкг/мл (134 мкмоль/л) фукофлоретол ингибировал развитие эмбрионов частично, что проявлялось в течение всего инкубационного периода.
Кукумариозид А7 оказывал цитотоксическое действие в концентрации ≥1.2 мкг/мл (0.79 мкмоль/л). Влияние гликозида в концентрации <1.2 мкг/мл приводило к задержке развития, частичной гибели и морфологическим нарушениям в развитии эмбрионов (рис. 3Б: в), тогда как в концентрации 0.2 мкг/мл это соединение оказывало слабое стимулирующее действие (рис. 5б, рис. 6). Значения ИК50 для фукофлоретола и кукумариозида А7 составили 96.9 ± 12.2 и 0.39 ± 0.01 мкмоль/л соответственно (рис. 5в, г).
Рис. 5.
Цитотоксическое действие фукофлоритола (а) и кукумариозида А7 (б) на развивающиеся эмбрионы морского ежа Strongylocentrotus intermedius, а также сигмоидальная доз-зависимость выживаемости эмбрионов для определения ИК50 фукофлоретола (в) и кукумариозида А7 (г). В результате подгонки теоретических зависимостей к экспериментальным точкам по модели Хилла определены коэффициенты нелинейной регрессии k и n, соответствующие ИК50 и коэффициенту кооперативности, который отражает число мест связывания лиганда. Вертикальные линии на рисунках (а) и (б) отражают стандартную ошибку среднего, тогда как на рисунках (в) и (г) – стандартную ошибку подгонки теоретической кривой к экспериментальным точкам.
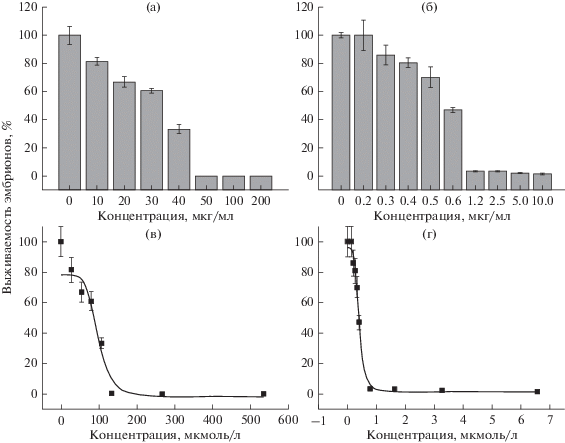
Рис. 6.
Совместное действие фукоиданов и тритерпенового гликозида кукумариозид А7. а – фукоидан F1 (m = 0.60); б – фукоидан F2 (m = 0.98). 1 – кукумариозид А7; 2 – 10 мкг/мл фукоидана + кукумариозид А7; 3 – 50 мкг/мл фукоидана + кукумариозид А7; 4 – 100 мкг/мл фукоидана + кукумариозид А7; 5 – 250 мкг/мл фукоидана + кукумариозид А7. Результаты представлены в виде графиков зависимости средних значений выживаемости эмбрионов от концентраций кукумариозида ± стандартная ошибка среднего (вертикальные линии) при доверительной вероятности p ≤ 0.05.
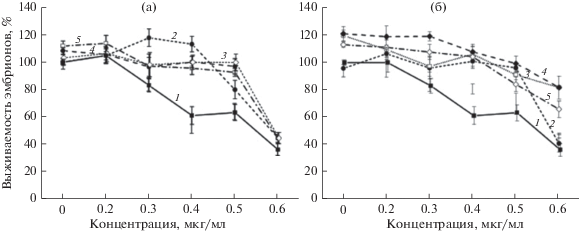
Совместное действие фукоиданов F1, F2 и кукумариозида А7 на эмбриогенез морского ежа
Фукоиданы F1 и F2 в исследованных концентрациях снимали токсическое действие кукумариозида А7 на развивающиеся эмбрионы морского ежа (рис. 6), за исключением кукумариозида А7 в концентрации 0.6 мкг/мл, при которой фукоидан F1 практически не оказывал защитного действия. Наиболее эффективно эмбрионы морского ежа защищал фукоидан F2 в концентрациях 100–250 мкг/мл (рис. 6а).
В данном исследовании мы привели результаты изучения биологических свойств образцов фукоидана F0, F1 и F2 из бурой водоросли F. evanescens, которые имеют одинаковую структуру, но различаются по степени загрязнения полифенольными соединениями, образующими с полисахаридом прочный комплекс. Очистка полисахарида заключалась в разрушении данного комплекса под действием перекиси водорода и в последующей хроматографии на анионообменном носителе. Степень загрязнения образцов фукоидана полифенольными соединениями контролировали методом флуоресценции самих соединений (Урванцева и др., 2004) и колориметрическим методом Фолина–Чокальтеу (Kuda, Ikemori, 2009). Результаты, полученные с помощью этих методов, хорошо согласуются. Однако простой и высокочувствительный метод собственной флуоресценции позволяет без дополнительных реагентов и разрушения структуры полисахарида выявить присутствие полифенольных соединений. Этот метод очень удобен для контроля очистки полисахаридов от любых флуоресцирующих примесей.
Для изучения биологической активности полисахаридов нами давно и успешно применяется модель развивающихся эмбрионов морского ежа. В наших ранних исследованиях показано, что полисахариды бурых водорослей независимо от моносахаридного состава увеличивали продолжительность жизни эмбрионов (Киселева и др., 2005, 2015; Kiseleva et al., 2008). Степень очистки полисахаридов от полифенольных примесей в данных исследованиях не контролировали. В настоящей работе исследовали влияние на эмбриогенез морского ежа одного фукоидана, но с разным содержанием полифенольных примесей (образцы F1 и F2) (табл. 1). Сырой образец фукоидана F0 был гетерогенным по моносахаридному составу и содержал наибольшее количество полифенолов (33.3 мгPGEq/гDW, степень очистки m = 0). В концентрациях ≥100 мкг/мл этот образец проявлял высокую эмбриотоксическую активность (рис. 2а). Цитотоксический эффект частично очищенного образца фукоидана F1 (20.0 мгPGEq/гDW, m = 0.6) наблюдался лишь при концентрациях 500 и 1000 мкг/мл. Наиболее благоприятным для жизнедеятельности эмбрионов оказался образец фукоидана F2, очищенный от полифенольных примесей. Этот образец, как и образец фукоидана F1, поддерживал и удлинял жизнь эмбрионов, а также, что очень важно, предупреждал появление аномалий в их развитии. Фукофлоретол – полифенольное соединение, выделенное из этой же водоросли, оказывал цитотоксическое действие в концентрациях ≤50 мкг/мл; ИК50 = 96.9 ± 12.2 мкмоль/л (рис. 5а, б).
Ранее на модели развивающихся эмбрионов морского ежа нами было показано, что фукоиданы снижают токсическое действие ингибиторов белковой природы из бурой водоросли Saccharina cichorioides (см.: Киселева и др., 2015), однако содержание полифенольных примесей в образцах белков и полисахаридов не определялось. В качестве токсина мы выбрали кукумариозид А7 из голотурии C. frondosa, известный как соединение, ингибирующее и блокирующее деление яйцеклеток в наномолярных концентрациях (Agafonova et al., 2003). В нашем эксперименте кукумариозид А7 также показал высокую цитотоксическую активность (ИК50 = 0.39 ± 0.01 мкмоль/л). При предварительной обработке эмбрионов образцами фукоидана F1 и F2 токсическое действие этого соединения различалось. Особенно заметное различие защитных свойств фукоиданов F1 и F2 было отмечено при высоких концентрациях кукумариозида А7 (0.6 мкг/мл) и полисахарида (100 и 250 мкг/мл). Наиболее эффективную защиту оказывал высокоочищенный образец фукоидана F2 (степень очистки m = 0.98) (рис. 6б, линии 4 и 5): выживаемость эмбрионов в его присутствии увеличилась по сравнению с таковой в контроле и при действии фукоидана F1 (рис. 6а, линии 4 и 5) более чем на 40%.
Таким образом, на модели развивающихся эмбрионов морского ежа было показано, что лишь полностью очищенный от полифенольных примесей образец фукоидана (F2) из бурой водоросли F. distichus стимулировал эмбриогенез и эффективно защищал эмбрионы от токсического действия кукумариозида А7. Полифенольные примеси негативно влияли на биологическую активность образцов фукоидана, вызывая появление большого количества эмбрионов с морфологическими нарушениями. Образец фукоидана (F1), содержавший полифенолы, не снижал эмбриотоксическое действие высоких концентраций кукумариозида А7. В связи с этим следует отметить, что при изучении биологических свойств фукоиданов необходимо контролировать количество примеси полифенольных соединений, которые можно легко обнаружить при измерении спектра флуоресценции образца полисахарида.
Список литературы
Бузников Г.А., Подмарев В.К. Морские ежи Strongylocenrotus drobachiensis, S. nudus, S. intermedius // Объекты биологии развития. М.: Наука. 1975. С. 178–216.
Дроздова О.А., Авилов С.А., Калиновский А.И. и др. Трисульфатированные гликозиды из голотурии Cucumaria japonica // Химия природ. соедин. 1993. № 3. С. 369–374.
Имбс Т.И., Звягинцева Т.Н. Флоротаннины – полифенольные метаболиты бурых водорослей // Биол. моря. 2018. Т. 44. № 4. С. 217–227.
Киселева М.И., Шевченко Н.М., Крупнова Т.Н., Звягинцева Т.Н. Влияние фукоиданов на развивающиеся эмбрионы морского ежа Strongylocentrotus intermedius // Журн. эвол. биохим. и физиол. 2005. Т. 41. № 1. С. 51–57.
Киселева М.И., Ермакова С.П., Звягинцева Т.Н. Действие белков и полисахаридов бурых водорослей на оплодотворение яйцеклеток и развитие эмбрионов морского ежа Strongylocentrotus intermedius A. Agassiz, 1863 // Биол. моря. 2015. Т. 41. № 6. С. 437–446.
Урванцева А.М., Бакунина И.Ю., Ким Н.Ю. и др. Выделение очищенного фукоидана из природного комплекса с полифенолами и его характеристика // Химия растит. сырья. 2004. № 3. С. 15–24.
Agafonova I.G., Aminin D.L., Avilov S.A., Stonik V.A. Influence of cucumariosides upon intracellular [Ca2+]i and lysosomal activity of macrophages // J. Agric. Food Chem. 2003. V. 51. № 24. P. 6982–6986.
Bilan M.I., Grachev A.A., Ustuzhanina N.E. et al. Structure of a fucoidan from the brown seaweed Fucus evanescens C. Ag. // Carbohydr. Res. 2002. V. 337. № 8. P. 719–730.
Imbs T.I., Skriptsova A.V., Zvyagintseva T.N. Antioxidant activity of fucose-containing sulfated polysaccharides obtained from Fucus evanescens by different extraction methods // J. Appl. Phycol. 2015. V. 27. № 1. P. 545–553.
Imbs T.I., Silchenko A.S., Fedoreev S.A. et al. Fucoidanase inhibitory activity of phlorotannins from brown algae // Algal Res. 2018. V. 32. № 1. P. 54–59.
Kiseleva M.I., Balabanova L.A., Rasskazov V.A., Zvyagintseva T.N. Effect of 1,3;1,6-β-D-glucans on developing sea urchin embryos // Mar. Biotechnol. 2008. V. 10. № 4. P. 466–470.
Kobayashi N. Marine ecotoxicological testing with echinoderms. In Ecotoxicological Testing for the Marine Environment (Proc. International Symposium on Ecotoxicological Testing for the Marine Environment, Ghent, Belgium, September 12–14, 1983), Persoone G., Jaspers E., Claus C., Eds., Bredene, Belgium: State Univ. of Ghent, 1984. V. 1. P. 341–405.
Kobayashi N., Okamura H. Effects of new antifouling compounds on the development of sea urchin // Mar. Pollut. Bull. 2002. V. 44. № 8. P. 748–751.
Kuda T., Ikemori T. Minerals, polysaccharides and antioxidant properties of aqueous solutions obtained from macroalgal beach-casts in the Noto Peninsula, Ishikawa, Japan // Food Chem. 2009. V. 112. № 3. P. 575–581.
Kusaykin M., Bakunina I., Sova V. et al. Structure, biological activity, and enzymatic transformation of fucoidans from the brown seaweeds // Biotechnol. J. 2008. V. 3. № 7. P. 904–915.
Li B., Lu F., Wei X., Zhao R. Fucoidan: structure and bioactivity // Molecules. 2008. V. 13. № 8. P. 1671–1695.
Luthuli S., Wu S., Cheng Y. et al. Therapeutic effects of fucoidan: A review on recent studies // Mar. Drugs. 2019. V. 17. Art. ID 487. https://doi.org/10.3390/md17090487
Menshova R.V., Shevchenko N.M., Imbs T.I. et al. Fucoidans from brown alga Fucus evanescens: structure and biological activity // Front. Mar. Sci. 2016. V. 3. Art. ID 129. https://doi.org/10.3389/fmars.2016.00129
Ragan M.A., Glombitza K.W. Phlorotannins, brown alga polyphenols // Progress in Phycological Research / Eds.: F.E. Round, D.J. Chapman. Bristol, U.K.: Biopress. 1986. V. 4. P. 129–241.
Silchenko A.S., Imbs T.I., Zvyagintseva T.N. et al. Brown alga metabolites – inhibitors of marine organism fucoidan hydrolases // Chem. Nat. Compd. 2017. V. 53. № 2. P. 345–350.
Дополнительные материалы отсутствуют.



