Биология моря, 2021, T. 47, № 4, стр. 253-261
Видовой состав и экология цианобактерий литорали Кольского залива Баренцева моря
Е. С. Мирошниченко *
Институт биологии южных морей им. А.О. Ковалевского РАН
299011 Севастополь, Россия
* E-mail: esmiroshnichenko@ibss-ras.ru
Поступила в редакцию 29.06.2020
После доработки 29.12.2020
Принята к публикации 01.04.2021
Аннотация
Представлены результаты исследования сообществ цианобактерий обрастания природных и антропогенных субстратов литорали Кольского залива Баренцева моря в 2010–2019 гг. Обнаружено 95 видов цианобактерий, принадлежавших 6 порядкам, 20 семействам и 46 родам, из которых 22 вида приведены впервые для Баренцева моря. Большинство цианобактерий относились к бентосным видам (70%), обитавшим преимущественно на природных субстратах. Обилие видов от нижней литорали к супралиторали снижалось. Доля планктонных и бенто-планктонных видов цианобактерий составляла 12 и 18% соответственно. На литорали залива встречались пресноводные (44%), морские (37%), солоноватоводные (3%) и эвригалинные (16%) виды. Выявлено 27 индикаторов среды, большинство из которых олиго- и олиго-бетамезосапробионты. Среди цианобактерий отмечены преимущественно бореально-тропически-нотальные (26%), космополитные (23%) и бореальные (18%) виды. По количеству видов цианобактерий выявлены ранневесенний (март) и осенний (октябрь) пики. Индекс видового сходства был наименьшим для районов с повышенной антропогенной нагрузкой от морских портовых городов.
Изучение биологического разнообразия в настоящее время становится все более актуальным, особенно при анализе видового состава биоты на региональном уровне. Первые упоминания о цианобактериях в Баренцевом море связаны с именем Челльмана (Kjellman, 1883), который описал находки Calothrix scopulorum C. Agardh ex Bornet & Flahault на побережье о-ва Новая Земля и о-ва Вайгач. В Кольском заливе Баренцева моря цианобактерии впервые были описаны Ельфвингом (Elfving, 1895), а также отечественными учеными Еленкиным (1906) и Зиновой (1912). В дальнейшем литературные данные и результаты собственных исследований цианобактерий приливно-отливной зоны Баренцева моря, в том числе Кольского залива, были обобщены в ряде работ (Белякова, 2002, 2005, 2006) и представлены в аннотированных списках 94 видами. Для фитопланктона Кольского залива Баренцева моря известно 25 видов цианобактерий (Макаревич, 2004). В результате проведенного молекулярно-генетического исследования эпифитных бактерий фукусовых водорослей из Кольского залива (район г. Мурманска) было установлено, что цианобактерии составляли 6.8% от всего изученного бактериального сообщества (Пуговкин и др., 2016). В других работах по изучению цианобактерий литорали Кольского залива описано 68 видов цианобактерий (Луценко и др., 2013; Мирошниченко, Москвина, 2016). Таким образом, имеющиеся сведения о цианобактериях в баренцевоморских экосистемах фрагментарны и не дают полного представления о составе их сообществ.
Цель настоящей работы – анализ видового состава и экологии цианобактерий литорали Кольского залива Баренцева моря.
МАТЕРИАЛ И МЕТОДИКА
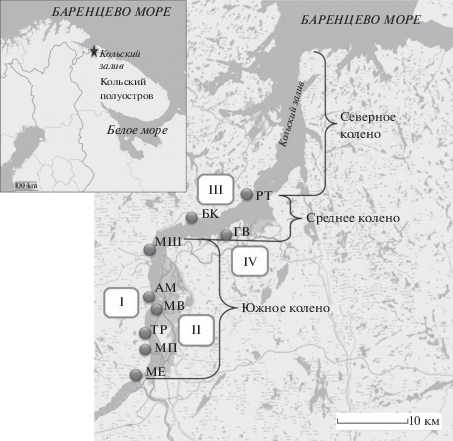
В статье проанализированы результаты работ, проведенных с сентября 2010 г. по апрель 2012 г. (Луценко и др., 2013), с января по май 2014 г. (Мирошниченко, Москвина, 2016) и с февраля по июнь 2019 г. Материал собирали на девяти станциях западного и восточного берегов южного и среднего колен Кольского залива Баренцева моря. Станции объединены в группы по районам (I–IV) исследования (рис. 1).
Рис. 1.
Карта-схема Кольского залива Баренцева моря с указанием станций отбора проб и районов исследования. МЕ – мыс Еловый; МП – мыс Притыка; ТР – Три Ручья; АМ – Абрам-мыс; МШ – мыс Мишуков; МВ – район Морского вокзала г. Мурманска; БК – губа Белокаменная; РТ – губа Ретинская; ГВ – губа Варламова в районе ЗАТО г. Североморск.
Материал собирали во время сизигийных отливов с поверхности субстратов разных типов в супралиторали, верхнем, среднем и нижнем горизонтах литорали методом соскоба скальпелем (всего 355 проб). Были обследованы скалы и валуны (262 пробы), металлические причалы и бетонные блоки, деревянные, стеклянные, резиновые и пластиковые предметы, поверхность раковин моллюсков, макрофитов и лишайников (93 пробы). Нативные препараты изучали под световыми микроскопами “Микромед-2” (Россия) и “Carl Zeiss AxioScope 40” (Германия) при увеличении ×400 и ×1000.
Для определения видового статуса цианобактерий использовали фундаментальные работы Комарека и Анагностидиса (Komárek, Anagnostidis, 1998, 2005; Komárek, 2013). Фитогеографическая принадлежность (Зернов, 1949; Рябушко, 2013) и экологическая характеристика видов приведены по литературным источникам и базам данных (Komárek, Anagnostidis, 1998, 2005; Komárek, 2013; Баринова и др., 2019; Guiry, Guiry, 2020). Встречаемость видов (P, %) оценивали по отношению количества проб, в которых обнаружен вид, к общему количеству проб, а сходство видов в сообществах – по коэффициенту Съеренсена (КS).
РЕЗУЛЬТАТЫ
На литорали Кольского залива Баренцева моря обнаружено 95 видов цианобактерий, относящихся к 46 родам, 20 семействам и 6 порядкам; 22 вида в этом море отмечены впервые (табл. 1).
Таблица 1.
Цианобактерии, обнаруженные на литорали Кольского залива Баренцева моря
| № п/п | Таксон | Э | Г | ФГ | Район | Горизонт литорали |
|---|---|---|---|---|---|---|
| 1 | Ammatoidea murmanica Ju. E. Petrov | Б | М | АБнот | III; IV | в, н |
| 2 | Anathece smithii (Komárk.-Legn. & Cronberg) Komárek, Kastovsky & Jezberová | Пл | П | АБТнот | I; II; III | в, с, н |
| 3 | Aphanocapsa holsatica (Lemm.) Cronberg & Komárek | Пл | М, П | К | II | с, н |
| 4 | A. litoralis Hansg. | БП | М, С, П | К | I; II; III | сл, в, с, н |
| 5* | A. marina Hаansg. | Б | М, П | АБТнот | I | в, н |
| 6 | A. salina Woron. | Б | С | АБТ | I; II | в, с |
| 7* | Aphanothece biceps Skuja | БП | П | Б | II | н |
| 8* | A. elabens (Brèb. ex Menegh.) Elenkin | БП | П | К | I | в |
| 9 | A. marina (Erceg.) Komárek & Anagn. | Б | М | Б | I; II | в, н |
| 10 | Calothrix aeruginea Thur. ex Bornet & Flah. | Эп | М | БТнот | I; II; III | сл, в, с, н |
| 11 | C. confervicola C. Agardh ex Bornet & Flah. | Б, Эп | М | БТнот | I | в |
| 12 | C. fusca Bornet & Flah. | Эп, Н | М | К | I | в, с |
| 13 | C. parietina Thur. ex Bornet & Flah. | Б, Н | П | К | I; III | сл, в, с, н |
| 14 | C. parva Erceg. | Б, Н | М | Б | I; III | сл, в, с, н |
| 15 | C. scopulorum C. Agardh ex Bornet & Flah. | Б, Н | М | АБТнот | I; III; IV | сл, в, с, н |
| 16 | Chroococcidiopsis fissurarum (Erceg.) Komárek & Anagn. | Б, Н | М | БТнот | II | с |
| 17 | Chroococcopsis amethystea (Rosenv.) Geitler | Б, Эп | М | АБ | IV | н |
| 18 | C. fluviatilis (Lagerh.) Komárek & Anagn. | Б | П | Бнот | I; III; IV | в, с, н |
| 19 | Chroococcus cf. cohaerens (Brèb.) Nägeli | Б, Н | П | К | I; III | в, с, н |
| 20* | C. dispersus (Keissl.) Lemm. | Пл | П | К | IV | с |
| 21* | C. minimus (Keissl.) Lemm. | БП | П | АБТ | I | в |
| 22 | C. minutus (Kütz.) Nägeli | БП | П | К | I; II | сл, в, с, н |
| 23 | C. turgidus (Kütz.) Nägeli | БП, Н | М, П | К | I; IV | с |
| 24* | C. vacuolatus Skuja | БП | П | Б | III | н |
| 25 | Coleofasciculus chthonoplastes (Thur. ex Gom.) M. Siegesmund, Johansen & Friedl. | Б, Н | М | К | II; IV | сл, н |
| 26* | Cyanobium gaarderi (Ålvik) Komárek, Kopecký & Cepák | Пл | М | Б | II; III | в, с,н |
| 27* | C. waterburyi Komárek | Пл | М | БТнот | I | н |
| 28 | Cyanocystis olivacea (Reinsch) Komárek & Anagn. | Б, Эп | М | БТнот | I; II; III; IV | в, с, н |
| 29 | Cyanosarcina cf. chroococcoides (Geitler) Kovácik | Б, Н | П | БТнот | I | н |
| 30 | Cyanothece aeruginosa (Nägeli) Komárek | БП, Эп, Н | П | К | II | с, н |
| 31 | Dermocarpa acervata (Setch. & Gardner) Pham-Hoàng Hô | Б, Эп | М | БТнот | I; II | с |
| 32 | Eucapsis microscopica (Komárk.-Legn. & Cronberg) Komárek & Hindák | Пл | П | Бнот | I; III | в, с,н |
| 33 | Eucapsis cf. minor (Skuja) Elenkin | БП | П | АБТнот | III | с |
| 34* | Gloeocapsa cf. punctata Nägeli | Эп, Н | П | К | I | в |
| 35 | G. salina Hansg. | Б, Н | П | Б | I; III | в, н |
| 36 | Gloeocapsopsis crepidinum (Thur.) Geitler ex Komárek | Б, Н | П | К | I; III; IV | в, с,н |
| 37 | Gloeothece subtilis Skuja | Б | П | АБнот | III | н |
| 38 | Heteroleibleinia epiphytica Komárek | Эп | М, П | БТнот | I; II; III; IV | сл, в, с, н |
| 39* | Jaaginema gracile (Böcher) Anagn. & Komárek | БП | П | АБТ | III | н |
| 40* | J. pallidum (Böcher) Anagn. & Komárek | Б | П | Б | II | сл, в, с |
| 41 | Kamptonema laetevirens (H. Crouan & P. Crouan ex Gom.) Strunecký, Komárek & J. Smarda | Б | П | БТнот | II; III; IV | сл, в, с, н |
| 42 | Komvophoron breve (N. Carter) Anagn. | Б | С | Б | I; III | сл, в, с, н |
| 43 | Leibleinia epiphytica (Hieron.) Compère | Эп | П | БТнот | I; II; III | сл, в, с, н |
| 44 | L. subtilis (Holden) Anagn. & Komárek | Б, Эп | М | Тнот | I; III | сл, н |
| 45 | Leptolyngbya ectocarpi (Gom.) Anagn. & Komárek | Б, Эп | М | БТ | III | н |
| 46 | L. foveolarum (Gom.) Anagn. & Komárek | Б, Н | П | БТ | I | н |
| 47 | L. fragilis (Gom.) Anagn. & Komárek | Б, Н | М | БТнот | I; II; III; IV | сл, в, с, н |
| 48 | L. frigida (Fritsch) Anagn. & Komárek | БП, Н | П | АБнот | I; II; III | в, с, н |
| 49 | L. gracilis (Lindstedt) Anagn. & Komárek | Б | М | БТ | I; II | сл, в, с |
| 50 | L. minuta (Lindstedt) Anagn. & Komárek | Б | М | Б | II | сл, в, с |
| 51 | L. mycoidea (Frémy) Anagn. | БП, Эп | М | Б | I; III | с, н |
| 52 | L. norvegica (Gom.) Anagn. & Komárek | Б | М, П | Б | I; III | в, н |
| 53 | L. saxicola (Gardner) Anagn. | Б | М | БТ | II; IV | с, н |
| 54 | Lyngbya lutea Gom. ex Gom. | БП | М, С, П | К | I; II | в, с |
| 55 | L. meneghiniana Gom. | Б, Эп | М, П | БТнот | I; II; IV | в, с, н |
| 56 | Merismopedia cf. tenuissima Lemm. | БП | М, П | К | II | н |
| 57* | M. warmingiana (Lagerh.) Forti | Пл, Н | М, С, П | Бнот | II; III | н |
| 58 | Microcystis firma (Kütz.) Schmidle | Пл | П | БТнот | I; II; III | в, с, н |
| 59 | M. natans Lemm. ex Skuja | Пл | П | Бнот | I; II; III | с, н |
| 60 | Myxosarcina gloeocapsoides (Setch. & Gardner) Komárek & Anagn. | Б | М | Бнот | I; II | в, н |
| 61 | Nostoc cf. minutissimum Kütz. ex Bornet & Flah. | Б, Н | М | АБнот | I | в, с, н |
| 62* | Phormidesmis molle (Gom.) Turicchia, Ventura, Komárk. & Komárek | Б, Н | П | К | III | н |
| 63 | Phormidium ambiguum Gom. | Б, Н | П | К | I; II | сл, с, н |
| 64 | P. holdenii (Forti) Branco, Sant’Anna, Azevedo & Sormus | Б, Эп | П | БТнот | I; II | в, с, н |
| 65 | P. papyraceum Gom. ex Gom. | Б, Н | П | К | II | с |
| 66* | P. retzii Kütz. ex Gom. | Б, Н | П | К | II | в |
| 67 | P. thwaitesii I. Umez. & M. Watan. | Б | М | БТ | II; III | сл, в, н |
| 68 | Planktothrix cf. agardhii (Gom.) Anagn. & Komárek | БП | П | БТнот | II | сл |
| 69 | Pleurocapsa fuliginosa Hauck | Б, Н | М | БТнот | I; III; IV | в, с, н |
| 70 | Pseudanabaena catenata Lauterborn | БП | П | К | I; II | сл, в, с, н |
| 71* | P. galeata Böcher | Б | П | АБнот | III | н |
| 72* | P. minima (G. S.An) Anagn. | Б, Н | П | АБ | II | н |
| 73 | P. mucicola (Naumann & Huber-Pestalozzi) Schwabe | Эп | П | БТнот | I | в, н |
| 74 | P. persicina (Reinke ex Gom.) Anagn. | Б, Эп | М, П | БТ | II | н |
| 75 | P. tenuis Koppe | Б | П | Бнот | I | в |
| 76 | P. westiana Anagn. | Б, Эп | П | Б | IV | н |
| 77 | Pseudocapsa maritima Komárek | Б, Н | М | Тнот | I; II | сл, с, н |
| 78 | P. sphaerica (Pr.-Lavr.) Kováčík | Б | П | БТ | I; II; IV | в, с, н |
| 79 | Pseudophormidium battersii (Gom.) Anagn. | Б, Н | М | К | I; II; IV | сл, в, с, н |
| 80 | P. golenkinianum (Gom.) Anagn. | Б | М | К | I; II | в, с, н |
| 81 | Radaisia gomontiana Sauv. | Б, Эп | М | Б | I; III | в, н |
| 82* | Rhabdogloea elenkinii (Roll) Komárek & Anagn. | Пл | П | Б | III | н |
| 83* | Rivularia nitida C. Ag. ex Bornet & Flah. | Б | М | БТ | I | в |
| 84 | Spirulina meneghiniana Zanard. ex Gom. | Б, Н | М, П | БТнот | II | с |
| 85 | S. subsalsa Oersted ex Gom. | Б, Н | М, С, П | БТнот | III | с |
| 86* | Stichosiphon cf. subarcticus S. V. Smirnova & Beljakova | Б | М | Б | I; II; III; IV | в, с, н |
| 87* | Synechococcus nidulans (Pringsh.) Komárek | БП | П | БТнот | I; II; III | в, н |
| 88* | S. salinarum Komárek | Б, Н | М | Б | I; III | н |
| 89 | Synechocystis pevalekii Erceg. | Эп, Н | С, П | БТнот | I; II; III | в, с, н |
| 90 | S. salina Wisl. | Пл | С | БТнот | I; II; III; IV | сл, в, с, н |
| 91 | Xenococcus pyriformis Setch. & Gardner | Б, Эп | М | БТнот | I; II | в, с |
| 92* | X. schousboei Thur. | Б, Эп | М | БТнот | I | с |
| 93 | Xenotholos kerneri (Hansg.) M.Gold-Morgan, G.Montejano & J.Komárek | Б, Эп | С, П | БТнот | I; II | с, н |
| 94 | X. starmachii (Geitler) M.Gold-Morgan, G.Montejano & Komárek | Б, Эп | П | Б | I; II; III; IV | в, с, н |
| 95 | Yonedaella lithophila (Erceg.) Umez. | Б | М | Бнот | I; II; III | в, с, н |
* Вид ранее не был указан для Баренцева моря. Примечание. Э – экологическая группа: Б – бентосный вид, Эп – эпифитный, Пл – планктонный, БП – бенто-планктонный, Н – наземный. Г – галобность: П – пресноводный; С – солоноватоводный; М – морской; М, С, П – эвригалинный. ФГ – фитогеографическая принадлежность: Б – бореальный, Бнот – бореально-нотальный, АБ – аркто-бореальный, АБнот – аркто-бореально-нотальный, БТ – бореально-тропический, БТнот – бореально-тропическо-нотальный, АБТ – аркто-бореально-тропический, АБТнот – аркто-бореально-тропическо-нотальный, Тнот – тропическо-нотальный, К – космополитный. Район обнаружения: I – западный берег южного колена, II – восточный берег южного колена, III – западный берег среднего колена, IV – восточный берег среднего колена. Горизонт литорали: сл – супралитораль; в – верхний, с – средний, н – нижний.
Наибольшим числом видов были представлены роды Leptolyngbya (9 видов), Pseudanabaena (7), Chroococcus (6), Calothrix (6), Phormidium (5) и Aphanocapsa (4 вида). На их долю приходилось 39% от всех зарегистрированных видов. Цианобактерии 23 родов были представлены одним видом.
Среди цианобактерий литорали преобладали бентосные виды, которые составляли от 56 (район IV) до 63% (район I) видового состава. На долю планктонных видов приходилось от 12 (районы I и II) до 20% (район IV), бенто-планктонных – от 12 (район IV) до 19% (район II).
Цианобактерии были представлены 10 фитогеографическими группами. Основную часть составляли бореально-тропически-нотальные (26%), космополитные (23%) и бореальные (18%) виды. На остальные семь групп цианобактерий (аркто-бореальные, аркто-бореально-нотальные, аркто-бореально-тропические, аркто-бореально-тропически-нотальные, бореально-нотальные, бореально-тропические, тропически-нотальные) приходилось лишь 33% от общего числа видов; каждая из этих групп включала 2–5 видов. Арктических видов цианобактерий не выявлено. Доля трех доминирующих групп цианобактерий в разных районах залива была следующей: бореальные виды – от 12 (районы II и IV) до 24% (район III); бореально-тропическо-нотальные – от 27 (район III) до 35% (район IV), космополиты – от 14 (район III) до 26% (район II). Повсеместно преобладали пресноводные (44%) и морские (37%) виды цианобактерий. Эвригалинных и солоноватоводных видов было значительно меньше (16 и 3% соответственно). В районах I и IV доминировали морские формы, в районах II и III – пресноводные.
На природных субстратах обнаружено 92 вида цианобактерий, из них 46 видов встречались и на объектах антропогенного происхождения. На камнях, скалах, бетонных блоках, моллюсках, деревянных, металлических и стеклянных предметах обнаружено 11 видов. В приливно-отливной зоне количество видов увеличивалось от супралиторали к нижнему горизонту литорали с 23 до 71 (табл. 1), при этом возрастала доля планктонных и бенто-планктонных форм. Увеличивалась и доля эвригалинных видов с 9 до 18%.
Коэффициент сходства видового состава цианобактерий верхнего, среднего и нижнего горизонтов литорали был невысоким и составлял от 0.30 до 0.37. Сходство населения литорали и супралиторали было еще ниже – от 0.20 до 0.24. Наибольшие величины КS определены для видового состава цианобактерий районов I и II (KS = 0.57), а также районов I и III (KS = 0.57), наименьшие (KS = 0.33) – для акваторий городов Мурманск (район II) и Североморск (район IV).
В сезонной динамике числа видов цианобактерий литорали залива зарегистрированы зимний минимум в январе (11 видов), ранневесенний пик в марте (49 видов) и осенний максимум в октябре (59 видов). В течение года сохранялась тенденция к доминированию бентосных видов (от 65% в августе до 82% в январе), а также наблюдалось почти равное соотношение морских (от 30% в августе до 55% в январе) и пресноводных форм (от 32% в феврале до 50% в августе). Немногочисленными были планктонные, бентопланктонные, солоноватоводные и эвригалинные виды. В целом 25 видов зарегистрированы при средней температуре воды в заливе выше 10°С, а 18 видов – только в более холодный период. В течение всего года отмечено 26 видов, из них 13 являлись морскими бентосными видами. Во все сезоны года в числе доминант присутствовали представители рода Calothrix, достигшие максимального развития в мае, и рода Leptolyngbya, преобладавшие с августа по октябрь. В октябре в группу доминант входили также представители родов Chroococcus и Pseudanabaena. В марте лидировали виды рода Aphanocapsa, в сентябре – рода Phormidium.
В составе цианобактерий отмечено 27 индикаторных видов. Большинство из них относились к олиго- и олиго-бетамезосапробионтам (7 и 6 видов соответственно), обитающим в чистых и умеренно загрязненных водах.
ОБСУЖДЕНИЕ
По сравнению с сообществами цианобактерий российских морей Арктической зоны, насчитывающими 47 видов (Белякова, 2006), цианобактериальные ценозы литорали Кольского залива Баренцева моря более разнообразны (95 видов). По разнообразию они сопоставимы с сообществами цианобактерий на участке Мурманского побережья Баренцева моря от губы Ярнышная до губы Большие Чевры (88 видов) (Белякова, 2005). В приполярном Белом море в разных районах найдено от 49 (Уланова, 2003) до 97 (Белякова, 1996) видов бентосных цианобактерий. Их разнообразие в Кольском заливе сравнимо с таковым в Казантипском природном заповеднике (83 вида) (Бондаренко и др., 2018) в Азовском море и на южном берегу Крыма в Черном море (99 видов) (Виноградова, 2017).
Таксономическая структура сообщества цианобактерий Кольского залива включала 6 порядков, из них Synechococcales являлся доминирующим (39%). Субдоминантами были представители порядков Chroococcales (20%), Oscillatoriales (18%) и Pleurocapsales (13%). На уровне семейств наибольшим разнообразием обладали Leptolyngbyaceae (12%), Chroococcaceae, Merismopediaceae и Pseudanabaenaceae (по 11%), которые суммарно составляли 43% всего сообщества. Семейство Chroococcaceae в группе доминант присутствовало только в районах I и IV. Семейство Pseudanabaenaceae в каждом из изученных районов занимало промежуточное положение по количеству видов, однако в сообществе залива в целом вошло в доминирующий компонент.
Наиболее часто в заливе встречались типичные для эпилитона полярных экосистем виды родов Aphanocapsa, Calothrix, Chroococcus, Leptolyngbya и Phormidium, которые обладают слизистыми оболочками, способствующими защите клеток от меняющихся климатических условий, и формируют биопленки и маты в морском прибрежье (Komárek, Anagnostidis, 1998, 2005; Ecology of cyanobacteria …, 2012; Komárek, 2013; Cyanobacteria …, 2019). Лишенные слизистых чехлов цианобактерии рода Pseudanabaena также занимали высокое положение в сообществе Кольского залива. Предположительно, они обладают метаболической устойчивостью к низким температурам и являются психротрофами, что было показано для штаммов полярных Pseudanabaena при молекулярно-генетических исследованиях (Chrismas et al., 2015) и культивировании при разной температуре (4, 15 и 25°С) (Khan et al., 2017). В каждом из изученных районов отмечено от трех до шести видов цианобактерий рода Leptolyngbya. В районах I и III у западного берега залива в большом количестве встречались гетероцистные азотфиксирующие цианобактерии рода Calothrix. Наибольшая представленность родов видами выявлена в сообществе цианобактерий южного колена залива (район I). В среднем колене (район IV) данный показатель был ниже. Количество родов в семействах цианобактерий на западном берегу залива (районы I и III) было выше, чем на более урбанизированном восточном берегу (районы II и IV).
Доля видов цианобактерий с наибольшей встречаемостью в сообществах различалась в зависимости от района исследования. Так, для эпифитных Heteroleibleinia epiphytica и Leibleinia epiphytica она варьировала от 22% в районе III до 50% в районе IV. В этих районах хорошо развито сообщество фукоидов. Дефицит соединений азота на каменистой литорали западного берега залива, выявленный в результате гидрохимических исследований (Мирошниченко, 2016), может восполняться благодаря азотфиксирующей активности гетероцистных видов Rivularia nitida и Nostoc cf. minutissimum, а также шести видов рода Calothrix, среди которых ведущим был C. scopulorum с максимальной встречаемостью в районе I (Р = 18%). Данный вид широко распространен в прибрежье морей и океанов (Komárek, 2013) и еще в конце XIX в. был указан для экосистемы Баренцева моря в районе о-ва Новая Земля и о-ва Вайгач (Elfving, 1895). Встречаемость в Кольском заливе еще одного широко распространенного вида Gloeocapsopsis crepidinum, найденного ранее также на юго-восточном берегу Баренцева моря (Белякова, 2005) и в прибрежье Белого моря (Белякова, 1996; Уланова, 2003), варьировала от 9% в опресненном районе I до 29% в более мористом районе IV.
Цианобактерии на литорали Кольского залива распределены неравномерно. Почти половина состава (48% видов) приурочена к субстратам с выраженной рельефностью поверхности (впадины, трещины и т.д.). Очевидно, здесь существуют специфические условия, защищающие микроорганизмы от воздействия факторов внешней среды. Различия в составе сообществ и снижение видового разнообразия по направлению от нижнего горизонта литорали к супралиторали позволяют предположить, что в последнем случае условия обитания для цианобактерий менее благоприятные. Это подтверждено и литературными данными, показывающими горизонтальное зонирование микробных матов и снижение в них обилия и разнообразия цианобактерий от нижней литорали к верхней (Hoffmann, 1999; Rothrock et al., 2005; Al-Thukair et al., 2007).
Наибольшее сходство видового состава цианобактерий обнаружено в акваториях со сходными условиями среды: в районах южного колена залива, характеризующихся сильно опресненной и загрязненной водой, и у западного берега залива с каменистыми берегами и ярко выраженным поясом фукоидов. Наименьшее значение коэффициента сходства отмечено для акваторий городов Мурманск и Североморск. Вероятно, это связано со специфичностью народнохозяйственной деятельности морских портовых городов, промышленные и бытовые стоки которых могут стимулировать или угнетать развитие разных представителей Cyanobacteria.
Присутствие в бентосном сообществе цианобактерий в большом количестве планктонных и бенто-планктонных видов, а также нахождение пресноводных и морских видов почти в равных долях, по-видимому, закономерно, так как Кольский залив является эстуарной экосистемой, где взаимодействие баренцевоморских водных масс и пресных вод из крупных рек приводит к перестройкам в структуре биоценоза. Ранее при исследовании фитопланктона (Макаревич, 2004; Олейник, 2011) и фитобентоса (Витченко, 2005) Кольского залива был отмечен морской характер альгоценозов со стабильным вкладом пресноводного компонента в их структуру. Это обусловлено проникновением в залив представителей с атлантическими водами и континентальным стоком.
На примере Баренцева, Карского и Азовского морей было показано, что в эстуариях солоноватоводные микроводоросли не достигают большого развития (Макаревич, 2004). Подобное явление было отмечено нами и для цианобактерий. Известная отрицательная корреляция между соленостью воды и численностью цианобактерий эпилитона залива (Луценко, Москвина, 2014) позволяет предположить их пресноводный генезис.
Доминирование в Кольском заливе цианобактерий с бореально-тропически-нотальным, космополитным и бореальным распространением можно связать с поступлением в сообщество отдельных представителей с Северо-Атлантическим течением, несущим теплые воды. При исследовании Cyanoprokaryota из Баренцева, Белого и дальневосточных морей было показано, что цианобактерии являются аллохтонным компонентом в морях бореальной зоны, и для них также характерно доминирование космополитных и бореально-тропически-нотальных видов, а также отсутствие арктических и аркто-бореальных видов (Белякова, 2005).
Сезонная динамика количества видов цианобактерий в Кольском заливе с одним зимним минимумом и пиками ранней весной и осенью соответствует установленной ранее картине развития микрофитобентоса южного побережья Баренцева моря (Макаревич, 2012). Первый пик числа видов в марте можно объяснить повышением температуры воды и увеличением инсоляции и, как следствие, активизацией процессов фотосинтеза в сообществах (Макаревич, 2004). Большинство бентосных цианобактерий в высокоширотных водоемах являются психротрофными и способны выдерживать низкие температуры окружающей среды при оптимуме развития выше 15°С (Tang et al., 1997). Такой адаптационный механизм, обнаруженный у цианобактерий Арктики, обусловливает их успешное развитие в экстремальных условиях полярной климатической зоны при нестабильном и значительном повышении температуры в межсезонье. Осенний максимум числа видов цианобактерий, по-видимому, связан с обогащением вод биогенными элементами после конвективного перемешивания, что согласуется с ранее проведенными количественными исследованиями цианобактерий эпилитона (Луценко, Москвина, 2014) и микроводорослей Кольского залива (Макаревич, 2004; Витченко, 2005).
В соответствии с оценкой качества вод у западного берега залива по микробиологическим и гидрохимическим анализам, зимой воды южного колена характеризовались как умеренно-загрязненные, а летом как загрязненные; среднего колена – как чистые зимой и умеренно-загрязненные летом (Мирошниченко, 2016). По нашему мнению, сапробиологическая оценка вод Кольского залива только по индикаторным видам цианобактерий не является достоверной, так как, во-первых, среди обнаруженных индикаторов 20 видов (74%) являются пресноводными и могут быть аллохтонным компонентом сообщества, привнесенным в залив из рек. Во-вторых, для большинства морских видов цианобактерий все еще не определена индикаторная значимость.
Список литературы
Баринова С.С., Белоус Е.П., Царенко П.М. Альгоиндикация водных объектов Украины: методы и перспективы. Хайфа; Киев: Изд-во университета Хайфы. 2019. 367 с.
Белякова Р.Н. Синезеленые водоросли Кандалакшского заповедника // Новости системат. низш. раст. 1996. Т. 31. С. 9–16.
Белякова Р.Н. Cyanophyta юго-восточной части Баренцева моря // Новости системат. низш. раст. 2002. Т. 36. С. 12–18.
Белякова Р.Н. Cyanoprokaryota Восточного Мурмана (Баренцево море) // Новости системат. низш. раст. 2005. Т. 38. С. 8–21.
Белякова Р.Н. Бентосные Cyanoprokaryota арктических морей России (исключая Белое море и западную часть Баренцева моря) // Новости системат. низш. раст. 2006. Т. 40. С. 19–29.
Бондаренко А.В., Рябушко Л.И., Садогурская С.А. Микроводоросли бентоса и планктона прибрежной акватории заповедника “Казантипский” (Азовское море, Крым) // Биота и среда заповед. территорий. 2018. № 4. С. 25–48.
Виноградова О.Н., Брянцева Ю.В. Таксономическая ревизия Cyanobacteria/Cyanoprokaryota черноморского побережья Украины // Альгология. 2017. Т. 27. № 4. С. 436–457.
Витченко Т.В. Структурно-продукционные характеристики микрофитобентоса литоральной зоны Восточного Мурмана: Автореф. дис. … канд. биол. наук. М.: ВНИРО. 2005. 25 с.
Еленкин А.А. Предварительный отчет о командировке на Мурманскую биологическую станцию летом 1906 г. // Тр. С.-Петербург. о-ва естествоиспыт. 1906. Т. 37. Вып. 1. С. 1–11.
Зернов С.А. Общая гидробиология. М.; Л.: Изд-во АН СССР. 1949. 587 с.
Зинова Е.С. Водоросли Мурмана. Ч. I. Введение. Зеленые и красные водоросли // Тр. Император. С.-Петербург. о-ва естествоиспыт. 1912. Т. 43. Вып. 2. 343 с.
Луценко Е.С., Москвина М.И. Годовая динамика численности и биомассы цианобактерий эпилитона литорали Кольского залива (Баренцево море) // Рыб. хоз-во. 2014. № 1. С. 53–58.
Луценко Е.С., Шалыгин С.С., Давыдов Д.А. Перифитонные цианобактерии литорали Кольского залива Баренцева моря // Вестн. Мурман. гос. тех. ун-та. 2013. Т. 16. № 3. С. 472–477.
Макаревич П.Р. Структура и функционирование планктонных альгоценозов эстуарных экосистем шельфовых морей: Дис. … докт. биол. наук. Мурманск: ММБИ КНЦ РАН. 2004. 345 с.
Макаревич П.Р. Первичная продукция Баренцева моря // Вестн. Мурман. гос. техн. ун-та. 2012. Т. 15. № 4. С. 786–793.
Мирошниченко Е.С. Бактериоценозы эпилитона литорали южного и среднего колен Кольского залива Баренцева моря: Дис. … канд. биол. наук. Мурманск. 2016. 176 с.
Мирошниченко Е.С., Москвина М.И. Экологическая характеристика цианобактериального перифитона литорали Кольского залива Баренцева моря // Вестн. Северного (Арктического) фед. ун-та. Серия: Естественные науки. 2016. № 3. С. 59–71.
Олейник А.А. Фитопланктон Кольского залива: Автореф. дис. … канд. биол. наук. Мурманск. 2011. 23 с.
Пуговкин Д.В., Ляймер А.В., Йенсен Дж.Б. Эпифитные бактериальные сообщества водорослей Fucus vesiculosus в разных по степени загрязнения нефтепродуктами акваториях Баренцева моря // Докл. РАН. 2016. Т. 471. № 3. С. 371–373.
Рябушко Л.И. Микрофитобентос Черного моря. Севастополь: ЭКОСИ-Гидрофизика. 2013. 416 с.
Уланова А.А. Водоросли водоемов с нестабильной соленостью побережий Белого и Баренцева морей: Дис. … канд. биол. наук. СПб. 2003. 250 с.
Al-Thukair A.A., Abed R.M.M., Mohamed L. Microbial community of cyanobacteria mats in the intertidal zone of oil-polluted coast of Saudi Arabia // Mar. Pollut. Bull. 2007. V. 54. № 2. P. 173–179. https://doi.org/10.1016/j.marpolbul.2006.08.043
Chrismas N.A.M., Anesio A.M., Sánchez-Baracaldo P. Multiple adaptations to polar and alpine environments within cyanobacteria: a phylogenomic and Bayesian approach // Front. Microbiol. 2015. V. 6. № 1070. P. 1–10. https://doi.org/10.3389/fmicb.2015.01070
Cyanobacteria: From Basic Science to Applications / Mishra A.K., Tiwari D.N., and Rai A.N., Eds., London: Academic, Elsevier, 2019. https://doi.org/10.1016/C2017-0-01395-2
Ecology of Cyanobacteria II: Their Diversity in Space and Time / Whitton B.A., Ed. Berlin Heidelberg: Springer Science + Business Media B.V. 2012. 760 p.
Elfving F. Anteckningar om Finlands Nostochaceae heterocysteae // Meddelanden af Societas pro Fauna et Flora Fennica. 1895. issue 21. P. 25–50.
Guiry M.D., Guiry G.M. AlgaeBase. World-Wide Electronic Publication, National University of Ireland, Galway. 2020. https://www.algaebase.org
Hoffmann L. Marine cyanobacteria in tropical regions: diversity and ecology // Eur. J. Phycol. 1999. V. 34. P. 371–379. https://doi.org/10.1080/09670269910001736432
Khan Z., Wan Omar W.M., Merican F.M.M.S. et al. Identification and phenotypic plasticity of Pseudanabaena catenata from the Svalbard archipelago // Pol. Polar. Res. 2017. V. 384. P. 445–458. https://doi.org/10.1515/popore-2017-0022
Kjellmann F.R. The algae of the Arctic Sea: A survey of the species, together with an exposition of the general characters and the development of the flora // Kongl. Svenska Vetenskaps-Academiens Handlingar. 1883. V. 20. № 5. 350 p.
Komárek J., Anagnostidis K. Cyanoprokaryota, 1 Teil: Chroococcales, in Süßwasserflora von Mitteleuropa. V. 19/1. Heidelberg, Berlin: Spektrum Akademischer Verlag. 1999.
Komárek J., Anagnostidis K. Cyanoprokaryota, 2. Teil: Oscillatoriales, in Süßwasserflora von Mitteleuropa. V. 19/2. München: Elsevier GmbH. 2005.
Komárek J. Cyanoprokaryota, 3. Teil: Heterocytous genera, in Süßwasserflora von Mitteleuropa. V. 19/3. Berlin Heidelberg: Springer-Verlag. 2013. https://doi.org/10.1007/978-3-8274-2737-3
Rothrock Jr., Michael J., Garcia-Pichel F. Microbial diversity of benthic mats along a tidal desiccation gradient // Environ. Microbiol. 2005. V. 7. № 4. P. 593–601. https://doi.org/10.1111/j.1462-2920.2005.00728.x
Tang E.P.Y., Tremblay R., Vincent W.F. Cyanobacterial dominance of polar freshwater ecosystems: are high-latitude mat-formers adapted to low temperature? // J. Phycol. 1997. V. 33. P. 171–181.
Дополнительные материалы отсутствуют.


