Биология моря, 2021, T. 47, № 5, стр. 339-349
Содержание хлорофилла а в донных отложениях мелководной лагуны Буссе (остров Сахалин)
Т. Г. Коренева 1, *, Л. Е. Сигарева 2, **, Е. М. Латковская 1
1 Сахалинский филиал ФГБНУ Всероссийский научно-исследовательский институт рыбного хозяйства
и океанографии (СахНИРО)
693023 Южно-Сахалинск, Россия
2 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 пос. Борок, Россия
* E-mail: t.koreneva@sakhniro.ru
** E-mail: sigareva@ibiw.ru
Поступила в редакцию 17.06.2020
После доработки 16.10.2020
Принята к публикации 01.04.2021
Аннотация
Представлены первые результаты определения содержания хлорофилла а и продуктов его разрушения в донных отложениях лагуны Буссе (о-в Сахалин) на прибрежных и центральных участках разного типа. Установлена связь между содержанием осадочных пигментов и физико-химическими свойствами донных отложений. Трофическое состояние разнотипных по осадочным пигментам участков бентали в лагуне изменяется от олиго- до эвтрофного. Для прибрежья среднее содержание хлорофилла а с феопигментами относится к олиготрофной категории, для центральной части – к мезотрофной. Концентрация хлорофилла с дериватами характеризуется снижением средних значений с 21.4 ± 5.6 мкг/г сухого осадка летом до 6.1 ± 1.9 мкг/г осенью и в целом для лагуны составляет 16.3 ± 4.4 мкг/г. Сезонная динамика осадочных пигментов не согласуется с таковой для фитопланктона и в значительной мере может определяться гидродинамической активностью. При сравнительно низком содержании осадочных пигментов для лагуны характерны регулярная гибель гидробионтов и илонакопление – признаки терминального этапа олиготрофно-эвтрофной сукцессии экосистемы.
Информация о растительных пигментах широко используется для оценки биомассы и выделения доминирующих отделов фитопланктона, а также для характеристики экологического состояния, продуктивности и трофического статуса как морских, так и пресноводных экосистем (Кобленц-Мишке, Ведерников, 1977; Bianchi et al., 2002; Szymczak-Żyła et al., 2011; Мордасова, 2014; Krajewska et al., 2017). Большинство гидробиологических работ, связанных с изучением растительных пигментов, выполнено на фитопланктоне, однако в настоящее время повышается интерес к пигментам в донных отложениях (ДО) как системным экологическим показателям (Szymczak-Żyła et al., 2017; Тимофеева и др., 2018; Сигарева и др., 2019; Buchaca et al., 2019). Результаты исследований осадочных пигментов часто используются при изучении эволюции водных экосистем. Однако терминальную стадию развития экосистем рассматривают, как правило, на примере небольших пресноводных озер, а морские водоемы фактически не изучены (Хендерсон-Селлерс, Маркленд, 1990; Naeher et al., 2016; Reavie et al., 2017).
Лагуна Буссе – памятник природы и особо охраняемая акватория регионального значения Сахалинской области; используется для рекреации, промысла уникальных видов гидробионтов и развития марикультуры (Бровко и др., 2002; Чернышова, Прохорова, 2018). Для лагуны характерны заиление и регулярная массовая гибель водных организмов (Калганова, 1993; Тепаева, Калганова, 2012). Эти события можно рассматривать как признаки последней стадии олиготрофно-эвтрофной сукцессии экосистемы. Уникальное сочетание характеристик мелководной лагуны с географическими (защищенность от волнового воздействия открытого моря, постоянная связь с основным водоемом и сушей) и климатическими (более мягкий климат, чем на острове) факторами продуктивности объясняет не только практический, но и теоретический интерес к этому водоему.
Цель настоящей работы – изучить трофическое состояние бентали лагуны Буссе по содержанию хлорофилла а и феопигментов в ДО, а также выявить причины варьирования трофии разнотипных участков этого мелководного морского водоема.
МАТЕРИАЛ И МЕТОДИКА
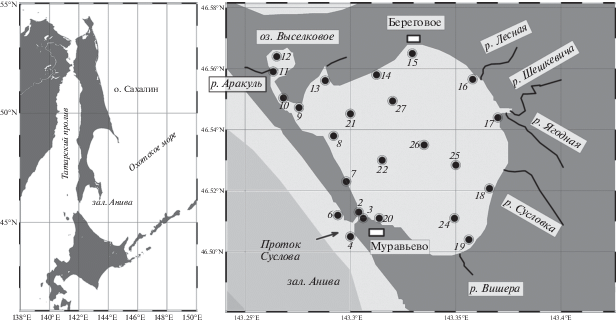
Лагуна Буссе – морской водоем, расположенный на западном побережье Тонино-Анивского полуострова о-ва Сахалин (46°35′ N, 143°18′ E; 46°30′ N, 143°23′ E) и сообщающийся с зал. Анива (Охотское море) через узкий прол. Суслова. Морфология береговой зоны и дна лагуны представлена абразионно-аккумулятивными равнинами с признаками ледового воздействия (Задкова и др., 1975). В лагуну впадают не менее десяти дренирующих заболоченные лесные почвы ручьев и рек, береговые обрывы и дно которых сформированы песчаником, алевролитами и аргиллитами (Тарасевич, 1970). Наибольшую площадь дна лагуны (43%) занимают пески с диаметром частиц от 1 до 0.1 мм; грубообломочные отложения (>1 мм), представленные галечником и гравием, составляют 26%, тонкозернистые осадки (алевриты и пелиты, <0.1 мм) – 31% (Ефанов и др., 2013). Для вод лагуны характерна высокая соленость (26–31‰) за счет интенсивного водообмена с морем (Бровко, 1990; Бровко и др., 2002).
Фитопланктон лагуны формируется морскими (50–63%), пресноводными (до 20%) и пресноводно-солоноватоводными (до 15%) видами. Наблюдается значительное сезонное изменение видового состава и количественных характеристик фитопланктона (Ефанов, Калганова, 2014; Ефанов, Тепаева, 2014). По биомассе фитопланктона лагуна относится к олиготрофным водоемам (Дмитриев и др., 1997).
Массовый продуцент среди макрофитов – красная морская водоросль анфельция тобучинская (Огородников, Сергеенко, 2001), известный источник агар-агара. Отмечено снижение общей площади полей и средней биомассы анфельции; в 1999–2012 гг. фитомасса водорослей сократилась с 31.8 до 26.3 тыс. тонн сырого сырья (Балконская, Чумаков, 2002; Евсеева, 2016). На зарослях анфельции в виде эпифитов часто встречаются бурые водоросли, преимущественно ламинариевые. Вдоль берега поля анфельции окаймлены морскими травами. В местах впадения рек доминируют рдесты и зостера. Большая часть побережья занята огромными скоплениями отмершей водной растительности (Фурсенко, Фурсенко, 1970).
Пробы воды и донных отложений отбирали в июле и ноябре 2013 г. Станции отбора проб располагались в следующих районах: I – проток Суслова, II – зал. Анива, III – западный прибрежный район, IV – оз. Выселковое, V – северный прибрежный район, VI – восточный прибрежный район, VII – южный прибрежный район и VIII – центральный район. Летом станции охватывали всю акваторию лагуны (22 станции), осенью – лишь прибрежные районы (16 станций) (рис. 1, табл. 1).
Таблица 1.
Расположение и некоторые характеристики станций в лагуне Буссе (2013 г.)
| Номер района | Район | Станция | Глубина, м | Тип донных отложений |
|---|---|---|---|---|
| I | Проток Суслова | 2 | 0.5 | Песок гравелистый |
| 3 | 0.5 | Песок крупный | ||
| II | Зал. Анива | 4 | 0.5 | Гравийный |
| 6 | 0.5 | Песок гравелистый | ||
| III | Западный прибрежный район | 7 | 0.5 | Песок гравелистый |
| 8 | 0.5 | Песок средней крупности | ||
| 9 | 0.5 | Песок мелкий | ||
| 10 | 0.5 | Песок средней крупности | ||
| IV | Оз. Выселковое | 11 | 0.5 | Песок гравелистый |
| 12 | 0.5 | Песок мелкий | ||
| V | Северный прибрежный район | 13 | 0.5 | Песок мелкий |
| 14 | 0.5 | Песчано-алевритовый ил | ||
| 15(1) | 0.5 | Песчано-алевритовый ил | ||
| 15(2) | 0.5 | Песок крупный | ||
| VI | Восточный прибрежный район | 16 | 0.5 | Песок гравелистый |
| 17 | 0.5 | Песок мелкий | ||
| VII | Южный прибрежный район | 18 | 0.5 | Песок пылеватый |
| 19 | 0.5 | Песок пылеватый | ||
| 20 | 0.5 | Песчано-алевритовый ил | ||
| VIII | Центральный район | 21 | 0.5 | Мелкоалевритовый ил |
| 22 | 5.7 | Мелкоалевритовый ил | ||
| 24 | 5.7 | Мелкоалевритовый ил | ||
| 25 | 3.7 | Мелкоалевритовый ил | ||
| 26 | 4.6 | Песчано-алевритовый ил | ||
| 27 | 5.3 | Песчано-алевритовый ил |
В придонном слое на каждой станции рН-метром-иономером МА130 фирмы “Mettler Toledo” измеряли температуру (Т) и водородный показатель (рН); соленость (S) измеряли с помощью портативной системы YSI-63 фирмы “YSI incorporated”. Процент насыщения воды кислородом рассчитывали после определения его концентрации методом Винклера (Объемная концентрация…, 2010).
Донные осадки отбирали из верхнего 5-сантиметрового слоя дночерпателем Ван-Вина (площадь захвата 0.025 м2). Воду сливали, пробы упаковывали в полиэтиленовые пакеты и хранили не более месяца при температуре −20°С. Перед анализом пробы размораживали. Экстракты готовили в соответствии с традиционной процедурой. Оптическую плотность ацетоновых экстрактов измеряли спектрофотометрическим методом (Коренева, Сигарева, 2019). Концентрации хлорофилла а (Хл) и феопигментов (Ф) рассчитывали по формулам Лоренцена (Lorenzen, 1967) в микрограммах на 1 г сухой массы образца (мкг/г сухого осадка) и миллиграммах на 1 г органического вещества (мг/г ОВ).
Влажность ДО определяли по разнице между массой навесок до и после высушивания при температуре 105°С. Содержание ОВ измеряли фотометрическим методом (ГОСТ 26213-91, 1991), предварительно промывая образцы дистиллированной водой для удаления хлоридов. Тип ДО устанавливали по размеру фракций: от 10 до 1 мм – галечник и гравий, от 1 до 0.1 мм – пески, от 0.1 до 0.005 мм – алевриты и пелиты (ГОСТ 25100-2011, 2013).
Трофический статус бентали оценивали по концентрации хлорофилла а в сумме с феопигментами (Хл + Ф, мкг/г сухого осадка) (Möller, Scharf, 1986). Для статистического анализа использовали прикладные программы Excel и Statistica. Наличие связи между пигментами, биотическими и абиотическими характеристиками воды и ДО определяли с помощью корреляционного анализа (r-Pearson). Многофакторный дисперсионный анализ корреляционной матрицы по методу главных компонент с варимакс- вращением применяли для выявления факторов, отвечающих за наличие связей между изученными показателями (Лакин, 1990; Мазуркин, Тойшева, 2010).
РЕЗУЛЬТАТЫ
Абиотические условия летом и осенью 2013 г. в лагуне Буссе существенно различались. Температура и соленость в июле были выше, чем в ноябре (табл. 2). Реакция среды (рН) изменялась в слабощелочной области, отражая способность растительных организмов к фотосинтезу. Процентное содержание растворенного кислорода в воде в июле также было выше и изменялось сильнее (Cv = 25%), чем в ноябре (Cv = 9%). Экстремально высокие значения показателя насыщения (174–199%) отмечены летом в северном прибрежье.
Таблица 2.
Абиотические условия в придонном слое воды лагуны Буссе в 2013 г.
| Показатель | Центральный район | Прибрежные районы | Сv, % | ||
|---|---|---|---|---|---|
| июль | июль | ноябрь | июль | ноябрь | |
| Температура, °С | $\frac{{19.2{\kern 1pt} --{\kern 1pt} 21.7}}{{20.4 \pm 0.4}}$ | $\frac{{16.2{\kern 1pt} --{\kern 1pt} 28.7}}{{22.3 \pm 0.9}}$ | $\frac{{5.1{\kern 1pt} --{\kern 1pt} 10.0}}{{7.9 \pm 0.4}}$ | 15 | 18 |
| Соленость, ‰ | $\frac{{30.6{\kern 1pt} --{\kern 1pt} 32.3}}{{31.6 \pm 0.3}}$ | $\frac{{0.6{\kern 1pt} --{\kern 1pt} 32.4}}{{25.6 \pm 2.6}}$ | $\frac{{0.0{\kern 1pt} --{\kern 1pt} 30.1}}{{20.3 \pm 3.9}}$ | 34 | 58 |
| рН, ед. | $\frac{{7.72{\kern 1pt} --{\kern 1pt} 7.87}}{{7.81 \pm 0.02}}$ | $\frac{{7.43{\kern 1pt} --{\kern 1pt} 8.51}}{{8.11 \pm 0.07}}$ | $\frac{{7.23{\kern 1pt} --{\kern 1pt} 8.49}}{{8.05 \pm 0.08}}$ | 3 | 4 |
| Растворенный кислород, мг/дм3 | $\frac{{6.74{\kern 1pt} --{\kern 1pt} 8.30}}{{7.49 \pm 0.21}}$ | $\frac{{7.68{\kern 1pt} --{\kern 1pt} 13.77}}{{9.94 \pm 0.50}}$ | $\frac{{8.86{\kern 1pt} --{\kern 1pt} 13.10}}{{10.67 \pm 0.28}}$ | 22 | 10 |
| Растворенный кислород, % насыщения | $\frac{{91.3{\kern 1pt} --{\kern 1pt} 110.1}}{{100.2 \pm 2.8}}$ | $\frac{{91.7{\kern 1pt} --{\kern 1pt} 198.8}}{{133.7 \pm 8.1}}$ | $\frac{{82.8{\kern 1pt} --{\kern 1pt} 118.7}}{{102.3 \pm 2.2}}$ | 25 | 9 |
Примечание. Здесь и в табл. 3: в числителе – диапазоны, в знаменателе – среднее значение с ошибкой среднего; Cv – коэффициент вариации.
Исследованные образцы ДО типичны для грунтового комплекса лагуны Буссе (табл. 1). Отложения в прибрежных районах были представлены преимущественно песками (рис. 2в): на станциях 13–17 – мелкими, а на станциях 7–10 и 18–20 – крупными и средними c включением гальки и гравия. В осадках повсеместно присутствовали илистые частицы, а также большое количество пустых раковин моллюсков. В центральном районе лагуны (станции 21–23, 25, 27 и 28) преобладали алеврито-пелитовые отложения в виде черных илов с резким запахом сероводорода.
Рис. 2.
Содержание осадочных пигментов (а), воды и ОВ (б) и размерных фракций (в) в донных отложениях лагуны Буссе на разных станциях (среднеарифметические значения по результатам трех параллельных измерений для каждого из параметров с абсолютными значениями погрешности при Р = 0.95). По оси абсцисс – номера станций; по оси ординат: а – концентрация Хл + Ф; б – влажность и содержание ОВ; в – содержание размерных фракций, % сухого осадка.
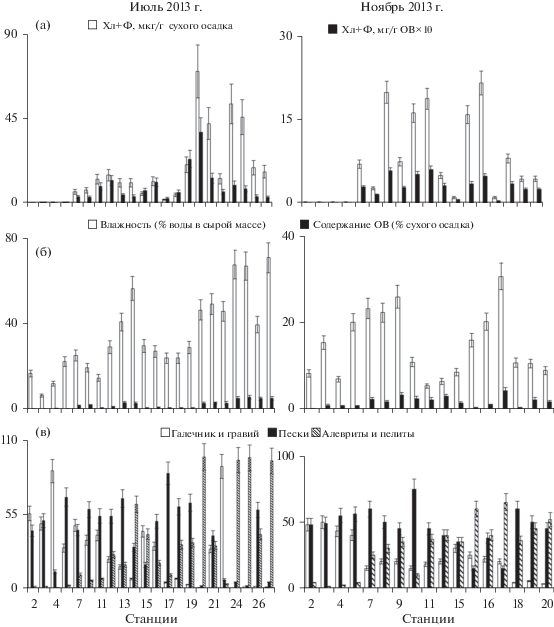
Растительные пигменты в ДО были распределены неравномерно. Концентрация Хл + Ф изменялась от 0.2–70.2 мкг/г сухого осадка (0.03–3.9 мг/г ОВ) летом до 0.2–21.6 мкг/г сухого осадка (0.01–0.59 мг/г ОВ) осенью (табл. 3). Содержание Ф варьировало от 0.2–66.1 мкг/г сухого осадка в июле до 0.2–21.3 мкг/г в ноябре. Максимальное содержание пигментов отмечено в июле в песчано-алевритовых илах (станция 20) вблизи протоки и устья безымянного ручья (рис. 2а). Минимальной концентрация пигментов была в ноябре в отложениях гравелистого песка мелководной станции 2 в протоке Суслова с активной гидродинамикой. Тесная связь между концентрациями Хл + Ф и Ф (r = 0.95–0.97, р < 0.05) отражает преимущественно фитопланктонное происхождение пигментов, а коэффициенты вариации их средних значений (Cv = 120–127%) позволяют говорить о сходном характере пространственного распределения. Средняя концентрация Хл + Ф в лагуне составляла 16.3 ± 4.4 мкг/г сухого осадка (0.59 ± 0.15 мг/г ОВ), а Ф – 13.4 ± 3.1 мкг/г. Основная доля (71–86%) от суммы Хл и Ф приходилась на продукты разрушения (табл. 3). В целом вклад феопигментов в афотических зонах морских и пресных водоемов, как правило, был выше, чем в эвфотических.
Таблица 3.
Содержание растительных пигментов и физико-химические характеристики донных отложений в лагуне Буссе в 2013 г.
| Показатель | Центральный район |
Прибрежные районы | Сv, % | ||
|---|---|---|---|---|---|
| июль | июль | ноябрь | июль | ноябрь | |
| Хл + Ф, мкг/г сухого осадка | $\frac{{13.1{\kern 1pt} --{\kern 1pt} 52.8}}{{31.7 \pm 7.0}}$ | $\frac{{0.2{\kern 1pt} --{\kern 1pt} 70.2}}{{11.0 \pm 4.2}}$ | $\frac{{0.2{\kern 1pt} --{\kern 1pt} 21.6}}{{6.1 \pm 1.9}}$ | 116 | 124 |
| Хл + Ф, мг/г ОВ | $\frac{{0.32{\kern 1pt} --{\kern 1pt} 1.46}}{{0.74 \pm 0.1}}$ | $\frac{{0.03{\kern 1pt} --{\kern 1pt} 3.9}}{{0.79 \pm 0.25}}$ | $\frac{{0.01{\kern 1pt} --{\kern 1pt} 0.59}}{{0.23 \pm 0.05}}$ | 112 | 127 |
| Ф, мкг/г сухого осадка | $\frac{{8.8{\kern 1pt} --{\kern 1pt} 50.1}}{{27.2 \pm 6.7}}$ | $\frac{{0.2{\kern 1pt} --{\kern 1pt} 66.1}}{{7.8 \pm 3.9}}$ | $\frac{{0.2{\kern 1pt} --{\kern 1pt} 21.3}}{{5.1 \pm 1.7}}$ | 129 | 125 |
| Ф, % от суммы Хл + Ф | $\frac{{67.5{\kern 1pt} --{\kern 1pt} 94.9}}{{85.8 \pm 4.1}}$ | $\frac{{42.2{\kern 1pt} --{\kern 1pt} 94.1}}{{71.2 \pm 4.3}}$ | $\frac{{54.9{\kern 1pt} --{\kern 1pt} 100.0}}{{84.4 \pm 4.0}}$ | 22 | 19 |
| Влажность, % | $\frac{{20.3{\kern 1pt} --{\kern 1pt} 70.5}}{{52.2 \pm 8.1}}$ | $\frac{{6.6{\kern 1pt} --{\kern 1pt} 56.2}}{{26.4 \pm 3.6}}$ | $\frac{{6.5{\kern 1pt} --{\kern 1pt} 30.6}}{{15.3 \pm 1.9}}$ | 59 | 49 |
| Содержание ОВ, % | $\frac{{2.1{\kern 1pt} --{\kern 1pt} 5.8}}{{4.5 \pm 0.6}}$ | $\frac{{0.4{\kern 1pt} --{\kern 1pt} 3.7}}{{1.3 \pm 0.2}}$ | $\frac{{0.2{\kern 1pt} --{\kern 1pt} 4.4}}{{1.7 \pm 0.3}}$ | 84 | 70 |
Пространственная изменчивость пигментов согласовывалась с динамикой содержания ОВ в ДО, а также, в меньшей степени, с влажностью и типом осадков (рис. 2). В алеврито-пелитовых ДО центральной части лагуны все рассмотренные показатели (за исключением Хл + Ф в ОВ) были в 2–3 раза выше, чем в грубообломочных и песчаных осадках прибрежных районов (рис. 3, табл. 3). Так, максимальные концентрации Хл + Ф (в среднем 31.8 ± 7.3 мкг/г) и Ф (25.2 ± 5.9 мкг/г) в южном прибрежье и в центре лагуны летом были приурочены к илам с высокими значениями влажности (45.8 ± 6.4%) и содержания ОВ (3.4 ± 0.7%) (рис. 3). Осенью повышенные средние концентрации Хл (13.8 ± 3.4 мкг/г) и Ф (11.6 ± 2.7 мкг/г) в оз. Выселковое (район IV) и в восточном прибрежье (VI) лагуны также были характерны для илистых осадков при влажности 19.1 ± 3.7% и содержании ОВ 2.8 ± 0.5%. Минимальные концентрации Хл + Ф (0.22 ± 0.04 мкг/г) и Ф (0.20 ± 0.04 мкг/г) отмечены в крупнозернистых донных отложениях протока Суслова (район I), а также в прибрежной зоне зал. Анива (район II) с пониженными значениями влажности (13.5 ± 3.2%) и содержания ОВ (0.6 ± 0.09%).
Рис. 3.
Содержание осадочных пигментов и физико-химические характеристики донных отложений в лагуне Буссе по районам (среднеарифметические значения со стандартной ошибкой среднего, где n – количество станций в районе, как в табл. 1). По оси абсцисс – номера районов; по оси ординат: а – концентрация Хл + Ф; б – влажность и содержание органического вещества; в – содержание размерных фракций, % сухого осадка.
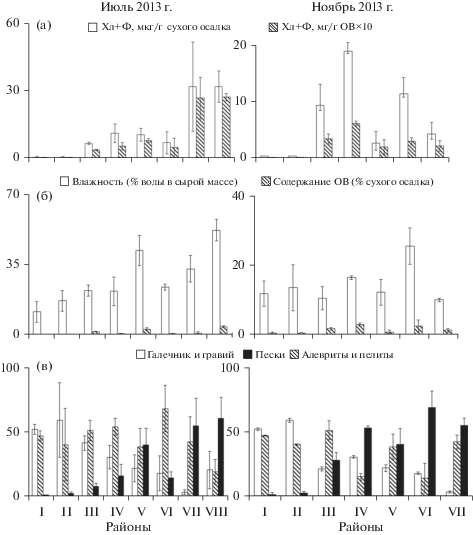
В целом высокие пигментные показатели были характерны для осадков оз. Выселковое, северного и южного прибрежья и центральной части лагуны (рис. 3а), т.е. для районов с незначительным варьированием всех абиотических показателей. Пониженные концентрации растительных пигментов отмечены в мелководных районах с активной гидродинамикой, препятствующей накоплению и сохранению ОВ, – в западном и восточном прибрежье, а также в протоке Суслова и зал. Анива.
Характер корреляционной связи между содержанием пигментов и гранулометрическим составом ДО зависит от размера слагающих их частиц и отражает уменьшение концентрации пигментов в гравийно-галечниковых и песчаных осадках, а также ее увеличение в пелитах и алевритах (табл. 4). Влияние таких абиотических факторов, как температура, рН и концентрация растворенного кислорода, на содержание растительных пигментов в осадках не выявлено. Достаточно значимой (r соответственно −0.47 и −0.55, p < 0.05) в ноябре была связь концентрации Хл + Ф и Ф с соленостью, что, вероятно, свидетельствует о сохранении пигментов в районах с несущественным влиянием морских вод.
Таблица 4.
Коэффициенты корреляции (r-Pearson) между концентрациями осадочных пигментов, а также биотическими и абиотическими показателями воды и донных отложений в лагуне Буссе в 2013 г.
| Показатель | Хл + Ф, мкг/г сухого осадка | Ф, мкг/г сухого осадка | |||
|---|---|---|---|---|---|
| июль | ноябрь | июль | ноябрь | ||
| Глубина, м | +0.35 | – | +0.44 | – | |
| Соленость, ‰ | +0.19 | −0.55 | +0.27 | −0.47 | |
| Влажность, % | +0.74 | +0.38 | +0.77 | +0.32 | |
| Содержание ОВ, % | +0.67 | +0.95 | +0.64 | +0.92 | |
| Хл + Ф, мг/г ОВ | +0.56 | +0.97 | +0.84 | +0.84 | |
| Диаметр частиц, %: | 10–1 мм | −0.43 | −0.25 | −0.44 | −0.24 |
| 1–0.1 мм | −0.46 | −0.11 | −0.46 | −0.12 | |
| 0.1–0.005 мм | +0.76 | +0.57 | +0.57 | +0.64 | |
Статистический анализ показал, что изменчивость изученных параметров в лагуне Буссе определяли несколько факторов: биотический (содержание Хл + Ф и Ф), гидролого-гидрохимический (Т, рН, растворенный кислород), геоморфологический (влажность и гранулометрический состав ДО) и соленость. В июле наиболее значимым (40% от суммарной дисперсии) был биотический фактор, действие которого на пигментные характеристики максимально проявлялось на участках с зарослями макрофитов, в том числе анфельции (станции 19–21 и 24–25). Меньше влияли геоморфологический (19%), гидролого-гидрохимический факторы (16%), а также соленость (10%) (табл. 5). В ноябре изменчивость пигментных и типологических показателей ДО на участках с макрофитами (станции 9, 12 и 17) также определял биотический фактор (45%). Гидролого-гидрохимические факторы, в том числе соленость, как и летом, влияли на формирование осадочного комплекса пигментов в меньшей степени (16–20%).
Таблица 5.
Факторные нагрузки для изученных параметров воды и донных отложений лагуны Буссе в 2013 г.
| Показатель | Июль | Ноябрь | ||||||
|---|---|---|---|---|---|---|---|---|
| факторы | ||||||||
| биотический | гидроло- гидрохимический | геоморфологический | соленость | биотический | гидроло- гидрохимический | соленость | ||
| Температура, °С | −0.13 | −0.70 | 0.48 | −0.10 | 0.12 | 0.77 | 0.10 | |
| pH, ед. | −0.02 | −0.90 | −0.22 | 0.16 | −0.24 | 0.59 | 0.44 | |
| Соленость, ‰ | 0.22 | −0.27 | −0.18 | 0.77 | −0.53 | 0.08 | 0.74 | |
| Растворенный кислород, % насыщения | −0.09 | −0.94 | 0.07 | −0.04 | −0.19 | 0.96 | 0.03 | |
| Влажность, % | 0.50 | 0.04 | 0.71 | 0.39 | 0.44 | 0.25 | 0.68 | |
| Содержание ОВ, % | 0.36 | 0.28 | 0.59 | 0.58 | 0.98 | 0.03 | 0.04 | |
| Хл + Ф, мкг/г сухого осадка | 0.95 | 0.10 | 0.23 | 0.11 | 0.98 | −0.16 | −0.22 | |
| Хл + Ф, мг/г ОВ | 0.87 | −0.15 | −0.02 | −0.41 | 0.95 | −0.06 | −0.26 | |
| Ф, мкг/г сухого осадка | 0.93 | 0.11 | 0.26 | 0.20 | 0.96 | -0.21 | 0.00 | |
| Диаметр частиц, %: | 10–1 мм | −0.31 | 0.06 | −0.69 | 0.09 | −0.35 | 0.02 | 0.19 |
| 1–0.1 мм | −0.35 | −0.02 | −0.65 | 0.06 | −0.33 | −0.02 | 0.13 | |
| 0.1–0.005 мм | 0.41 | −0.05 | 0.87 | −0.13 | 0.45 | −0.08 | −0.19 | |
| Вклад фактора в суммарную дисперсию, % | 40 | 16 | 19 | 10 | 45 | 20 | 16 | |
ОБСУЖДЕНИЕ
Распределение и накопление растительных пигментов в ДО водоемов зависит от продукционных и деструкционных процессов, интенсивности первичной продукции ОВ, деградации пигментов в водной толще, от соотношения автохтонного и аллохтонного ОВ, скорости осадконакопления и других параметров гидродинамической активности (Leavitt, 1993; Сигарева, 2012). Корреляционный анализ показал, что концентрации Хл и Ф в лагуне Буссе достоверно связаны с характеристиками ДО (табл. 4), что согласуется с данными, полученными ранее для зал. Анива (Коренева, Сигарева, 2019). Тесная линейная зависимость между пигментами и концентрациями ОВ (r = 0.64–0.95) подтверждает индикаторную значимость осадочных пигментов как продукционных показателей лагуны, поскольку регулируется совокупностью условий, главные из которых – физиологическое состояние планктона и бентоса, а также доступность ОВ в качестве субстрата (Агатова, 2017). Влияние солености на изменчивость продукционных характеристик в лагуне Буссе, выявленное в результате статистического анализа (табл. 3, 4), свидетельствует о том, что содержание пигментов в ДО зависит не только от их концентрации в планктоне, но и от условий седиментации взвеси. Продукционные показатели планктонных водорослей в осенний период могут быть выше, чем летом и весной (Коновалова, 2016), однако гидрологические условия прибрежья, характеризующиеся усилением приливно-отливных течений и ветрового перемешивания водных масс в осенний период (Ефанов и др., 2014), привели к резкому снижению концентрации пигментов на исследованных участках в ноябре.
С гидрологическими условиями формирования ДО и их продукционных свойств в лагуне Буссе связана также неоднородность пространственного распределения осадочных пигментов. Высокие пигментные показатели характерны для осадков из районов с незначительным варьированием всех абиотических показателей, что свидетельствует о низкой активности водных масс в этих частях лагуны (Задкова и др., 1975; Ефанов и др., 2014). В гидродинамически активном мелководном прибрежье содержание пигментов минимально.
Сравнение данных факторного анализа позволяет говорить о превалирующем влиянии биотического фактора на изменчивость продукционных характеристик в лагуне Буссе во все периоды, тогда как в зал. Анива – морском водоеме, связанном с лагуной, летом наиболее значимым был биотический фактор, а осенью – гидрологический (Коренева, Сигарева, 2019).
Особенности распределения пигментов в бентали лагуны Буссе обусловливают различия оценок трофического статуса по содержанию пигментов в ДО. В июле по среднему уровню концентрации Хл + Ф в ДО (21.4 ± 5.6 мкг/г сухого осадка или 0.77 ± 0.21 мг/г ОВ) лагуна Буссе в целом попадает в разряд мезотрофных водоемов, при этом прибрежные районы – олиготрофные, а центральный район – мезотрофный (Möller, Scharf, 1986). Эвтрофное состояние характерно для участка, расположенного в зоне влияния морских и пресных поверхностных вод (станция 20), с концентрацией Хл + Ф, равной 70.2 мкг/г сухого осадка (3.79 мг/г ОВ). Осенью, как и летом, содержание Хл + Ф в ДО (6.1 ± 1.9 мкг/г сухого осадка или 0.23 ± 0.05 мг/г ОВ) характеризует прибрежные районы в лагуне Буссе как олиготрофные участки.
В мелководной лагуне Буссе концентрация Хл + Ф (0.2–70.2 мкг/г, среднее 16.3 ± 4.4 мкг/г сухого осадка) в ДО выше, чем содержание осадочных пигментов в более глубоких морских водоемах – в зал. Анива Охотского моря (1.9–19.5 мкг/г, среднее 6.5 ± 0.7 мкг/г сухого осадка) (Коренева, Сигарева, 2019) и в Амурском заливе Японского моря (3.0–10.0 мкг/г) (Марьяш и др., 2010). Однако концентрация Хл + Ф в ДО лагуны существенно меньше, чем в мелководном пресноводном оз. Неро (Ярославская область), в котором средняя концентрация осадочных пигментов (Хл + Ф) достигает 300 мкг/г сухого осадка (Сигарева и др., 2019). При сравнении содержания осадочных пигментов в лагуне, расположенной в области умеренно-муссонного климата, в водоемах муссонной области Вьетнама и европейской части России обнаружены аналогичные закономерности распределения и характер связей с типологическими свойствами осадков, несмотря на то, что основные факторы продуктивности (температурный и световой режимы) заметно различались (Сигарева, 2012; Тимофеева и др., 2018). Известно, что показатели продуктивности фитопланктона в лагуне ниже, чем в ближайшем более крупном морском водоеме зал. Анива (Кантаков и др., 2007), и существенно ниже, чем в пресноводном оз. Неро (Бабаназарова и др., 2018). Однако и в морских, и в пресных водоемах с разным уровнем трофии сохраняется универсальная связь содержания осадочных пигментов с физико-химическими характеристиками ДО (Коренева, Сигарева, 2019; Сигарева и др., 2019). Следовательно, концентрации пигментов в ДО разнотипных по трофии водоемах (морской и пресноводный) обусловлены прежде всего взаимодействием гидрологических факторов с продуктивностью фитопланктона. Несмотря на разный уровень трофии, в обоих озеровидных водоемах отмечены признаки терминального этапа эволюции экосистемы – регулярная гибель гидробионтов и илонакопление (Тепаева, Калганова, 2012; Бабаназарова и др., 2018). Очевидно, признаки “умирания” экосистем могут проявляться при разном уровне продуктивности фитопланктона и разном содержании пигментов в ДО. Возраст превращения водных экосистем (гипертрофного пресноводного озера и мезотрофной морской лагуны), например, в болота (или другие природные объекты) будет зависеть от всего комплекса биотических и абиотических условий.
ЗАКЛЮЧЕНИЕ
Полученные результаты дополняют сведения о содержании и закономерностях распределения осадочных пигментов в морских водоемах, расположенных в районе умеренно-муссонного климата. Концентрации растительных пигментов в мелководной лагуне Буссе изменяются в зависимости от типа ДО и их физико-химических характеристик, отражая влияние растительных организмов на формирование структуры осадочного комплекса. Содержание пигментов минимально в гидродинамически активном мелководном прибрежье и максимально в статической глубоководной зоне центральной части лагуны. Неоднородное пространственное распределение осадочных пигментов связано с различиями условий формирования ДО и продуцирования ОВ. Трофическое состояние лагуны Буссе, оцененное по средним концентрациям пигментов в ДО, изменяется от олиготрофного (в прибрежных районах) до мезотрофного (в центральной части).
Список литературы
Агатова А.И. Органическое вещество в морях России. М.: Изд-во ВНИРО. 2017. 260 с.
Бабаназарова О.В., Сиделев С.И., Жданова С.М. и др. Уровень воды в мелководном высокоэвтрофном озере – фактор развития по макрофитовому или фитопланктонному типу (оз. Неро, Ярославская область) // Вод. ресурсы. 2018. Т. 45. № 6. С. 645–655.
Балконская Л.А., Чумаков А.А. Современное состояние полей Ahnfeltia tobuchiensis (Kannoet Matsub.) Makijenko и запасы ее фитомассы в лагуне Буссе (остров Сахалин) // Растит. ресурсы. 2002. Т. 38. № 1. С. 34–43.
Бровко П.Ф. Развитие прибрежных лагун. Владивосток: Изд-во ДВГУ. 1990. 148 с.
Бровко П.Ф., Микишин Ю.А., Рыбаков В.Ф. и др. Лагуны Сахалина. Владивосток: ДВГУ. 2002. 80 с.
ГОСТ 26213-91. Почвы. Методы определения органического вещества. М.: Изд-во стандартов. 1991. 7 с.
ГОСТ 25100-2011. Грунты. Классификация. М.: Стандартинформ. 2013. 46 с.
Дмитриев В.В., Мякишева Н.В., Третьяков В.Ю., Хованов Н.В. Многокритериальная оценка экологического состояния и устойчивости геосистем на основе метода сводных показателей. II. Трофический статус водных экосистем // Вестн. СПбГУ. 1997. Сер. 7. Вып. 1. № 7. С. 51–67.
Евсеева Н.В. Современное состояние ресурсов анфельции тобучинской Сахалино-Курильского региона и перспективы их рационального использования // Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование: Материалы VII Всерос. научно-практ. конф. с междунар. участием (Петропавловск-Камчатский, 22−24 марта 2016 г.). 2016. С. 85–88.
Ефанов В.Н., Выпряжкин Е.Н., Латковская Е.М. Современное состояние донных отложений лагуны Буссе (залив Анива) // Наука и бизнес: пути развития. 2013. № 11(41). С. 31–37.
Ефанов В.Н., Выпряжкин Е.Н., Латковская Е.М. Гидрохимическая характеристика и видовой состав организмов спата лагуны Буссе (залив Анива) в июне 2012 года // Инновации и инвестиции. 2014. № 12. С. 159–163.
Ефанов В.Н., Калганова Т.Н. О микро- и нанопланктоне лагуны Буссе (залив Анива) // Глобальный науч. потенциал. 2014. № 11(44). С. 27–30.
Ефанов В.Н., Тепаева А.Е. Сезонное развитие и количественные показатели фитопланктона лагуны Буссе // Перспективы науки. 2014. № 11(62). С. 22–30.
Задкова И.И., Малюшко Л.Д., Сарочан В.Ф. Геохимия лагуны Буссе на Сахалине. Новосибирск: Наука. 1975. 90 с.
Калганова Т.Н. Питание приморского гребешка и использование им кормовой базы в лагуне Буссе (о. Сахалин). // Влияние антропогенных факторов на структуру и функционирование экосистем и их отдельные компоненты: Межвуз. сб. науч. тр. М.: МПУ. 1993. С. 71–75.
Кантаков Г.А., Стоник И.В., Селина М.С., Орлова Т.Ю. Адвекция, вертикальная устойчивость вод и особенности пространственно-временного распределения фитопланктона в заливе Анива Охотского моря в 2001–2003 гг. // Тр. СахНИРО. 2007. Т. 9. С. 295–324.
Кобленц-Мишке О.И., Ведерников В.И. Первичная продукция // Океанология. Биология океана. Т. 2. Биологическая продуктивность океана. М.: Наука. 1977. С. 183–209.
Коновалова Н.В. Современное состояние фитопланктона лагуны Буссе (о. Сахалин) // Озерные экосистемы: биологические процессы, антропогенная трансформация, качество воды: Материалы V Международ. науч. конф. (Минск–Нарочь, 12–17 сентября 2016 г.). Минск: БГУ. 2016. С. 150.
Коренева Т.Г., Сигарева Л.Е. Распределение хлорофилла а в донных отложениях залива Анива (Охотское море) // Биол. моря. 2019. Т. 45. № 5. С. 299–308.
Лакин Г.Ф. Биометрия. М.: Высшая школа. 1990. 352 с.
Мазуркин П.М., Тойшева Н.П. Факторный анализ химических веществ почвы // Охрана и защита, обустройство, индикация и тестирование природной среды: Сб. статей. М.: Академия естествознания. 2010. С. 153–157.
Марьяш А.А., Ходоренко Н.Д., Звалинский В.И., Тищенко П.Я. Хлорофилл, гуминовые вещества и органический углерод в эстуарии реки Раздольная в период ледостава // Вестн. ДВО РАН. 2010. № 6. С. 44–51.
Мордасова Н.В. Косвенная оценка продуктивности вод по содержанию хлорофилла // Тр. ВНИРО. 2014. Т. 152. С. 41–56.
Объемная концентрация растворенного кислорода в морских водах. Методика измерений йодометрическим методом: РД 52.10.736-2010. М.: ФГУ ГОИН. 2010. 27 с.
Огородников В.С., Сергеенко В.А. История промысла и состояние запасов анфельции лагуны Буссе // Рыб. хоз-во. 2001. № 1. С. 34–35.
Сигарева Л.Е. Хлорофилл в донных отложениях волжских водохранилищ. М.: Товарищество науч. изд. КМК. 2012. 217 с.
Сигарева Л.Е., Тимофеева Н.А., Законнов В.В. и др. Признаки естественного эвтрофирования мелководного оз. Неро по осадочным пигментам // Биол. внутр. вод. 2019. № 4–2. С. 27–35.
Тарасевич Ю.Н. Третичная система: Геология СССР. Т. 33. М.: Недра. 1970. С. 168–173.
Тепаева А.Е., Калганова Т.Н. Развитие фитопланктона в лагуне Буссе летом 2011 года // Международ. журн. прикл. и фундамент. исслед. 2012. № 1. С. 104–106.
Тимофеева Н.А., Сигарева Л.Е., Гусаков В.А., Законнов В.В. Содержание растительных пигментов в донных отложениях водоемов Вьетнама // Биол. внутренних вод. 2018. № 3. С. 45–53.
Фурсенко А.В., Фурсенко К.Б. О фораминиферах лагуны Буссе и условиях их существования // Общие вопросы изучения микрофауны Сибири, Дальнего Востока и других районов // Тр. Ин-та геол. и геофиз. СО АН СССР. М.: Наука. 1970. Вып. 71. С. 114–135.
Хендерсон-Селлерс Б., Маркленд Х. Умирающие озера. Причины и контроль антропогенного эвтрофирования. Л.: Гидрометеоиздат. 1990. 279 с.
Чернышова Ю.С., Прохорова Н.Ю. Перспективы использования лагуны Буссе как природного источника для получения спата приморского гребешка Mizuhopecten yessoensis // Изв. ТИНРО. 2018. Т. 195. С. 219–228.
Bianchi T.S., Rolff C., Widbom B., Elmgren R. Phytoplankton pigments in Baltic Sea seston and sediments: seasonal variability, fluxes, and transformations // Estuarine, Coastal Shelf Sci. 2002. V. 55. № 3. P. 369–383.
Buchaca T., Kosten S., Lacerot G. et al. Pigments in surface sediments of South American shallow lakes as an integrative proxy for primary producers and their drivers // Freshwater Biol. 2019. V. 64. P. 1437–1452.
Krajewska M., Szymczak-Żyła M., Kowalewska G. Algal pigments in Hornsund (Svalbard) sediments as biomarkers of Arctic productivity and environmental conditions // Pol. Polar Res. 2017. V. 38. № 4. P. 423–443.
Leavitt P.R. A review of factors that regulate carotenoid and chlorophyll deposition and fossil pigment abundance // J. Paleolimnol. 1993. V. 9. Iss. 2. P. 109–127.
Lorenzen C.J. Determination of chlorophyll and pheo-pigments: Spectrophotometric equations // Limnol. Oceanogr. 1967. V. 12. № 2. P. 343–346.
Möller W.A.A., Scharf B.W. The content of chlorophyll in the sediment of the volcanic maar lakes in the Eifel region (Germany) as an indicator for eutrophication // Hydrobiologia. 1986. V. 143. P. 327–329.
Naeher S., Suga H., Ogawa N.O. et al. Compound-specific carbon and nitrogen isotopic compositions of chlorophyll a and its derivatives reveal the eutrophication history of Lake Zurich (Switzerland) // Chem. Geol. 2016. V. 443. P. 210–219.
Reavie E.D., Edlund M.B., Andresen N.A. et al. Paleolimnology of the Lake of the Woods southern basin: continued water quality degradation despite lower nutrient influx // Lake Reservoir Manage. 2017. V. 33. Iss. 4. P. 369–385.
Szymczak-Żyła M., Kowalewska G., Louda J.W. Chlorophyll-a and derivatives in recent sediments as indicators of productivity and depositional conditions // Mar. Chem. 2011. V. 125. P. 39–48.
Szymczak-Żyła M., Krajewska G., Winogradow A. et al. Tracking trends in eutrophication based on pigments in recent coastal sediments // Oceanologia. 2017. V. 59. Iss. 1. P. 1–17.
Дополнительные материалы отсутствуют.