Биология моря, 2021, T. 47, № 5, стр. 291-303
Личинки Rhizocephala с кентрогонидным типом развития и их роль в таксономии и филогении паразитических ракообразных
О. М. Корн 1, *, Д. Д. Голубинская 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: olgamkorn@mail.ru
Поступила в редакцию 23.11.2020
После доработки 27.01.2021
Принята к публикации 05.03.2021
Аннотация
Обзор посвящен пелагическим личинкам корнеголовых ракообразных с кентрогонидным типом развития (Thecostraca: Cirripedia: Rhizocephala), претерпевших в связи с паразитическим образом жизни столь значительную редукцию взрослых стадий, что лишь наличие в их личиночном развитии науплиусов указывает на принадлежность этой уникальной группы к ракообразным. Основное внимание уделено морфологическим признакам личинок, которые могут использоваться в таксономии и филогении Rhizocephala. Показаны различия между личинками пельтогастридного и саккулинидного типов развития. Проанализирован половой диморфизм циприсов, связанный с разными функциями мужских и женских личинок.
Корнеголовые ракообразные (Thecostraca: Cirripedia: Rhizocephala) являются паразитами других ракообразных, главным образом декапод, реже перакарид, стоматопод и усоногих раков. Это уникальный надотряд паразитических усоногих раков, которые претерпели значительную редукцию взрослых стадий и потеряли практически все признаки членистоногих, в том числе сегментацию, конечности и внутренние органы, кроме гонад. Лишь наличие в развитии корнеголовых науплиуса – типичной личинки ракообразных, указывает на их принадлежность к данной группе.
Биология и жизненные циклы Rhizocephala хорошо изучены и подробно описаны в ряде обзоров (Høeg, Lützen, 1985, 1995, 1996; Høeg, 1992, 1995; Walker, 2001). Взрослый организм самки корнеголового ракообразного представлен внутренней интерной – корневой системой в теле хозяина, обеспечивающей паразита трофическими ресурсами, и наружной экстерной – его репродуктивным телом. В мантийной полости экстерны располагается висцеральный мешок, в котором находятся развивающийся яичник и рецептакулы с криптическими карликовыми самцами, редуцированными до сперматогенной ткани. Таким образом, у корнеголовых ракообразных наблюдается криптогонохоризм – экстремальная форма полового диморфизма, когда карликовые самцы претерпевают редукцию всех тканей, кроме сперматогенной.
Зрелые ооциты выходят в мантийную полость экстерны, где происходят оплодотворение и развитие эмбрионов до стадии науплиуса (рис. 1). У большинства ризоцефал личинки на этой стадии появляются в планктоне и после нескольких науплиальных линек превращаются в циприсовидную личинку, которая служит для поиска нового хозяина или ювенильной экстерны. У настоящих пресноводных, полуназемных и глубоководных видов, а также у всех видов с акентрогонидным типом развития науплиальные стадии выпадают, и во внешнюю среду выходит циприсовидная личинка (Andersen et al., 1990; Høeg, Lützen, 1995).
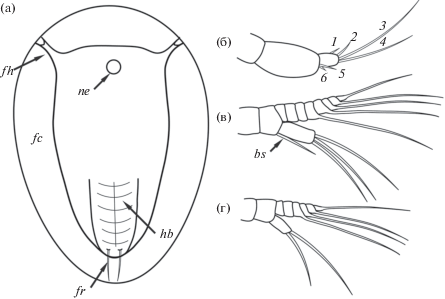
Рис. 1.
Строение науплиуса Rhizocephala: общий вид (а), антеннула (б), антенна (в) и мандибула (г). Обозначения: bs –щетинка на базисе антенны; fc – плавательный воротничок; fh – фронтолатеральные рожки; fr – фурка; hb – задняя часть тела; ne – науплиальный глаз; 1–6 – щетинки на антеннуле.
Личинки корнеголовых ракообразных разнополые. У видов с кентрогонидным типом развития женские циприсы оседают на нового хозяина и после линьки превращаются в высокоспециализированную стадию – кентрогон, который с помощью кутикулярного стилета инъецирует через покровы следующую стадию – вермигон. Червеобразный вермигон формирует интерну в полости тела хозяина. Интерна растет, через некоторое время появляется экстерна, которая прорывает покровы и выходит наружу. Мужские личинки оседают на мантийное отверстие ювенильной экстерны, метаморфизируют в стадию трихогона, сходного с вермигоном, который проникает в рецептакулы и имплантирует в них сперматогенную ткань (Høeg, 1985, 1987; Glenner, Høeg, 1994, 1995; Glenner et al., 2000). При акентрогонидном типе развития стадии кентрогона, вермигона и трихогона отсутствуют, а проникновение женских личинок в организм хозяина и мужских личинок в ювенильную экстерну происходит с помощью антеннул циприсовидной личинки (Høeg, 1990).
За сезон размножения экстерна продуцирует множество генераций личинок. Кроме того, паразит способен к бесполому размножению с образованием колоний, в результате чего на теле хозяина появляются множественные экстерны. Возможно также повторное заражение новыми личинками. Чередование полового и бесполого размножения приводит к появлению огромного количества личинок в планктоне и, следовательно, к заражению значительной части популяции хозяина (Isaeva et al., 2001, 2004).
Количество структурных признаков экстерны − видимой части корнеголового ракообразного, ограничено, поэтому исследование личинок представляется необходимым при изучении таксономии и филогении этой уникальной группы паразитов. До подключения молекулярной систематики родство между группами класса Thecostraca подтверждалось исключительно морфологией личинок (Høeg, 1992; Høeg, Møller, 2006; Høeg et al., 2004a, 2009). Присутствие в цикле развития всех подклассов Thecostraca циприсовидной личинки подтверждает монофилию этого класса. Наличие фронтолатеральных рожек у науплиусов всех трех надотрядов Cirripedia подтверждает монофилию этого подкласса (Høeg et al., 2014a).
Хорошо развитых планктотрофных личинок свободноживущих усоногих ракообразных многие годы изучали с применением только световой микроскопии (Moyse, 1987; Korn, 1995), в то же время редуцированных лецитотрофных личинок корнеголовых ракообразных практически с самого начала исследовали с применением сканирующего электронного микроскопа, чтобы максимально увеличить количество таксономических признаков. В настоящее время группа Rhizocephala включает 250–300 известных видов (Høeg et al., 2014b, 2020), однако полное личиночное развитие исследовано не более чем у 10 из них (Hawkes et al., 1985; Walker, 1988; Collis, Walker, 1994; Walossek et al., 1996; Rybakov et al., 2002; Chan et al., 2005; Ponomarenko et al., 2005; Tu et al., 2009; Trédez et al., 2016; Korn et al., 2020a, 2020b). У ряда видов изучены или проиллюстрированы отдельные личиночные стадии или отдельные структуры личинок (Walker, 1985, 1999; Glenner et al., 1989; Jensen et al., 1994; Moyse et al., 1995; Rybakov et al., 2003; Høeg et al., 2004b; Høeg, Rybakov, 2007; Yoshida et al., 2011, 2013, 2015; Рыбаков, Хёг, 2013; Kobayashi et al., 2018).
Таксономия Rhizocephala
Класс Thecostraca объединяет три подкласса ракообразных: Cirripedia, Ascothoracida и Facetotecta (Martin et al., 2014), которые в ходе приспособления к условиям существования – паразитизму, сидячему или сверлящему образу жизни – приобрели уникальные морфологические адаптации и необычные жизненные циклы (Høeg et al., 2014a).
Надотряд корнеголовых ракообразных (Cirripedia: Rhizocephala) традиционно разделяли на два отряда: Kentrogonida, имеющие в своём развитии стадию кентрогона, и Akentrogonida, утратившие эту стадию жизненного цикла (Høeg, Lützen, 1985, 1995; Høeg, 1995; Martin, Davis, 2001; Martin et al., 2014). Однако последние данные молекулярной систематики показали, что эти таксоны являются парафилетическими (Høeg et al., 2020). В настоящее время Kentrogonida и Akentrogonida можно рассматривать лишь как жизненные формы или типы развития корнеголовых ракообразных.
Генетические исследования позволили внести и другие существенные изменения в систематику Rhizocephala (Glenner, Hebsgaard, 2006; Glenner et al., 2010, 2021; Lützen et al., 2016; Høeg et al., 2019). Наиболее важным является слияние семейства Peltogastridae и парафилетического семейства Lernaeodiscidae с сохранением монофилетического рода Lernaeodiscus (Høeg et al., 2020). Корнеголовые ракообразные семейства Lernaeodiscidae паразитируют в основном на крабах, а пельтогастриды на раках-отшельниках, поэтому морфология взрослых паразитов из этих семейств существенно различается. Однако науплиусы и циприсы имеют много общих черт, что позволяет рассматривать их как личинки пельтогастридного типа и подтверждает корректность объединения семейств Peltogastridae и Lernaeodiscidae на основании молекулярных данных. Род Peltogasterella был выведен из семейства Peltogastridae в отдельное семейство Peltogasterellidae, объединяющее пельтогастрид с колониальной экстерной, что, по-видимому, является их апоморфным признаком (Høeg et al., 2020). Тем не менее, личинки этих двух семейств имеют много общих признаков, поэтому науплиусы и циприсы Peltogasterellidae также могут быть отнесены к личинкам пельтогастридного типа.
Саккулины из парафилетического семейства Sacculinidae на основании молекулярного анализа были разделены между двумя семействами – Sacculinidae и Polyascidae (Høeg et al., 2020). Три вида рода Sacculina остались в семействе Sacculinidae вместе с родами Heterosaccus, Loxothylacus, Ptychascus и Sesarmaxenos. В семейство Polyascidae включены монофилетический род Polyascus и пять других видов из рода Sacculina, образовавших род Parasacculina. По умолчанию в семействе Sacculinidae остались 164 вида, для которых генетические данные пока отсутствуют. Взрослые особи и личинки саккулин и парасаккулин сходны по строению. Морфологические подтверждения новой системы ещё предстоит проанализировать. Личинки семейств Sacculinidae и Polyascidae в отличие от науплиусов и циприсов семейств Peltogastridae и Peltogasterellidae могут рассматриваться как личинки саккулинидного типа.
Количество науплиальных стадий и длительность личиночного развития
Первоначально у корнеголовых ракообразных с кентрогонидным типом развития были описаны лишь 4 науплиальные стадии, одна из которых (третья либо четвертая), вероятно, была пропущена (Hawkes et al., 1985; Walker, 1988; Collis, Walker, 1994; Walker, Clare, 1994; Walker, Lester, 1998). Это можно объяснить тем, что личинок из культуры фиксировали один раз в сутки (что правомерно для науплиусов Thoracica), в то время как линька науплиусов Rhizocephala происходит чаще – при оптимальных условиях через 5–16 ч. Впервые 5 науплиальных стадий были зарегистрированы у Briarosaccus tenellus (Walossek et al., 1996). Позже точное количество стадий у ряда видов определили подсчетом личиночных экзувиев при каждой линьке. В результате 5 науплиальных стадий было обнаружено у родов Peltogasterella (Корн и др., 1999; Rybakov et al., 2002), Peltogaster (Кашенко, Корн, 2003), Sacculina (Корн, Рыбаков, 2001), Polyascus (Корн и др., 2000) и Heterosaccus (Ponomarenko et al., 2005). Тщательный мониторинг культуры с фиксацией личинок каждые четыре часа показал, что пелагический период хорошо изученного вида Sacculina carcini также включает 5 науплиальных стадий (Trédez et al., 2016), а не 4, как предполагали ранее (Walker, 1988; Collis, Walker, 1994). Однако у Parasacculina sinensis (Chan et al., 2005) и Polyascus planus (Tu et al., 2009) обнаружены только 4 науплиальные стадии, несмотря на то, что личинок последнего вида фиксировали каждые шесть часов.
Длительность развития в планктоне у личинок разных видов различается и, вероятно, определяется температурой. У тепловодных видов циприсовидная личинка появляется на третьи–четвертые сутки (Корн и др., 1999, 2000; Корн, Рыбаков, 2001; Кашенко, Корн, 2002, 2003; Kashenko, Korn, 2002; Kashenko et al., 2002; Rybakov et al., 2002; Chan et al., 2005; Ponomarenko et al., 2005; Tu et al., 2009; Trédez et al., 2016; Korn et al., 2020a, 2020b). У холодноводных видов, таких как Briarosaccus callosus (Hawkes et al., 1985) и B. tenellus (Walossek et al., 1996), развитие занимает около месяца. У видов, личинки которых длительное время находятся в планктоне и мало изучены, не исключено наличие большего числа науплиальных стадий. Например, первая стадия B. tenellus (Walossek et al., 1996) морфологически соответствует второй стадии, так что у этого вида, вероятно, 6 науплиальных стадий (Rybakov et al., 2002). Недавно было обнаружено, что науплиусы холодноводной фасетотекты Hansenocaris itoi в Белом море имеют 7 науплиальных стадий (Kolbasov et al., 2021), в то время как для тепловодного вида H. furcifera описаны только 5 науплиальных стадий (Itô, 1990). Возможно, что количество науплиальных стадий у Rhizocephala варьирует от 4 до 6 при базовом значении 5 (Høeg et al., 2014b).
Лецитотрофия личинок
И науплиусы, и циприсовидные личинки Rhizocephala не питаются. Благодаря лецитотрофии у науплиусов корнеголовых ракообразных произошла редукция структур, связанных с питанием (Walker, 1988). Лабрум по сравнению с довольно крупной верхней губой базовых планктотрофных личинок Cirripedia представляет собой маленький отросток. Перистые щетинки на конечностях, которые у планктотрофных науплиусов образуют фильтрующий аппарат для ловли фитопланктона, у личинок Rhizocephala редуцированы. Полностью отсутствуют гнатобазы. Плавательные щетинки также менее развиты, поскольку личинки Rhizocephala по сравнению с науплиусами свободноживущих циррипедий проводят в планктоне короткое время и не переносятся на большие расстояния.
Плавательный воротничок (рис. 2)
Рис. 2.
Внешний вид (а–г) и структура (д–ж) плавательного воротничка науплиусов Peltogaster (а, д), Lernaeodiscus (б, е), Parthenopea (в, ж) (по: Рыбаков, Хёг, 2013, рис. 3г) и Sacculina (г). Обозначения: cfl – каудальный отросток плавательного воротничка; ne – науплиальный глаз.
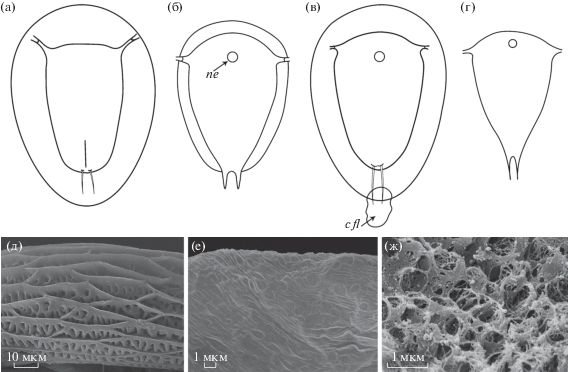
У науплиусов некоторых видов Rhizocephala формируется уникальная структура – плавательный воротничок, позволяющий личинке парить в толще воды (Høeg et al., 2004b). В других группах ракообразных подобная структура не обнаружена (Høeg et al., 2014b). Плавательный воротничок имеется у науплиусов родов Peltogaster, Briarosaccus, Septosaccus, Ommatogaster, Lernaeodiscus, Peltogasterella, Cyphosaccus и Parthenopea. У представителей первых двух родов воротничок большой, хорошо заметный, его кутикула имеет отчетливую сетчатую структуру (рис. 2а, 2д) (Hawkes et al., 1985; Høeg, Lützen, 1985; Walossek et al., 1996; Korn et al., 2020b). У остальных родов, кроме Parthenopea, плавательный воротничок тонкий, малозаметный, легко теряется, а в световом микроскопе выглядит гладким и прозрачным. На фотографиях, полученных с помощью сканирующего электронного микроскопа, виден сетчатый орнамент (рис. 2б, 2е), наличие которого в значительной степени может быть обусловлено процессом высушивания (Rybakov et al., 2002; Høeg et al., 2004b; Yoshida et al., 2011; Korn et al., 2020a). У науплиусов единственного в семействе Parthenopeidae рода Parthenopea плавательный воротничок третьего типа (рис. 2в, ж). Он имеет пористую структуру и каудальный отросток, не обнаруженный ни у одного из исследованных видов Rhizocephala (рис. 2в) (Рыбаков, Хёг, 2013). У личинок Sacculina, Parasacculina, Heterosaccus и Polyascus плавательный воротничок отсутствует (рис. 2г).
Как правило, плавательный воротничок появляется на второй стадии, но узкий прозрачный ободок вокруг тела науплиуса первой стадии свидетельствует о том, что формирование воротничка начинается раньше (Yoshida et al., 2011; Korn et al., 2020b). Плавательный воротничок фиксируется на прикрепительном гребне; если воротничок отрывается, вдоль гребня заметны поры. Поры найдены на разных участках прикрепительного гребня у науплиусов B. tenellus, Peltogaster paguri и P. reticulata (Walossek et al., 1996; Høeg et al., 2004b; Korn et al., 2020b), у личинок Peltogasterella поры не обнаружены (Rybakov et al., 2002).
Плавательный воротничок, вероятно, представляет собой плезиоморфный признак (Høeg et al., 2004b). Его наличие улучшает гидродинамические свойства науплиуса и способствует большему распространению личинок. Ранее наличие плавательного воротничка считалось синапоморфией семейств Peltogastridae и Lernaeodiscidae, образующих монофилетическую кладу (Høeg et al., 2004b). В настоящее время наличие воротничка подтверждает объединение этих двух семейств, однако не является их синапоморфией, поскольку воротничок имеется и у видов новых семейств Peltogasterellidae и Parthenopeidae (Rybakov et al., 2002; Рыбаков, Хёг, 2013).
Глаза (рис. 2)
Пигментированный медиальный глаз, обеспечивающий положительный фототаксис, присутствует у науплиусов и циприсов большинства описанных видов Rhizocephala. Интересно, что личинки родов Peltogaster и Briarosaccus с наиболее развитым плавательным воротничком не имеют науплиального глаза и фототаксис у них отсутствует (рис. 2а) (Hawkes et al., 1985; Høeg, Lützen, 1985; Walossek et al., 1996; Korn et al., 2020b). У видов с тонким воротничком, т.е. при частичной редукции этой структуры, науплиальный глаз появляется, и личинки положительно реагируют на свет (рис. 2б).
Сложные глаза, которые характерны для циприсовидных личинок свободноживущих усоногих раков и появляются у них уже на последней науплиальной стадии, среди корнеголовых обнаружены только у Parthenopea subterranea. Наличие сложных глаз рассматривается как плезиоморфный признак (Рыбаков, Хёг, 2013). Уникальные признаки личинок P. subterranea, особенно необычный плавательный воротничок у науплиусов и сложные глаза у циприсов, подтверждают выделение рода Parthenopea в отдельное семейство Parthenopeidae (Рыбаков, Хёг, 2013; Høeg et al., 2020).
Дорсальные щетинки карапакса (рис. 3)
Рис. 3.
Карапакс науплиуса пельтогастридного типа (а, в), циприсовидная личинка (б, г) и решетчатый орган пятой пары (д). Обозначения: fhp – поры желез фронтальных рожек (врезка); p – терминальная пора решетчатого органа; pf – поровое поле; 1–5 – дорсальные щетинки (а, в) и соответствующие им решетчатые органы (б). Рис. 3в по: Korn et al., 2020a, fig. 13C , с разрешения правообладателя.
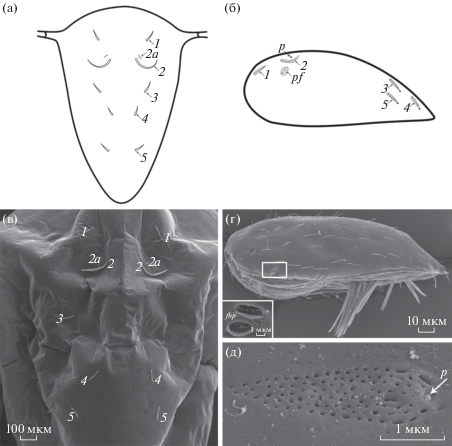
На карапаксе науплиусов находятся дорсальные щетинки, которые, вероятно, являются предшественниками решетчатых органов циприсовидных личинок (Jensen et al., 1994; Rybakov et al., 2003). У науплиусов с пельтогастридным типом развития обычно 6 пар дорсальных щетинок – 3 пары передних и 3 пары задних, причем крупные щетинки второй пары имеют U-образную форму, более изогнутую у родов Briarosaccus и Peltogaster (Walossek et al., 1996; Korn et al., 2020b) (рис. 3а, в). U-образная форма щетинок – еще один признак, подтверждающий объединение семейств Peltogastridae и Lernaeodiscidae. У циприсов пельтогастридного типа сходную серповидную форму имеют решетчатые органы второй пары, что подтверждает гомологию этих структур (Rybakov et al., 2002, 2003; Korn et al., 2020a, 2020b) (рис. 3б). Маленькие щетинки 2а, возможно, являются предшественниками поровых полей, всегда расположенных около второй пары решетчатых органов (Rybakov et al., 2003). Щетинки второй пары появляются, как правило, на второй науплиальной стадии, однако у Peltogasterella gracilis они видны уже на первой стадии (Rybakov et al., 2002).
У некоторых науплиусов саккулинидного типа обнаружено меньшее количество щетинок – 2 пары у Parasacculina sinensis (Chan et al., 2005), 4 пары у Polyascus polygeneus (Rybakov et al., 2003), но 6 пар у Heterosaccus papillosus (Ponomarenko et al., 2005). Дорсальные щетинки обычно заканчиваются терминальной порой, возможно, гомологичной крупной концевой поре решетчатых органов.
Фронтолатеральные рожки (рис. 4)
Рис. 4.
Фронтолатеральные рожки науплиусов Lernaeodiscus rybakovi (а, в) (по: Korn et al., 2020a, fig. 8C, 10D , с разрешения правообладателя); Peltogaster reticulata (б) (по: Korn et al., 2020b, fig. 9H , с разрешения правообладателя); Peltogasterella gracilis (г) и Heterosaccus papillosus (д) (по: Ponomarenko et al., 2005, fig. 5C, с разрешения правообладателя). Обозначения: cf – кутикулярная бахрома; po –пора; se – субтерминальные щетинки; su – борозда (шов); ts – терминальные выросты (шипы).
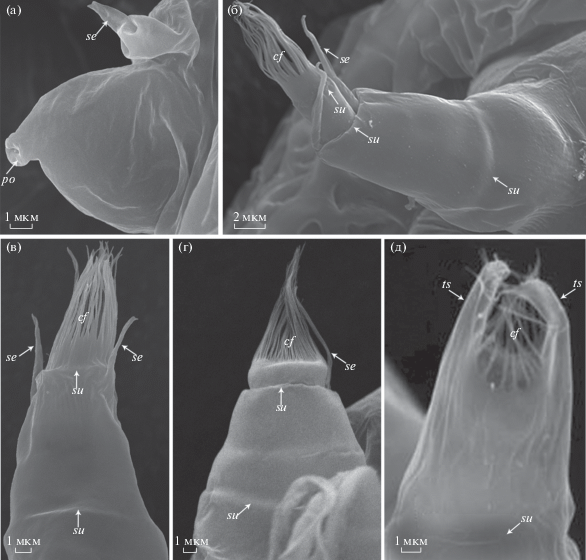
Фронтолатеральные рожки науплиусов являются синапоморфией всех Cirripedia (Walossek et al., 1996; Høeg et al., 2014a). На концах у каждого рожка открываются поры крупных одноклеточных желез. На первой науплиальной стадии личинки имеют одну субтерминальную щетинку (рис. 4а). Начиная со второй стадии, отверстия на концах рожек обрамлены кутикулярной бахромой (рис. 4б–4д); у личинок Peltogaster, Briarosaccus и Lernaeodiscus (рис. 4б, 4в) на рожках присутствуют 2 субтерминальные щетинки – наружная и внутренняя (Hawkes et al., 1985; Walossek et al., 1996; Korn et al., 2020a, 2020b), у науплиусов Peltogasterella (рис. 4г) субтерминальная щетинка одна (Rybakov et al., 2002).
У науплиусов Peltogasterella и Lernaeodiscus фронтолатеральные рожки разделены бороздами (швами) на 3 части, или “сегмента” (рис. 4в, 4г) (Rybakov et al., 2002; Korn et al., 2020a). У личинок Peltogaster и Briarosaccus рожки длиннее, дистальная часть разделена пополам менее отчетливой бороздой. На более поздних стадиях количество борозд в проксимальной части рожек увеличивается и количество “сегментов” может достигать 5 (рис. 4б) (Walossek et al., 1996; Korn et al., 2020b).
Ранее считали, что у личинок саккулинидного типа рожки короткие и несегментированные (Collis, Walker, 1994; Ponomarenko et al., 2005), но фотографии в статьях свидетельствуют о том, что эти рожки также имеют проксимальную борозду и, соответственно, разделяются на два “сегмента” (рис. 4д). Дистальная борозда у них не выражена (Chan et al., 2005; Ponomarenko et al., 2005; Tu et al., 2009; Trédez et al., 2016). Субтерминальные щетинки на фронтолатеральных рожках у науплиусов саккулинидного типа отсутствуют, однако рожки заканчиваются двумя терминальными выростами (шипами) (рис. 4д). Пока неясно, являются ли данные образования гомологичными. Либо это разные структуры, либо дистальные сегменты у рожек личинок саккулинидного типа редуцируются, а субтерминальные щетинки становятся терминальными выростами. В этом случае вооружение фронтолатеральных рожек у науплиусов пельтогастридного типа является плезиоморфным состоянием.
Задняя часть науплиуса (рис. 5)
Рис. 5.
Науплиальные стадии I–V (а); зубчики, маркирующие ориентацию торакальных сегментов науплиуса III (б), IV (в) и фурка (г). Обозначение: de – зубчики по бокам фурки.
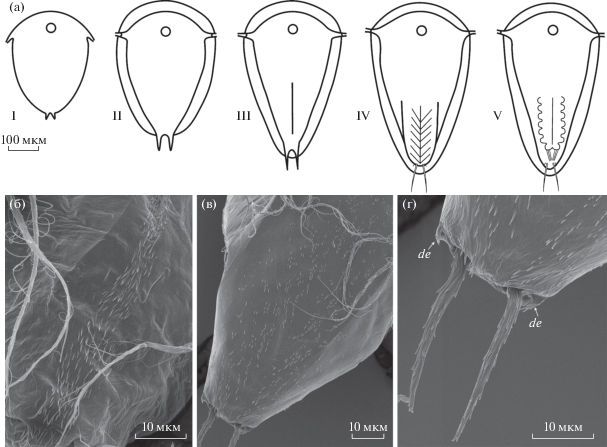
Задняя часть науплиуса постепенно приобретает сегментацию, по характеру которой можно различать науплиальные стадии (рис. 5а). Сегментация отражает формирование торакальных сегментов будущей циприсовидной личинки. На пятой стадии под покровами науплиуса отчетливо видны торакальные конечности циприса. В сканирующем электронном микроскопе заметны мелкие зубчики, маркирующие ориентацию торакальных сегментов – продольная полоса на третьей науплиальной стадии и косые полосы на четвертой и пятой стадиях (рис. 5б, 5в). Время появления такой сегментации у разных видов слегка варьирует (Walossek et al., 1996; Корн и др., 2000; Корн, Рыбаков, 2001; Rybakov et al., 2002; Ponomarenko et al., 2005; Korn et al., 2020a, 2020b).
Задняя часть тела науплиуса заканчивается фуркой с мелкими зубчиками (шипиками) по бокам на поздних науплиальных стадиях (рис. 5г). У науплиусов саккулинидного типа зубчики менее выражены, в то же время между ветвями фурки имеется небольшой бугорок, не характерный для личинок пельтогастридного типа (Корн и др., 2000; Chan et al., 2005; Ponomarenko et al., 2005; Tu et al., 2009; Trédez et al., 2016).
Конечности
Науплиус корнеголового ракообразного, как и всех Cirripedia, имеет три пары конечностей – одноветвистые антеннулы, двуветвистые антенны и мандибулы (рис. 1б–г). Антеннулы несут пять щетинок. На четвертой стадии первая щетинка редуцируется. У поздних науплиусов ряда видов около пятой щетинки обнаружен маленький шип (Walossek et al., 1996; Rybakov et al., 2002; Ponomarenko et al., 2005; Korn et al., 2020a, 2020b). Высказано предположение, что это шестая рудиментарная щетинка (Rybakov et al., 2002). У Sacculina carcini подобный шип встречался не у всех исследованных особей, поэтому авторы полагают, что его нельзя рассматривать как истинную рудиментарную щетинку (Trédez et al., 2016). У Lernaeodiscus rybakovi, S. carcini и Heterosaccus papillosus пятая антеннулярная щетинка на ранних стадиях находится на среднем сегменте, позже она сдвигается на дистальный сегмент (Ponomarenko et al., 2005; Trédez et al., 2016). Подобный “прыжок” щетинки был ранее описан у личинок балянусов (Grygier, 1994). На последних стадиях внутри среднего сегмента антеннулы развивается прикрепительный диск будущей циприсовидной личинки, поэтому сегмент становится вздутым.
Антенна науплиусов корнеголовых ракообразных имеет 8-сегментный экзоподит, а не 7-сегментный, как считали ранее (Korn et al., 2020b). Одни исследователи не учитывали маленький дистальный сегмент (Rybakov et al., 2002), другие пропускали последний проксимальный сегмент, который постепенно увеличивается в ходе развития личинки (Ponomarenko et al., 2005). У всех известных видов на экзоподите антенны 5 щетинок, а на эндоподите – 3 щетинки; исключением является вид Parthenopea subterranea, науплиус которого на антеннальном эндоподите несет лишь 2 щетинки (Рыбаков, Хёг, 2013).
Щетинка на базисе антенны длинная у науплиусов Peltogaster, Briarosaccus и Lernaeodiscus (Hawkes et al., 1985; Walossek et al., 1996; Korn et al., 2020a, 2020b) и значительно короче у личинок Peltogasterella (Rybakov et al., 2002). У личинок саккулинидного типа и у науплиусов P. subterranea базис антенны не вооружен. Эта щетинка, возможно, представляет собой рудимент гнатобазы, присутствующей у планктотрофных науплиусов. Её наличие, по-видимому, является плезиоморфным признаком (Rybakov et al., 2002). Мандибула науплиуса имеет 4 щетинки на экзоподите и 2 – на эндоподите.
Пол личинок
Корнеголовые с кентрогонидным типом развития, по-видимому, являются единственной группой ракообразных, у которых существует половой диморфизм личинок. Науплиусы различаются главным образом по размеру – мужские личинки, как правило, крупнее женских. Обычно их размеры слегка перекрываются (Chan et al., 2005; Korn et al., 2020a), хотя точно установить это можно лишь при наличии однополых генераций личинок. Иногда наблюдаются небольшие морфологические различия. Так, у Heterosaccus papillosus передний край у мужских науплиусов III–V более выпуклый, чем у женских (Ponomarenko et al., 2005). Задняя часть тела у женских науплиусов Polyascus planus более узкая, чем у самцов. Первая щетинка и головной щиток мужских науплиусов имеет поры, отсутствующие у женских личинок (Tu et al., 2009).
Мужские циприсы паразитов с кентрогонидным типом развития также крупнее женских, но их размеры тоже могут перекрываться, поэтому размер не является единственным критерием при определении пола циприсовидных личинок. Примеры неперекрывающихся размеров можно объяснить недостаточным количеством измерений либо неверным определением пола личинок (Ritchie, Høeg, 1981; Korn, Rybakov, 2001; Ponomarenko et al., 2005; Tu et al., 2009).
Как упоминалось выше, в течение сезона размножения каждая экстерна производит несколько (иногда много) генераций личинок. Соотношение мужских и женских личинок в одной генерации варьирует в зависимости от сезона и определяется стадией репродуктивного цикла паразита. В сезон размножения, когда доля ювенильных экстерн в популяции высока, преобладают мужские или смешанные генерации с большим количеством мужских личинок, что приводит к многократному оплодотворению, появлению все новых эмбрионов и личинок. В зал. Петра Великого Японского моря это обычно происходит летом. При завершении сезона размножения (осенью) в популяциях Polyascus polygeneus, Lernaeodiscus rybakovi и Peltogaster reticulata начинают преобладать женские личинки, способные заражать новых хозяев (Корн и др., 2004; Korn et al., 2020a, 2020b). В Гонконге в летний период встречаются исключительно мужские личинки Parasacculina sinensis, а зимой преобладают женские (Chan et al., 2005). В то же время на Тайване летом встречаются преимущественно женские личинки Polyascus planus, а зимой мужские (Tu et al., 2009). В Калифорнии мужские личинки L. porcellanae преобладают в зимние месяцы, а женские летом (Ritchie, Høeg, 1981). У Sacculina carcini из прол. Ла-Манш мужские личинки преобладают поздней весной и ранним летом, когда встречаются ювенильные экстерны, а женские личинки более многочисленны в начале осени (Høeg, 1985; Høeg, Lützen, 1995).
Строение мужских и женских циприсовидных личинок
Размер циприсовидных личинок Rhizocephala меньше, чем науплиусов. Поверхность карапакса циприсов пельтогастридного типа густо покрыта довольно длинными щетинками и порами (рис. 3г) (Glenner et al., 1989; Walossek et al., 1996; Rybakov et al., 2002; Korn et al., 2020a, 2020b). У личинок с саккулинидным типом развития щетинки и поры на карапаксе встречаются реже (Walker, 1999; Chan et al., 2005). По бокам карапакса видны по две щелевидные поры, через которые открываются железы фронтолатеральных рожек (рис. 3г, врезка).
У циприсов корнеголовых ракообразных c кентрогонидным типом развития на поверхности карапакса обычно располагается 5 пар решетчатых органов (2 передние пары и 3 задние) (рис. 3б, 3д), причем у личинок пельтогастридного типа 2-я пара серповидной формы, а у циприсов саккулинидного типа она почти прямая. Остальные пары у всех видов прямые; 5-я пара находится сбоку от 3-й или 4-й пары (Jensen et al., 1994; Walossek et al., 1996; Rybakov et al., 2002, 2003; Chan et al., 2005; Tu et al., 2009; Korn et al., 2020a, 2020b). Расположение решетчатых органов относительно средней линии карапакса у разных видов несколько различается, например, у Polyascus planus решетчатые органы 2-й пары заметно смещены к вентральной стороне карапакса (Tu et al., 2009). У мужских циприсов Heterosaccus lunatus решетчатые органы 4-й и 5-й пар сливаются, в то время как у женских циприсов они раздельные (Glenner et al., 2008).
У личинок пельтогастридного типа на конце решетчатых органов обычно располагаются терминальные поры: впереди у 1–2-й пар и сзади у 3–5-й пар (рис. 3д). У личинок саккулинидного типа терминальные поры чаще встречаются только на передних парах решетчатых органов (Rybakov et al., 2003; Glenner et al., 2008; Tu et al., 2009). У циприсов H. lunatus поры отсутствуют на всех решетчатых органах (Walker, 1999). Помимо решетчатых органов на поверхности карапакса часто наблюдаются поровые поля. Решетчатые органы и поровые поля циприсовидной личинки выполняют хемосенсорную функцию (Høeg et al., 1998), как, по-видимому, и дорсальные щетинки науплиусов.
У циприсовидной личинки Rhizocephala имеется 6 пар двуветвистых торакоподов и парные каудальные отростки, которые используются для плавания. Наибольший интерес представляет антеннула (рис. 6), с помощью которой осуществляются поиск и обследование субстрата. У корнеголовых ракообразных с кентрогонидным типом развития антеннулы мужских и женских циприсовидных личинок существенно различаются, что связано с их разными функциями.
Рис. 6.
Строение антеннулы мужских (а–в, з, и) и женских (г–е, ж) циприсовидных личинок Lernaeodiscus rybakovi (а, г, ж), Peltogaster reticulata (б, д, з) и Sacculina pugettiae (в, е, и). Обозначения: as – аксиальная сенсорная щетинка; cv – кутикулярные ворсинки; fe –расширение прикрепительного диска; fp – нитчатые отростки; ma – мужской эстетаск; oes – сенсорная щетинка с порой на конце; pas1 – постаксиальная сенсорная щетинка 1; pas2 – постаксиальная сенсорная щетинка 2; sa – субтерминальный эстетаск; sp – шиповидный вырост; ta – терминальный эстетаск; ts – терминальные щетинки; 2–4 – антеннулярные сегменты.
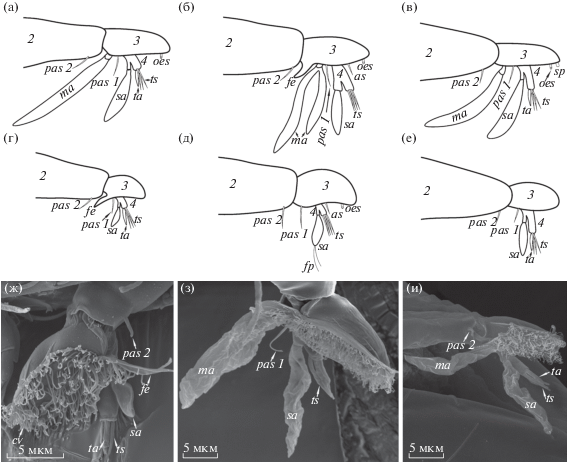
Антеннула состоит из четырех сегментов. Третий сегмент образует прикрепительный диск, благодаря которому и происходит фиксация личинки на теле хозяина или на поверхности экстерны. Диск покрыт кутикулярными ворсинками и редкими порами, вероятно, представляющими собой отверстия антеннулярных желез (Walker, 1999). Периметр диска окаймлен кутикулярной складкой или “юбкой”, более выраженной у женских циприсов. Расширение заднего (проксимального) края прикрепительного диска встречается у мужских личинок Heterosaccus lunatus, H. papillosus, H. californicus и Peltogaster reticulata (Walker, 1999; Ponomarenko et al., 2005; Glenner et al., 2008; Korn et al., 2020b) (рис. 6б), в то же время у Lernaeodiscus rybakovi оно отмечено у женских циприсов (Korn et al., 2020a) (рис. 6г, 6ж). На втором сегменте находится постаксиальная сенсорная щетинка, а на прикрепительном диске видны аксиальная и постаксиальные сенсорные щетинки, число и расположение которых различаются у разных родов и семейств.
У мужских циприсов многих корнеголовых ракообразных на дистальном крае прикрепительного диска имеется так называемый шиповидный вырост. Он находится внутри поры крупной одноклеточной железы. Этот вырост найден у Sacculina carcini, H. lunatus, H. californicus, H. papillosus, Parasacculina sinensis и P. planus (Høeg, 1987; Glenner et al., 1989; Moyse et al., 1995; Walker, 1999; Chan et al., 2005; Ponomarenko et al., 2005; Tu et al., 2009), а также у Sacculina pugettiae (рис. 6в). У мужских циприсов семейства Peltogastridae шиповидный вырост отсутствует (Glenner et al., 1989; Moyse et al., 1995; Walossek et al., 1996; Rybakov et al., 2002; Korn et al., 2020a, 2020b). Щетинка с порой на конце, расположенная в передней части прикрепительного диска Peltogasterella sulcata и Peltogaster paguri, названа шиповидным выростом ошибочно (Glenner et al., 1989). Обычно она почти незаметна, но, по-видимому, присутствует у личинок обоих полов (рис. 6б, д). Одновременное присутствие шиповидного выроста и этой щетинки у мужских личинок H. lunatus (Walker, 1999) и S. pugettiae (рис. 6в) свидетельствует о том, что это разные структуры. Оба образования характерны только для личинок Rhizocephala (Glenner et al., 1989).
Мужские и женские личинки корнеголовых ракообразных различаются по количеству и размеру антеннулярных эстетасков – особых утолщенных сенсорных щетинок. На проксимальном крае антеннулярного диска у мужских циприсов обычно расположен крупный мужской эстетаск. Четвертый сегмент антеннулы имеет довольно большой субтерминальный эстетаск (рис. 6а–6в). У женских циприсов мужской эстетаск на антеннулярном диске отсутствует, однако более короткий субтерминальный эстетаск на четвертом сегменте имеется (рис. 6г–6е). На конце четвертого сегмента у личинок обоих полов обычно находятся короткий терминальный эстетаск (или мешкообразная щетинка) и три щетинки с порами на концах (рис. 6).
У циприсов разных родов и даже видов Rhizocephala антеннулярный диск имеет характерные особенности. Крупный мужской эстетаск личинок рода Peltogaster разделяется на две лопасти (рис. 6б, з) (Glenner et al., 1989; Korn et al., 2020b), в то же время у циприсов родов Briarosaccus, Lernaeodiscus, Peltogasterella, Sacculina и Polyascus только одна лопасть (рис. 6а, в, и) (Glenner et al., 1989; Moyse et al., 1995; Rybakov et al., 2002; Tu et al., 2009; Korn et al., 2020a). Мужской эстетаск отсутствует у циприсов Heterosaccus lunatus, H. papillosus и редуцирован у H. californicus (Walker, 1999; Ponomarenko et al., 2005), что, вероятно, является апоморфным признаком этого рода (Glenner et al., 2008). Субтерминальный эстетаск женских циприсов рода Peltogaster заканчивается двумя нитчатыми отростками, не встречающимися у личинок других родов (рис. 6д). Постаксиальная сенсорная щетинка на третьем антеннулярном сегменте у личинок Peltogaster reticulata слегка раздвоена (рис. 6з), а у P. paguri разделяется даже на три кончика. В то же время циприс P. reticulata имеет дополнительную аксиальную сенсорную щетинку (рис. 6б, д), которая, вероятно, отсутствует у личинок P. paguri (Glenner et al., 1989; Korn et al., 2020b). Задняя сенсорная щетинка на кутикулярной “юбке” обнаружена только у циприсов рода Peltogasterella (Rybakov et al., 2002).
ЗАКЛЮЧЕНИЕ
Морфология и ультраструктура личинок корнеголовых ракообразных часто представляют более важную информацию для таксономии и филогении Rhizocephala, чем морфология и анатомия экстерны. Несмотря на то, что личинки живут и эволюционируют в пелагиали, т.е. в другой среде, чем взрослые особи, их строение в значительной степени определяется таксономическим положением. Личинки каждого семейства и даже рода корнеголовых ракообразных имеют характерные особенности. Описание личиночного развития является обязательной составляющей комплексного исследования Rhizocephala.
Список литературы
Кашенко С.Д., Корн О.М. Адаптивные реакции личинок корнеголового рака Peltogasterella gracilis на изменение температуры и солености морской воды // Биол. моря. 2002. Т. 28. № 5. С. 356–361.
Кашенко С.Д., Корн О.М. Cовместное влияние температуры и солености морской воды на развитие личинок корнеголового ракообразного Peltogaster reticulatus (Crustacea: Cirripedia) // Биол. моря. 2003. Т. 29. № 3. С. 178–183.
Корн О.М., Рыбаков А.В., Хёг Й.Т. Развитие личинок корнеголового рака Peltogasterella gracilis // Биол. моря. 1999. Т. 25. № 2. С. 127–128.
Корн О.М., Рыбаков А.В. Развитие личинок корнеголового ракообразного Sacculina pilosella // Биол. моря. 2001. Т. 27. № 3. С. 209–212.
Корн О.М., Рыбаков А.В., Кашенко С.Д. Развитие личинок корнеголового рака Sacculina polygenea // Биол. моря. 2000. Т. 26. № 5. С. 353–356.
Корн О.М., Шукалюк А.И., Трофимова А.В., Исаева В.В. Репродуктивная стадия жизненного цикла корнеголового ракообразного Polyascus polygenea (Crustacea: Cirripedia) // Биол. моря. 2004. Т. 30. № 5. С. 380–392.
Рыбаков А.В., Хёг Й.Т. Таксономическое положение корнеголовых ракообразных рода Parthenopea Kossmann, 1874 (Cirripedia: Rhizocephala) с обоснованием нового семейства Parthenopeidae fam. nov. // Биол. моря. 2013. Т. 39. № 5. С. 355–361.
Andersen M.L., Bohn M., Høeg J.T., Jensen P.G. Cyprid ultrastructure and adult morphology in Ptychascus barnwelli, new species, and P. glaber (Cirripedia: Rhizocephala), parasites on semiterrestrial crabs // J. Crustacean Biol. 1990. V. 10. № 1. P. 20–28.
Chan B.K.K., Poon D.Y.N., Walker G. Distribution, adult morphology, and larval development of Sacculina sinensis (Cirripedia: Rhizocephala: Kentrogonida) in Hong Kong coastal waters // J. Crustacean Biol. 2005. V. 25. № 1. P. 1–10.
Collis S.A., Walker G. The morphology of the naupliar stages of Sacculina carcini (Crustacea: Cirripedia: Rhizocephala) // Acta Zool. 1994. V. 75. № 4. P. 297–303.
Glenner H., Hebsgaard M.B. Phylogeny and evolution of life history strategies of the parasitic barnacles (Crustacea, Cirripedia, Rhizocephala) // Mol. Phylogenet. Evol. 2006. V. 41. P. 528–538.
Glenner H., Høeg J.T. Metamorphosis in the Cirripedia Rhizocephala and the homology of the kentrogon and trichogon // Zool. Scr. 1994. V. 23. № 2. P. 161–173.
Glenner H., Høeg J.T. A new motile, multicellular stage involved in host invasion by parasitic barnacles (Rhizocephala) // Nature. 1995. V. 377. P. 147–150.
Glenner H., Høeg J.T., O,Brien J.J., Sherman T.D. Invasive vermigon stage in the parasitic barnacles Loxothylacus texanus and L. panopaei (Sacculinidae): closing of the rhizocephalan life cycle // Mar. Biol. 2000. V. 136. P. 249–257.
Glenner H., Høeg J.T., Klysner A., Larsen B.B. Cypris ultrastructure, metamorphosis and sex in seven families of parasitic barnacles (Crustacea: Cirripedia: Rhizocephala) // Acta Zool. 1989. V. 70. № 4. P. 229–242.
Glenner H., Høeg J.T., Rees D.J., Schubart C.D. Phylogenetic analyses suggest a single origin of freshwater barnacles // Recent advances in freshwater crustacean biodiversity and conservation. Boca Raton: CRC Press. 2021. Ch. 2. P. 3–18.
Glenner H., Høeg J.T., Stenderup J., Rybakov A.V. The monophyletic origin of a remarkable sexual system in akentrogonid rhizocephalan parasites: a molecular and larval structural study // Exp. Parasitol. 2010. V. 125. P. 3–12.
Glenner H., Thomsen P.F. et al. The phylogeny of rhizocephalan parasites of the genus Heterosaccus using molecular and larval data (Cirripedia: Rhizocephala: Sacculinidae) // Isr. J. Ecol. Evol. 2008. V. 54. P. 223−238.
Grygier M.J. Developmental patterns and hypotheses of homology in the antennules of thecostracan nauplius larvae (Crustacea) // Acta Zool. 1994. V. 75. № 3. P. 219–234.
Hawkes C.R., Meyers T.R., Shirley T.C. Larval biology of Briarosaccus callosus Boschma (Cirripedia: Rhizocephala) // Proc. Biol. Soc. Wash. 1985. V. 98. № 4. P. 935–944.
Høeg J.T. Cypris settlement, kentrogon formation and host invasion in the parasitic barnacle Lernaeodiscus porcellanae (Müller) (Crustacea: Cirripedia: Rhizocephala) // Acta Zool. 1985. V. 66. № 1. P. 1–45.
Høeg J.T. Male cypris metamorphosis and a new male larval form, the trichogon, in the parasitic barnacle Sacculina carcini (Crustacea: Cirripedia: Rhizocephala) // Philos. Trans. R. Soc. London. B. 1987. V. 317. № 1183. P. 47–63.
Høeg J.T. “Akentrogonid” host invasion and an entirely new type of life cycle in the rhizocephalan parasite Clistosaccus paguri (Thecostraca: Cirripedia) // J. Crustacean Biol. 1990. V. 10. № 1. P. 37–52.
Høeg J.T. Rhizocephala // Microscopic anatomy of invertebrates. New York: Alan Liss, Inc. 1992. V. 9. P. 313–345.
Høeg J.T. The biology and life cycle of the Rhizocephala (Cirripedia) // J. Mar. Biol. Assoc. U.K. 1995. V. 75. P. 517–550.
Høeg J.T., Chan B.K.K., Martin J.W. Introduction to the Thecostraca // Atlas of Crustacean Larvae. Baltimore: Johns Hopkins Univ. Press. 2014a. P. 97–99.
Høeg J.T., Chan B.K.K., Rybakov A.V. Rhizocephala // Atlas of Crustacean Larvae. Baltimore: Johns Hopkins Univ. Press. 2014b. P. 111–113.
Høeg J., Hosfeld B., Jensen P.G. TEM studies of lattice organs of cirripede cypris larvae (Crustacea, Thecostraca, Cirripedia) // Zoomorphology. 1998. V. 118. P. 195–205.
Høeg J.T., Lagersson N.C., Glenner H. The complete cypris larva and its significance in thecostracan phylogeny // Evolutionary Developmental Biology of Crustacea. Lisse, The Netherlands: A.A. Balkema. 2004a. P. 197–215. Crustacean Issues; V. 15.
Høeg J.T., Lützen J. Crustacea Rhizocephala. Marine invertebrates of Scandinavia. Norway: Norwegian Univ. Press. V. 6. 1985. 90 p.
Høeg J.T., Lützen J. Life cycle and reproduction in the Cirripedia Rhizocephala // Oceanogr. Mar. Biol. Annu. Rev. 1995. V. 33. P. 427–485.
Høeg J.T., Lützen J. Super-ordre des Rhizocéphales (Rhizocephala F. Müller, 1862) // Traité de zoologie. V. 7. Tasc. 2. Crustacés Géneralités (suite) et systématique (1re partie). Paris: Masson. 1996. P. 541–568.
Høeg J.T., Møller O.S. When similar beginnings lead to different ends: constraints and diversity in cirripede larval development // Invertebr. Reprod. Dev. 2006. V. 49. № 3. P. 125–142.
Høeg J.T., Møller O.S., Rybakov A.V. The unusual floatation collar around nauplii of certain parasitic barnacles (Crustacea: Cirripedia: Rhizocephala) // Mar. Biol. 2004b. V. 144. P. 483–492.
Høeg J.T., Noever C., Rees D.A. et al. A new molecular phylogeny-based taxonomy of parasitic barnacles (Crustacea: Cirripedia: Rhizocephala) // Zool. J. Linn. Soc. 2020. V. 190. № 2. P. 632–653.
Høeg J.T., Perez-Losada M., Glenner H. et al. Evolution of morphology, ontogeny and life cycles within the Crustacea Thecostraca // Arthropod Syst. Phylog. 2009. V. 67. № 2. P. 199–217.
Høeg J.T., Rees D.J., Jensen P.C., Glenner H. Unravelling the evolutions of the Rhizocephala: a case study for molecular-based phylogeny in the parasitic Crustacea // Parasitic Crustacea: State of Knowledge and Future Trends. Berlin: Springer. 2019. P. 387–419 (Zoological Monographs; V. 3).
Høeg J.T., Rybakov A.V. Cypris larvae in Polysaccus mediterraneus and Mycetomorpha vancouverensis: their importance in analyzing the phylogeny and sexual evolution of parasitic barnacles (Crustacea: Cirripedia: Rhizocephala) // Isr. J. Ecol. Evol. 2007. V. 53. P. 9–31.
Isaeva V.V., Shukalyuk A.I., Korn O.M. et al. Development of primordial externae in the colonial interna of Polyascus polygenea (Crustacea: Cirripedia: Rhizocephala) // Crustacean Res. 2004. № 33. P. 61–71.
Isaeva V.V., Shukalyuk A.I., Trofimova A.V. et al. The structure of colonial interna in Sacculina polygenea (Crustacea: Cirripedia: Rhizocephala) // Crustacean Res. 2001. № 30. P. 133–146.
Itô T. Naupliar development of Hansenocaris furcifera Itô (Crustacea: Maxillopoda: Facetotecta) from Tanabe Bay, Japan // Publ. Seto Mar. Biol. Lab. 1990. V. 34. № 4/6. P. 201–224.
Jensen P.G., Moyse J., Høeg J., Al-Yahya H. Comparative SEM studies of lattice organs: putative sensory structures on the carapace of larvae from Ascothoracida and Cirripedia (Crustacea Maxillopoda Thecostraca) // Acta Zool. 1994. V. 75. № 2. P. 125–142.
Kashenko S.D., Korn O.M. Effects of temperature and salinity on the larvae of two species of rhizocephalan (Crustacea: Cirripedia) // Invertebr. Reprod. Dev. 2002. V. 41. № 1–3. P. 179–184.
Kashenko S.D., Korn O.M., Rybakov A.V. Effects of temperature and salinity on the larvae of Sacculina polygenea (Crustacea: Cirripedia: Rhizocephala) // Crustacean Res. 2002. V. 31. P. 9–17.
Kobayashi M., Wong Y.H., Oguro-Okano M. et al. Identification, characterization, and larval biology of a rhizocephalan barnacle, Sacculina yatsui Boschma, 1936, from northwestern Japan (Cirripedia: Sacculinidae) // J. Crustacean Biol. 2018. V. 38. № 3. P. 329–340.
Kolbasov G.A., Petrunina A.S., Dreyer N. et al. Naupliar development of Facetotecta (Crustacea: Thecostraca) and the nature of the first nauplius instar in the Crustacea – pro et contra the Hexanauplia concept // Org. Diversity Evol. 2021. V. 21. P. 209–230.
Korn O.M. Naupliar evidence for cirripede taxonomy and phylogeny // New frontiers in barnacle evolution. Rotterdam: A.A. Balkema. 1995. P. 87–122. (Crustacean Issues; № 10).
Korn O.M., Golubinskaya D.D., Rees D.J. et al. Phylogenetic position, complete larval development and larval sexual dimorphism in a rhizocephalan barnacle, Lernaeodiscus rybakovi sp. nov. (Cirripedia: Rhizocephala: Peltogastridae), parasitizing the crab Pachycheles stevensii Stimpson, 1858 (Decapoda: Anomura: Porcellanidae) // Zool. Anz. 2020a. V. 287. P. 178–197.
Korn O.M., Golubinskaya D.D., Sharina S.N. The parasitic barnacle Peltogaster reticulata Shiino, 1943 (Rhizocephala, Peltogastridae) from Russian waters of the Sea of Japan: morphological description, molecular identification and complete larval development // Zootaxa. 2020b. V. 4768. № 1. P. 6–24.
Lützen J., Itani G., Jespersen Å. et al. On a new species of parasitic barnacle (Crustacea: Rhizocephala), Sacculina shiinoi sp. nov., parasitizing Japanese mud shrimps Upogebia spp. (Decapoda: Thalassinidea: Upogebiidae), including a description of a novel morphological structure in the Rhizocephala // Zool. Sci. 2016. V. 33. P. 204–212.
Martin J.W., Davis G.E. An updated classification of the recent Crustacea. Los Angeles: Nat. Hist. Mus. Los Angeles County. Sci. Ser. № 39. 2001. 124 p.
Martin J.W., Olesen J., Høeg J.T. Introduction // Atlas of crustacean larvae. Baltimore: Johns Hopkins Univ. Press. 2014. P. 1–7.
Moyse J. Larvae of lepadomorph barnacles // Barnacle biology. Rotterdam: A.A. Balkema. 1987. P. 329–362.
Moyse J., Høeg J.T., Jensen P.G., Al-Yahya H.A.H. Attachment organs in cypris larvae: Using scanning electron microscopy // New frontiers in barnacle evolution. Crustacean Issues 10. Rotterdam: A.A. Balkema. 1995. P. 153–178.
Ponomarenko E.A., Korn O.M., Rybakov A.V. Larval development of the parasitic barnacle Heterosaccus papillosus (Cirripedia: Rhizocephala: Sacculinidae) studied under laboratory conditions // J. Mar. Biol. Assoc. U.K. 2005. V. 85. P. 921–928.
Ritchie E., Høeg J.T. The life history of Lernaeodiscus porcellanae (Cirripedia: Rhizocephala) and co-evolution with its porcellanid host // J. Crustacean Biol. 1981. V. 1. № 3. P. 334–347.
Rybakov A.V., Høeg J.T., Jensen P.G., Kolbasov G.A. The chemoreceptive lattice organs in cypris larvae develop from naupliar setae (Thecostraca: Cirripedia, Ascothoracida and Facetotecta) // Zool. Anz. 2003. V. 242. P. 1–20.
Rybakov A.V., Korn O.M., Høeg J.T., Waloszek D. Larval development in Peltogasterella studied by scanning electron microscopy (Crustacea: Cirripedia: Rhizocephala) // Zool. Anz. 2002. V. 241. P. 199–221.
Trédez F., Rabet N., Bellec L., Audebert F. Synchronism of naupliar development of Sacculina carcini Thompson, 1836 (Pancrustacea, Rhizocephala) revealed by precise monitoring // Helgol. Mar. Res. 2016. V. 70. № 26. P. 1–11.
Tu T.-H., Chan B.K.K., Jeng K.M.-S. Larval development and sex ratio variation of Polyascus plana (Cirripedia: Rhizocephala), a parasite of the crab Grapsus albolineatus, in Taiwan // Bull. Mar. Sci. 2009. V. 84. № 3. P. 331–349.
Walker G. The cypris larvae of Sacculina carcini Thompson (Crustacea: Cirripedia: Rhizocephala) // J. Exp. Mar. Biol. Ecol. 1985. V. 93. P. 131–145.
Walker G. Observations on the larval development of Sacculina carcini (Crustacea: Cirripedia: Rhizocephala) // J. Mar. Biol. Assoc. U.K. 1988. V. 68. № 3. P. 377–390.
Walker G. The cypris larvae of the rhizocephalan barnacle Heterosaccus lunatus with particular reference to antennular morphology // Acta Zool. 1999. V. 80. P. 209–217.
Walker G. Introduction to the Rhizocephala (Crustacea: Cirripedia) // J. Morphol. 2001. V. 249. P. 1–8.
Walker G., Clare A.S. The effect of salinity on the development of Loxothylacus panopaei larvae (Crustacea: Cirripedia: Rhizocephala) // Estuaries. 1994. V. 17. № 1B. P. 276–282.
Walker G., Lester R.J.G. Effects of salinity on development of larvae of Heterosaccus lunatus // J. Crustacean Biol. 1998. V. 18. № 4. P. 650–655.
Walossek D., Høeg J.T., Shirley T.C. Larval development of the rhizocephalan cirripede Briarosaccus tenellus (Maxillopoda: Thecostraca) reared in the laboratory: a scanning electron microscopy study // Hydrobiologia. 1996. V. 328. P. 9–47.
Yoshida R., Hirose M., Hirose E. A new peltogastrid rhizocephalan parasitising a hermit crab from the Japanese coast: a second species of Dipterosaccus Van Kampen & Boschma, 1925 (Crustacea: Cirripedia) // Syst. Parasitol. 2013. V. 84. P. 137–147.
Yoshida R., Hirose M., Hirose E. Peltogasterella sensuru n. sp. (Crustacea: Cirripedia: Rhizocephala) from off Okinawa Island (Ryukyu Archipelago, Japan) with remarks on its single brood externae // Syst. Parasitol. 2015. V. 92. P. 31–44.
Yoshida R., Osawa M., Hirose M., Hirose E. A new genus and two new species of Peltogastridae (Crustacea: Cirripedia: Rhizocephala) parasitizing hermit crabs from Okinawa Island (Ryukyu Archipelago, Japan), and their DNA-barcodes // Zool. Sci. 2011. V. 28. P. 853–862.
Дополнительные материалы отсутствуют.
Инструменты
Биология моря


