Биология моря, 2021, T. 47, № 5, стр. 304-312
Состав и структура фитопланктона лагуны Буссе (юго-восточный Сахалин)
И. В. Мотылькова 1, *, Н. В. Коновалова 1
1 Сахалинский филиал ФГБНУ Всероссийский научно-исследовательский институт рыбного хозяйства
и океанографии (СахНИРО)
693023 Южно-Сахалинск, Россия
* E-mail: surirella@mail.ru
Поступила в редакцию 15.06.2020
После доработки 04.03.2021
Принята к публикации 01.04.2021
Аннотация
Представлены результаты изучения видового состава, количественных характеристик и сезонной динамики фитопланктона лагуны Буссе по результатам съемки 2014–2015 гг. Обнаружено 306 видов и внутривидовых таксонов микроводорослей. Среднемесячная численность варьировала от 14.79 до 105.19 тыс. кл./л, биомасса – от 42.25 до 553.11 мг/м3. Среднегодовая численность фитопланктона составляла 46.08 тыс. кл./л, биомасса – 176.13 мг/м3. В годовом цикле развития по биомассе преобладали диатомовые и динофитовые водоросли. Сезонная динамика характеризовалась двумя подъемами численности, совпадающими с таковыми биомассы: весенним (май) и летним (сентябрь). Весенний пик был сформирован массовым развитием Rhizosolenia setigera, летний – Prorocentrum micans. Сравнение результатов наблюдений с опубликованными данными позволило выявить некоторые изменения в характере сезонной динамики видового состава, а также количественных показателей и комплекса доминирующих видов.
Расположенная в юго-восточной части о-ва Сахалин лагуна Буссе – это уникальный природный водоем, обладающий разнообразными биоценозами и перспективный для создания хозяйств марикультуры. Гидрологические процессы в лагуне формируются под воздействием речного стока, водообмена с зал. Анива (Охотское море) и климатических факторов. Важную роль играет мелководность лагуны (глубины от 2.5 до 5.0 м), которая определяет высокую вариабельность суточных и сезонных колебаний температуры воды. Наибольший прогрев водоема (до 22°С) наблюдается в августе–сентябре. Соленость по всей толще воды изменяется в пределах 26–32‰. Гидродинамика лагуны сложна: течения здесь не имеют определенной направленности, за исключением проток, где преобладают приливно-отливные течения, а также центрального и юго-восточного районов, где течения приобретают циклонический характер. Сильные приливно-отливные течения и ветровое перемешивание водных масс приводят к снижению их стратификации (Шпилько, Шевченко, 2018).
Показано, что условия лагуны Буссе благоприятны для проведения мероприятий по коллекторному сбору молоди приморского гребешка (Ефанов и др., 2016; Чернышова, Прохорова, 2018), значимую роль в питании которого играет фитопланктон (Калганова, 1982). В свою очередь, культивируемые моллюски в процессе жизнедеятельности могут стимулировать развитие микроводорослей, в том числе вредоносных и потенциально-токсичных видов (Arzul et al., 2001). Так, широко известны случаи “цветения” микроводорослей на акваториях, занятых установками марикультуры, в том числе и на Дальнем Востоке России (Селина, 1998; Морозова, Орлова, 2005; Шевченко и др., 2011). Поэтому изучение структурных характеристик и количественных показателей фитопланктона является важным и актуальным. Фитопланктон лагуны Буссе хорошо изучен благодаря долговременным исследованиям, начавшимся в 1970-х годах (Калганова, 1980, 2010; Тепаева, Калганова, 2012; Ефанов, Тепаева, 2014). Настоящая работа является продолжением многолетних исследований.
Цели данной работы − выявить и количественно оценить изменения в составе фитопланктона, в том числе массовых вредоносных видов, а также охарактеризовать пространственно-временное распределение фитопланктона.
МАТЕРИАЛ И МЕТОДИКА
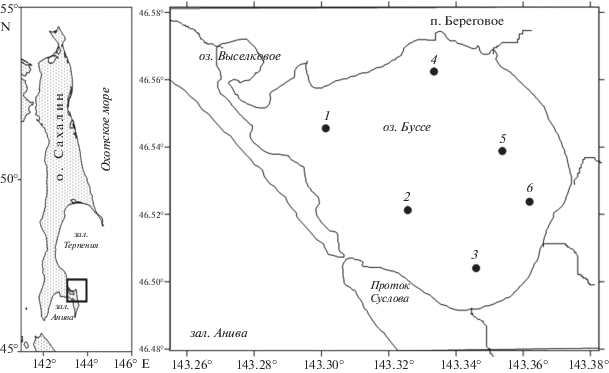
В работе использовали фитопланктонные пробы, собранные в лагуне Буссе сотрудниками Отдела исследований среды и мониторинга антропогенного воздействия СахНИРО. Пробы отбирали батометром из поверхностного и придонного горизонтов на шести равномерно распределенных по основным геоморфологическим элементам станциях (рис. 1) ежемесячно с мая по ноябрь 2014 г. и на пяти станциях в феврале 2015 г. В 2015 г. тонкий лед и промоины не позволили взять пробы на станции 2. Всего было отобрано 94 пробы фитопланктона объемом 1.5 л.
Пробы, фиксированные раствором Утермеля, концентрировали с помощью воронки обратной фильтрации через нуклеопоровые лавсановые фильтры с диаметром пор 3 мкм (Федоров, 1979; Радченко и др., 2010). Морфологию микроводорослей изучали с помощью светового микроскопа Leica с увеличением до ×1600; для идентификации видов использовали атласы и монографии как отечественных, так и зарубежных авторов (Коновалова и др., 1989; Диатомовые…, 1992; Hasle, Syvertsen, 1996; Коновалова, 1998; Lange-Bertalot, 2001; Horner, 2002; Throndsen et al., 2007; Генкал, Трифонова, 2009; Hoppenrath et al., 2009; Коновалова, Селина, 2010). При формировании таксономического списка применяли современные системы классификации, составленные с учетом общепризнанной международной базы данных Интернет-ресурса AlgaeBase (Guiry, Guiry, 2020). Клетки подсчитывали в камере Нажотта объемом 0.05 мл при увеличении ×320. Крупные и редкие виды определяли в камере типа “Пенал” объемом 1 мл. Учитывали как планктонные, так и бентосные формы микроводорослей.
Биомассу определяли, приравнивая клетки водорослей к определенным геометрическим фигурам (Кольцова, 1970; Макарова, Пичкилы, 1970; Радченко и др., 2010).
К видам, формирующим доминантный комплекс, относили виды, численность или биомасса которых равнялась или превышала 20% от общей численности или биомассы (Коновалова, 1984). Численность или биомассу для каждой станции рассчитывали как средневзвешенные значения по двум горизонтам (поверхность, дно). Среднемесячные значения численности или биомассы получали путем усреднения данных по шести станциям с двух горизонтов (поверхность, дно).
РЕЗУЛЬТАТЫ
Флора микроводорослей
Всего за период исследования в фитопланктоне обнаружено 306 таксонов водорослей рангом ниже рода из 9 отделов, 16 классов, 59 порядков и 158 родов. Из них 28 таксонов идентифицированы только до рода, а два представляют внутривидовые таксоны (разновидности и формы). Подобная структура таксономического состава типична для прибрежных морских акваторий умеренной зоны (табл. 1). В составе альгофлоры лагуны Буссе выявлено четыре ведущих рода с наибольшим количеством видов (от 10 и выше). Видовым богатством отличались роды Navicula Bory (15 видов и внутривидовых таксонов), Protoperidinium Bergh (16 видов), Nitzschia Hassall (15) и Gymnodinium F. Stein (14) (табл. 1).
Таблица 1.
Таксономический состав планктонных микроводорослей лагуны Буссе в 2014–2015 гг.
| Отдел | Класс | Порядок | Семейство | Род | Вид |
|---|---|---|---|---|---|
| Сyanobacteria | Cyanophyceae | 2 | 3 | 4 | 4 |
| Bacillariophyta | Bacillariophyceae | 17 | 34 | 58 | 133 |
| Mediophyceae | 7 | 9 | 11 | 22 | |
| Coscinodiscophyceae | 9 | 12 | 14 | 22 | |
| Cryptophyta | Cryptophyceae | 1 | 2 | 3 | 3 |
| Charophyta | Conjugatophyceae | 1 | 1 | 2 | 3 |
| Chlorophyta | Chlorodendrophyceae | 1 | 1 | 1 | 1 |
| Chlorophyceae | 1 | 3 | 8 | 8 | |
| Trebouxiophyceae | 3 | 3 | 5 | 5 | |
| Pyramimonadophyceae | 1 | 2 | 3 | 3 | |
| Euglenozoa | Euglenophyceae | 2 | 3 | 3 | 4 |
| Miozoa | Dinophyceae | 10 | 27 | 41 | 93 |
| Noctilucophyceae | 1 | 1 | 1 | 1 | |
| Ochrophyta | Dictyochophyceae | 1 | 1 | 2 | 2 |
| Raphidophyceae | 1 | 1 | 1 | 1 | |
| Cercozoa | Thecofilosea | 1 | 1 | 1 | 1 |
| Всего | 59 | 104 | 158 | 306 |
Одновременное присутствие в лагуне морских, речных и собственно лагунных вод обусловило разнообразие групп микроводорослей по отношению к солености. Благодаря интенсивному приливному водообмену с морем (Бровко и др., 2002) доля морских видов составляла 44% от общего числа. Пресноводные и солоноватоводные виды были менее представительными – 16 и 5% соответственно. Из видов смешанных групп наиболее разнообразными были солоноватоводно-морские (15%) и пресноводно-солоноватоводные (9%).
Приблизительно половину от общего количества обнаруженных видов составляли планктонные формы. Из-за мелководности лагуны альгофлора была представлена большим количеством бентосных (29%) и планктонно-бентосных микроводорослей (13%). Некоторые из них в той или иной степени развивались в лагуне круглогодично, это Actinoptychus senarius (Ehrenberg) Ehrenberg, Cocconeis scutellum Ehrenberg, Grammatophora marina (Lyngbye) Kützing, Navicula transitans f. delicatula Heimdal, Nitzschia sigma (Kützing) W. Smith, Odontella aurita (Lyngbye) C. Agardh, Paralia sulcata (Ehrenberg) Cleve и Pleurosigma angulatum (J.T. Quekett) W. Smith.
Количество видов и внутривидовых таксонов в разные месяцы варьировало от 87 до 130. Наибольшее число видов за счет пресноводных и пресноводно-солоноватоводных видов зарегистрировано весной (в мае и июне) во время паводков при значительном влиянии опресненных вод из впадающих водотоков, наименьшее – в августе и сентябре при максимальном прогреве воды и массовом развитии динофитовых (табл. 2).
Таблица 2.
Количество видов и внутривидовых таксонов фитопланктона в лагуне Буссе в разные месяцы в 2014−2015 гг.
| Отдел | Месяц | |||||||
|---|---|---|---|---|---|---|---|---|
| V | VI | VII | VIII | IX | X | XI | II | |
| Cyanobacteria | 4 | 1 | ||||||
| Bacillariophyta | 81 | 74 | 50 | 47 | 54 | 57 | 76 | 67 |
| Cryptophyta | 2 | 2 | 3 | 2 | 1 | 2 | 2 | 3 |
| Charophyta | 2 | 1 | 1 | 1 | 1 | |||
| Chlorophyta | 7 | 6 | 6 | 2 | 2 | 8 | 5 | 3 |
| Euglenozoa | 1 | 1 | 1 | 1 | 2 | 1 | 2 | |
| Miozoa | 37 | 40 | 42 | 34 | 25 | 32 | 28 | 13 |
| Ochrophyta | 1 | 2 | 1 | |||||
| Cercozoa | 1 | 1 | 1 | 1 | 1 | |||
| Всего | 130 | 126 | 103 | 87 | 87 | 105 | 113 | 92 |
Пространственно-временное распределение фитопланктона
В сезонной динамике развития фитопланктона среднемесячные величины количественных показателей изменялись в следующих пределах: численность – от 14.79 до 105.19 тыс. кл./л, биомасса – от 42.2 до 553.1 мг/м3. Выявлены два пика разной степени интенсивности: весенний и летний (рис. 2).
Рис. 2.
Относительная численность (a) и относительная биомасса (б) микроводорослей разных систематических групп (слева), а также динамика численности (а) и динамика биомассы (б) (справа) фитопланктона лагуны Буссе с мая 2014 г. по февраль 2015 г. Условные обозначения: 1 – диатомовые, 2 – динофитовые, 3 – криптофитовые, 4 – прочие микроводоросли. Приведены усредненные данные по численности и биомассе для каждого отдела микроводорослей для шести станций с двух горизонтов для каждого месяца.
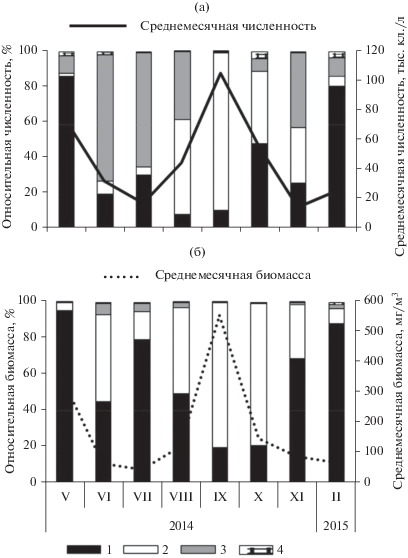
Весенний относительно небольшой пик биомассы, как и пик численности фитопланктона, зарегистрирован в мае при температуре воды 3.0–11.7°С. Пики были вызваны увеличением инсоляции после разрушения ледового покрова, а также выраженным влиянием речных стоковых вод, обеспечивающих лагуну высокой концентрацией биогенных элементов. Основу биомассы в это время формировали диатомовые водоросли (рис. 2а, 2б) при обильном развитии Rhizosolenia setigera. Биомасса фитопланктона на разных станциях варьировала от 244.8 до 379.6 мг/м3 и распределялась довольно равномерно, с небольшим увеличением в северной и юго-восточной кутовых частях лагуны (рис. 3а).
Рис. 3.
Распределение биомассы (мг/м3) и относительный вклад водорослей доминирующего комплекса в биомассу фитопланктона в лагуне Буссе в разные месяцы 2014 г. (а – май, б – июнь, в – июль, г – август, д – сентябрь, е – октябрь, ж – ноябрь) и в феврале 2015 г. (з). Условные обозначения: 1 – Rhizosolenia setigera, 2 – Odontella aurita, 3 – Actinoptychus senarius, 4 – Preperidinium meunieri, 5 – Gonyaulax digitalis, 6 – Prorocentrum micans, 7 – Prorocentrum triestinum, 8 – Pleurosigma strigosum, 9 – Thalassiosira nordenskioeldii, 10 – Pronoctiluca pelagica и 11 – прочие микроводоросли. Цифры над диаграммами – средняя биомасса фитопланктона, мг/м3.
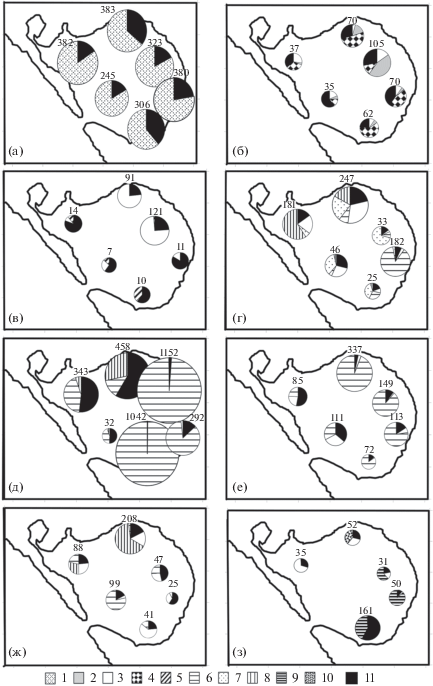
При позднем наступлении гидрологической весны (в июне) и увеличении температуры воды до 12.7°С, а также при максимальном развитии паводков наблюдалось изменение структуры фитопланктона, которое сопровождалось снижением количественных показателей (рис. 2а, 2б). По численности преобладали криптофитовые водоросли (рис. 2а), по биомассе – динофитовые и диатомовые (рис. 2б). Монодоминантный комплекс, сформированный в мае R. setigera, заменялся комплексом доминирующих видов, состоящим из планктонно-бентосных A. senarius, O. aurita и планктонной Preperidinium meunieri (Pavillard) Elbrächter. Повышенной биомассой отличалась зона смешения морских, собственно лагунных и речных вод в центральной восточной частях лагуны (рис. 3б).
В июле средние значения численности и биомассы снижались еще значительнее (рис. 2а, 2б). Причем уменьшение этих показателей наблюдалось в зоне наибольшего влияния морской воды – в западной части лагуны. Из структурных перестроек следует отметить увеличение доли диатомовых и частичную смену видов доминирующего комплекса (рис. 3в). В августе при максимальном прогреве воды до 22°С отмечено плавное увеличение количественных показателей. Численность по станциям варьировала в пределах 15.58–109.80 тыс. кл./л, биомасса – 24.9–247.0 мг/м3. Основное скопление микроводорослей зарегистрировано на кутовых станциях в северной (при массовом развитии Pleurosigma strigosum и видов рода Prorocentrum) и юго-восточной (при обильной вегетации Prorocentrum micans) частях лагуны (рис. 3г). Динофитовые и криптофитовые водоросли были значимыми по численности (рис. 2а), а динофитовые и диатомовые – по биомассе (рис. 2б).
В сентябре при температуре воды 16.0–16.8°С наблюдали второй пик биомассы (рис. 2б), который был связан с активной вегетацией динофлагелляты P. micans. Этот вид доминировал в лагуне, формируя до 99.8% численности и 99.9% биомассы. Его обильное развитие наблюдалось у поверхности воды в юго-западной и центральной восточной зонах (рис. 3д), где численность клеток водорослей достигала 428.22 тыс. кл./л, а биомасса – 2064.0 мг/м3. Доминирующей группой в это время являлись динофитовые (рис. 2а, 2б).
В октябре с понижением температуры воды (от 12°С) и уменьшением инсоляции количественные показатели фитопланктона в лагуне снижались. На большей части акватории биомасса в осенний период (октябрь−ноябрь) варьировала от 25 до 149 мг/м3. Однако в кутовой северо-восточной части лагуны, где в октябре в фитопланктоне преобладал вид P. micans, а в ноябре P. strigosum, биомасса превышала 200 мг/м3 (рис. 3е, 3ж).
Образование ледового покрова в феврале способствовало еще большему снижению количественных показателей фитопланктона (рис. 2а, 2б): средняя численность составляла 15.17 тыс. кл./л, средняя биомасса – 66.0 мг/м3. В это время были многочисленны колониальные виды диатомей из родов Actinoptychus, Aulacoseira, Plagiogrammopsis, Paralia, Navicula и Thalassiosira, а также представители криптофитовых и динофитовых водорослей. Комплекс доминирующих по биомассе формировали 3 вида, среди которых наибольшего развития на кутовых станциях в северной зоне достигал вид A. senarius, в северо-восточной зоне – Pronoctiluca pelagica, а в южной и центральной восточной зонах – Thalassiosira nordenskioeldii (рис. 3з).
ОБСУЖДЕНИЕ
Таксономический список микроводорослей планктона, сформированный по результатам наших исследований, показал, что по сравнению с другими водоемами подобного типа в юго-восточной части о-ва Сахалин (озера Птичье и Изменчивое) лагуна Буссе характеризуется наибольшим разнообразием видов. Анализ видовых списков по оригинальным данным, полученным в результате сборов материала, проведенных по единой схеме (ежемесячно в течение года на 5–6 станциях) в этих водоемах, позволяет предполагать, что увеличение видового состава связано с большей площадью и меньшей глубиной лагуны.
Особенности гидродинамического режима и донного рельефа определяют неоднородное распределение фитопланктона по акватории. Отмечено, что во все месяцы безледного периода, за исключением сентября, скопления биомассы фитопланктона были локализованы в восточной половине лагуны, где выражено влияние речного стока, способствующего опреснению, увеличению температуры воды и интенсивному поступлению биогенных элементов (Ефанов и др., 2016). Причем максимальные величины биомассы были характерны для кутовой северо-восточной зоны с песчано-илистыми грунтами, основными зарослями водорослей и минимальным перемешиванием водных масс. Наблюдаемое в сентябре смещение биомасс в южном направлении с наибольшими показателями в центральной восточной и юго-западной зонах связано с ветровым воздействием северного и северо-восточного направления (https://rp5.ru/). В районе протоки Суслова, характеризующейся высокой скоростью приливно-отливных течений, биомасса фитопланктона на протяжении всего периода наблюдений была пониженной.
При сравнении наших данных с результатами предыдущих исследований установлено, что среднемесячные количественные показатели, полученные нами, сопоставимы с данными конца 1970-х годов. Однако несколько изменился характер сезонной динамики видового состава, количественных показателей и комплекса доминирующих видов.
Согласно исследованиям 1970−1980-х годов, наиболее разнообразный видовой состав в лагуне наблюдался летом (июнь−начало сентября) и осенью (конец сентября−ноябрь) (Калганова, 1980). По нашим данным наибольшее количество видов приходилось на весну (май−июнь), тогда как лето (август−сентябрь) отличалось минимальным за весь период наблюдений набором видов.
Ранее были выделены 2–3 пика развития фитопланктона: в апреле, июле и октябре−ноябре. Весенний пик связан с развитием центрических холодноводных диатомей, летний – цианобактерий или мелких диатомей, а осенний – с развитием комплекса диатомовых и динофитовых водорослей. Летний пик не всегда проявлялся в сезонной динамике. Такая межгодовая изменчивость обусловлена влиянием речного стока, вариацией термического режима, наличием или полным отсутствием стратификации во всей водной толще и усиленным выеданием фитопланктона зоопланктерами. Весенний и осенний пики на протяжении многих десятков лет были стабильными (Калганова, 1980, 2010; Ефанов, Тепаева, 2014). В наших исследованиях осеннего подъема биомассы фитопланктона не наблюдалось. Из-за метеорологических условий (пониженный температурный фон по сравнению с таковым в сентябре в предыдущие годы и ливневые дожди) пик был сдвинут на более ранние сроки и связан с массовым развитием Prorocentrum micans. Полвека назад этот вид не был отмечен в водах лагуны (Калганова, 1980, 1986, 1995). Однако в последние 20 лет P. micans регистрировали в составе доминантного комплекса с высокой частотой встречаемости в осеннее время (Калганова, 2010; Ефанов, Тепаева, 2014).
Известно, что P. micans при обильной вегетации выделяет активные вещества, подавляющие рост и развитие диатомовых и динофитовых водорослей (Uchida, 1977; Гольдин, 2013), а также веслоногих рачков (Ianora et al., 1999). По-видимому, это стало основной причиной резкого уменьшения количества видов, численности и биомассы водорослей других отделов в августе и сентябре. Являясь вредоносным видом, P. micans способен вызывать обширное “цветение” воды во многих морях (Матишов, Фуштей, 2003; Terenko, 2019), часто приводящее к замору гидробионтов (рыб, моллюсков), связанному с гипоксией (Faust et al., 1999). Во время наших исследований “цветения” этот вид не вызывал, а его численность не превышала 428.22 тыс. кл./л. Тем не менее, появление P. micans в водах лагуны Буссе требует дальнейшего контроля за его развитием.
Значительные перестройки в структуре фитопланктона вызваны, на наш взгляд, как негативной антропогенной нагрузкой на экосистему лагуны (загрязнение сточными водами и промышленными отходами, беспощадным разрушением биоценозов промысловых беспозвоночных любительским и браконьерским ловом), так и природными факторами (заиление и обмеление некоторых участков лагуны, а также стимулирующее воздействие продуктов жизнедеятельности моллюсков на микроводоросли). В сентябре 2020 г. в соответствии с решением Министерства природных ресурсов и экологии РФ лагуне Буссе был присвоен статус природного парка. Возможно, это предотвратит назревающую угрозу экологического дисбаланса в водах водоема.
ЗАКЛЮЧЕНИЕ
Обнаружено 306 видов и внутривидовых таксонов микроводорослей. Видовое разнообразие фитопланктона лагуны Буссе определяют диатомовые и динофитовые водоросли. Среднегодовая численность фитопланктона составляет 46.08 тыс. кл./л, среднегодовая биомасса – 176.1 мг/м3.
Сезонная динамика численности и биомассы характеризуется двумя подъемами: весенним и летне-осенним. В отдельные годы наблюдается летний пик, зависящий, главным образом, от развития цианобактерий.
В годовом цикле развития по биомассе преобладают диатомовые и динофитовые водоросли. Причем последние наиболее значимы в летний и осенний периоды, а диатомовые – в зимний и весенний сезоны. Комплекс доминирующих видов по биомассе представлен 10 таксонами, среди которых A. senarius отличается наибольшей частотой доминирования.
Впервые в лагуне выявлено обильное развитие вредоносной динофлагелляты P. micans, максимальные количественные показатели которой зарегистрированы в сентябре в восточной и юго-западной зонах.
Наибольшая биомасса фитопланктона приурочена к северо-восточной части водоема, наименьшая – к району протоки Суслова.
Список литературы
Бровко П.Ф., Микишин Ю.А., Рыбаков В.Ф. и др. Лагуны Сахалина. Владивосток: ДВГУ. 2002. 80 с.
Генкал С.И., Трифонова И.С. Диатомовые водоросли планктона Ладожского озера и водоемов его бассейна. Рыбинск: Рыбинский Дом печати. 2009. 72 с.
Гольдин Е.Б. Биологическая активность микроводорослей и ее значение в межвидовых взаимоотношениях // Экосистемы, их оптимизация и охрана. 2013. Вып. 9. С. 49–76.
Диатомовые водоросли СССР (ископаемые и современные). СПб.: Наука. 1992. Т. II. Вып. 2. 125 с.
Ефанов В.Н., Выпряжкин Е.Н., Пономарева О.С., Латковская Е.М. Результаты исследований среды, опыт выращивания приморского гребешка в лагуне Буссе и организация “Биотехнопарка Сахалинский” // Лучшие практики рыбохозяйственного образования: Сб. материалов Всерос. научно-практ. школы–конференции (18–21 октября 2016 г.). СПб.: Изд-во ООО “ИНФОСТИ”. 2016. С. 36–62.
Ефанов В.Н., Тепаева А.Е. Сезонное развитие и количественные показатели фитопланктона лагуны Буссе // Перспективы науки. 2014. № 11(62). С. 24–30.
Калганова Т.Н. Сезонное распределение фитопланктона в лагуне Буссе (залив Анива) // Распределение и рациональное использование водных зооресурсов Сахалина и Курильских островов. Владивосток: ДВНЦ АН СССР. 1980. С. 3–7.
Калганова Т.Н. О питании приморского гребешка разных возрастных групп в лагуне Буссе (о. Сахалин) // Проблемы рационального использования промысловых беспозвоночных: Тез. докл. III Всесоюз. конф. 12–16 октября 1982 г. Калининград. 1982. С. 108–109.
Калганова Т.Н. Роль сезонной динамики планктона в питании приморского гребешка в лагуне Буссе (Южный Сахалин) // IV Всесоюз. конф. по промысловым беспозвоночным (тез. докл.). Севастополь, апрель 1986 г. Ч. II. М. 1986. С. 235–236.
Калганова Т.Н. Результаты исследования кормовой базы и питания приморского гребешка в лагуне Буссе (залив Анива) // Материалы XXX научно-методич. конф. преподавателей ЮСГПИ. Апрель, 1995 г. Докл. и тез. докл. Ч. II. Южно-Сахалинск: ЮСГПИ. 1995. С. 86–91.
Калганова Т.Н. О микро- и наннопланктоне лагуны Буссе (залив Анива) // IX Дальневост. конф. по заповедному делу. Владивосток, 20–22 октября 2010 г. Материалы конф. Владивосток: Дальнаука. 2010. С. 196–199.
Кольцова Т.И. Определение объема и поверхности клеток фитопланктона // Биол. науки. 1970. № 6. С. 114–120.
Коновалова Г.В. Структура планктонного фитоценоза залива Восток Японского моря // Биол. моря. 1984. № 1. С. 13–23.
Коновалова Г.В. Динофлагелляты (Dinophyta) дальневосточных морей России и сопредельных акваторий Тихого океана. Владивосток: Дальнаука. 1998. 398 с.
Коновалова Г.В., Орлова Т.Ю., Паутова Л.А. Атлас фитопланктона Японского моря. Л.: Наука. 1989. 157 с.
Коновалова Г.В., Селина М.С. Динофитовые водоросли (Dinophyta). Владивосток: Дальнаука. 2010. 352 с.
Макарова И.В., Пичкилы Л.О. К некоторым вопросам методики вычисления биомассы фитопланктона // Бот. журн. 1970. Т. 55. № 10. С. 1488–1494.
Матишов Г.Г., Фуштей Т.В. К проблеме вредоносных “цветений воды” в Азовском море // Электрон. журн. “Исследовано в России”. 2003. С. 213–225.
Морозова Т.В., Орлова Т.Ю. Мониторинг фитопланктона в районе хозяйства марикультуры в заливе Восток Японского моря // Биол. моря. 2005. Т. 31. № 1. С. 11–16.
адченко И.Г., Капков В.И., Федоров В.Д. Практическое руководство по сбору и анализу проб морского фитопланктона: Учебно-методич. пособ. для студентов биологических специальностей М.: Мордвинцев. 2010. 60 с
Селина М.С. Фитопланктон залива Восток Японского моря: Автореф. дис. … канд. биол. наук. Владивосток: Дальнаука. 1998. 25 с.
Тепаева А.Е., Калганова Т.Н. Развитие фитопланктона в лагуне Буссе летом 2011 года //Международ. журн. приклад. и фундамент. исслед. 2012. № 1–1. С. 104–106.
Федоров В.Д. О методах изучения фитопланктона и его активности. М.: Изд. МГУ. 1979. 166 с.
Чернышова Ю.С., Прохорова Н.Ю. Перспективы использования лагуны Буссе как природного источника для получения спата приморского гребешка Mizuhopecten yessoensis // Изв. ТИНРО. 2018. Т. 195. С. 219–228.
Шевченко О.Г., Масленников С.И., Бложко Т.В. Мониторинг потенциально токсичных микроводорослей в бухте Северной (Славянский залив) в 2008, 2009 гг. // Науч. тр. Дальрыбвтуза. 2011. Т. 24. С. 34–42.
Шпилько Т.С., Шевченко Г.В. Влияние приливо-отливной динамики на обмен меропланктона (Bivalvia, Gastropoda) между лагуной Буссе и прилегающей морской акваторией залива Анива // Изв. ТИНРО. 2018. Т. 195. С. 92–110.
Arzul G., Seguel M., Clément A. Effect of marine animal excretions on differential growth of phytoplankton species // ICES J. Mar. Sci. 2001. V. 58. P. 386–390.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. 2020. URL: https://www.algaebase.org/ on 2020-02-11.
Faust M., Larsen J., Moestrup Ø. Potentially toxic phytoplankton. 3. Prorocentrum (Dinophyceae) // ICES Identification Leaflets for Plankton. København, Denmark: Intern. Council for the Exploration of the Sea. 1999. № 184. P. 2–24.
Hoppenrath M., Elbrächter M., Drebes G. Marine phytoplankton. Selected microphytoplankton species from the North Sea around Helgoland and Sylt. Stuttgart, Germany: Scweizerbart Science Publishers. 2009. 264 p.
Horner R.A. A taxonomic guide to some common marine phytoplankton. Bristol: Biopress Ltd. 2002. 195 p.
Ianora A., Miralto A., Buttino I. et al. First evidence of some dinoflagellates reducing male copepod fertilization capacity // Limnol. Oceanogr. 1999. № 44. P. 147–153.
Lange-Bertalot H. Navicula sensu stricto, 10 genera separated from Navicula sensu lato, Frustulia. Diatoms of Europe: Diatoms of the European inland waters and comparable habitats. V. 2. Ruggell: Liechtenstein: Gantner Verlag. 2001. 526 p.
Terenko G.V. The influence of red tide on the contour biotopes of the sea //International scientific conference, dedicated to 95th Anniversary of Academician of the NAS of Ukraine, Yuvenaly Zaitsev “Achievements in studies of marginal effect in water ecosystems and their practical significance”: Book of abstracts (June 13–14, 2019, Odessa, Ukraine). Odessa: Institute of marine biology, NAS of Ukraine. 2019. P. 58.
Throndsen J., Hasle G.R., Tangen K. Phytoplankton of Norwegian coastal waters. Oslo: Almater Forlag. 2007. 343 p.
Hasle G.R., Syvertsen E.E. Marine diatoms. Ch. 2. Identifying Marine Diatoms and Dinoflagellates. San Diego, CA: Academic Press. 1996. P. 5–385.
Uchida T. Excretion of a diatom inhibitory substance by Prorocentrum micans Ehrenberg // Jap. J. Ecol. 1977. № 27. P. 1–4.
Дополнительные материалы отсутствуют.