Биология моря, 2021, T. 47, № 6, стр. 411-420
К вопросу об эффективности крупномасштабного заводского разведения кеты Oncorhynchus keta (Walbaum, 1792) на острове Итуруп (Курильские острова)
А. М. Каев 1, *, Л. В. Ромасенко 1, Д. А. Каев 2
1 Сахалинский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
693023 Южно-Сахалинск, Россия
2 Дальневосточный федеральный университет
690922 Владивосток, Россия
* E-mail: kaev@outlook.com
Поступила в редакцию 08.11.2020
После доработки 05.01.2021
Принята к публикации 17.02.2021
Аннотация
Известно, что за последние 20 лет выпуск молоди кеты с лососевых рыборазводных заводов на о-ве Итуруп увеличился более чем в 10 раз. Предполагается, что столь значительное наращивание объемов выпуска заводской молоди на о-ве Итуруп стало причиной уменьшения средней массы рыб и более высокого, чем на юге Сахалина, темпа снижения возврата производителей относительно численности выпускаемой молоди. На основе склеритограмм изучены особенности роста в первый год жизни молоди кеты, которая нагуливается в заливах о-ва Итуруп. Установлено, что замедление роста рыб, отмеченное при больших объемах выпущенной заводской молоди, происходит только в ранний морской период жизни, в то время как характер роста в открытых морских водах существенно не изменяется. Следовательно, доводы о переполнении лососями старше малькового возраста экологической емкости Северной Пацифики и прилегающих дальневосточных морей представляются необоснованными.
На Дальнем Востоке России Сахалино-Курильский регион многие десятилетия остается лидером по объемам заводского разведения горбуши Oncorhynchus gorbuscha (Walbaum, 1792) и кеты O. keta (Walbaum, 1792) (Марковцев, 2011). Однако дискуссии об эффективности лососевых рыборазводных заводов (ЛРЗ) еще продолжаются. Несмотря на положительные оценки заводского разведения горбуши (Рухлов, Шубин, 1986; Хоревин, 1994; Романчук, 2000), сомнения вызывает отсутствие значимых возвратов рыб в районы расположения ЛРЗ в случаях резкого сокращения численности молоди, скатывающейся с естественных нерестилищ. Ни в одном из районов разведения кеты за период 1970–1995 гг. не обнаружено статистически значимой положительной корреляции между выпусками молоди и последующими уловами. Более того, после замены в 1960-х годах в бассейне р. Найба на юго-восточном побережье Сахалина естественного воспроизводства кеты крупномасштабным заводским разведением местное стадо кеты в последующие годы фактически перестало фигурировать как единица промыслового запаса. Попытки исправить положение за счет инкубации на ЛРЗ икры, привозимой с о-ва Итуруп, не принесли положительного результата (Kaev, 2012).
Ситуация начала коренным образом меняться в 1990-х годах благодаря реконструкции действующих ЛРЗ (в том числе систем водоснабжения), совершенствованию биотехники разведения, переводу части предприятий на самостоятельную хозяйственную деятельность и строительству новых ЛРЗ с частной формой собственности (Каев, Игнатьев, 2015). Предпочтение в разведении стали отдавать кете, которая в отличие от горбуши служит идеальным объектом для пастбищного лососеводства. Молодь кеты, как и молодь горбуши, скатывается в море на первом году жизни, однако она активно питается в пресных водах, что позволяет успешно менять сроки ее подкормки для достижения наибольшего успеха при выпуске в природную среду. Кроме того, сравнительно короткие сроки выращивания молоди кеты при обильном и качественном водоснабжении во многом снижают риски эпизоотий. В Японии использование такого подхода позволило увеличить уловы кеты с 30 тыс. т в 1970 г. до 235 тыс. т в начале XXI века (Eggers et al., 2005). Существенные успехи достигнуты и в Сахалино-Курильском регионе. Вылов кеты (преимущественно в районах расположения ЛРЗ) увеличился (в среднем) с 2367 т в 1986–1990 гг. до 25936 т в 2008–2013 гг. Рост уловов произошел в основном за счет повышения жизнестойкости выпускаемой молоди; на некоторых ЛРЗ индексы выживаемости рыб в течение морского периода жизни достигли мирового уровня (Каев, Игнатьев, 2015).
Эти успехи основаны на использовании заводами пастбищного принципа, когда выращенных в заводских условиях мальков выпускают в естественную среду обитания для нагула и дальнейшей жизни. Поэтому нельзя исключить, что в определенной ситуации наращивание объемов выпуска молоди может спровоцировать действие факторов, связанных с плотностью. Некоторые исследователи считают, что снижение размеров тела, наблюдаемое у многих популяций разных видов лососей по обоим побережьям Северной Пацифики, связно с фактическим удвоением численности лососевых рыб в результате реализации с начала 1980-х годов программ по восстановлению их запасов (Bigler et al., 1996; Гриценко и др., 2000; Кловач, 2003). Однако до сих пор не получено каких-либо достоверных фактов, подтверждающих, что именно пищевой фактор жестко лимитирует численность лососевых рыб в открытых морских водах (Шунтов и др., 2010, 2019; Волков, 2016).
Цель данного исследования – оценка состояния стада кеты о-ва Итуруп в условиях наращивания объемов заводского разведения на основе (а) анализа выживаемости и массы тела вернувшихся на о-в Итуруп производителей по сравнению с аналогичными показателями на юго-западном и юго-восточном побережьях о-ва Сахалин, где развитие заводского разведения этого вида менее интенсивно; (б) изучения по склеритограммам особенностей роста в течение первого года жизни кеты и горбуши, которые обитают в совместных скоплениях сначала как мальки в прибрежных водах о-ва Итуруп, а затем как сеголетки в открытых водах Охотского моря.
МАТЕРИАЛ И МЕТОДИКА
Для анализа межгодовых изменений выживаемости и размеров тела кеты привлечены данные по количеству молоди, выпущенной с ЛРЗ, по численности вернувшихся производителей (далее – возвратов) и средней массе тела кеты, полученные при подготовке ежегодных статистических документов Северотихоокеанской комиссии по анадромным рыбам (http://www.npafc.org/new/pub_documents.html). Возврат производителей кеты в нерестовые или базовые заводские реки происходит в возрасте от 2+ до 6+ лет. Для характеристики выживаемости отдельных поколений обычно применяют коэффициент возврата – процентное отношение численности вернувшихся рыб всех возрастных групп изучаемого поколения к соответствующей численности выпущенной молоди. Согласно нашим расчетам, основанным на фондовых материалах Сахалинского филиала ВНИРО, в возвратах основная часть рыб представлена возрастными группами 3+ и 4+, доли которых на о-ве Итуруп в среднем составляют соответственно 65.3 и 28.8%, на юго-восточном побережье о-ва Сахалин 68.5 и 25.1%, а на его юго-западном побережье 26.8 и 61.0%. Но даже на юго-западном побережье, где в возвратах доминируют пятилетки, отмечается достоверная зависимость (R2 = 0.68) между суммарной численностью трехлеток и четырехлеток, а также суммарной численностью рыб более старшего возраста (Каев, Игнатьев, 2013). Поэтому при анализе соотношения между скатом и возвратом для привлечения данных о последних еще не полностью вернувшихся поколениях использовали условный показатель – отношение суммарной численности рыб в нерестовой части популяции в годы возврата четырехлеток соответствующих поколений к количеству выпущенной молоди.
Чешую у кеты и горбуши собирали по общепринятой методике (McLellan, 1987) из уловов закидным неводом в устье р. Рыбацкая и расположенных вблизи ставных неводов (около 8 км в средней части побережья зал. Курильский). Ретроспективную оценку роста четырехлеток кеты по первой годовой зоне (ПГЗ) роста чешуи проводили по методике, отработанной на горбуше (Каев, 2015а). Межсклеритные расстояния на чешуе измеряли в направлении наибольшего радиуса, начиная со второго склерита. Первый склерит (центральную чешуйную пластинку) не измеряли, чтобы избежать возможных ошибок из-за разной степени деформации центра чешуи, присущей в той или иной степени всем рыбам на завершающих этапах нерестовой миграции лососей. Межсклеритные расстояния представлены в процентах к величине радиуса ПГЗ, начиная со второго склерита. Чтобы унифицировать полученные данные с данными предыдущих лет, за окончание ПГЗ принимали последний из четырех смежных склеритов с наименьшей суммой межсклеритных расстояний. В соответствии с этой методикой измеряли ПГЗ на чешуе у четырехлетних особей кеты из возвратов в зал. Курильский о-ва Итуруп соответственно в 2017 (28 экз.), 2018 (99 экз.) и 2019 (139 экз.) годах. Пересчитали, исключая радиус центральной чешуйной пластинки, ранее полученные данные измерений чешуи четырехлеток кеты в этом же районе в 2002 г. (59 экз.), 2004 г. (71 экз.) и 2006 г. (70 экз.).
Измерения чешуи и расчеты приростов длины горбуши, пойманной в 2011, 2014, 2015, 2017–2019 гг. (соответственно 147, 241, 238, 194, 152, 241 экз.) проводили по стандартной методике (Каев, 2015б).
Количество склеритов на чешуе разных рыб неодинаково, поэтому для сопоставления склеритограмм ПГЗ число склеритов нормировали к единому часто встречавшемуся у рыб этих видов значению: у кеты – к 27, а у горбуши – к 23 (Каев, 2003, 2015а).
Количество проанализированных образцов чешуи зависело от объема собранных проб и от качества чешуи. У ряда образцов наблюдали не только деформацию, но и разрушение центральной части чешуи. Чаще всего чешуя с разрушенной центральной частью встречалась у кеты; ранее это считали характерным признаком рыб, происходящих с ЛРЗ о-ва Хоккайдо (Bigler, 1988). Однако подобное повреждение чешуи обнаружено и у кеты на о-ве Итуруп (многолетние неопубликованные наблюдения А.М. Каева). В 2017 г. было проанализировано небольшое число образцов, что связано как с повреждением чешуи, так и с низкой долей четырехлетних рыб в этом году. Однако анализ массивов данных по величине межсклеритных расстояний показал, что даже в этой малой выборке 24 из 27 эмпирических распределений статистически не отличались от нормального (значения p в пределах от 0.195 до 0.820). В остальных трех распределениях уровень отличия от нормального превышал только первый статистический уровень значимости (p от 0.016 до 0.048). Это близко к результатам анализа больших по объему выборок кеты в другие годы: из 130 эмпирических распределений 111 статистически не отличались от нормального (p от 0.0521 до 0.9363), в 15 распределениях уровень отличия от нормального превысил первый (p от 0.0184 до 0.0477) и только в четырех распределениях – второй статистический уровень значимости (p от 0.0012 до 0.0071). Такая же ситуация отмечена и для горбуши, у которой 123 эмпирических распределения статистически не отличались от нормального (p от 0.0570 до 0.9930), в восьми распределениях уровень отличия от нормального превысил первый (p от 0.0180 до 0.0429) и только в одном распределении – второй статистический уровень значимости (p = 0.0014), что приемлемо для биологических исследований (Плохинский, 1970). Статистическая обработка материалов проведена в среде Windows в программе Microsoft Office Excel. Проверка данных на соответствие нормальному распределению (по критерию χ2) выполнена с применением компьютерной программы “Statistica”. Для суждения о степени расхождения фрагментов кривых роста из разных выборок при их попарном сравнении оценивали достоверность различия по критерию Фишера (F) между средними значениями приростов за время формирования соответствующих склеритов.
РЕЗУЛЬТАТЫ
До 2000 г. на о-ве Итуруп действовали всего два ЛРЗ (Курильский и Рейдовый), выпускавшие молодь кеты в заливы Курильский и Простор; в 2010 г. число ЛРЗ достигло 8, а в 2020 г. – 18 (рис. 1). В конце прошлого столетия в среднем выпускали по 10.1 млн мальков, в начале нынешнего столетия – по 40.6 млн, в 2010 г. количество молоди превысило 100 млн, а в 2020 г. достигло 300 млн особей (рис. 2а). На Сахалине увеличение численности выпусков молоди кеты было значительно менее интенсивным: на юго-западном побережье в 1991–2000 гг. выпустили в среднем за год по 74.7 млн, в 2001–2010 гг. – по 76.9 млн, в 2011–2020 гг. – по 103.4 млн мальков; на юго-восточном побережье в эти же периоды выпустили соответственно по 40.1, 79.2 и 116.4 млн мальков. Причем, если на Сахалине 16 ЛРЗ, выпускающих молодь кеты на юго-западном побережье, рассредоточены по рекам на протяжении примерно 175 км, а 11 ЛРЗ на юго-восточном побережье на протяжении 135 км, то на о-ве Итуруп 88% молоди кеты выпускают на сравнительно небольшую акваторию средней части охотоморского побережья острова (заливы Куйбышевский, Курильский и кутовая часть зал. Простор) с расстоянием между устьями крайних базовых рек 5, 9 и 10 км соответственно.
Рис. 1.
Карта-схема расположения на о-ве Итуруп лососевых рыборазводных заводов, выпускавших молодь кеты Oncorhynchus keta в 2017–2020 гг. Обозначения: объем от 0.2 до 1.4 млн экз. – мелкие кружки, от 6 до 19 млн экз. – средние и от 19 до 42 млн экз. − крупные.
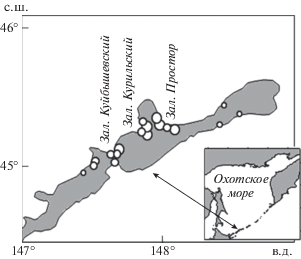
Рис. 2.
Количество выпускаемой молоди кеты Oncorhynchus keta в 2001–2020 гг. (а) и относительная численность взрослых рыб в возвратах через 3 года (б) на о-ве Итуруп (1), юго-восточном (2) и юго-западном (3) побережьях о-ва Сахалин.

Ни в одном из рассматриваемых районов возврат рыб дикого происхождения не создает существенных помех для анализа относительной величины возврата выпущенной заводской молоди. На юго-западном и юго-восточном побережьях Сахалина промысловые уловы кеты представлены рыбами заводских популяций. В некоторых реках, где отсутствуют ЛРЗ, отмечены заходы немногочисленных производителей этого вида, часть которых, по-видимому, результат стреинга рыб заводского происхождения. Дикие рыбы в значимом количестве представлены только в возвратах кеты на о-ве Итуруп, однако изменение их количества заметно сказывалось на расчетах коэффициента возврата заводских популяций только в 1990-х годах, когда численность заводской молоди сильно варьировала и была сопоставима с величиной ската молоди с нерестилищ. Устойчивое наращивание количества выпускаемой заводской молоди в последующие годы привело к тому, что доля мальков, скатывающихся с нерестилищ, стала незначительной. Например, в 2014–2018 гг. в зал. Курильский с ЛРЗ выпускали в среднем по 72.4 млн мальков, а численность покатников с нерестилищ по экспертной оценке составляла лишь 7.3 млн экз. Разница в соотношении диких и заводских рыб в возвратах, по-видимому, была еще больше, так как с ЛРЗ выпускают подращенных мальков, а с нерестилищ часть молоди скатывается с не полностью рассосавшимся желточным мешком (Каев, 2003).
Сопоставление трендов соотношения выпусков молоди и последующих возвратов взрослых рыб показало, что у кеты на юго-западном и юго-восточном побережьях Сахалина относительные возвраты сначала возрастали и были наибольшими от выпусков молоди в 2003–2011 гг., а затем этот показатель снижался. Процесс роста возвратов кеты начал развиваться и на о-ве Итуруп (судя по наибольшим значениям возвратов от выпусков молоди в 2005–2006 гг.), однако вскоре последовал устойчивый спад относительных значений возврата (рис. 2б).
Во всех рассматриваемых районах наблюдалось уменьшение массы тела кеты (рис. 3). При этом темп снижения массы рыб на обоих побережьях южной части о-ва Сахалин был примерно одинаковым, а кета о-ва Итуруп мельчала заметно быстрее, о чем можно судить по коэффициентам, характеризующим степень наклона линейных трендов, рассчитанных для 2001–2020 гг. для кеты о-ва Итуруп (Y = –74.28x + 152 728), юго-западного (Y = –48.37x + 100 519) и юго-восточного (Y = –35.84x + 75 102) побережья о-ва Сахалин.
Рис. 3.
Изменение средней массы кеты Oncorhynchus keta на о-ве Итуруп (1), юго-восточном (2) и юго-западном (3) побережьях о-ва Сахалин в 2001–2020 гг.

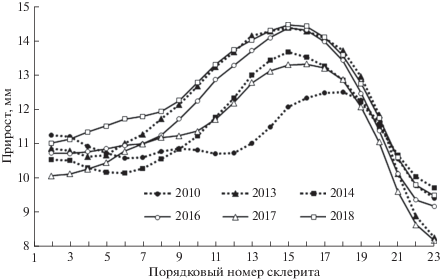
Профили склеритограмм указывают на существенные изменения роста кеты о-ва Итуруп, произошедшие у последних поколений, молодь которых нагуливалась в прибрежных водах острова в 2014, 2015 и 2016 гг., по сравнению с поколениями с нагулом молоди соответственно в 1999, 2001 и 2003 гг. (рис. 4). Судя по первым девяти межсклеритным расстояниям, различия в скорости роста, оцененные по критерию Фишера (F) от 10.26 (p < 0.01) до 22.35 (p < 0.001) или в среднем 15.53 (p < 0.001), в этот период у молоди были довольно велики в 1999, 2001 и 2003 гг. Однако они в несколько раз меньше, чем при попарном сопоставлении такого же сочетания межсклеритных расстояний между поколениями данной группы и рыб, нагуливавшихся в прибрежных водах острова в 2014, 2015 и 2016 гг. (F от 45.81 до 149.87, в среднем 90.05; во всех случаях p < 0.001). В то же время межгодовые различия в росте рыб в прибрежных водах у молоди второй группы оказались кардинально меньше; значения F варьировали от 0.15 (p > 0.05) до 7.35 (p < 0.01) и в среднем составляли 3.54 (p > 0.05).
Рис. 4.
Изменение межсклеритных расстояний в первой годовой зоне у четырехлеток кеты Oncorhynchus keta о-ва Итуруп при нагуле в Охотском море.
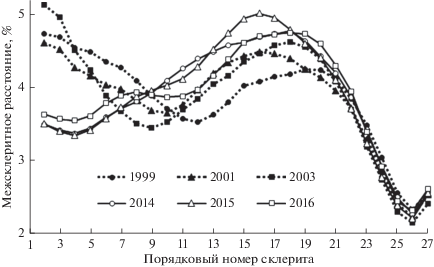
У молоди горбуши в последние годы также отмечено изменение конфигурации в профиле кривых роста при нагуле в прибрежных водах о-ва Итуруп (рис. 5). В результате слабых приростов при формировании первых склеритов по сравнению с таковым последующих исчез локальный минимум на кривых, характерный для предыдущих поколений в период откочевки мальков в открытые морские воды (между 4 и 7 склеритами). В то же время приросты у сеголеток последних трех поколений в открытых морских водах в среднем были выше, чем у предыдущих поколений, что, вероятно, и послужило причиной искусственного завышения у них расчетной длины мальков при формировании первого склерита.
ОБСУЖДЕНИЕ
Отмеченные расхождения трендов соотношения выпусков заводской молоди и последующих возвратов кеты в подавляющей степени определяются условиями выживания в ранний морской период жизни, так как уже во второй половине первого года нагула молодь горбуши и кеты разных стад охотоморского бассейна находится в едином огромном скоплении в центрально-южной части Охотского моря, а при первой зимовке – в океане (Шунтов, Темных, 2008, 2011). На решающее значение раннего морского периода жизни в формировании численности лососей разных стад давно обращали внимание (Parker, 1962; Ricker, 1964; Шершнев, 1975; Каев, 1979, 2003; Heard, 1991; Карпенко, 1998). Эта точка зрения превалирует и в настоящее время, несмотря на появление гипотезы о двух критических периодах и критических размерах лососей в течение морского периода жизни (Beamish, Mahnken, 2001; Howard et al., 2016), так как при отсутствии непосредственных доказательств значимость второго критического периода и критического размера рыб остается дискуссионной (Beacham et al., 2018). Важность периода прибрежного морского обитания для формирования численности поколений показана для горбуши о-ва Итуруп (Kaev, Irvine, 2016) − вида, который покидает эти воды раньше, чем кета, уходя в районы обширного нагула в открытом море. Показанная значимость прибрежного периода жизни для становления численности поколений лососей позволяет предположить, что начавшееся с 2007 г. снижение на о-ве Итуруп относительных возвратов кеты связано с нарастанием плотности скоплений молоди в его заливах.
Размеры рыб – один из индикаторов условий их обитания, поэтому рост считается одним из важнейших атрибутов динамики стада (Никольский, 1974). В 1980-х годах было замечено снижение размеров лососей, в том числе и кеты разных популяций, по азиатскому (Каев, 1994; Kaeriyama, 1996) и американскому (Bigler, Helle, 1994; Helle, Hoffman, 1995) побережьям северной части Тихого океана. Высказывалось предположение, что наблюдаемое снижение размеров тела у разных видов лососей – результат фактического удвоения с начала 1980-х годов численности рыб в ходе реализации программ по восстановлению их запасов (Bigler et al., 1996; Гриценко и др., 2000). Действительно, суммарный выпуск заводской молоди лососей с начала 1970-х годов (0.9 млрд экз.) увеличился в 5 раз к началу 1990-х годов (5.1 млрд экз.), причем на азиатском побережье рост был связан в основном с выпуском молоди кеты в Японии – с 0.5 до 2.1 млрд экз. (Irvine et al., 2012).
На наш взгляд, более важную роль могло сыграть устойчивое потепление атмосферы и гидросферы северной части Тихого океана, начавшееся с середины ХХ столетия. Изменения происходили не равномерно, а ступенчато, с резкими переходами от одного климатического состояния к другому. Наиболее важные “климатические сдвиги” произошли в 1977 и 1989 гг., в первом случае наблюдался положительный “сдвиг”, а во втором – отрицательный. Изменения, произошедшие в последние годы, позволяют говорить о переходе в новую климатическую эпоху, более теплую, чем предыдущие два десятилетия (Хен и др., 2019). Тенденция к снижению размеров тела кеты с начала 1980-х годов появилась после первого “климатического сдвига”. В 1990-х годах в северо-западной части Тихого океана сохранялась высокая численность кеты и началось значительное увеличение численности горбуши, однако в эти годы произошло изменение тренда размеров тела кеты с отрицательного на положительный (Kaev, Romasenko, 2003). В нынешнем столетии тренд размеров тела кеты вновь сменился на отрицательный. Судя по изменениям средней массы кеты в рассматриваемых нами стадах (см. рис. 3), этот тренд развивается и в настоящее время. К отмеченным климатическим процессам можно добавить замеченные в начале 1990-х годов крупные перестройки в составе и структуре зоопланктонных и нектонных сообществ, причина которых лежит в плоскости законов и принципов цикличности природных процессов и явлений, связанных с глобальными изменениями климата (Шунтов, 1994, 2000, 2001; Иванов, 1998), что также могло отразиться на росте лососей.
На размерах тела кеты в возвратах может существенно сказываться скорость роста молоди кеты в прибрежных морских водах. Даже на расположенном рядом о-ве Кунашир кета значительно мельче, чем на о-ве Итуруп, что связано с ее медленным ростом в менее богатых кормовыми ресурсами прибрежных кунаширских водах (Каев, Ромасенко, 2017). Более того, даже в пределах острова кета на охотоморском побережье Кунашира несколько крупнее; у нее в ПГЗ роста чешуи на 1 склерит больше, чем у рыб на океанском побережье, что связано с ускорением роста рыб на охотоморском побережье благодаря проникающим сюда теплым водам Цусимского течения (Каев, 1998). В дальнейшем рыбы растут в совместных скоплениях в центрально-южной части Охотского моря в сравнительно близких для разных популяций условиях нагула, а затем – в океанских водах. Заметим, что многие годы кета о-ва Итуруп была существенно крупнее кеты южной части о-ва Сахалин, что связано с благоприятными условиями нагула молоди в прибрежных водах о-ва Итуруп (Каев, 2003). Однако в настоящее время масса тела рыб этих стад почти не различается, и это сложно объяснить, учитывая специфические условия обитания кеты о-ва Итуруп, сложившиеся именно для нее в открытых морских и океанских водах. В то же время данный процесс по времени совпал с интенсивным наращиванием объемов заводского разведения кеты на этом острове, что привело к созданию в прибрежье моря сверхплотных скоплений молоди и, как следствие, к замедлению ее роста.
Это замедление хорошо видно при сопоставлении склеритограмм ПГЗ чешуи четырехлеток кеты разных поколений (рис. 4). Профиль склеритограмм у поколений, молодь которых нагуливалась в зал. Курильский в 1999, 2001 и 2003 гг., полностью соответствует профилю склеритограмм у молоди, нагуливавшейся в этом заливе в 1994 г. (Каев, 1998), и указывает на быстрый рост молоди в прибрежных водах. В процессе откочевки темп роста кеты постепенно снижается, однако, достигнув центрально-южной части Охотского моря, рыбы снова вступают в период быстрого роста. У молоди последних поколений наблюдается резкое замедление роста в прибрежье, в то время как профиль склеритограмм, характеризующий обитание молоди в центрально-южной части моря, остается прежним. При внешнем сходстве склеритограмм у четырехлеток кеты первых трех поколений выявлены статистически достоверные различия по ширине межсклеритных расстояний, формировавшихся при нагуле в прибрежных водах в разные годы. Отчасти такие различия в росте молоди разных поколений могут быть обусловлены плотностью зоопланктона в прибрежных водах острова, заметно меняющейся год от года в зависимости от притока водных масс разного происхождения. Однако в большинстве случаев эти изменения не носили фатального характера благодаря лабильности питания мальков. Лишь в отдельных случаях, судя по переходу на питание нехарактерными в обычной ситуации мелкими объектами и по снижению показателей накормленности, отмечали дефицит пищи, который отражался на показателях роста молоди (Каев, 2003).
Исследования особенностей питания, в результате которых в 2015 г. впервые зафиксирована ситуация с голоданием молоди кеты и горбуши из-за недостатка кормовых объектов (Чебанова и др., 2018), недавно были возобновлены. Все последние рекордные по величине выпуска с ЛРЗ поколения кеты характеризовались слабым ростом молоди при формировании первых склеритов. Одновременно уменьшились и межгодовые различия в росте молоди вплоть до статистически незначимых величин. Вероятно, в сверхплотных скоплениях молоди в прибрежных водах о-ва Итуруп межгодовые изменения условий обитания не так заметно отражаются на росте рыб.
В последние годы рекордно высокие выпуски на о-ве Итуруп заводской молоди кеты в сочетании с высокой численностью молоди горбуши (в 2011–2020 гг. с нерестилищ скатывалось в среднем по 289 млн экз., в дополнение к которым с ЛРЗ выпускали в среднем по 116 млн мальков горбуши) привели к замедлению роста у последних поколений молоди горбуши в прибрежных водах острова (рис. 5). Как правило, в прибрежных водах молодь горбуши питается преимущественно крупными формами калянид, а кета чаще переходит на питание другими объектами. Принято считать, что если при переходе кеты на питание другими объектами снижается накормленность мальков, значит переход обусловлен дефицитом крупных калянид, в добывании которых горбуша имеет преимущество благодаря высокой численности и более быстрому росту, чем у кеты (Каев, 2003). В настоящее время, судя по синхронному снижению темпов роста в прибрежных водах острова у обоих видов, в связи с большими выпусками с ЛРЗ предварительно подращенной молоди кеты ситуация изменилась. Как и у кеты, замедление роста молоди горбуши последних поколений произошло только в ранний морской период жизни, темпы роста рыб в центральной-южной части Охотского моря остались на уровне предыдущих поколений. Необычным выглядит лишь рост сеголеток в открытых морских водах в 2010 г., однако это не связано с плотностью рыб. Такая же аномалия в росте, отмеченная в 2010 г. у горбуши юго-восточного побережья Сахалина, связана не с переходом на питание второстепенными кормовыми объектами, а прежде всего с аномально выраженным прогревом поверхностных вод в центрально-южной части Охотского моря (Каев, 2015б).
Полученные результаты позволяют заключить, что значительное увеличение выпусков молоди кеты на довольно ограниченную акваторию (центральная часть охотоморского побережья о-ва Итуруп) привело к возрастанию в динамике стада роли факторов, связанных с плотностью, что обусловило уменьшение выживаемости и размеров тела рыб в морском периоде жизни. Судя по профилям склеритограмм ПГЗ, у молоди кеты, как и у обитающей совместно с ней молоди горбуши, снижение темпов роста наблюдалось только при нагуле в прибрежных водах острова; в открытых морских водах характер роста у данных видов не изменился. Эти выводы соответствуют основанной на результатах многолетних комплексных экосистемных исследований точке зрения об отсутствии существенных оснований для высказываний о переполнении лососями старше малькового возраста экологической емкости Северной Пацифики и прилегающих дальневосточных морей (Шунтов и др., 2010, 2017, 2019).
Список литературы
Волков А.Ф. Элементарная трофология тихоокеанских лососей в Беринговом море. Видовые и региональные отличия. Обеспеченность пищей при различных условиях среды // Изв. ТИНРО. 2016. Т. 187. С. 162–186.
Гриценко О.Ф., Заварина Л.О., Ковтун А.А., Путивкин С.В. Экологические последствия крупномасштабного искусственного разведения кеты // Промыслово-биологические исследования рыб в тихоокеанских водах Курильских островов и прилежащих районах Охотского и Берингова морей в 1992–1998 гг. М.: ВНИРО. 2000. С. 241–246.
Иванов О.А. Эпипелагическое сообщество рыб и головоногих моллюсков прикурильских вод Тихого океана в 1986–1995 гг. // Изв. ТИНРО. 1998. Т. 124. С. 3–54.
Каев А.М. Некоторые особенности роста молоди осенней кеты Oncorhynchus keta (Walbaum) в прибрежье о. Итуруп // Вопр. ихтиологии. 1979. Т. 19. Вып. 5. С. 853–859.
Каев А.М. Только ли морской промысел определяет “недоловы” кеты? // Рыб. хоз-во. 1994. № 4. С. 28–30.
Каев А.М. Идентификация происхождения и истории жизни охотоморской кеты Oncorhynchus keta по чешуе // Вопр. ихтиологии. 1998. Т. 38. № 5. С. 650–658.
Каев А.М. Особенности воспроизводства кеты в связи с ее размерно-возрастной структурой. Южно-Сахалинск: Изд-во СахНИРО. 2003. 288 с.
Каев А.М. Ретроспективная оценка роста горбуши Oncorhynchus gorbuscha по чешуе: региональная изменчивость // Вопр. ихтиологии. 2015а. Т. 55. № 3. С. 298–312.
Каев А.М. Ретроспективная оценка роста горбуши Oncorhynchus gorbuscha по чешуе: межгодовая изменчивость // Вопр. ихтиологии. 2015б. Т. 55. № 5. С. 570–585.
Каев А.М., Игнатьев Ю.И. Методические аспекты прогнозирования численности кеты заводского происхождения в Сахалинской области // Изучение тихоокеанских лососей на Дальнем Востоке. 2013. Бюл. № 8. С. 72–82.
Каев А.М., Игнатьев Ю.И. Развитие заводского разведения тихоокеанских лососей в Сахалино-Курильском регионе и его значение для промысла // Тр. ВНИРО. 2015. Т. 153. С. 95–104.
Каев А.М., Ромасенко Л.В. Горбуша и кета острова Кунашир (структура популяций, воспроизводство, промысел). Южно-Сахалинск: Изд-во СахГУ. 2017. 124 с.
Карпенко В.И. Ранний морской период жизни тихоокеанских лососей. М.: Изд-во ВНИРО. 1998. 165 с.
Кловач Н.В. Экологические последствия крупномасштабного разведения кеты. М.: Изд-во ВНИРО. 2003. 164 с.
Марковцев В.Г. Современное состояние и перспективы разведения лососей на Дальнем Востоке // Изучение тихоокеанских лососей на Дальнем Востоке. 2011. Бюл. № 6. С. 170–183.
Никольский Г.В. Теория динамики стада рыб. М.: Пищевая пром-ть. 1974. 448 с.
Плохинский Н.А. Биометрия. М.: Изд-во МГУ. 1970. 367 с.
Романчук Е.Д. Взаимодействие смешанных популяций горбуши искусственного и естественного воспроизводства в Сахалино-Курильском бассейне // Вопросы взаимодействия естественных и искусственных популяций лососей. Хабаровск: ХоТИНРО. 2000. С. 96–102.
Рухлов Ф.Н., Шубин А.О. О промысловом возврате горбуши заводского происхождения // Марикультура на Дальнем Востоке. Владивосток: ТИНРО. 1986. С. 3–12.
Хен Г.В., Устинова Е.И., Сорокин Ю.Д. Изменчивость и взаимосвязь основных климатических индексов для северной части Тихого океана: тренды, климатические сдвиги, спектры, корреляции // Изв. ТИНРО. 2019. Т. 199. С. 163–178.
Хоревин Л.Д. Значение разведения лососей для поддержания их запасов в Сахалинской области // Систематика, биология и биотехника разведения лососевых рыб. СПб.: ГосНИОРХ. 1994. С. 204–206.
Чебанова В.В., Френкель С.Э., Зеленихина Г.С. Связь питания молоди кеты Oncorhynchus keta и горбуши O. gorbuscha с обилием зоопланктона в прибрежье залива Простор (о. Итуруп) // Вопр. ихтиологии. 2018. Т. 58. № 5. С. 608–616.
Шершнев А.П. Биология молоди кеты из прибрежных вод юго-восточной части Татарского пролива // Лососевые Дальнего Востока: Тр. ВНИРО. 1975. Т. 106. С. 58–66.
Шунтов В.П. Новые данные о перестройках в пелагических экосистемах дальневосточных морей // Вестн. ДВО РАН. 1994. № 2. С. 59–66.
Шунтов В.П. Результаты изучения макроэкосистем дальневосточных морей России: задачи, итоги, сомнения // Вестн. ДВО РАН. 2000. № 1. С. 19–29.
Шунтов В.П. Биология дальневосточных морей России. Владивосток: Изд-во ТИНРО-центра. 2001. Т. 1. 580 с.
Шунтов В.П., Темных О.С. Тихоокеанские лососи в морских и океанических экосистемах. Владивосток: Изд-во ТИНРО-центра. 2008. Т. 1. 481 с.
Шунтов В.П., Темных О.С. Тихоокеанские лососи в морских и океанических экосистемах. Владивосток: Изд-во ТИНРО-центра. 2011. Т. 2. 473 с.
Шунтов В.П., Темных О.С., Иванов О.А. Об устойчивости стереотипов в представлении о морской экологии тихоокеанских лососей (Oncorhynchus spp.) // Изв. ТИНРО. 2017. Т. 188. С. 3–36.
Шунтов В.П., Темных О.С., Найденко С.В. и др. К обоснованию экологической емкости дальневосточных морей и субарктической Пацифики для пастбищного выращивания тихоокеанских лососей. Сообщ. 4. Влияние фактора плотности на обеспеченность тихоокеанских лососей пищей и их роль в потреблении кормовой базы нектона // Изв. ТИНРО. 2010. Т. 161. С. 25–52.
Шунтов В.П., Темных О.С., Найденко О.С. Еще раз о факторах, лимитирующих численность тихоокеанских лососей (Oncorhynchus spp., сем. Salmonidae) в океанический период их жизни // Изв. ТИНРО. 2019. Т. 196. С. 3–22.
Beacham T.D., Araujo H.A., Tucker S., Trudel M. Validity of inferring size-selective mortality in Pacific salmon from scale circulus spacing // First NPAFC-IYS Workshop on Pacific Salmon Production in a Changing Climate, Khabarovsk, Russia, May 26–27, 2018 / North Pacific Anadromous Fish Commission Technical. Report № 11. Vancouver: North Pac. Anadromous Fish Comm. 2018. P. 56–58.
Beamish R.J., Mahnken C. A critical size and period hypothesis to explain natural regulation of salmon abundance and the linkage to climate and climate change // Prog. Oceanogr. 2001. V. 49. № 1–4. P. 423–437.
Bigler B. Focal scale damage among chum salmon (Oncorhynchus keta) of Hokkaido, Japan // Can. J. Fish. Aquat. Sci. 1988. V. 45. № 4. P. 698–704.
Bigler B.S., Helle J.H. Decreasing size of North Pacific salmon (Oncorhynchus sp.): possible causes and consequences // North Pac. Anadromous Fish Comm. Doc. 1994. № 61. P. 1–34.
Bigler B.S., Welch D.W., Helle J.H. A review of size trends among North Pacific salmon (Oncorhynchus spp.) // Can. J. Fish. Aquat. Sci. 1996. V. 53. № 2. P. 455–465.
Eggers D.M., Irvine J.R., Fukuwaka M., Karpenko V.I. Catch trends and status of North Pacific salmon // North Pac. Anadromous Fish Comm. Doc. 2005. № 723. P. 1–35.
Heard W.R. Life history of pink salmon (Oncorhynchus gorbuscha) // Pacific salmon life histories. Vancouver: UBC Press. 1991. P. 119–230.
Helle J.H., Hoffman M.S. Size decline and older age at maturity of two chum salmon (Oncorhynchus keta) stocks in western North America, 1972–92 // Climate Change and Northern Fish Populations / Canadian Special Publication of Fisheries and Aquatic Sciences № 121. Ottawa: Natl. Res. Counc. Can. 1995. P. 245–260.
Howard K.G., Murphy J.M., Wilson L.I. et al. Size-selective mortality of Chinook salmon in relation to body energy after the first summer in nearshore marine habitats // Pacific Salmon and Steelhead Production in a Changing Climate: Past, Present, and Future / North Pacific Anadromous Fish Commission Bulletin № 6. Vancouver: North Pac. Anadromous Fish Comm. 2016. P. 1–11.
Irvine J.R., Tompkins A., Saito T. et al. Pacific salmon status and abundance trends − 2012 update // North Pac. Anadromous Fish Comm. Doc. 2012. № 1422. P. 1–89.
Kaeriyama M. Population dynamics and stock management of hatchery-reared salmons in Japan // Bull. Natl. Res. Inst. Aquacult. 1996. Suppl. 2. P. 11–15.
Kaev A.M. Wild and hatchery reproduction of pink and chum salmon and their catches in the Sakhalin-Kuril region, Russia // Environ. Biol. Fishes. 2012. V. 94. P. 207–218.
Kaev A.M., Irvine J.R. Population dynamics of pink salmon in the Sakhalin-Kuril Region, Russia // Pacific Salmon and Steelhead Production in a Changing Climate: Past, Present, and Future / North Pacific Anadromous Fish Commission Bulletin № 6. Vancouver: North Pac. Anadromous Fish Comm. 2016. P. 297–305.
Kaev A.M., Romasenko L.V. Some results of studying chum salmon in Ilyushin and Sernovodka rivers on the Kunashir Island (Kuril Islands) // North Pac. Anadromous Fish Comm. Doc. 2003. № 670. P. 1–14.
McLellan S.E. Guide for sampling structures used in age determination of Pacific salmon. Nanaimo, British Columbia: Dept. Fish. Oceans, Fish. Res. Branch, Pac. Biol. Stn. 1987. 27 p.
Parker R.R. Estimations of ocean mortality rates for Pacific salmon (Oncorhynchus) // J. Fish. Res. Board Can. 1962. V. 19. № 4. P. 561–589.
Ricker W.E. Ocean growth and mortality of pink and chum salmon // J. Fish. Res. Board Can. 1964. V. 21. № 5. P. 905–931.
Дополнительные материалы отсутствуют.