Биология моря, 2022, T. 48, № 2, стр. 133-139
Находка в лабораторном морском аквариуме водорослей, новых для юго-восточной Камчатки
О. Н. Селиванова 1, *, Г. Г. Жигадлова 1
1 Камчатский филиал Тихоокеанского института географии ДВО РАН
683000 Петропавловск-Камчатский, Россия
* E-mail: oselivanova@mail.ru
Поступила в редакцию 20.07.2021
После доработки 14.10.2021
Принята к публикации 25.11.2021
- EDN: USEUJI
- DOI: 10.31857/S0134347522020097
Аннотация
Красные водоросли Acrosorium yendoi Yamada (Delesseriaceae, Ceramiales) и Lukinia dissecta Perestenko (Phyllophoraceae, Gigartinales) были обнаружены в лабораторном морском аквариуме, содержащем грунт и воду из Авачинского залива (Восточная Камчатка). Ранее эти водоросли в данном регионе не встречались. Вид L. dissecta отмечен только на Сахалине, Курильских и Командорских островах, поэтому его обнаружение в водах юго-восточной части Камчатки значительно расширяет ареал распространения вида, который ранее считался дизъюнктивным и исключительно островным. Очевидно, его следует признать сплошным протяженным и не приуроченным только к островам. Вид A. yendoi, ранее известный из российских вод Японского моря, а также из Японии, Китая и Кореи, в результате наших исследований впервые зарегистрирован у Восточной Камчатки, что расширяет ареал A. yendoi, смещая его к северу и изменяя фитогеографические характеристики.
В последние годы исследования в морских аквариумах стали весьма популярными, но объектами, как правило, выступают представители зообентоса. В частности, такие работы активно проводятся нашими коллегами-зоологами из Лаборатории гидробиологии Камчатского филиала (КФ) Тихоокеанского института географии (ТИГ) ДВО РАН (Sanamyan et al., 2019). Изначально целью установки аквариума было создание биотопа, подходящего для жизнедеятельности морских беспозвоночных. Водоросли не входили в сферу интересов исследователей. Подавляющее большинство работ в современной научно-технической, нормативной и методической литературе посвящено зоологическим и ихтиологическим аспектам аквакультуры. Информация о бентосных водорослях в морских аквариумах в отечественной научной литературе крайне скудна. Чаще всего проблема аквариумных водорослей обсуждается в популярной литературе и на интернет-форумах аквариумистов, где предлагаются либо методика борьбы с водорослями как нежелательными вселенцами, либо, наоборот, методы культивирования отдельных видов для прикладных целей. Как таковые флористические исследования морских аквариумных водорослей не проводились. Поэтому нами предпринята попытка мониторинговых исследований с целью восполнить пробел в знаниях о данной группе морских организмов, растущих в аквариуме и создающих среду обитания для других гидробионтов (рис. 1). Была выполнена инвентаризация всех обнаруженных видов водорослей-макрофитов, попавших в аквариум с водой и грунтом из Авачинского залива и не являющихся случайными вселенцами вследствие небрежного обслуживания аквариума. В данной работе мы попытались объяснить нахождение в аквариуме ранее не отмеченных в районе исследований водорослей, признавая их реальными природными объектами, что позволило уточнить имевшиеся сведения о географии этих видов.
Рис. 1.
Морской аквариум Камчатского филиала Тихоокеанского института географии ДВО РАН (г. Петропавловск-Камчатский).

МАТЕРИАЛ И МЕТОДИКА
Альгологический материал был собран из лабораторного морского аквариума, представлявшего собой типовой искусственный водоем (рис. 1). Субстрат, состоявший из камней и битой ракуши, был взят в Авачинском заливе. Камни в качестве субстрата для аквариума выбирали по их размерам, удобным для размещения в аквариуме и обеспечивающим благоприятные условия для жизни морских беспозвоночных. Морскую воду для аквариума набирали приблизительно в тех же участках, где брали камни.
Воду набирали в открытом море с поверхности, затем досаливали искусственной морской солью до нормальной океанической солености (33−35‰). По химическому составу вода соответствовала природной, кроме содержания фосфатов и нитратов, которое значительно превышало естественные показатели. Освещение аквариума было стабильным и несильным (2 люминесцентные лампы по 50 ватт); его длительность не менялась по сезонам года и составляла 6 ч в сут (с 10 до 16 ч). Вода постоянно перемешивалась помпой, создававшей течение в аквариуме. Температуру воды в аквариуме поддерживали на уровне 6−7°C; воду меняли, как правило, один раз в год на 2/3 от общего объема аквариума (примерно 300 л из 500).
Определение аквариумных образцов водорослей выполняли с использованием светового биологического микроскопа Olympus CX-31. При идентификации материала его сравнивали с оригинальным описанием таксонов, со сведениями из опубликованных работ по данным видам (Yamada, 1930; Перестенко, 1994; Клочкова, 1996; Nam, Kang, 2012; Лопатина, Клочкова, 2016), а также с эксикатами из гербарной коллекции “Морские водоросли Внутреннего моря Сето” (“The marine algae of the Seto Inland Sea”), любезно присланными доктором Хироши Каваи (Dr. Hiroshi Kawai, Япония). Образцы изучали и фотографировали с помощью цифровой камеры “Olympus SZ-20”. Изученный материал хранится в Лаборатории гидробиологии КФ ТИГ ДВО РАН (Петропавловск-Камчатский, Россия).
РЕЗУЛЬТАТЫ
Всего в аквариуме было обнаружено более 10 видов морских макроводорослей (см. табл. 1). Большинство из них − обычные для изучаемого региона виды, однако среди водорослей оказались виды, которые прежде не встречались в водах Восточной Камчатки. Это красные водоросли Acrosorium yendoi Yamada, 1930 (Delesseriaceae, Ceramiales) и Lukinia dissecta Perestenko, 1994 (Phyllophoraceae, Gigartinales).
Таблица 1.
Виды водорослей-макрофитов, растущих в лабораторном морском аквариуме Камчатского филиала Тихоокеанского института географии ДВО РАН
| Видовое название | Систематическая принадлежность | Обилие в аквариуме |
|---|---|---|
| Chlorophyta | ||
| Ulva fenestrata Postels et Ruprecht | Ulvales, Ulvaceae | Отдельные экземпляры |
| Rhodophyta | ||
| Acrosorium yendoi Yamada | Ceramiales, Delesseriaceae | Обильный |
| Neoabbotiella araneosa (Perestenko) S.C. Lindstrom | Halymeniales, Halymeniaceae | Довольно многочисленный |
| Lukinia dissecta Perestenko | Gigartinales, Phyllophoraceae | Несколько экземпляров |
| Callophyllis rhynchocarpa Ruprecht | Gigartinales, Kallymeniaceae | Довольно многочисленный |
| Savoiea hamata (E.S. Sinova) M.J. Wynne | Ceramiales, Rhodomelaceae | Отдельные экземпляры |
| Scagelia sp. | Ceramiales, Ceramiaceae | Отдельные экземпляры |
| Constantinea sp. juv. | Gigartinales, Dumontiaceae | Отдельные экземпляры |
| Mesophyllumaceae (несколько видов рода Clathromorphum Foslie) | Hapalidiales | Отдельные экземпляры |
Acrosorium yendoi Yamada, 1930: 33, pl. V, fig. 4
Исследованные образцы: Acrosorium yendoi (рис. 2) – из аквариума Лаборатории гидробиологии КФ ТИГ, Петропавловск-Камчатский, Россия; № 5524 собран 24.02.2021, №№ 5525 и 5526 собраны 01.03.2021. Определены Г.Г. Жигадловой.
Рис. 2.
Acrosorium yendoi Yamada. а – внешний вид растений из аквариума; б – молодое растение с ризоидальными выростами на пластине; в – ризоиды на пластине под микроскопом. Масштаб: а и б – 2 см, в – 2 мкм.
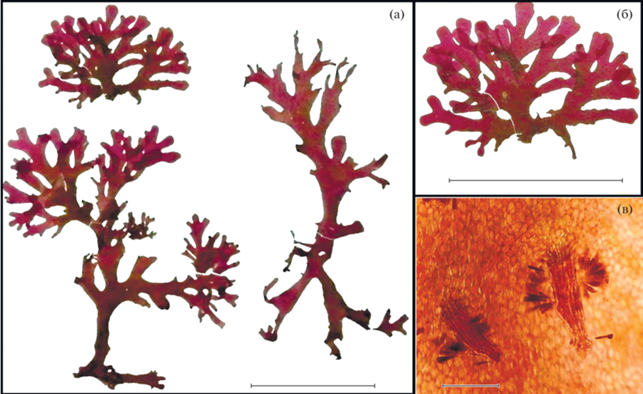
Общая морфология согласуется с оригинальным описанием. Слоевище пурпурно-красного цвета высотой до 3−7 см; пленчатое, стелющееся по субстрату, прикрепляется многочисленными ризоидами. Ветвление неправильно дихотомическое. Ветви переплетаются друг с другом при помощи ризоидальных выростов. Пластины с ровным краем, на поперечном срезе видны микроскопические одно-трехслойные вены.
Lukinia dissecta Perestenko, 1994: 129 (табл. XI , 1, 2; XXXIII, 2)
Исследованные образцы: Lukinia dissecta (рис. 3a) – из аквариума Лаборатории гидробиологии КФ ТИГ, Петропавловск-Камчатский, Россия; № 5520 – собран 24.02.2021, определен Г.Г. Жигадловой. Lukinia dissecta – образцы № 4543 (с цистокарпами) и № 4544 собраны в природе 05.07. 1992. Командорские острова, о-в Медный, мыс Матвея, глубина 20 м, валуны. Cобраны В.И. Шалухановым, определены Г.Г. Жигадловой. Lukinia dissecta (рис. 3б) – № 4905 (с цистокарпами) собран в природе 11.06.1979; за пределами скал Кирилоф, мыс Кирилоф, Амчитка, Аляска (60−80′) 51°24′52″ N, 179°18′18″ E. Собран П.А. Лебедником, определен С. Линдстром (S.C. Lindstrom) 01.10.1997.
Рис. 3.
Lukinia dissecta Perestenko. a – растения из аквариума, б – образцы из гербария Университета Британской Колумбии (Канада). Масштаб – 4 см.

Общая морфология согласуется с оригинальным описанием. Слоевище красно-фиолетовое, пластинчатое, высотой до 12 см. Пластина овальная, рассеченная на лопасти, узкоклиновидная при основании, с коротким стволиком. Прикрепляется подошвой. Сердцевина из длинных разветвленных нитей; клетки внутренней коры вытянутые, довольно крупные; клетки наружной коры мелкие, округлые. Обнаружены женские фертильные образцы с цистокарпами (до 1 мм в поперечнике), выпуклыми с одной стороны пластины и рассеянными по ее поверхности.
ОБСУЖДЕНИЕ
Делессериевая водоросль Acrosorium yendoi первоначально была описана из Японии (Yamada, 1930) и отмечена в южных районах Дальнего Востока России (Японское море: Татарский пролив, зал. Петра Великого) (Перестенко, 1994; Клочкова, 1996; Kozhenkova, 2020). Кроме Японии (Yoshida, 1998; Yoshida et al., 2015) и России вид A. yendoi обнаружен в Китае (Liu, 2008; Tseng, 2009) и Корее (Lee, Kang, 2001; Nam, Kang, 2012). В отечественной фикологической литературе A. yendoi принято считать бореально-тропическим пацифическим приазиатским видом (Перестенко, 1980) или приазиатским низкобореально-субтропическим видом (Клочкова, 1996). Находка этого вида в нашем аквариуме является первой для Камчатки.
Второй вид Lukinia dissecta описан с Командорских островов (Перестенко, 1994), отмечен на Сахалине и Курильских островах; российскими фикологами считался представителем островной флоры с дизъюнктивным ареалом (Перестенко, 1994; Клочкова и др., 2009, Selivanova, 2011; Selivanova, Zhigadlova, 2013; Лопатина, Клочкова, 2016; Скрипцова, 2020). Наши данные позволяют говорить о более обширном непрерывном ареале L. dissecta вдоль тихоокеанского побережья России. За пределами российского Тихоокеанского региона вид был обнаружен на Аляске (США). У авторов имеются гербарные образцы этой водоросли, любезно присланные нам доктором С.К. Линдстром (Sandra C. Lindstrom) (Университет Британской Колумбии, Канада) (рис. 3б). Однако информация о произрастании L. dissecta на Аляске до сих пор не опубликована и не цитируется в базе данных (Lindeberg, Lindstrom, 2010; Molinari-Novoa in Guiry and Guiry, algaebase, searched on September 2, 2021).
Чем можно объяснить обнаружение в аквариуме несвойственных для изучаемой акватории водорослей? Случайный занос спор из достоверно известных местообитаний видов исключен ввиду их географической удаленности от района исследований, поэтому мы предполагаем, что споры или ювенильные растения содержались в воде или грунте, которые были отобраны для аквариума из Авачинского залива. В природных условиях эти виды ранее не были обнаружены, вероятно, из-за мелких размеров, малочисленности или недостаточной изученности флоры региона.
Наблюдения за развитием экосистемы аквариума показали активное разрастание бентосных водорослей разных таксономических групп, но особенно новых для Восточной Камчатки видов, относящихся к родам Lukinia и Acrosorium. При этом водоросли рода Acrosorium, имеющие мелкое стелющееся слоевище, оказались настолько активными, что практически захватили все подходящие поверхности субстрата и стали доминирующими (рис. 1). По-видимому, условия в аквариуме оказались благоприятными для их развития. По личному сообщению нашего коллеги К.Э. Санамяна, часто в устоявшихся морских аквариумах находят виды зообентоса, которые неизвестны в месте отбора воды, грунта и животных. Это связано с тем, что в условиях, отличных от природных, могут преобладать очень редкие для данной акватории виды. Вероятно, для водорослей свойственна та же тенденция. Подчеркнем, что в нашем случае речь идет не об инвазивных, а об аборигенных видах, которые ранее не были обнаружены в природе. Находка Lukinia в нашем аквариуме, содержавшем воду и грунт из Авачинского залива, неудивительна, а закономерна. Как было отмечено, она описана с Командор, позже найдена намного южнее − на Сахалине и Курилах, но попасть туда эта водоросль могла только через камчатскую акваторию благодаря системе морских течений в Тихом океане. При этом одним из промежуточных пунктов распространения вида на юг является Авачинский залив. Вид A. yendoi, вероятно, также произрастал в прикамчатских водах, но был редок и угнетен; в аквариуме новые условия способствовали тому, что он размножился активнее других водорослей. Можно предполагать, что температурные и химические условия, в частности избыточное содержание соединений азота и фосфора в аквариуме, оказались благоприятными для этих водорослей. В случае с A. yendoi лимитирующим фактором, вероятно, послужила температура. Относительно недавно выяснилось, что этот вид не так уж теплолюбив, как было принято считать (Перестенко, 1980, 1994; Клочкова, 1996). В частности, в работе китайских исследователей (Sun et al., 2010), проводивших многолетний мониторинг биоразнообразия бентосных водорослей литорали островов Нанджи (Национальный природный заповедник, Южно-Китайское море, Китай), показано, что с постепенным увеличением температуры воды в сообществе донных макроводорослей доля субтропических видов увеличилась, а умеренно-холодноводных видов заметно снизилась. Общая доля умеренно-тепловодных водорослей не претерпела явных изменений, однако количество их видов уменьшилось на 40%. Авторы предположили, что причиной прогрессивного уменьшения численности некоторых видов водорослей явилось глобальное потепление климата. Выяснилось, что обилие A. yendoi на литорали островов за 40 лет снизилось примерно в 1.5 раза и вид из категории доминирующих перешел в категорию обычных (Sun et al., 2010).
Значимость погодно-климатического фактора в динамике видового баланса водорослей была отмечена нами на примере литоральных сообществ Авачинского залива (Селиванова, 2015, 2016). В настоящее время Камчатка находится в мировом тренде повышения средней годовой температуры поверхностного слоя Земли и Мирового Океана. В 2014 г. Комиссией по климатологии Всемирной метеорологической организации был утвержден период в 30 лет как показательный для многолетних наблюдений, данные которых могут корректно применяться в настоящее время. При сравнительном анализе двух 30-летних периодов (1973−2003 и 1983−2013 гг.) было показано увеличение среднегодовой температуры воздуха в г. Петропавловск-Камчатский на 0.5°С (http://kammeteo.ru). Соответственно повышению температуры воздушных масс повышается температура воды, так что обнаружение считавшихся тепловодными видов морских гидробионтов в прикамчатской акватории не является неожиданностью. Можно предположить, что в связи с потеплением климата A. yendoi стал продвигаться на север, в том числе к берегам Камчатки, и таким образом попал в наш аквариум.
Нахождение прежде необычных для региона водорослей в аквариуме может быть индикатором их присутствия в водах Авачинского залива и послужить стимулом для поиска в этой акватории. Таким образом, обнаружение в аквариуме видов L. dissecta и A. yendoi, которые ранее не указывались в районе Восточной Камчатки, позволяет расширить и уточнить их природные ареалы.
ЗАКЛЮЧЕНИЕ
Лабораторные исследования в аквариуме позволили скорректировать географический ареал двух видов красных водорослей тихоокеанского побережья России. Наши данные расширили ареал Lukinia dissecta от Сахалина и Курильских островов до Командорских островов через Восточную Камчатку и показали, что этот вид имеет обширный сплошной ареал, который раньше рассматривался как дизъюнктивный островной. Присутствие L. dissecta на Аляске позволяет предположить, что этот вид еще более широко распространен в Тихом океане и, возможно, должен рассматриваться как бореальный интерзональный пан-пацифический вид (включающий американский сектор).
Первая находка Acrosorium yendoi в водах Восточной Камчатки значительно смещает ареал вида к северу по сравнению с известными ранее местообитаниями в Японском море. Таким образом, A. yendoi, вероятно, не следует считать бореально-тропическим, пацифическим приазиатским или приазиатским низкобореально-субтропическим видом, а необходимо признать широко бореальным азиатско-тихоокеанским видом.
Список литературы
Клочкова Н.Г. Флора водорослей макрофитов Татарского пролива и особенности ее формирования. Владивосток: Дальнаука. 1996. 289 с.
Клочкова Н.Г., Королева Т.Н., Кусиди А.Э. Атлас водорослей-макрофитов прикамчатских вод. Т. 2. Красные водоросли. Петропавловск-Камчатский: КамчатНИРО. 2009. 300 с.
Лопатина Н.А., Клочкова Н.Г. Род Lukinia (Rhodophyta: Gigartinales) в морях российского Дальнего Востока // Вестн. Камчат. гос. техн. ун-та. 2016. № 36. С. 74–78.
Перестенко Л.П. Водоросли залива Петра Великого. Л.: Наука. 1980. 231 с.
Перестенко Л.П. Красные водоросли дальневосточных морей России. СПб.: Ольга. 1994. 331 с.
Селиванова О.Н. Изменения в составе литоральных альгоценозов Авачинского залива как показатель динамики биоразнообразия водоема // Материалы XVI междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. 2015. С. 138–142.
Селиванова О.Н. Новые данные о состоянии литоральных альгоценозов Авачинского залива на примере пальмариевых водорослей // Материалы XVII междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. 2016. С. 240–243.
Скрипцова А.В. Дополнение к флоре морских макроводорослей средних Курил // Бот. журн. 2020. Т. 105. № 10. С. 1000−1009.
Kozhenkova S.I. Checklist of marine benthic algae from the Russian continental coast of the Sea of Japan // Phytotaxa. 2020. V. 437. № 4. P. 177–205.
Lee Y., Kang S. A catalogue of the seaweeds in Korea. Jeju: Cheju National Univ. Press. 2001. 662 p. [нa кop. яз.].
Lindeberg M.R., Lindstrom S.C. Field guide to seaweeds of Alaska. Alaska Sea Grant College Program. Univ. of Alaska. Fairbanks. 2010. 188 p.
Checklist of biota of Chinese seas / Ed. R.Y. Liu. Beijing: Science Press; Academia Sinica. 2008. 1267 p. [нa кит. яз.].
Molinari-Novoa E.A. // Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. National University of Ireland. Galway. 2021. http://www.algaebase.org; searched on 2 September 2021.
Nam K.W., Kang P.J. Algal flora of Korea. V. 4. № 7. Rhodophyta: Florideophyceae: Ceramiales: Delesseriaceae: 22 genera including Acrosorium. Incheon: National Institute of Biological Resources. 2012. P. 1–129.
Sanamyan K.E., Sanamyan N.P., Martynov A., Korshunova T. A new species of Ernstia (Porifera, Calcarea) described form marine aquarium // Zootaxa. 2019. V. 4603. № 1. P. 192–200.
Selivanova O.N. Marine macrophytic algae of the western sector of North Pacific (Russia) // The dynamical processes of biodiversity – Case studies of evolution and spatial distribution / Eds O. Grillo, G. Venora. Rijeka; Croatia: Intech. d.o.o. 2011. Ch. 8. P. 187–210.
Selivanova O.N., Zhigadlova G.G. Marine benthic algae of the Commander Islands (Pacific coast of Russia) with checklist revised in 2012 // ISRN Oceanogr. V. 2013. Art. ID 470185. https://doi.org/10.5402/2013/470185
Sun J.-Z., Ning X.-R., Le F.-F. et al. Long term changes of biodiversity of benthic macroalgae in the intertidal zone of the Nanji Islands // Acta Ecol. Sin. 2010. V. 30. P. 106−112.
Tseng C.K. Seaweeds in Yellow Sea and Bohai Sea of China. Beijing: Science Press. 2009. 1– 453 p. [Ha кит. яз.]
Yamada Y. Notes on some Japanese algae. I // J. Fac. Sci. Hokkaido Imp. Univ. 1930. V. 1. P. 27–36.
Yoshida T. Marine algae of Japan. Tokyo: Uchida Rokakuho Publishing Co., Ltd. 1998. 1222 p. [Ha яп. яз.]
Yoshida T., Suzuki M., Yoshinaga K. Checklist of marine algae of Japan (revised in 2015) // Jpn. J. Phycol. 2015. V. 63. P. 129–189.
Дополнительные материалы отсутствуют.


