Биология моря, 2023, T. 49, № 2, стр. 114-126
Возрастная и сезонная динамика клеточной популяции гемоцитов у двустворчатого моллюска Crenomytilus grayanus (Dunker, 1853)
А. А. Анисимова 1, *, М. Н. Дягилева 1, А. В. Синенко 1, И. А. Дмитриева 1
1 Институт Мирового океана, Дальневосточный федеральный университет
690922 Владивосток, Россия
* E-mail: anisan77@mail.ru
Поступила в редакцию 15.06.2022
После доработки 15.11.2022
Принята к публикации 24.11.2022
- EDN: DUZMAM
- DOI: 10.31857/S013434752302002X
Аннотация
Клеточный состав гемолимфы мидии Crenomytilus grayanus представлен гемобластами, гиалиноцитами, базофильными, нейтрофильными и эозинофильными гранулоцитами с существенным преобладанием последних. С возрастом моллюска увеличивались средние значения размера и гранулярности гемоцитов за счет накопления в гемолимфе гранулоцитов (вплоть до 100% от всех клеток) и их зрелых высокодифференцированных эозинофильных форм (вплоть до 99% от всех клеток), что свидетельствует о снижении скорости обновления клеточной популяции. В осенний период половой инертности в гемолимфе мидий наблюдали уменьшение числа клеток с увеличением возраста моллюска, но без связи с размером раковины. Однако летом, в период нереста, концентрация гемоцитов либо не менялась, либо росла по мере увеличения размера тела, прямо коррелируя с количеством молодых базофильных гранулоцитов. Последнее может указывать либо на взаимосвязь между количеством гемоцитов и способностью мидий достигать крупных размеров, либо на более высокие потенции возрастных мидий к экстренной мобилизации системы иммунитета в летний сезон за счет быстрого восполнения пула циркулирующих клеток с последующим перераспределением молодых и зрелых клеточных форм между гемолимфой и внутренними органами.
В последние десятилетия широко исследуется возможность использования гемолимфы двустворчатых моллюсков в качестве индикатора состояния морских экосистем (см. обзоры: Анисимова, 2013; Oliver, Fisher, 1999; Renault, 2015; Farrington et al., 2016; Metzger et al., 2016; Dos Santos et al., 2022). Даже самые общие гематологические показатели, такие как концентрация гемоцитов и их дифференциальное число (распределение по морфотипам), зависят от условий обитания моллюсков – температуры воды, солености, инфекционной нагрузки, загрязнений и т. д. (см. обзоры: Анисимова, 2013; Donaghy et al., 2009). Помимо внешних средовых факторов на параметры популяции гемоцитов влияют и внутренние онтогенетические причины. Некоторые авторы сообщают о возраст-зависимом повышении концентрации клеток в гемолимфе (Flye-Sainte-Marie et al., 2009) и увеличении количества гранулоцитов (Carballal et al., 1998; Ottaviani et al., 1998; Mosca et al., 2011). С другой стороны, есть данные об изменении как общего (Pipe et al., 1995; Fisher et al., 1996; Delaporte et al., 2006), так и дифференциального (Анисимова и др., 2017) числа гемоцитов в связи с половым циклом. Понимание границ нормы физиологических параметров, используемых в биоиндикации, их изучение в возрастной и сезонной динамике в естественных условиях, не отягченных экстремальными воздействиями, служат базой для разработки методов оценки влияния среды на морскую биоту.
Представителей семейства Mytilidae активно исследуют в отношении реакций гемолимфы на антропогенный стресс (Farrington et al., 2016; Batel et al., 2018; Parrino et al., 2019; Sendra et al., 2020; Dos Santos et al., 2022). С этой точки зрения особый интерес представляет мидия Грея Crenomytilus grayanus (Dunker, 1853). Возраст особей в естественных популяциях моллюска достигает 150 лет (Явнов, 2000), что делает его удобной моделью для изучения механизмов адаптации к стрессовым воздействиям у видов-долгожителей. В предыдущем сообщении (Анисимова и др., 2022) нами были изучены состав и кинетика популяции гемоцитов у мидии Грея, показавшей себя как относительно стабильная клеточная система с низкой скоростью обновления. Все клетки гемолимфы у С. grayanus, по-видимому, составляют единый гистогенетический ряд в полном соответствии со схемой гемопоэза, предложенной Миксом (Mix, 1976) и поддержанной в ряде других работ (Ottaviani et al., 1998; Hine, 1999). Учитывая высокую продолжительность жизни вида, мы предположили, что моллюск реализует стратегию длительного сохранения клеток с накоплением в гемолимфе высокодифференцированных форм гемоцитов. Стратегия гистогенеза должна проявляться и в специфических изменениях параметров тканевых систем в течение жизни особей, поэтому в настоящем исследовании на трех выборках мидии Грея из фоновых акваторий Приморья проведен анализ возрастной динамики клеточной популяции гемоцитов в разные сезоны. Такой подход позволил выявить границы нормальной вариабельности гемограммы C. grayanus и оценить вклад естественных причин в общую совокупность факторов, влияющих на нее, что в дальнейшем при использовании гемоцитов мидии Грея в мониторинге антропогенных загрязнений даст возможность принимать в расчет возраст-зависимые и сезонные эффекты.
МАТЕРИАЛ И МЕТОДИКА
Сбор моллюсков
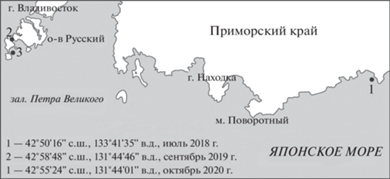
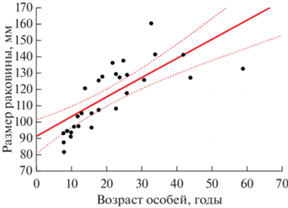
Материалом для исследования послужила гемолимфа 80 разновозрастных мидий Crenomytilus grayanus из трех фоновых акваторий Приморья (рис. 1). Длина раковины варьировала от 26 до 160 мм, при этом особи данного вида становятся половозрелыми, достигая размеров 60–70 мм (Явнов, Поздняков, 2000). Для определения стабильности возрастных эффектов все три выборки взяты в разные годы и сезоны, на разных стадиях полового цикла моллюсков, с учетом того, что нерест у мидии Грея растянут с июня по август включительно (Явнов, 2000). В 2018 г. моллюски были выловлены в б. Киевка (42°50′16″ с.ш., 133°41′35″ в.д.) в середине июля (t воды 17°C), в разгар нереста; в 2019 г. – в прол. Старка зал. Петра Великого (42°58′48″ с.ш., 131°44′46″ в.д.) в начале сентября (t воды 21°C), вблизи августовской нерестовой волны; в 2020 г. – в прибрежной зоне о-ва Рейнеке зал. Петра Великого (42°55′24″ с.ш., 131°44′01″ в.д.) в конце октября (t воды 10°C), после полного завершения нереста. В летних выборках некоторые особи имели гонады с признаками активного выброса гамет; в осенней выборке признаки половой активности отсутствовали, поэтому при анализе возрастной динамики эту выборку рассматривали как эталонную. У о-ва Рейнеке собрано 30 особей с длиной раковины от 81 до 160 мм, возраст которых варьировал от 8 до 59 лет (данные о возрасте моллюсков любезно предоставлены ст.н.с. лаборатории систематики и морфологии ННЦМБ ДВО РАН Н.И. Селиным). Возраст моллюсков определяли по кольцам зимней задержки роста на поверхности раковины и структурным меткам на продольном спиле створки. Между возрастом и длиной раковины была обнаружена значительная прямая связь (r = 0.88, р < 0.05) (рис. 2), на основании чего в двух других выборках возрастные ряды формировали, исходя из размеров раковины. В выборке из б. Киевка (10 особей) длина раковины варьировала от 30 до 110 мм, в выборке из прол. Старка (40 особей) – от 26 до 121 мм.
Сбор, фиксация и анализ гемолимфы
Гемолимфу отбирали из заднего мускула-аддуктора в 0.3 М раствор Na2ЭДТА на фильтрованной морской воде, после чего гемоциты в виде клеточных суспензий сразу фиксировали в 4%-ном параформальдегиде. Анализ проводили с помощью светового микроскопа Axioscope (Zeiss, Германия) и проточного цитометра Accuri C6 (Becton Dickinson, США). Методом световой микроскопии определяли морфотипы гемоцитов, окрашенных по Романовскому-Гимзе, оценивали их дифференциальное число и средний диаметр в программе ZEN 2012 (blue edition). Методом проточной цитометрии гемоциты исследовали на предмет средних величин прямого (FSC) и бокового (SSC) светорассеяния (соответственно размер и уровень структурной сложности клеток), их общей концентрации и распределения по размерно-морфологическим группам (цитометрическим регионам). Детали использованных методик изложены в нашем предыдущем сообщении (Анисимова и др., 2022). Там же дана характеристика клеточного состава гемолимфы C. grayanus: гемобласты (0.2 ± 0.1%), гиалиноциты (1.9 ± 0.3%), базофильные (10.9 ± 1.4%), нейтрофильные (13.3 ± 3.0%) и эозинофильные (74.1 ± 2.9%) гранулоциты (пропорции рассчитаны для половозрелых мидий размером от 80 до 120 мм из прибрежной зоны о-ва Рейнеке в период половой инертности, конец октября), а также приведены обоснования для выделения методом проточной цитометрии четырех размерно-морфологических групп гемоцитов (регионы R1, R2, R3 и R4) и их соответствия клеточным морфотипам: R1 и R2 – агранулоциты (гемобласты и гиалиноциты соответственно), R3 и R4 – гранулоциты, где R4 преимущественно представлен эозинофильными гранулоцитами с повышенным уровнем структурной сложности (рис. 3). Эти результаты были использованы в настоящей работе.
Рис. 3.
Дифференциация гемоцитов двустворчатого моллюска Crenomytilus grayanus методом проточной цитометрии и схема их позиционирования на гистограмме прямого (FSC) и бокового (SSC) светорассеяния. R1 – небольшие агранулярные клетки, R2 – слабогранулярные клетки среднего размера, R3 – умеренно-гранулярные клетки среднего размера, R4 – большие гранулярные клетки. Масштабная линейка 10 мкм.

РЕЗУЛЬТАТЫ
Предварительную оценку возрастной динамики популяции гемоцитов у мидии Грея провели на небольшой июльской выборке из б. Киевка, состоящей из 10 особей размером от 30 до 110 мм. Несмотря на малый объем выборки и нерестовый период, длина раковины оказалась скоррелирована (р < 0.05) с рядом гематологических показателей: положительно – с общим числом гемоцитов (r = 0.70) и их средним размером, как с диаметром (r = 0.64), так и с FSC (r = 0.49), и отрицательно – с долей клеток в регионе R2 (r = –0.93) и долей гемобластов (r = –0.72); последняя, в свою очередь, влияла на средний размер гемоцитов (r = –0.84). У половозрелых особей наблюдали два состояния, резко отличавшихся долей эозинофильных гранулоцитов, которая варьировала от 0 до 56% и не коррелировала с длиной раковины.
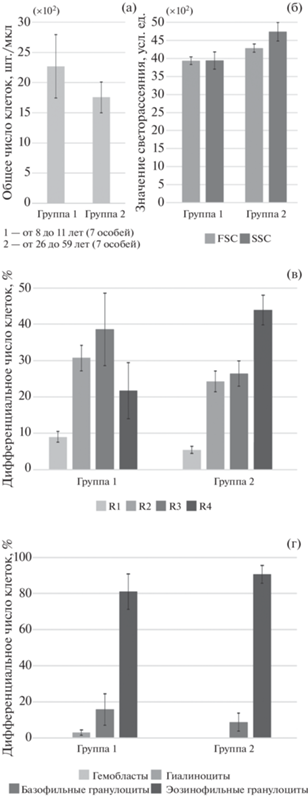
Чтобы подтвердить факт влияния возраста/размера моллюсков на параметры гемограммы, исследование продолжили на двух репрезентативных выборках – 30 особей из прибрежной зоны о-ва Рейнеке (“осенние” мидии в состоянии половой инертности) и 40 особей из прол. Старка (“летние” мидии в состоянии половой активности). Внутри эталонной осенней выборки корреляционный анализ обнаружил изменение всех ключевых параметров гемограммы с увеличением возраста (табл. 1): росли показатели среднего размера гемоцитов (FSC) и среднего уровня их гранулярности (SSC), а также количество гранулоцитов и доля клеток в R4. В соответствии с этим становилось меньше агранулоцитов, в частности, гиалиноцитов, количество событий в R1 также уменьшалось, что привело к снижению общей концентрации клеток в гемолимфе. Те же закономерности выявлены при использовании длины раковины как косвенного показателя возраста, хотя некоторые корреляции при таком подходе исчезли, а именно: прямая корреляция с SSC и обратные – с общей концентрацией гемоцитов, количеством гиалиноцитов и долей клеток в R1. Помимо корреляционного анализа для оценки возрастной динамики мы применили парные сравнения Манна–Уитни, разбив выборку на две возрастные группы. Разделение на группы проводили поэтапно: сначала выборку разделили пополам, а затем из анализа последовательно исключали особей, находившихся в середине возрастного ряда. Наибольшее количество значимых различий получено при формировании групп по 7 особей. Группу 1 представляли молодые моллюски от 8 до 11 лет (81–97 мм), группу 2 – возрастные особи от 26 до 59 лет (126–160 мм) (рис. 4). При парных сравнениях обнаружены те же тенденции, что и при корреляционном анализе, за исключением снижения концентрации гемоцитов с возрастом (рис. 4а). По сравнению с молодыми, у возрастных мидий были повышены средние значения FSC (p = 0.005) и SSC (p = 0.003) гемоцитов (рис. 4б) и снижены количества клеток в R1 (p = 0.003), R2 (p = 0.030) и R3 (p = 0.048) за счет прироста числа клеток в R4 (p = 0.005) (рис. 4в). Также с возрастом становилось меньше агранулоцитов (p = 0.015) вследствие снижения доли гиалиноцитов (p = 0.015) и больше гранулоцитов (p = 0.015) в результате возрастания доли эозинофилов (p = = 0.011) (рис. 4г). При этом в обеих группах значительно преобладали гранулоциты, большая часть которых была представлена эозинофильной формой (рис. 4г). В полной выборке из прибрежной зоны о-ва Рейнеке у 10 особей более 95% от всех клеток были представлены эозинофильными гранулоцитами; в группе молодых мидий среднее их количество составило 60.3 ± 8.4% при медиане 67%, а максимальное – 80%, у возрастных – 85.3 ± 4.3%, 87 и 99% соответственно. Количество всех гранулоцитов в группе 1 было определено как 93.9 ± 3.4% при медиане 97%, в группе 2 – как 99.6 ± 0.3% при медиане 100%. Аналогичные тренды получены при группировании особей по размеру раковины.
Таблица 1.
Корреляции гематологических параметров с возрастом и размером особей у двустворчатого моллюска Crenomytilus grayanus в период половой инертности
| Переменная | Ранговые корреляции Спирмена | r | |
|---|---|---|---|
| Возраст особей, годы | Прямые | FSC гемоцитов, усл. ед. | 0.50 |
| (от 8 до 59 лет) | SSC гемоцитов, усл. ед. | 0.41 | |
| Доля клеток в регионе R4, % | 0.52 | ||
| Доля гранулоцитов, % | 0.46 | ||
| Обратные | Концентрация гемоцитов, шт./мкл | –0.36 | |
| Доля клеток в регионе R1, % | –0.41 | ||
| Доля агранулоцитов, % | –0.46 | ||
| Доля гиалиноцитов, % | –0.45 | ||
| Длина раковины, мм | Прямые | FSC гемоцитов, усл. ед. | 0.50 |
| (от 81 до 160 мм) | Доля клеток в регионе R4, % | 0.45 | |
| Доля гранулоцитов, % | 0.37 | ||
| Обратные | Доля агранулоцитов, % | –0.36 | |
Рис. 4.
Возраст-зависимые изменения параметров клеточной популяции гемоцитов у двустворчатого моллюска Crenomytilus grayanus в период половой инертности (конец октября, о-в Рейнеке): а – концентрация клеток в гемолимфе (проточная цитометрия), б – средний размер (FSC) и средний уровень гранулярности (SSC) гемоцитов (проточная цитометрия), в – распределение гемоцитов по размеру и гранулярности (проточная цитометрия), г – распределение гемоцитов по морфотипам (световая микроскопия). На графике указаны средние значения в сопровождении 95% доверительных интервалов.
Для анализа летней выборки мидий из прол. Старка в качестве возрастного маркера использовали длину раковины. Ключевые эффекты, характерные для осенней выборки, были подтверждены и в этом случае: прямые корреляции между длиной раковины и средними значениями FSC и SSC гемоцитов (r = 0.40 и r = 0.41 соответственно), а также обратная корреляция между длиной раковины и количеством клеток в R1 (r = –0.47).
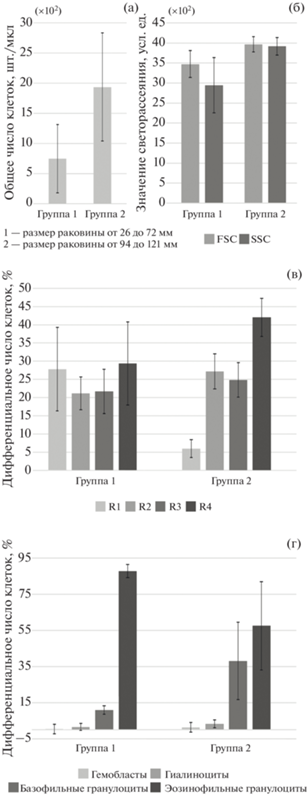
Ту же динамику наблюдали и в парных сравнениях при разделении выборки на две размерные группы. Различия в SSC и количестве клеток в R1 оказались значимыми даже при разделении выборки пополам (p = 0.040 и p = 0.014 соответственно), а различия в FSC (p = 0.049) – при разделении на группы по 11 особей (26–76 и 85–121 мм). Наибольшее количество различий получено при разделении на группы по 7 особей: моллюски с длиной раковины 26–72 и 94–121 мм в группе 1 и 2 соответственно (рис. 5). Обозначенные выше тенденции приобрели характер убедительных закономерностей (p = 0.021 для FSC, p = = 0.005 для SSC и p = 0.001 для R1) (рис. 5б, 5в). Кроме того, были найдены различия в концентрации гемоцитов, которая оказалась выше в группе 2 (p = 0.022) (рис. 5а), а также в пропорции базофильных и эозинофильных гранулоцитов (p = 0.021 и p = 0.018 соответственно): первых с увеличением размера раковины стало больше, вторых – меньше (рис. 5г), что подтвердил и корреляционный анализ (r = 0.36). Доля базофильных гранулоцитов прямо коррелировала с общим числом клеток (r = 0.42).
Рис. 5.
Возраст-зависимые изменения параметров клеточной популяции гемоцитов у двустворчатого моллюска Crenomytilus grayanus в период нереста (начало сентября, прол. Старка): а – концентрация клеток в гемолимфе (проточная цитометрия), б – средний размер (FSC) и средний уровень гранулярности (SSC) гемоцитов (проточная цитометрия), в – распределение гемоцитов по размеру и гранулярности (проточная цитометрия), г – распределение гемоцитов по морфотипам (световая микроскопия). На графике указаны средние значения в сопровождении 95% доверительных интервалов.
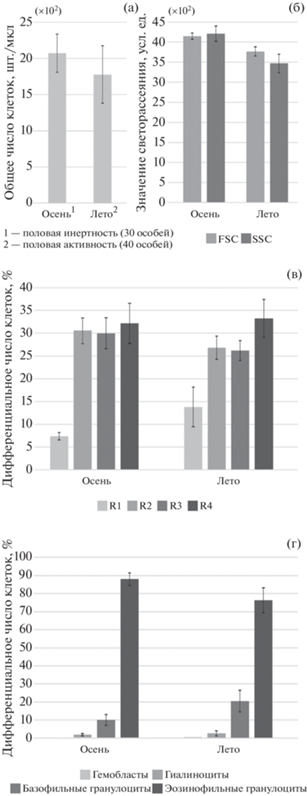
Таким образом, наряду с возрастными трендами, описанными для осенней выборки о-ва Рейнеке, у летних мидий из прол. Старка были выявлены и прямо противоположные эффекты. При объединении мидий всех возрастов и размеров (рис. 6) летняя выборка отличалась от осенней более низкими значениями FSC и SSC гемоцитов (р < 0.001), а также более высоким содержанием агранулоцитов (медиана 3% против 2%, р = 0.03) и базофильных гранулоцитов (медиана 15% против 10%, р = 0.008). Чтобы исключить влияние неоднородности возрастного состава моллюсков на полученные различия, из каждой выборки были отобраны по 20 особей размером от 80 до 120 мм. При этом различия в пропорции гранулоцитов и агранулоцитов исчезли, но значения FSC и SSC гемоцитов у летних мидий по-прежнему были ниже (р = 0.004 и р = 0.02), а доля базофильных гранулоцитов – выше (р = 0.01).
Рис. 6.
Сезонные различия параметров клеточной популяции гемоцитов у двустворчатого моллюска Crenomytilus grayanus, полученные при сравнении полных возрастных рядов: а – концентрация клеток в гемолимфе (проточная цитометрия), б – средний размер (FSC) и средний уровень гранулярности (SSC) гемоцитов (проточная цитометрия), в – распределение гемоцитов по размеру и гранулярности (проточная цитометрия), г – распределение гемоцитов по морфотипам (световая микроскопия). На графике указаны средние значения в сопровождении 95% доверительных интервалов.
ОБСУЖДЕНИЕ
В предыдущем сообщении (Анисимова и др., 2022), посвященном общему анализу гемограммы у мидии Грея Crenomytilus grayanus, мы разделили гемоциты этого моллюска на пять морфотипов – гемобласты (малые агранулоциты), гиалиноциты (большие агранулоциты), а также базофильные, нейтрофильные и эозинофильные гранулоциты, что согласуется с микроскопическими описаниями клеточного состава гемолимфы других митилид(Анисимова, 2012; Pipe et al., 1995; Carballal et al., 1997, 1998; Ottaviani et al., 1998; Wootton et al., 2003; Galimany et al., 2008; Le Foll et al., 2010; Renwrantz et al., 2013; Andreyeva et al., 2019; Burioli et al., 2019; Parrino et al., 2019). При этом в гемолимфе C. grayanus гранулоциты существенно преобладали над агранулоцитами, что, судя по всему, является характерной чертой моллюсков этого семейства (Анисимова, 2012; Carballal et al., 1998; Wootton et al., 2003; Le Foll et al., 2010; Renwrantz et al., 2013; Burioli et al., 2019), а наблюдаемые в ряде случаев отклонения от этой пропорции (Andreyeva et al., 2019; Parrino et al., 2019) свидетельствуют о влиянии на гемограмму мидий дополнительных факторов. Иногда разнятся сведения о соотношении гранул разных размеров и аффинности в цитоплазме гранулоцитов. Так, Буриоли и соавторы (Burioli et al., 2019) сообщают, что в гемолимфе исследованных ими мидий Mytilus edulis нейтрофильные гранулоциты отсутствовали, базофильные были редкостью, а эозинофильные представляли абсолютное большинство, при этом размер гранул варьировал в одной и той же клетке. Расхождение собственных данных с другими описаниями авторы объясняют разницей в физиологических состояниях и условиях обитания моллюсков.
Нами показано, что гемоциты мидии Грея в большинстве случаев могут быть дифференцированы методом проточной цитометрии на четыре группы (региона), исходя из их размера и внутренней структуры, а общая морфология клеток и количественные отношения между разными их структурными типами свидетельствуют в пользу гистогенетической преемственности гиалиноцитов и гранулоцитов (Mix, 1976; Ottaviani et al., 1998; Hine, 1999). Однако из-за высокой лабильности морфофункциональных параметров гемолимфы количество и степень дискретности регионов могут варьировать. Поэтому, несмотря на единство мнений в отношении структурной классификации гемоцитов митилид, количество клеточных “субпопуляций”, выделяемых методом проточной цитометрии, разнится даже для одного и того же вида. Так, гемоциты M. galloprovincialis группируются то в 2 (Andreyeva et al., 2019; Parrino et al., 2019), то в 3 (Le Foll et al., 2010; Sendra et al., 2020), то в 4 (Garcia-Garcia et al., 2008) кластера, что лишь подчеркивает последовательный характер и динамичность структурных преобразований в ходе созревания и функционирования клеток фагоцитарного типа.
Анализ клеточной популяции гемоцитов у C. grayanus, проведенный в настоящей работе с учетом возраста и/или размера моллюсков, обнаружил закономерности, которые следует трактовать как проявления возрастной динамики. Три выборки были взяты из трех фоновых акваторий Приморья (б. Киевка, прол. Старка и прибрежная зона о-ва Рейнеке) в разные сезоны (середина июля, начало сентября и конец октября соответственно), что позволило параллельно оценить степень влияния сопутствующих природных факторов на возраст-зависимые параметры гемограммы.
В ходе предварительного исследования, проведенного на 10 особях C. grayanus из б. Киевка в разгар нереста, была обнаружена прямая корреляция между общим числом клеток в гемолимфе и размером раковины моллюска. При этом у крупных особей был увеличен средний размер гемоцитов (FSC) за счет снижения числа событий в регионе R2, который у мидии Грея сформирован преимущественно молодыми клетками с низким содержанием гранул – гиалиноцитами и базофильными гранулоцитами (Анисимова и др., 2022). В некоторых других работах, напротив, наблюдали обратную корреляцию между концентрацией гемоцитов и их средним размером, но эти эффекты были связаны не с возрастной, а с годовой динамикой. Так, у Ruditapes philippinarum рост числа клеток в гемолимфе отмечали в весенне-летний сезон, одновременно с увеличением доли молодых гемоцитов небольшого размера (Soudant et al., 2004). В то же время с увеличением возраста и размера тела количества гиалиноцитов и гранулоцитов в гемолимфе R. philippinarum росли пропорционально друг другу (Flye-Sainte-Marie et al., 2009).
В двух других, более репрезентативных выборках мидии Грея, зависимость общей концентрации гемоцитов от возраста оказалась противоречивой. При разделении моллюсков летней выборки из прол. Старка на две размерные группы более крупные мидии также показали увеличение числа циркулирующих клеток по сравнению с мелкими особями; однако корреляционный анализ не подтвердил наличие этой связи. В эталонной осенней выборке из акватории о-ва Рейнеке и вовсе обнаружена обратная корреляция между числом гемоцитов и возрастом моллюсков при отсутствии соответствующей связи с размером раковины, но при сравнении двух возрастных групп различия не подтвердились. Аналогичное сравнение особей M. galloprovincialis разных возрастов также не выявило различий в общей концентрации клеток, но показало более высокое содержание гранулоцитов у возрастных мидий (Carballal et al., 1998; Ottaviani et al., 1998).
Таким образом, общая концентрация клеток в гемолимфе мидий C. grayanus проявила себя как параметр, либо не имеющий возрастной динамики, либо в гораздо большей степени подверженный влиянию других причин. Колебания численности клеток в циркуляции могут быть связаны с индивидуальными особенностями метаболизма моллюсков, их разным иммунологическим статусом (активация или подавление иммунитета в связи с заражением), болезнями иммунной системы (повышенная пролиферация клеток в связи с неоплазией), а также сезонными явлениями – изменением температуры воды и периодизацией полового цикла (см. обзоры: Donaghy et al., 2009; Анисимова, 2013; Одинцова, 2020). Так, наблюдаемое у R. philippinarum увеличение числа клеток в гемолимфе в весенне-летний сезон авторы объясняют всплеском пролиферации гемоцитов на фоне повышения температуры (Soudant et al., 2004). Результаты оценки влияния природных факторов на гемолимфу моллюсков указывают на их сочетанный эффект. В естественных условиях обитания суммарный вклад внешних воздействий в изменение количества циркулирующих клеток у R. philippinarum не превышал 10%, при этом на долю наиболее значимого температурного фактора отводили всего 3.3% от общей вариабельности (Flye-Sainte-Marie et al., 2009). Между тем, половой цикл, который в природе четко скоррелирован с сезонными изменениями температуры воды, существенно влияет на гемограмму моллюсков. К примеру, установлено снижение концентрации гемоцитов у мидий M. galloprovincialis (Pipe et al., 1995) и устриц Crassostrea virginica (Fisher et al., 1996) в летний сезон; в обоих случаях авторы объясняют это перемещением клеток из гемолимфы в нерестовые гонады. Для устрицы Crassostrea gigas аналогичный эффект, полученный в эксперименте, связывают с подавлением пролиферации гемоцитов на фоне гаметогенеза, в пользу которого распределены энергетические ресурсы организма (Delaporte et al., 2006). Наконец, массовый выброс клеток в гемолимфу может быть спровоцирован стрессом различной природы (Malagoli et al., 2007; Renwrantz et al., 2013), тогда как в нормальных физиологических условиях концентрация циркулирующих гемоцитов снижена за счет их адгезии к стенкам гемальных синусов (Renwrantz et al., 2013). Еще раз подчеркнем, что общее количество клеток в гемолимфе, если и имеет возрастную динамику, то опосредовано множеством дополнительных факторов как внутренних, так и внешних, которые нивелируют возрастные эффекты. Кроме того, если у мидии Грея и были выявлены прямые корреляции, то между числом гемоцитов и размером раковины, в то время как единственная корреляция с реальным возрастом, полученная для осенней выборки, была обратной. Возможно, моллюски с высокой концентрацией гемоцитов и, соответственно, более эффективной иммунной защитой, просто могут достигать более крупных размеров, чем особи того же возраста, у которых концентрация гемоцитов по какой-либо причине снижена.
Что касается среднего размера (FSC) и среднего уровня гранулярности (SSC) гемоцитов, у мидии Грея эти параметры четко и стабильно коррелировали как с возрастом, так и с размером раковины, независимо от сезона и места сбора моллюсков. Удобнее прокомментировать эту закономерность на примере осенней выборки из акватории о-ва Рейнеке, где следует ожидать наиболее чистых возрастных эффектов, не искаженных влиянием нереста. В этом случае динамика средних значений светорассеяния гемоцитов была ассоциирована с возраст-зависимым изменением пропорции клеточных морфотипов.
У возрастных мидий относительное количество гранулоцитов и их эозинофильных форм было выше, чем у молодых, что влияло на соотношение числа событий в цитометрических регионах в сторону увеличения количества клеток в R4 (крупные гемоциты с высоким уровнем гранулярности) и уменьшения в R1 (малые агранулярные гемоциты). Напомним, что накопление гранулоцитов с возрастом отмечали и у M. galloprovincialis (Carballal et al., 1998; Ottaviani et al., 1998). В одной из этих работ авторы сообщают об изменении доли гранулоцитов с 8.5% у молодых мидий до 26.6% у возрастных (Ottaviani et al., 1998), в другой – с 70 до 84% соответственно, однако тенденцию к увеличению числа гранулоцитов с возрастом наблюдали только зимой (Carballal et al., 1998). У молодых особей мидии Грея соответствующие значения в осенний период составляли 93.9 ± 3.4%, а у возрастных – 99.6 ± 0.3%; в последнем случае почти все гранулоциты могли быть представлены эозинофилами: 85.3 ± 4.3% в среднем и до 99% у отдельных особей. Эозинофильные гранулоциты, как известно, наиболее активны в отношении фагоцитоза и продукции АФК, и их можно рассматривать как терминально дифференцированные иммуноциты (Carballal et al., 1997; Wootton et al., 2003; Garcia-Garcia et al., 2008; Le Foll et al., 2010; Andreyeva et al., 2019). Таким образом, возраст-зависимое увеличение числа гранулоцитов, отмеченное и в других работах, по-видимому, должно быть связано с усилением иммунитета. У моллюсков Chamelea gallina, которым свойственно преобладание гиалиноцитов над гранулоцитами, концентрация последних все же повышалась с увеличением размера тела, при этом закономерно росли и показатели фагоцитоза (Mosca et al., 2011). В то же время у R. philippinarum на фоне одновременного увеличения числа гранулоцитов и гиалиноцитов с возрастом наблюдали снижение доли клеток, вовлеченных в фагоцитоз (Flye-Sainte-Marie et al, 2009), что, вероятно, следует расценивать как проявление возрастной динамики без изменения пропорции молодых и зрелых клеточных форм, либо объяснять дополнительным влиянием какого-то сопутствующего фактора. Принимая во внимание модель последовательного созревания гиалиноцитов в гранулоциты в ходе гемопоэза у Bivalvia (Mix,1976; Ottaviani et al., 1998; Hine, 1999), к которой склоняемся и мы (Анисимова и др., 2022), можно предположить, что у мидий скорость обновления популяции гемоцитов с возрастом снижается, за счет чего происходит смещение пропорции морфотипов в пользу терминально дифференцированных клеток – эозинофильных гранулоцитов. Возможно, этим и объясняется типичное для митилид преобладание гранулоцитов над агранулоцитами.
Основные события, связанные с размножением гемоцитов, у двустворчатых моллюсков происходят не в гемолимфе. Так, у устриц в подлежащем слое жаберного эпителия вблизи сосудов были обнаружены клетки, совмещающие пролиферативную активность с экспрессией генов Sox2 (один из маркеров стволовых клеток) и Cu/Zn-супероксиддисмутазы (маркёр гемопоэза) (Jemaà et al., 2014). Массовое размножение клеток в гемолимфе двустворчатых моллюсков, как правило, ассоциировано с гемической неоплазией (см. обзор: Одинцова, 2020), хотя и в этом случае митотическая активность клеток в гемолимфе больных мидий может оставаться низкой, что подразумевает их активную пролиферацию в других тканях (Burioli et al., 2019; Skazina et al., 2021). Тем не менее, как репликативная (Mix, 1976; Renwrantz et al., 2013), так и митотическая (Matozzo et al., 2008; Cima, Matozzo, 2018) активности свойственны циркулирующим гемоцитам Bivalvia даже в отсутствии их опухолевой трансформации или иммунологической стимуляции. У M. edulis до 9.5% клеток в гемолимфе включали предшественник синтеза ДНК бромдезоксиуридин без каких-либо митогенных стимулов, а после инъекции митогенов или отбора некоторого количества гемолимфы из аддуктора уровень пролиферации возрастал до 10–20% (Renwrantz et al., 2013). У R. philippinarum в течение 15 дней после экспериментального заражения бактериями пролиферативную активность начинали проявлять разные типы гемоцитов (Cima, Matozzo, 2018), хотя в отсутствии такой стимуляции митозы были обнаружены только в гемобластах (Matozzo et al., 2008; Cima, Matozzo, 2018). Анализ митотического цикла гемоцитов у мидии Грея, независимо от возраста и сезона, не выявил сколько-нибудь значимую их пролиферацию, даже среди гемобластов (Анисимова и др., 2022). Мы полагаем, что это отражает видовую особенность кинетики клеточных популяций C. grayanus – низкую скорость их обновления и, соответственно, долгий период жизни дифференцированных клеток, что может быть характерной чертой малоподвижных, а также долгоживущих организмов, к которым относится мидия Грея (Явнов, 2000). Некоторые факты демонстрируют радикальные отличия в стратегии поддержания тканевого гомеостаза у коротко- и долгоживущих видов. Так, долгоживущий моллюск Arctica islandica сохраняет стабильно высокий уровень антиоксидантной защиты в клетках мантии и жабр в возрастном диапазоне от 30 до 200 лет (Abele et al., 2008: цит. по: Strahl, Abele, 2010), за счет чего, вплоть до этого возраста, концентрация белковых карбонилов, появляющихся в результате окисления белков, остается низкой. В то же время в мантии короткоживущего гребешка Aequipecten opercularis всего лишь в течение двух лет наблюдали значительное снижение уровня антиоксидантной защиты и, соответственно, повышение концентрации белковых карбонилов до уровня 200-летних A. islandica (Strahl et al. 2007: цит. по: Strahl, Abele, 2010). Энергосберегающий стиль жизни A. islandica сокращает уровень окислительных повреждений и позволяет сохранять стабильное число клеток без частого их обновления, а высокозатратный метаболизм подвижного A. opercularis, коррелирующий с малой продолжительностью жизни, требует активной ротации клеточных популяций за счет высоких уровней пролиферации и апоптоза (Strahl, Abele, 2010). Описанные различия, по всей видимости, должны влиять и на функционирование системы клеточного иммунитета. Известно, что сила иммунного ответа и устойчивость к одним и тем же воздействиям не одинаковы у моллюсков разных видов, хотя эти свойства не всегда коррелируют с количеством гранулоцитов. Так, сравнение целого ряда иммунологических показателей у Cerastoderma edule, Ensis siliqua и M. edulis дает основание полагать, что у мидий при сходных параметрах гемограммы система иммунитета действует более эффективно, чем у двух других исследованных видов (Wootton et al., 2003). Вопрос видовой иммунологической специфики остается предметом обсуждений и требует дальнейших исследований с учетом комплексной характеристики объектов.
В летних выборках мидии Грея, несмотря на сохранение прямой корреляции между длиной раковины моллюска и средними показателями размера и гранулярности гемоцитов, возрастная динамика имела особенности. В июльской выборке из б. Киевка содержание эозинофильных гранулоцитов не зависело от возраста. В сентябрьской выборке из прол. Старка и вовсе с возрастом происходило снижение доли эозинофильных гранулоцитов, а относительное количество базофильных гранулоцитов росло пропорционально общему количеству клеток в циркуляции. Более того, исчезала прямая корреляция между размером тела и количеством всех гранулоцитов. В б. Киевка была отмечена дифференциация половозрелых особей на две группы по содержанию эозинофилов, что могло быть связано с асинхронностью вступления моллюсков в нерест. В этот период, как уже отмечалось выше, происходит перераспределение гранулоцитов между гемолимфой и гонадами, которое может быть настолько радикальным, что полностью инвертирует пропорцию морфотипов. Так, у Corbicula japonica в летний сезон из циркуляции практически полностью исчезали крупные гранулоциты (Анисимова и др., 2017). Нельзя исключить и влияние сезонных патогенов, которые могли спровоцировать как пролиферацию молодых гемоцитов, так и миграцию зрелых функционально активных фагоцитов в участки поражения для обеспечения локального иммунного ответа. Полагают, что не пролиферация, а именно перераспределение гемоцитов является причиной резких колебаний общего и дифференциального числа клеток в гемолимфе мидий. Например, рост относительного числа молодых базофильных клеток в гемолимфе M. edulis, вызванный инвазией токсичных микроводорослей, наблюдали одновременно со скоплением зрелых гранулоцитов вокруг пищеварительной железы – основной мишени токсического поражения (Galimany et al., 2008). Сходным образом при экспериментальном воздействии бактериальными липополисахаридами у M. edulis отмечали увеличение доли базофильных гранулоцитов на фоне снижения общей концентрации клеток и исчезновения эозинофильных гранулоцитов из циркуляции (Renwrantz et al., 2013).
Итак, у C. grayanus, как и у других митилид, возрастная динамика популяции гемоцитов оказалась связана с увеличением средних показателей размера и гранулярности клеток за счет накопления в гемолимфе высокодифференцированных форм – эозинофильных гранулоцитов. Опосредованная сезоном стадия полового цикла и, очевидно, ряд сопутствующих внешних факторов оказывали влияние на соотношение клеточных морфотипов в гемолимфе, а общая концентрация гемоцитов хоть прямо и не зависела от возраста моллюска, но положительно коррелировала с количеством молодых базофильных гранулоцитов. Последний факт противоречит экспериментальным данным Ренвранца и соавторов (Renwrantz et al., 2013), согласно которым повышение доли базофильных гранулоцитов у M. edulis коррелировало с уменьшением общего числа гемоцитов, что было связано с оттоком эозинофильных гранулоцитов в ткани. Однако примечательно, что в данной работе включения бромдезоксиуридина наблюдали только в ядрах базофильных гранулоцитов, а это указывает на их участие в восстановлении запаса функционально активных эозинофильных гранулоцитов, которые затем покидали циркуляторное русло. Таким образом, выявленные в нашем исследовании прямые связи между общей концентрацией гемоцитов, количеством базофильных гранулоцитов и размером тела моллюска в летний сезон могут отражать повышенную готовность возрастных мидий к быстрому восполнению пула циркулирующих клеток, определяя их устойчивость к сезонным факторам, требующим экстренной мобилизации системы иммунитета.
Список литературы
Анисимова А.А. Идентификация клеточных субпопуляций гемоцитов Modiolus kurilensis (Bernard, 1983) (Bivalvia: Mytilidae) методами проточной цитометрии и световой микроскопии // Биол. моря. 2012. Т. 38. № 5. С. 400–408.
Анисимова А.А. Морфофункциональные параметры гемоцитов в оценке физиологического состояния двустворчатых моллюсков // Биол. моря. 2013. Т. 39. № 6. С. 389–399.
Анисимова А.А., Пономарева А.Л., Гринченко А.В. и др. Состав и сезонная динамика клеточной популяции гемоцитов двустворчатого моллюска Corbicula japonica Prime, 1864 из эстуария реки Киевка (бассейн Японского моря) // Биол. моря. 2017. Т. 43. № 2. С. 125–132.
Анисимова А.А., Дягилева М.Н., Карушева О.А. и др. Состав и кинетика клеточной популяции гемоцитов у двустворчатого моллюска Crenomytilus grayanus (Dunker, 1853) // Биол. моря. 2022. Т. 48. № 4. С. 251–261.
Одинцова Н.А. Лейкемия-подобный рак у двустворчатых моллюсков // Биол. моря. 2020. Т. 46. № 2. С. 75–84.
Явнов С.В. Атлас двустворчатых моллюсков дальневосточных морей России. Владивосток: Дюма. 2000. 168 с.
Andreyeva A.Y., Efremova E.S., Kukhareva T.A. Morphological and functional characterization of hemocytes in cultivated mussel (Mytilus galloprovincialis) and effect of hypoxia on hemocyte parameters // Fish Shellfish Immunol. 2019. V. 89. P. 361–367.
Batel I., Fafanđel M., Smodlaka Tanković M. et al. Cell cycle alterations in the mussel Mytilus galloprovincialis hemocytes caused by environmental contamination // Acta Adriat. 2018. V. 59. № 2. P. 161–172.
Burioli E.A.V., Trancart S., Simon A. et al. Implementation of various approaches to study the prevalence, incidence and progression of disseminated neoplasia in mussel stocks // J. Invertebr. Pathol. 2019. V. 168. 107271. https://doi.org/10.1016/j.jip.2019.107271
Carballal M.J., López C., Azevedo C., Villalba A. In vitro study of phagocytic ability of Mytilus galloprovincialis Lmk. Haemocytes // Fish Shellfish Immunol. 1997. V. 7. № 6. P. 403–416.
Carballal M.J., Villalba A., López C. Seasonal variation and effects of age, food availability, size, gonadal development, and parasitism on the hemogram of Mytilus galloprovincialis // J. Invertebr. Pathol. 1998. V. 72. № 3. P. 304–312.
Cima F., Matozzo V. Proliferation and differentiation of circulating haemocytes of Ruditapes philippinarum as a response to bacterial challenge // Fish Shellfish Immunol. 2018. V. 81. P. 73–82.
Delaporte M., Soudant P., Lambert C. et al. Impact of food availability on energy storage and defense related hemocyte parameters of the Pacific oyster Crassostrea gigas during an experimental reproductive cycle // Aquaculture. 2006. V. 254. № 1–4. P. 571–582.
Donaghy L., Lambert C., Choia K-S., Soudant P. Hemocytes of the carpet shell clam (Ruditapes decussatus) and the Manila clam (Ruditapes philippinarum): current know-ledge and future prospects // Aquaculture. 2009. V. 297. № 1–4. P. 10–24.
Dos Santos F.S., Neves R.A., Crapez M.A.C. et al. How does the brown mussel Perna perna respond to environmental pollution? A review on pollution biomarkers // J. Environ. Sci. 2022. V. 111. P. 412–428. https://doi.org/10.1016/j.jes.2021.04.006
Farrington J.W., Tripp B.W., Tanabe S. et al. Edward D. Goldberg’s proposal of “the Mussel Watch”: Reflections after 40 years // Mar. Pollut. Bull. 2016. V. 110. № 1. P. 501–510.
Fisher W.S., Oliver L.M., Edwards P. Hematologic and serologic variability of Eastern oysters from Apalachicola Bay, Florida // J. Shellfish Res. 1996. V. 15. № 3. P. 555–564.
Flye-Sainte-Marie J., Soudant P., Lambert C. et al. Variabi-lity of the hemocyte parameters of Ruditapes philippinarum in the field during an annual cycle // J. Exp. Mar. Biol. Ecol. 2009. V. 377. № 1. P. 1–11.
Galimany E., Place A.R., Ramón M. et al. The effects of feeding Karlodinium veneficum (PLY # 103; Gymnodinium veneficum Ballantine) to the blue mussel Mytilus edulis // Harmful Algae. 2008. V. 7. № 1. P. 91–98.
Garcia-Garcia E., Prado-Alvarez M., Novoa B. et al. Immune responses of mussel hemocyte subpopulations are differentially regulated by enzymes of the PI 3-K, PKC, and ERK kinase families // Dev. Comp. Immunol. 2008. V. 32. № 5. P. 637–653.
Hine P.M. The inter-relationships of bivalve haemocytes // Fish Shellfish Immunol. 1999. V. 9. № 5. P. 367–385.
Jemaà M., Morin N., Cavelier P. et al. Adult somatic proge-nitor cells and hematopoiesis in oysters // J. Exp. Biol. 2014. V. 217. № 17. P. 3067–3077.
Le Foll F., Rioult D., Boussa S., Pasquier J. Characterisation of Mytilus edulis hemocyte subpopulations by single cell time-lapse motility imaging // Fish Shellfish Immunol. 2010. V. 28. № 2. P. 372–386.
Malagoli D., Casarini L., Sacchi S., Ottaviani E. Stress and immune response in the mussel Mytilus galloprovincialis // Fish Shellfish Immunol. 2007. V. 23. № 1. P. 171–177. https://doi.org/10.1016/j.fsi.2006.10.004
Matozzo V., Marin M.G., Cima F., Ballarin L. First evidence of cell division in circulating haemocytes from the Manila clam Tapes philippinarum // Cell Biol. Int. 2008. V. 32. № 7. P. 865–868.
Metzger M.J., Villalba A., Carballal M.J. et al. Widespread transmission of independent cancer lineages within multiple bivalve species // Nature. 2016. V. 534. P. 705–709.
Mix M.C. A general model for leukocyte cell renewal in bivalve mollusks // Mar. Fish. Rev. 1976. V. 38. № 10. P. 37–41.
Mosca F., Narcisi V., Cargini D. et al. Age-related properties of the Adriatic clam Chamelea gallina (L. 1758) hemocytes // Fish Shellfish Immunol. 2011. V. 31. № 6. P. 1106–1112. https://doi.org/10.1016/j.fsi.2011.09.017
Oliver L.M., Fisher W.S. Appraisal of prospective bivalve immunomarkers // Biomarkers. 1999. V. 4. № 6. P. 510–530.
Ottaviani E., Franchini A., Barbieri D., Kletsas D. Compa-rative and morphofunctional studies on Mytilus galloprovincialis hemocytes: Presence of two aging-related hemocyte stages // Ital. J. Zool. 1998. V. 65. № 4. P. 349–354.
Parrino V., Costa G., Cannavà C. et al. Flow cytometry and micro-Raman spectroscopy: Identification of hemocyte populations in the mussel Mytilus galloprovincialis (Bivalvia: Mytilidae) from Faro Lake and Tyrrhenian Sea (Sicily, Italy) // Fish Shellfish Immunol. 2019. V. 87. P. 1–8.
Pipe R.K., Coles J.A., Thomas M.E. et al. Evidence for environmentally derived immunomodulation in mussels from the Venice Lagoon // Aquat. Toxicol. 1995. V. 32. № 1. P. 59–73. https://doi.org/10.1016/0166-445X(94)00076-3
Renault T. Immunotoxicological effects of environmental contaminants on marine bivalves // Fish Shellfish Immunol. 2015. V. 46. № 1. P. 88–93. https://doi.org/10.1016/j.fsi.2015.04.011
Renwrantz L., Siegmund E., Woldmann M. Variations in hemocyte counts in the mussel, Mytilus edulis: similar reaction patterns occur in disappearance and return of molluscan hemocytes and vertebrate leukocytes // Comp. Biochem. Physiol., Part A: Mol. Integr. Physiol. 2013. V. 164. № 4. P. 629–637.
Sendra M., Carrasco-Braganza M.I., Yeste P.M. et al. Immunotoxicity of polystyrene nanoplastics in different hemocyte subpopulations of Mytilus galloprovincialis // Sci. Rep. 2020. V. 10. № 1. article ID 8637. https://doi.org/10.1038/s41598-020-65596-8
Skazina M., Odintsova N., Maiorova M. et al. First description of a widespread Mytilus trossulus-derived bivalve transmissible cancer lineage in M. trossulus itself // Sci. Rep. 2021. V. 11. № 1. article ID 5809. https://doi.org/10.1038/s41598-021-85098-5
Soudant P., Paillard C., Choquet G. et al. Impact of season and rearing site on the physiological and immunological parameters of the Manila clam Venerupis (=Tapes=Ruditapes) philippinarum // Aquaculture. 2004. V. 229. № 1–4. P. 401–418. https://doi.org/10.1016/S0044-8486(03)00352-1
Strahl J., Abele D. Cell turnover in tissues of the long-lived ocean quahog Arctica islandica and the short-lived scallop Aequipecten opercularis // Mar. Biol. 2010. V. 157. № 6. P. 1283–1292.
Wootton E.C., Dyrynda E.A., Ratcliffe N.A. Bivalve immunity: comparisons between the marine mussel (Mytilus edulis), the edible cockle (Cerastoderma edule) and the razor-shell (Ensis siliqua) // Fish Shellfish Immunol. 2003. V. 15. № 3. P. 195–210. https://doi.org/10.1016/s1050-4648(02)00161-4
Дополнительные материалы отсутствуют.