Биология моря, 2023, T. 49, № 3, стр. 186-194
Содержание микроэлементов в тканях брюхоногих моллюсков семейства Buccinidae (Gastropoda) у берегов юго-восточного Сахалина (Охотское море)
Ю. Н. Полтев 1, *, Т. Г. Коренева 1, В. Е. Марыжихин 1
1 Сахалинский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии (СахНИРО)
693023 Южно-Сахалинск, Россия
* E-mail: y.poltev@sakhniro.ru
Поступила в редакцию 14.07.22
После доработки 19.12.2022
Принята к публикации 26.01.2023
- EDN: SBMYWU
- DOI: 10.31857/S0134347523030105
Аннотация
Проведена оценка содержания Pb, Cd, Cu, Cr, Mn, Ni, Fe и As в мускуле, мантии и пищеварительной железе брюхоногих моллюсков Neptunea excelsior, N. behringiana, N. multistriata и N. varicifera, а также Buccinum verkruezeni, обитающих у берегов юго-восточного Сахалина. У представителей родов Neptunea и Buccinum отмечены различия по диапазонам варьирования и рядам последовательности значений концентраций микроэлементов в мускуле. Превышение гигиенического норматива по содержанию As в гепатопанкреасе выявлено у всех исследованных моллюсков, а в мускуле – у всех, кроме N. behringiana. Предельно допустимый уровень концентрации Cd превышен в гепатопанкреасе N. multistriata.
Моллюски семейства Buccinidae (трубачи) – одни из наиболее массовых представителей морских беспозвоночных животных Gastropoda, широко распространенные в умеренных и тропических водах, главным образом Северного полушария (Кантор, Сысоев, 2006). С учетом подсемейства Beringiinae, которое иногда выделяют в отдельное семейство, в морях Дальнего Востока России обитают более 220 видов трубачей (Golikov et al., 2001). Около 120 из них встречаются в водах Сахалина и Курильских о-вов (Клитин, Смирнов, 2021). Наряду с головоногими и двустворчатыми, брюхоногие моллюски относятся к объектам промысла. Планируемый ежегодный ловушечный вылов этих гидробионтов у берегов Сахалина составляет 1800 т, из которых 1500 т предполагается выловить у восточного побережья острова (Клитин, Смирнов, 2021). У крупных видов брюхоногих моллюсков в качестве морепродукта используются нога и мантия, у мелких – все мягкие ткани.
Способность гастропод аккумулировать микроэлементы из водной среды приводит к изменению их микроэлементного состава и ухудшению качества морепродукта, что в конечном итоге может повлиять на здоровье человека и продолжительность его жизни. Для определения безопасности пищевых продуктов, получаемых из гидробионтов, очень важна количественная оценка содержания элементов, в том числе нормируемых, в органах и тканях промысловых беспозвоночных. Информация о микроэлементном составе брюхоногих моллюсков в дальневосточных морях России ограничивается сведениями по элементному составу мягких тканей Lottia pelta (Rathke, 1833) (= Collisella cassis), обитающей в литорали и самой верхней сублиторали южных Курильских о-вов (Христофорова, Малиновская, 2000) и Японского моря (Христофорова, 1981), а также некоторых глубоководных представителей Buccinidae из впадины Дерюгина (1431–1448 м) и охотоморских вод у о-ва Парамушир (778 м) (Kosyan, Gulbin, 2016).
Недостаточная освещенность данного вопроса послужила основой для постановки цели настоящего исследования – выявить содержание и особенности накопления микроэлементов, в том числе токсичных, в органах и тканях брюхоногих моллюсков из морских вод юго-восточного Сахалина для оценки микроэлементного состава и качества этих промысловых гидробионтов.
МАТЕРИАЛ И МЕТОДИКА
Материалом для анализа служили образцы мускула (ноги), мантии и гепатопанкреаса брюхоногих моллюсков семейства Buccinidae, добытых с помощью донного трала в ходе научно-исследовательских работ на НИС “Дмитрий Песков” в июне 2020 г. В координатах 48°21′ с.ш., 145°06′ в.д. с глубины 140 м отловлены Neptunea excelsior Fraussen et Terryn, 2017 и N. behringiana (Middendorff, 1849); N. multistriata (Aurivillius, 1885) – с глубины 61 м (47°59′ с.ш., 143°28′ в.д.); N. varicifera (Dall, 1907) (47°36′ с.ш., 144°19′ в.д.) и Buccinum verkruezeni Kobelt, 1882 (47°44′4 с.ш., 144°31′4 в.д.) – с глубины 161 м (рис. 1). Для получения образцов тканей использовали по 1 экз. каждого вида моллюсков. Высота раковины выловленных особей изменялась от 61 до 134 мм, диаметр устья – от 37 до 76 мм, масса животного с раковиной – от 25 до 196 г (табл. 1).
Рис. 1.
Места отбора брюхоногих моллюсков семейства Buccinidae: 1 – Neptunea excelsior и N. behringiana; 2 – N. varicifera; 3 – Buccinum verkruezeni; 4 – N. multistriata.
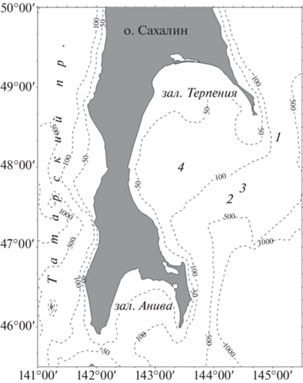
Таблица 1.
Некоторые биологические параметры исследованных брюхоногих моллюсков семейства Buccinidae
| Вид | Пол | Высота раковины, мм | Диаметр устья раковины, мм | Масса*, г |
|---|---|---|---|---|
| Neptunea excelsior | Самец | 110 | 68 | 140 |
| N. behringiana | Самец | 102 | 61 | 115 |
| N. multistriata | Самец | 61 | 37 | 25 |
| N. varicifera | Самец | 134 | 76 | 196 |
| Buccinum verkruezeni | Самка | 104 | 59 | 94 |
Керамическим ножом от тела брюхоногих моллюсков отделяли мускул, мантию и гепатопанкреас. Полученные пробы хранили в морозильной камере при температуре –20°С, перед анализом размораживали, гомогенизировали и отбирали навеску массой 1 г с точностью до 0.01 г.
Навески помещали в тефлоновые сосуды, приливали по 5 см3 азотной кислоты особой чистоты (ОСЧ), затем проводили минерализацию в лабораторной микроволновой системе MARS 6 (Cem Corp., USA) при максимальных значениях температуры 300°С, давлении 800 psi. Минерализаты количественно переносили в градуированные пробирки объемом 10 см3, доводили до метки дистиллированной водой и анализировали (Методика…, 2009). Анализ навесок выполняли в двух повторностях. Для контроля чистоты кислоты для каждой партии проб (5 шт.) проводили минерализацию холостой пробы.
Концентрации Pb, Cd, Cu, Cr, Mn, Ni и As определяли атомно-абсорбционным методом в режиме электротермической атомизации (GFAA) на спектрофотометре АА-6800 (Shimadzu, Япония) с графитовой печью и коррекцией фона на основе эффекта Зеемана. Концентрацию Fe измеряли этим же методом, но в пламенном режиме с дейтериевой коррекцией фона (FLAA). Точность измерений составила 20% для Fe, 25% – для Pb и Cu, 26% – для Cd, 32% – для As и Mn, 34% – для Cr и 36% – для Ni (Методика …, 2009). Для градуировки спектрофотометра и контроля точности результатов измерений применяли стандартные образцы утвержденного типа – ГСО 7330-96 состава раствора ионов металлов (Fe, Cd, Mn, Cu, Ni и Pb), ГСО 7264-96 состава раствора ионов As (III), ГСО 7781-2000 состава раствора ионов Cr (VI).
РЕЗУЛЬТАТЫ
Полученные результаты свидетельствуют о широком диапазоне концентраций и разных уровнях аккумуляции микроэлементов органами и тканями брюхоногих моллюсков. Наибольшее различие между максимальным и минимальным содержанием в органах и тканях нептуней характерно для Cd. У Neptunea varicifera эти показатели различаются в 14.3 раза, а у N. multistriata – до 72 раз. Содержание Cr характеризуется наибольшим постоянством, различия между его максимумом и минимумом составляют от 1.3 раза у N. multistriata и N. behringiana до 1.6 раза у N. excelsior (табл. 2). У Buccinum verkruezeni максимальное различие накопления (8.2 раза) характерно для Cu, минимальное – для As, содержание которого в тканях этого моллюска оставалось практически на одном уровне.
Таблица 2.
Концентрации микроэлементов в тканях брюхоногих моллюсков семейства Buccinidae из вод юго-восточного Сахалина
| Ткань/орган | Микроэлемент, мг/кг сырой массы | |||||||
|---|---|---|---|---|---|---|---|---|
| Fe | As | Cu | Mn | Cr | Ni | Pb | Cd | |
| Neptunea excelsior | ||||||||
| Мускул | 22 | 5.3 | 4.0 | 1.5 | 0.90 | 0.26 | 0.17 | 0.04 |
| Гепатопанкреас | 192 | 20.5 | 7.3 | 3.9 | 0.92 | 2.64 | 0.26 | 0.61 |
| Мантия | 35 | 10.7 | 4.9 | 1.4 | 0.56 | 0.24 | 0.07 | 0.32 |
| N. behringiana | ||||||||
| Мускул | 38 | 3.8 | 11.5 | 1.5 | 0.54 | 0.37 | 0.06 | 0.01 |
| Гепатопанкреас | 197 | 6.7 | 5.8 | 6.5 | 0.71 | 1.82 | 0.28 | 0.58 |
| Мантия | 44 | 7.7 | 16.5 | 2.8 | 0.60 | 0.77 | 0.08 | 0.39 |
| N. varicifera | ||||||||
| Мускул | 145 | 90.1 | 6.2 | 3.0 | 0.58 | 0.29 | 0.09 | 0.03 |
| Гепатопанкреас | 216 | 92.1 | 39.7 | 15.0 | 0.68 | 0.85 | 0.58 | 0.43 |
| Мантия | 93 | 15.2 | 8.3 | 3.2 | 0.80 | 0.20 | 0.07 | 0.04 |
| N. multistriata | ||||||||
| Мускул | 108 | 11.0 | 9.3 | 3.8 | 0.43 | 0.30 | 0.08 | 0.05 |
| Гепатопанкреас | 213 | 6.5 | 13.2 | 2.9 | 0.32 | 1.29 | 0.48 | 3.60 |
| Buccinum verkruezeni | ||||||||
| Мускул | 60 | 28.8 | 5.2 | 1.1 | 0.74 | 0.31 | 0.08 | 0.21 |
| Гепатопанкреас | 134 | 27.8 | 42.8 | 0.5 | 0.15 | 0.46 | 0.15 | 0.24 |
| Соотношение max и min значений концентраций микроэлементов в тканях | ||||||||
| Мускул | 6.6 | 23.7 | 2.9 | 3.5 | 2.1 | 1.4 | 2.8 | 21.0 |
| Гепатопанкреас | 1.6 | 14.2 | 7.4 | 30.0 | 6.1 | 5.7 | 3.9 | 15.0 |
| Мантия | 2.7 | 2.0 | 3.4 | 2.3 | 1.4 | 3.9 | 1.1 | 8.0 |
В мускуле всех исследованных особей максимальное различие предельных значений концентрации элемента отмечено для As (23.7 раза), минимальное – для Ni (1.4 раза). В гепатопанкреасе разных видов гастропод этот показатель был максимальным для Mn, содержание которого варьировало от 15.0 до 0.5 мг/кг сырой массы, минимальной была разница в содержании Fe (1.6 раза). В мантии предельные значения концентраций максимально отличались у Cd (8.0 раз), а содержание Pb у разных видов было практически одинаковым.
Последовательность микроэлементов, расположенных в порядке снижения их содержания в исследованных тканях отдельных видов брюхоногих моллюсков, также различалась (рис. 2, табл. 3). У N. excelsior в разных тканях в ряду совпадало положение Fe, As, Cu и Mn, у N. behringiana – только Fe, у N. multistriata – Fe, Ni и Pb, а у B. verkruezeni – Fe, Mn и Pb. В рядах последовательностей для мантии и мускула N. varicifera совпадало положение всех элементов, а для гепатопанкреаса – всех, кроме Ni и Cr. В целом, в тканях всех исследованных моллюсков максимальными были концентрации Fe, минимальными – преимущественно Cd или Pb (табл. 3).
Рис. 2.
Распределение концентраций микроэлементов в мускуле (а), гепатопанкреасе (б) и мантии (в) брюхоногих моллюсков из вод юго-восточного Сахалина (Охотское море).
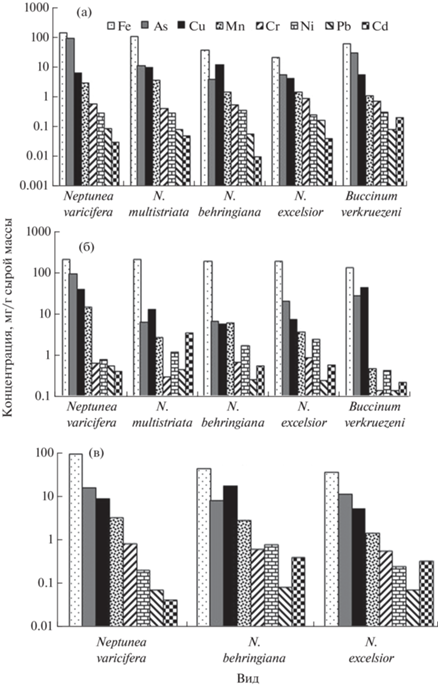
Таблица 3.
Последовательности микроэлементов по мере убывания их концентрации в тканях брюхоногих моллюсков семейства Buccinidae
| Вид | Ткань | Микроэлемент | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Neptunea excelsior | Гепатопанкреас | Fe | As | Cu | Mn | Ni | Cr | Cd | Pb |
| Мантия | Fe | As | Cu | Mn | Cr | Cd | Ni | Pb | |
| Мускул | Fe | As | Cu | Mn | Cr | Ni | Pb | Cd | |
| N. behringiana | Гепатопанкреас | Fe | As | Mn | Cu | Ni | Cr | Cd | Pb |
| Мантия | Fe | Cu | As | Mn | Ni | Cr | Cd | Pb | |
| Мускул | Fe | Cu | As | Mn | Cr | Ni | Pb | Cd | |
| N. varicifera | Гепатопанкреас | Fe | As | Cu | Mn | Ni | Cr | Pb | Cd |
| Мантия | Fe | As | Cu | Mn | Cr | Ni | Pb | Cd | |
| Мускул | Fe | As | Cu | Mn | Cr | Ni | Pb | Cd | |
| N. multistriata | Гепатопанкреас | Fe | Cu | As | Cd | Mn | Ni | Pb | Cr |
| Мускул | Fe | As | Cu | Mn | Cr | Ni | Pb | Cd | |
| Buccinum verkruezeni | Гепатопанкреас | Fe | As | Cu | Mn | Cr | Ni | Cd | Pb |
| Мускул | Fe | Cu | As | Mn | Ni | Cd | Cr | Pb | |
В мускуле последовательность микроэлементов, расположенных в порядке убывания их концентрации, полностью совпадала у N. excelsior, N. varicifera и N. multistriata, а у N. behringiana и B. verkruezeni отличалась незначительно (табл. 3).
Наибольшее содержание в мускуле Fe и As отмечено у N. varicifera, Cu и Ni – у N. behringiana, Mn – N. multistriata, Cr – N. excelsior, а Pb и Cd – у B. verkruezeni. Минимальные концентрации Fe, Cu и Ni зафиксированы у N. excelsior; As, Pb и Cu – у N. behringiana; Mn – у B. verkruezeni и Cr – у N. multistriata (табл. 2).
В гепатопанкреасе максимальные концентрации Fe, As, Mn и Pb выявлены у N. varicifera, Cr и Ni – у N. excelsior, Cd – у N. multistriata и Cu – у B. verkruezeni (табл. 2). Минимальное содержание большинства рассматриваемых микроэлементов (Mn, Cr, Ni, Pb и Cd) в этой железе установлено для B. verkruezeni, As – для N. multistriata и Cu – для N. behringiana (табл. 4).
Таблица 4.
Последовательности видов брюхоногих моллюсков, расположенных по мере убывания содержания отдельных элементов в их тканях
| Элемент | Ткань | Последовательность видов |
|---|---|---|
| Fe | Мускул | N. varicifera > N. multistriata > B. verkruezeni > N. behringiana > N. excelsior |
| Гепатопанкреас | N. varicifera > N. multistriata > N. behringiana > N. excelsior > B. verkruezeni | |
| Мантия | N. varicifera > N. behringiana > N. excelsior | |
| As | Мускул | N. varicifera > B. verkruezeni > N. multistriata > N. excelsior > N. behringiana |
| Гепатопанкреас | N. varicifera > B. verkruezeni > N. excelsior > N. behringiana > N. multistriata | |
| Мантия | N. varicifera > N. excelsior > N. behringiana | |
| Cu | Мускул | N. behringiana > N. multistriata > N. varicifera > B. verkruezeni > N. excelsior |
| Гепатопанкреас | B. verkruezeni > N. varicifera > N. multistriata > N. excelsior > N. behringiana | |
| Мантия | N. behringiana > N. varicifera > N. excelsior | |
| Mn | Мускул | N. multistriata > N. varicifera > N. excelsior > N. behringiana > B. verkruezeni |
| Гепатопанкреас | N. varicifera > N. behringiana > N. excelsior > N. multistriata > B. verkruezeni | |
| Мантия | N. varicifera > N. behringiana > N. excelsior | |
| Cr | Мышцы | N. excelsior > B. verkruezeni > N. varicifera > N. behringiana > N. multistriata |
| Гепатопанкреас | N. excelsior > N. behringiana > N. varicifera > N. multistriata > B. verkruezeni | |
| Мантия | N. varicifera > N. behringiana > N. excelsior | |
| Ni | Мышцы | N. behringiana > B. verkruezeni > N. multistriata > N. varicifera > N. excelsior |
| Гепатопанкреас | N. excelsior > N. behringiana > N. multistriata > N. varicifera > B. verkruezeni | |
| Мантия | N. behringiana > N. excelsior > N. varicifera | |
| Pb | Мышцы | B. verkruezeni > N. excelsior > N. varicifera > N. multistriata > N. behringiana |
| Гепатопанкреас | N. varicifera > N. multistriata > N. behringiana > N. excelsior > B. verkruezeni | |
| Мантия | N. behringiana > N. excelsior > N. varicifera | |
| Cd | Мышцы | B. verkruezeni > N. multistriata > N. excelsior > N. varicifera > N. behringiana |
| Гепатопанкреас | N. multistriata > N. excelsior > N. behringiana > N. varicifera > B. verkruezeni | |
| Мантия | N. behringiana > N. excelsior > N. varicifera |
Нептунеи, в отличие от представителя рода Buccinum, демонстрируют сходство по микроэлементам с максимальной (Cd) и минимальной (Cr) вариативностью концентраций. Кроме того, у разных представителей рода Neptunea положение микроэлементов в рядах последовательности их концентраций в мускуле совпадает или отличается незначительно.
ОБСУЖДЕНИЕ
Известно, что биодоступность вещества зависит от его химических свойств и химических свойств среды, от уровня температуры и присутствия взвешенных веществ, а также от особенностей и состояния гидробионтов (Алексевнина, Поздеев, 2016). В нашем исследовании также прослеживается зависимость уровней аккумуляции микроэлементов органами и тканями брюхоногих моллюсков от ряда факторов. Так, у близких по размерам нептуней Neptunea excelsior и N. behringiana, отобранных на одном участке (глубина 140 м), концентрации микроэлементов в отдельных тканях различались в пределах 1.0–4.0 раз. У представителей разных родов N. varicifera и Buccinum verkruezeni, выловленных в одном и том же месте на глубине 161 м, в мускуле и гепатопанкреасе различия в содержании всех микроэлементов также находились в пределах одного порядка (от 1.1 до 4.5 раза), за исключением Mn, содержание которого в гепатопанкреасе N. varicifera было выше на порядок. Максимальные различия в содержании микроэлементов в тканях выловленной с глубины 61 м наиболее мелкоразмерной N. multistriata относительно N. excelsior и N. behringiana отмечены для Cd в гепатопанкреасе (выше в 5.9 и 6.2 раза соответственно), относительно N. varicifera – для As в гепатопанкреасе (на порядок ниже) и относительно B. verkruezeni – для Cd в гепатопанкреасе (на порядок выше). Близость мест поимок и сходные глубины (рис. 1) позволяют предположить, что на участках обитания N. varicifera и B. verkruezeni абиотические характеристики были сходными, как и в местах обитания N. excelsior и N. behringiana, но отличались от таковых у N. multistriata.
Отличия в содержании микроэлементов могут определяться не только параметрами среды, но и разными стадиями онтогенеза, физиологическим состоянием исследованных особей, а также видовыми особенностями аккумуляции элементов (Покаржевский, 1993) и особенностями питания. Как известно, брюхоногие моллюски могут быть детритофагами (Minami, 2000), падальщиками (Aguzzi et al., 2012) или хищниками, нападающими на полихет, двустворчатых (Taylor, 1978) и брюхоногих (Yamakami, Wada, 2021) моллюсков. Исследования, проведенные в водах северо-западной Атлантики, показали, что основу питания букцинума B. undatum составляют полихеты, а нептунеи N. antiqua – двустворчатые моллюски (Taylor, 1978). Возможно, у исследованных нами представителей родов Buccinum и Neptunea объекты преимущественного питания также различались, оказывая влияние на микроэлементный состав.
Геохимические особенности распределения микроэлементов в районах обитания гидробионтов влияют на аккумуляцию, определяя географические различия в рядах последовательности содержания микроэлементов в моллюсках. Так, в корейских водах ряды последовательности средних значений концентрации микроэлементов в N. arthritica cumingii и B. striatissimum имеют одинаковый вид: Cu > Mn > Pb > Cd > Cr > Ni (Mok et al., 2010), отличаясь от исследованных нами представителей родов Neptunea и Buccinum более высоким положением Pb и более низким – Ni.
Концентрации микроэлементов Cu > Cr > Ni > > Pb > Cd в мягких тканях (без органов пищеварения и выделения) брюхоногого моллюска Cipangopaludina chinensis (= Cipangopaludina chinensis malleata) из вод Кореи (Kim, Kim, 2006) и в тканях нептуней юго-восточного Сахалина располагаются в одинаковой последовательности. Не отличаются и последовательности концентраций микроэлементов в исследованных нами тканях брюхоногих моллюсков (за исключением гепатопанкреаса N. behringiana, где Fe > Mn > Cu > Pb) и в тканях Nerita bolteata (= Nerita articulate) и Littoraria undulata (= Littorina (Littoraria) undulata) из эстуария р. Хугли в Западной Бенгалии (Индия) (Mitra, Choudhury, 1993).
В ряду последовательностей микроэлементов в мускуле букцинума B. undatum из норвежских вод Fe, содержание которого было максимальным у исследованных нами брюхоногих моллюсков, занимает лишь третью (иногда вторую) позицию. Наиболее высокие концентрации отмечены для As, а вторую (иногда третью) позицию занимает Cu (Bakke et al., 2011).
Исследования брюхоногих моллюсков из впадины Дерюгина и охотоморских вод вблизи о-ва Парамушир показали, что для мускула и гепатопанкреаса N. convexa, N. insularis, B. pemphigus и Ancistrolepis grammata (= Ancistrolepis grammatus) короткий ряд последовательностей содержания микроэлементов в тканях имеет вид: Fe > Cu > > Cd > Ni (Kosyan, Gulbin, 2016), отличаясь от последовательностей рассматриваемых видов положением Cd и Ni.
Полученные нами данные характеризуют микроэлементный состав брюхоногих моллюсков на период их вылова. Ранее показано, что концентрации микроэлементов в тканях отдельных видов брюхоногих моллюсков зависят как от участка обитания (Bakke et al., 2011; Duysak, Ersoy, 2014), так и от времени года (Duysak, Ersoy, 2014; Ghosh et al., 2016), причем для Fe, Cu, Pb и Cr они могут различаться на порядок (Duysak, Ersoy, 2014).
Для гепатопанкреаса исследованных видов характерно более высокое, чем в мускуле и мантии, содержание анализируемых микроэлементов. У N. excelsior это справедливо для всех элементов, у N. behringiana – для Fe, Mn, Ni, Pb и Cd, у N. multistriata – Fe, Cu, Ni, Pb и Cd, у N. varicifera – Fe, As, Cu, Mn, Ni, Pb и Cd и у B. verkruezeni – Fe, Cu, Ni, Pb и Cd. Это согласуется с данными, полученными ранее для брюхоногих моллюсков из впадины Дерюгина и охотоморских вод вблизи о-ва Парамушир (Kosyan, Gulbin, 2016).
Орган-мишень – это орган или ткань, на которые в первую очередь воздействует то или иное вещество, в данном случае – орган, в котором концентрация микроэлементов превышает их содержание в других тканях в 5 и более раз. У исследованных представителей Buccinidae это гепатопанкреас, в котором у N. excelsior в 5 и более раз выше содержание Fe, Cr и Cd, у N. behringiana – Fe и Cd, у N. varicifera – As, Cu, Mn, Pb и Cd, у N. multistriata – Cd и у Buccinum verkruezeni – Cu. Органом-мишенью для As является также мускул N. varicifera.
В тканях исследованных моллюсков минимальные концентрации микроэлементов отмечены для Pb или Cd, максимальные – для Fe, что соответствует их содержанию (для Cd частично) в донных отложениях. На сопредельном участке шельфа северо-восточного Сахалина концентрации (мг/кг сухой массы) кислоторастворимых форм элементов в грунте снижаются в ряду в следующем порядке: Fe (2567) > Cr (4.72) > As (2.69) > > Pb (2.03) > Cu (0.92) > Cd (0.018) (Лишавская, Мощенко, 2008). Порядок распределения остальных рассмотренных элементов в тканях букцинид и в донных отложениях не совпадает. Более высокое положение As и Cu в рядах концентраций микроэлементов у букцинид относительно донных отложений обусловлено тем, что они, как и Fe, относятся к поглощаемым из геохимической среды биофильным элементам, которые используются в процессе жизнедеятельности гидробионтов (Геологический словарь, 1973). Накапливается все больше данных о важности этих микроэлементов в обеспечении нормальной жизнедеятельности организма (Скальный, Рудаков, 2005), в том числе и для As, который относят к биофильным (Иваненко, Ковековдова, 2014) или к условно биофильным элементам. По регламентирующим документам (СанПиН 2.3.2.1078-01, 2002; Технический регламент ТР ТС 021…, 2011; Технический регламент ТР ЕАЭС 040…, 2016), допустимые уровни токсичных элементов для беспозвоночных составляют для Pb – 10, для As – 5 и Cd – 2 мкг/г сырой массы. В мускуле исследованных брюхоногих моллюсков допустимые уровни по As превышены у всех видов, за исключением N. behringiana, а в гепатопанкреасе – у всех видов. Причем в мышцах и гепатопанкреасе N. varicifera нормы As превышены на порядок. В гепатопанкреасе N. multistriata отмечено также превышение допустимого содержания Cd (табл. 2).
Известно, что неорганические формы As более токсичны, чем органические (Leermakers et al., 2006). В морской биоте мышьяк содержится преимущественно в виде малотоксичных органических соединений: арсенобентаин, арсеносахара, арсенохолин и арсенолипиды, а также метиларсонат и диметиларсинат (Щукин и др., 2019). Согласно литературным данным, содержание неорганических форм As у рыб и морских млекопитающих в большинстве случаев ниже предела обнаружения, а у других групп гидробионтов – не выше 0.060 мг/кг. Во всех пробах содержание неорганического мышьяка составляет менее 1% от его общего содержания (Sloth et al., 2005). Содержание общего As в мышцах Buccinum undatum из норвежских вод в разных районах составило 15, 46 и 28 мг/кг сырой массы, а неорганического – 0.0026, 0.0069 и менее 0.0027 мг/кг сырой массы (Bakke et al., 2011). Следовательно, высокие значения общего содержания As в гидробионтах, в частности, в брюхоногих моллюсках, превышающие допустимые уровни содержания этого элемента, не являются показателем опасности для человека. На основании этого допустимые уровни содержания As в гидробионтах, прописанные в отечественных нормативных документах, необходимо привести в соответствие с научными данными.
Согласно полученным нами результатам, в мускуле исследованных брюхоногих моллюсков максимальная вариабельность содержания характерна для As и Cd, минимальная – для Ni. В гепатопанкреасе этот показатель был максимальным для Mn и минимальным для Fe, в мантии – соответственно для Cd и Pb. В тканях нептуней наибольшей вариабельностью концентраций отличался Cd, наименьшей – Cr. У B. verkruezeni наиболее широкий диапазон значений отмечен для Cu, минимальный – для As. Мускул нептуней характеризуется одинаковой (Fe > > As > Cu > Mn > Cr > Ni > Pb > Cd) или близкой последовательностями микроэлементов, расположенных в порядке снижения уровней их содержания в моллюсках, отличаясь от таковой у букцинума (Fe > Cu > As > Mn > Ni > Cd > Cr > Pb).
Превышение санитарно-гигиенического норматива по содержанию кадмия отмечено в гепатопанкреасе N. multistriata. Допустимые уровни по мышьяку превышены в гепатопанкреасе всех видов исследованных брюхоногих моллюсков, в мускуле также у всех, за исключением N. behringiana.
Список литературы
Алексевнина М.С., Поздеев И.В. Санитарная гидробиология с основами водной токсикологии: учебное пособие. Пермь: Книжный формат. 2016. 205 с.
Геологический словарь: в 2-х томах. М.: Недра. 1973. 456 с.
Иваненко Н.В., Ковековдова Л.Т. Микроэлементный состав лекарственных растений Приморского края // Тихоокеанский медицинский журнал. 2014. № 2. С. 18–21.
Кантор Ю.И., Сысоев А.В. Морские и солоноватоводные брюхоногие моллюски России и сопредельных стран: иллюстрированный каталог. М.: Т-во науч. изд. КМК. 2006. 371 с.
Клитин А.К., Смирнов И.П. Морские брюхоногие моллюски сахалино-курильских вод (семейство Buccinidae). Атлас. Серия “Естественная история Сахалина и Курильских островов”. Южно-Сахалинск: Сахалин – Приамурские ведомости. 2021. 136 с.
Лишавская Т.С., Мощенко А.В. Некоторые металлы в донных отложениях прибрежных акваторий острова Сахалин // Изв. ТИНРО. 2008. Т. 153. С. 295–311.
Методика количественного химического анализа. Определение As, Pb, Cd, Sn, Cr, Cu, Fe, Mn и Ni в пробах пищевых продуктов и пищевого сырья атомно-абсорбционным методом с электротермической атомизацией. № М-02-1009-08. Аттест. ВНИИМ им. Д.И. Менделеева. Свид-во № 242/43-09 от 08.07.2009. ООО “Аналит”. 2009. 21 с.
Покаржевский А.Д. Геохимическая экология наземных и почвенных животных (биоиндикационные и радиоэкологические аспекты). Автореф. дис. докт. биол. наук. Москва. 1993. 38 с.
СанПиН 2.3.2.1078-01. Гигиенические требования безопасности и пищевой ценности пищевых продуктов (с изменениями на 6 июля 2011 г.). М.: Минздрав России. 2002. 36 с.
Скальный А.В., Рудаков И.А. Биоэлементалогия – новый термин или новое научное направление? // Вестник ОГУ. 2005. № 2S-2(40). С. 4–8.
Технический регламент Таможенного союза ТР ТС 021/2011 “О безопасности пищевой продукции” / Комиссия Таможенного союза. 2011. 242 с.
Технический регламент Евразийского экономического союза “О безопасности рыбы и рыбной продукции” ТР ЕАЭС 040/2016 / Совет Евразийской экономической комиссии. 2016. 135 с.
Христофорова Н.К., Малиновская Т.М. Содержание металлов в моллюсках-индикаторах южных Курильских островов // Бюллетень дальневосточного малакологического общества. 2000. Вып. 4. С. 107–108.
Христофорова Н.К. Содержание тяжелых металлов в брюхоногом моллюске Collisella cassis из Японского моря // Биол. моря. 1981. № 4. С. 66–72.
Щукин В.М., Ерина А.А., Лисман Е.С. и др. Проблемы нормирования мышьяка в бурых водорослях и лекарственных препаратах на их основе // Ведомости Научного центра экспертизы средств медицинского применения. 2019. Т. 9. № 3. С. 167–171.
Aguzzi J., Jamieson A.J., Fujii T. et al. Shifting feeding behaviour of deep-sea buccinid gastropods at natural and simulated food falls // Mar. Ecol. Progr. Ser. 2012. V. 458. P. 247–253.
Bakke S., Frantzen S., Børnes C. Regional occurrence of heavy metals in the common whelk (Buccinum undatum) in Norway // Proceedings of: West European Fish Technologists Association Conference, Gothenburg 27–30 Sep. 2011. https://www.researchgate.net/publication/325828332_ Regional_occurrence_of_heavy_metals_in_the_common_whelk_Buccinum_undatum_in_Norway. Accessed: 05.01.2022.
Duysak Ö., Ersoy B. A Biomonitoring study: heavy metals in Monodonta turbinata (Mollusca: Gastropoda) From Iskenderun Bay, North-Eastern Mediterranean // Pakistan J. Zoology. 2014. V. 46. № 5. P. 1317–1322.
Golikov A.N., Sirenko B.I., Gulbin V.V. et al. Checklist of shell-bearing gastropods of the northwestern Pacific // Ruthenica. 2001. V. 11. № 2. P. 153–173.
Ghosh I., Maitra S., Biswas S. et al. First record on seasonal variations of heavy metal concentrations in Neritina (Dostia) violacea (Gmelin) from Nayachar Island, West Bengal, India // J. Environ. Sci. Comput. Sci. Eng. Technol. 2016. V. 5. № 2. P. 23–30.
Kim H.T., Kim J.G. Heavy Metal Concentrations in the Mollusc Gastropod, Cipangopaludina chinensis malleata from Upo Wetland Reflect the Level of Heavy Metals in the Sediments // J. Ecol. and Environ. 2006. V. 29. № 5. P. 453–460.
Kosyan A., Gulbin V. First case of imposex in Neptunea convexa (Gastropoda: Buccinidae) from bathyal depths (Sea of Okhotsk, >1400 v) // EMECS 11 – Sea coasts XXVI. Managing risks to coastal regions and communities in a changing world, St. Petersburg, August 22–27. 2016. P. 197.
Leermakers M., Baeyens W., De Gieter M. et al. Toxic arsenic compounds in environmental samples: Speciation and validation // Trends in Analyt. Chem. 2006. V. 25. № 1. P. 1–10.
Minami T. Food chain structure in the offshore benthic communities // Research and Information Office, Global Environment Department, Environment Agency (ed.), Global Environment Research in Japan (Final Reports for Projects Completed in 1999) Part 2. Tokyo, Ministry of Environment. 2000. P. 105–112.
Mitra A., Choudhury A. Trace metals in macrobenthic molluscs of the Hooghly Estuary, India // Mar. Pollut. Bull. 1993. V. 26. № 9. P. 521–522.
Mok J.S., Lee K.J., Shim K.B. et al. Contents of heavy metals in marine invertebrates from the Korean coast // J. Korean Society of Food Science and Nutrition. 2010. V. 39. № 6. P. 894–901.
Sloth J.J., Larsen E.H., Julshamn K. Survey of Inorganic Arsenic in marine animals and marine certified reference materials by anion exchange high-performance liquid chromatography-inductively coupled plasma mass spectrometry // J. Agric. and Food Chem. 2005. V. 53. P. 6011–6018.
Taylor J.D. Diet of Buccinum undatum and Neptunea antiqua (Gastropoda: Buccinidae) // J. Conchol. 1978. V. 29. № 6. P. 309–318.
Yamakami R., Wada S. Prey utilization by Neptunea arthritica (Caenogastropoda: Buccinidae): predation on gastropods and size-related variation // J. Molluscan Studies. 2021. V. 87. eyab016. https://doi.org/10.1093/mollus/eyab016
Дополнительные материалы отсутствуют.


