Биология моря, 2023, T. 49, № 3, стр. 175-185
Структура зоопланктонного сообщества в водах шпицбергена в зимний период
И. В. Берченко 1, *, А. А. Олейник 1, **
1 Мурманский морской биологический институт РАН
183010 Мурманск, Россия
* E-mail: berchenko.igor@gmail.com
** E-mail: oleinik@mmbi.info
Поступила в редакцию 10.03.2022
После доработки 26.10.2022
Принята к публикации 26.01.2023
- EDN: SAYGLE
- DOI: 10.31857/S0134347523030038
Аннотация
В зимний период с 30 ноября по 6 декабря 2015 г. исследовали планктонное сообщество Ис-фьорда (центральная часть западного побережья о-ва Западный Шпицберген). Отбор проб производили с борта НИС “Дальние Зеленцы” сетными и батометрическими ловами. Установлен качественный и количественный состав микро- и мезопланктона в разных частях Ис-фьорда, отличающихся гидрологической структурой вод. Отмечено, что данные по числу науплиев мелких копепод в пробах значительно различались в зависимости от способа лова. Основной акцент в обсуждении результатов исследований сделан на рассмотрении методических особенностей планктонных исследований на арктических акваториях в зимний период.
В полярных широтах неравномерность распределения солнечной энергии, поступающей в течение года, является основополагающим условием в формировании структуры арктических планктонных сообществ и ее сезонных изменений (Eilertsen, Degerlund, 2010). Данный фактор значительно воздействует на фитопланктонное сообщество – основу пищевой сети пелагиали – и опосредованно проявляется на всех трофических уровнях.
По общепринятым представлениям, активные процессы репродукции и роста в популяциях зоопланктонных организмов протекают в весенне-летний период, когда наблюдается максимальное обилие пищевых ресурсов, в данном случае фитопланктона. В зимний период в условиях практически полного отсутствия света (полярная ночь) продукционные характеристики фитопланктона минимальны и виды-фитофаги в большинстве своем пребывают в состоянии диапаузы, выживая за счет снижения биологической активности и использования запасенных ранее внутренних резервов (Lee et al., 2006).
По мере увеличения внимания к структурно-функциональным характеристикам планктонных сообществ в зимнее время критически важное значение приобретает объем доступной для анализа информации. Получение новых данных позволит как уточнить и детализировать существующие представления, так и вписать в общую картину уже имеющиеся противоречивые факты. Например, Берг с соавторами (Berge et al., 2015) указывают на высокие значения численности науплиев некоторых видов зоопланктона зимой, что, по мнению авторов, является свидетельством высокой биологической активности видов в это время.
Несмотря на уже проделанную работу (Daase et al., 2014; Morata, Søreide, 2015; Morata et al., 2015), мы все еще мало знаем о многих аспектах популяционной экологии зоопланктонных видов, активных в течение полярной ночи. Это относится не только к всеядным/хищным, но и к организмам-фитофагам, участвующим в пелагической жизни в зимнее время (Bathmann et al., 1990; Pedersen et al., 1995). Нераскрытыми остаются вопросы смертности и продукции яиц, уровней метаболизма и биохимического состава особей, а в более широком смысле – роли зоопланктона в передаче энергии другим участникам пищевых сетей.
Основная цель нашей работы, посвященной изучению планктона в акватории Ис-фьорда (архипелаг Шпицберген), – установить структурные особенности зоопланктонного сообщества в период полярной ночи и сравнить полученные данные с результатами других исследований.
МАТЕРИАЛ И МЕТОДИКА
Характеристика района исследования
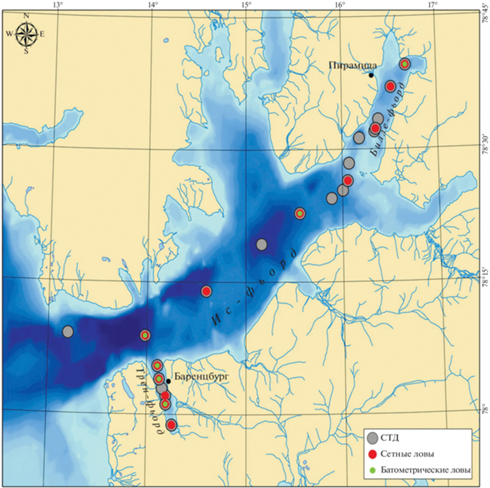
Исследованная акватория представляет собой крупнейшую фьордовую систему западного побережья архипелага Шпицберген. Станции отбора проб располагались в центральной части Ис-фьорда, а также во входящих в его состав Грен-фьорде и Билле-фьорде (рис. 1). Основная акватория Ис-фьорда не имеет подводного порога и открыта для беспрепятственного проникновения атлантических водных масс Западно-Шпицбергенского течения, что оказывает значительное воздействие на формирование гидрологической структуры водной толщи в течение всего года (Nilsen et al., 2008). Грен-фьорд, расположенный на южной стороне Ис-фьорда вблизи от его выхода, сравнительно небольшой (длина около 16 км), относительно мелководный. Его внешняя, более глубокая (до 150 м) часть, подвержена влиянию затока атлантических вод, а относительно мелководная внутренняя находится под воздействием пресного стока с нескольких ледников, расположенных неподалеку (Мещеряков, 2017). Структура вод Билле-фьорда значительно отличается от основной акватории. Его внутренний бассейн, максимальная глубина которого достигает 190 м, от основной части Ис-фьорда отделяют два подводных порога (глубина 50−70 м), которые ограничивают приток теплых атлантических вод. В результате в течение всего года в Билле-фьорде преобладают отрицательные температуры ниже −0.5°C, что способствует поддержанию здесь популяций арктических видов зоопланктона (Arnkværn et al., 2005).
Сбор материала
Исследования проводили в период с 30 ноября по 6 декабря 2015 г. в ходе экспедиции НИС “Дальние Зеленцы” (рис. 1, табл. 1).
Таблица 1.
Характеристики станций отбора проб, выполненных на исследованной акватории
| Номера станций | Дата | Время | N | E | Глубина, м | СТД-зонд | Сетные ловы | Батометрические ловы, горизонты, м |
|---|---|---|---|---|---|---|---|---|
| Грен-фьорд | ||||||||
| 27 | 30.11.2015 | 13:00 | 78.0353 | 14.1920 | 132 | + | 0 – дно | – |
| 29 | 02.12.2015 | 11:40 | 77.9800 | 14.2567 | 87 | + | 0 – дно | – |
| 30 | 02.12.2015 | 13:20 | 78.0492 | 14.1552 | 149 | + | – | – |
| 31 | 02.12.2015 | 14:00 | 78.0192 | 14.1942 | 125 | + | 0 – дно | 0, 10, 25, 50, 75, 100 |
| 32 | 02.12.2015 | 16:50 | 78.0667 | 14.1283 | 145 | + | 0 – дно | 0, 10, 20, 50, 100, 145 |
| 33 | 02.12.2015 | 18:40 | 78.0917 | 14.1083 | 136 | + | 0 – дно | 0, 10, 25, 60, 80, 135 |
| Ис-фьорд | ||||||||
| 38 | 03.12.2015 | 14:00 | 78.5212 | 16.1810 | 183 | + | – | – |
| 39 | 03.12.2015 | 14:40 | 78.4735 | 16.0704 | 69 | + | – | – |
| 40 | 03.12.2015 | 15:10 | 78.4227 | 16.0043 | 157 | + | – | – |
| 41 | 03.12.2015 | 15:40 | 78.4076 | 15.8888 | 195 | + | – | – |
| 46 | 05.12.2015 | 02:00 | 78.4408 | 16.0562 | 108 | + | 0 – дно | – |
| 47 | 05.12.2015 | 05:20 | 78.3800 | 15.5567 | 228 | + | 0 – дно | 0, 10, 25, 50, 100, 228 |
| 48 | 05.12.2015 | 08:20 | 78.3217 | 15.1617 | 280 | + | – | – |
| 49 | 05.12.2015 | 10:00 | 78.2333 | 14.5983 | 260 | + | 0 – дно | – |
| 50 | 06.12.2015 | 13:40 | 78.1485 | 13.9828 | 302 | + | 0 – дно | 0, 10, 25, 65, 125, 200 |
| 51 | 12.06.2015 | 16:40 | 78.1517 | 13.2000 | 280 | + | – | – |
| Билле-фьорд | ||||||||
| 35 | 03.12.2015 | 08:10 | 78.6583 | 16.6767 | 191 | + | 0 – дно | 0, 20, 30, 50, 75, 100 |
| 36 | 03.12.2015 | 13:00 | 78.5562 | 16.3837 | 152 | + | – | – |
| 37 | 03.12.2015 | 13:30 | 78.5336 | 16.3410 | 85 | + | – | – |
| 44 | 04.12.2015 | 20:30 | 78.6167 | 16.5217 | 143 | + | 0 – дно | – |
| 45 | 04.12.2015 | 23:10 | 78.5383 | 16.3533 | 104 | + | 0 – дно | – |
Соленость воды и температуру водной толщи на станциях определяли с помощью CTD-зонда SBE 19 plus SEACAT (США).
Отбор проб микропланктона осуществляли батометром Нискина объемом 1 л на шести станциях; на каждой станции пробы отбирали с шести горизонтов (табл. 1). Всего было отобрано 36 проб. Весь материал фиксировали нейтральным формалином в конечной концентрации 1–2% и затем концентрировали способом обратной фильтрации с последующим отстаиванием (Макаревич, Дружков, 1989). Фильтрацию проводили через ядерные лавсановые фильтры с порами 0.95 мкм. После отстаивания остаток с отфильтрованной взвесью объемом 10–15 мл декантировали до объема 1.5–2 мл с помощью трубки с U-образно изогнутым капилляром на конце. Микроскопирование проводили в проходящем свете при увеличениях ×100–400 в камере Нажотта. Объем клеток определяли методом геометрического подобия (Кольцова, 1970; Hillebrand et al., 1999; Olenina et al., 2006). Биомассу клеток рассчитывали, исходя из принятой удельной плотности клеточного содержимого, равной 1.
Пробы зоопланктона брали на 12 станциях, в качестве орудия лова использовали планктонную сеть Джеди с диаметром входного отверстия 37 см и величиной ячеи 155 мкм. Ловы осуществляли тотально, от дна до поверхности. Всего отобрано 12 проб, которые фиксировали 4%-ным раствором формалина. Камеральную обработку проводили, используя микроскоп МБС-10 и камеру Богорова.
РЕЗУЛЬТАТЫ
Океанографические параметры среды
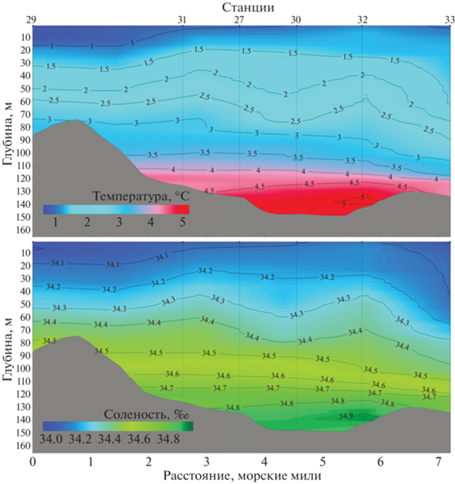
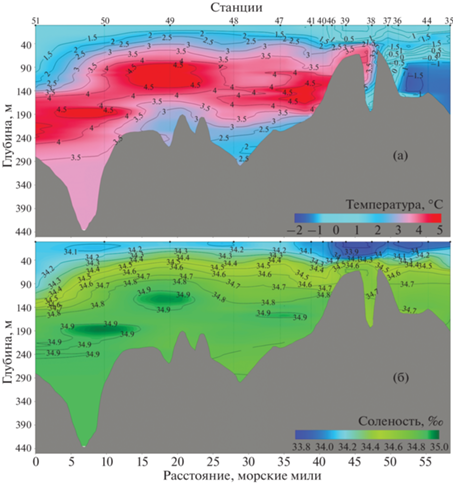
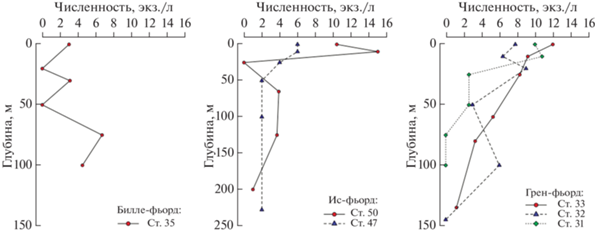
Главная особенность гидрологической структуры водной толщи Ис-фьорда – разная степень влияния теплых атлантических вод, поступающих из открытой части моря, на отдельные участки акватории. Так, в Грен-фьорде (ст. 27, 29–33) наиболее теплые и соленые воды отмечены в придонном слое ниже 100–110 м. Вышележащие слои характеризовались постепенным снижением температуры и солености до минимальных для этого фьорда значений (рис. 2). В основной акватории Ис-фьорда (ст. 38–41 и 46–50) теплые водные массы с аналогичными значениями температуры и солености локализовались в слое 100–200 м (рис. 3). Выше и ниже этого слоя изменения были схожи с таковыми в акватории Грен-фьорда и характеризовались постепенным снижением значений солености и температуры. Обратную картину распределения показателей солености и температуры наблюдали в Билле-фьорде (ст. 35–37 и 44, 45). Наличие подводного порога препятствует проникновению атлантических масс, в связи с чем в данной акватории слой от 50 м до дна представлен в основном водами с отрицательными температурами (рис. 3).
Микропланктон
В составе микропланктона отмечены 40 таксонов простейших разного ранга (табл. 2). На уровне отдельных видов доминирование не выражено, представители большинства таксонов отмечены 1–2 раза. Сравнительно регулярно встречались Dinophysis rotundata (Dinophyta), Halosphaera viridis (Prasinophyta), Salpingella acuminata, Strombidium strobilum (= Laboea strobila Lohmann) и Stenosemella oliva aff./Tintinnopsis ventricosa aff. (Infusoria). На станциях 32 и 33 зарегистрированы пресноводные формы: Aulacoseira granulata (Bacillariophyta) и Pediastrum duplex (Chlorophyta) соответственно. На станции 47 отмечен тропическо-бореальный вид Podolampas palmipes (Dinophyta).
Таблица 2.
Видовой состав микропланктона
| Bacillariophyta | Dinophyta |
|---|---|
| Aulacoseira granulata Simonsen, 1979 | Amphidinium sphenoides Wulff, 1916 |
| Chaetoceros borealis Bailey, 1854 | Ceratium arcticum Cleve, 1901 |
| Chaetoceros furcillatus Bailey, 1856 (споры) | Dinophysis contracta Balech, 1973 |
| Corethron criophilum Castracane, 1886 | Dinophysis norvegica Claparède et Lachmann, 1859 |
| Nitzschia longissima Ralfs, 1861/Cylindrotheca closterium Reiman et Lewin, 1964 | Dinophysis rotundata Claparède et Lachmann, 1859 |
| Odontella aurita Agardh, 1832 | Gyrodinium lachryma Kofoid et Swezy, 1921/G. fusiforme Koifoid et Swezy, 1921 |
| Paraliasulcata Cleve, 1873 | Lessardiaelongata Saldarriaga et F.J.R. Taylor, 2003 |
| Pleurosigma angulatum Smith, 1852 | Micracanthodinium claytonii Dodge, 1982 |
| Infusoria | Podolampas palmipes Stein, 1883 |
| Acanthostomella norvegica (Daday, 1887) | Pronoctiluca pelagica Fabre-Domerque, 1889 |
| Ormosella aff. cornucopia (Brandt, 1906) | Prorocentrum balticum Loeblich III, 1970 |
| Parafavella denticulata (Ehrenberg, 1840) (цисты) | Protoperidinium brevipes Balech, 1974 |
| Parundella caudata (Ostenfeld, 1899) | Protoperidinium depressum Balech, 1974 |
| Ptychocylis obtusa Brandt, 1906 | Protoperidinium pallidum Balech, 1973 |
| Salpingella acuminata (Claparède et Lachmann, 1858) | Protoperidinium pellucidum Bergh, 1881 |
| Salpingella aff. rotundata Kofoid et Campbell, 1929 | Protoperidinium pyriforme Balech, 1974 |
| Stenosemella oliva (Meunier, 1910)/Tintinnopsis ventricosa (Claparède et Lachmann, 1858) | Haptophyta |
| Strombidium aff. conicum (Lohmann, 1908) | Coccolithus pelagicus Schiller, 1930 |
| Strombidium strobilum (Lohmann, 1908) | Chlorophyta |
| Tintinnopsis fimbriata Meunier, 1919 | Pediastrum duplex Meyen, 1829 |
| Radiolaria | Prasinophyta |
| Sticholonche zanclea Hertwig, 1877 | Halosphaera viridis Schmitz 1878 |
| Incertae sedis: Solenicola setigera Pavillard, 1916 + Leptocylindrus mediterraneus Hasle, 1975 | |
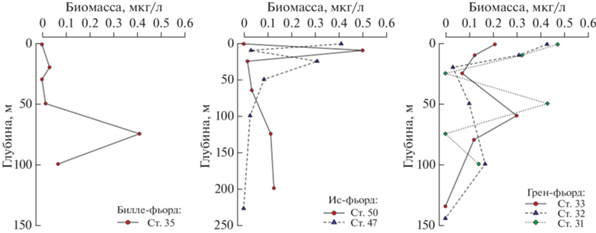
Микропланктон по акватории распределялся равномерно, средние значения биомассы для слоя от 0 м до дна на разных станциях варьировали в пределах от 0.09 до 0.23 мкг/л, а численности – от 2.2 до 7.5 кл./л. Максимальные количественные показатели отмечены преимущественно в поверхностном 60-метровом слое (рис. 4), за исключением станции 35 в Билле-фьорде, где наибольшее значение биомассы микропланктона зарегистрировано в нижележащем слое.
Мезозоопланктон
В исследованный период состав зоопланктона характеризовался достаточно высокой однородностью. В состав формирующего основную часть количественного обилия зоопланктона комплекса видов входили Oithona similis, Microcalanus sp., Pseudocalanus sp. и виды рода Calanus. Суммарный вклад этих представителей в общую численность составил более 90%, на долю оставшихся видов приходилось от 3 до 7% в зависимости от места отбора проб (рис. 5). Наибольшие значения численности отмечены у O. similis, они варьировали в пределах от 66 до 917 экз./м3. В качестве субдоминанты выступали виды Calanus sp. c диапазоном варьирования 20–665 экз./м3, уступая по данному показателю Pseudocalanus sp. лишь в акватории Грен-фьорда.
Рис. 5.
Относительное обилие видов мезозоопланктона во фьордах о-ва Западный Шпицберген в зимнее время.
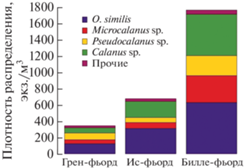
Несмотря на значительное сходство величины относительного вклада доминирующих видов в суммарное обилие сообщества, разные участки акватории характеризовались значениями, в несколько раз отличающимися друг от друга. Так, средняя численность зоопланктона в Грен-фьорде составляла 345 экз./м3, в основной акватории Ис-фьорда − 677 экз./м3, а в Билле-фьорде − 1767 экз./м3 (табл. 3).
Таблица 3.
Плотность распределения видов мезозоопланктона (экз./м3)
| Таксон | Ис-фьорд | Грен-фьорд | Билле-фьорд |
|---|---|---|---|
| Copepoda np. | 0.05 ± 0.06 | 1.17 ± 0.65 | 0.92 ± 0.96 |
| Oithona similis | 312.37 ± 82.28 | 124.05 ± 54.87 | 630.58 ± 376.26 |
| O. atlantica | 16.06 ± 4.48 | 9.98 ± 7.33 | 9.86 ± 5.28 |
| Microcalanus sp. | 73.03 ± 14.87 | 49.08 ± 15.21 | 331.41 ± 173.56 |
| Pseudocalanus sp. | 61.49 ± 14.08 | 82.90 ± 43.83 | 245.83 ± 55.07 |
| Calanus sp. III | 5.35 ± 4.26 | 1.47 ± 0.67 | 8.36 ± 4.81 |
| Calanus sp. IV | 98.14 ± 24.94 | 34.08 ± 13.72 | 360.93 ± 141.56 |
| Calanus sp. V | 92.19 ± 10.98 | 27.06 ± 12.10 | 135.13 ± 53.03 |
| Calanus sp. VI F | 2.20 ± 0.47 | 1.39 ± 0.77 | 4.27 ± 3.76 |
| Metridia longa I | 0.03 ± 0.06 | 0.19 ± 0.19 | 0 |
| Metridia longa II | 0.13 ± 0.10 | 0.28 ± 0.14 | 0.13 ± 0.22 |
| Metridia longa III | 0.35 ± 0.26 | 0.68 ± 0.31 | 0 |
| Metridia longa IV | 1.05 ± 0.85 | 1.35 ± 0.89 | 1.15 ± 1.37 |
| Metridia longa V | 2.87 ± 1.04 | 1.28 ± 0.53 | 3.40 ± 2.34 |
| Metridia longa VI F | 0.98 ± 0.64 | 0.39 ± 0.26 | 1.32 ± 0.89 |
| Metridia longa VI M | 1.82 ± 1.19 | 0.55 ± 0.53 | 1.15 ± 1.37 |
| Acartia sp. | 0.52 ± 0.43 | 0.51 ± 0.4 | 5.82 ± 8.76 |
| Chiridius obtusifrons | 0.05 ± 0.09 | 0 | 0 |
| Gaetanus tenuispinus | 0 | 0.01 ± 0.03 | 0 |
| Metridia lucens | 0.15 ± 0.11 | 0.23 ± 0.26 | 0 |
| Pareuchaeta sp. | 0.01 ± 0.02 | 0.09 ± 0.17 | 0 |
| Triconia borealis | 2.27 ± 1.82 | 0.58 ± 0.4 | 6.04 ± 3.34 |
| Microsetella norvegica | 0 | 0.08 ± 0.11 | 0 |
| Harpacticoida sp. | 0 | 0.04 ± 0.09 | 0 |
| Euphausiacea np. | 0 | 0 | 0.22 ± 0.31 |
| Euphausiacea | 1.41 ± 0.89 | 1.07 ± 0.75 | 1.72 ± 0.2 |
| Amphipoda | 0.09 ± 0.16 | 0.06 ± 0.04 | 0.02 ± 0.03 |
| Fritillaria borealis | 0.43 ± 0.5 | 2.31 ± 0.92 | 0.30 ± 0.27 |
| Oikopleura sp. | 0.20 ± 0.07 | 1.36 ± 0.35 | 0.45 ± 0.41 |
| Limacina helicina larvae | 2.34 ± 1.25 | 0.55 ± 0.37 | 8.89 ± 6.98 |
| L. retroversa larvae | 0.43 ± 0.27 | 0.58 ± 0.41 | 4.57 ± 7.91 |
| Parasagitta elegans | 0.97 ± 0.45 | 1.03 ± 0.29 | 1.25 ± 0.59 |
| Ekrohnia hamata | 0.11 ± 0.13 | 0 | 0 |
| Dimophyes arctica | 0 | 0.01 ± 0.03 | 0 |
| Aglantha digitale | 0.01 ± 0.02 | 0.03 ± 0.04 | 0 |
| Hydrozoa sp. | 0 | 0 | 0.16 ± 0.2 |
| Ctenophora sp. | 0.04 ± 0.03 | 0.19 ± 0.43 | 0.45 ± 0.71 |
| Polychaeta larvae | 0.11 ± 0.09 | 0.17 ± 0.18 | 0.13 ± 0.13 |
| Bivalvia larvae | 0.05 ± 0.09 | 0.32 ± 0.35 | 0 |
| Bryozoa larvae | 0.09 ± 0.19 | 0.12 ± 0.14 | 0.34 ± 0.39 |
| Echinodermata larvae | 0 | 0 | 0.09 ± 0.15 |
| Unident. Copepoda | 0.13 ± 0.2 | 0 | 2.99 ± 2.18 |
| Всего: | 677.5 ± 101.1 | 345.2 ± 87.45 | 1767.9 ± 180.7 |
Науплии копепод
В пробах, отобранных с помощью сети Джеди, количество науплиев было небольшим и составляло 0.09−1.91 экз./м3 в зависимости от места отбора проб. В пробах со станций 27, 49 и 50 отмечено их полное отсутствие. С учетом этого частота встречаемости науплиев в сетных пробах составила 75%. В то же время в батометрических пробах среднее значение численности науплиев на станциях варьировало от 2.9 до 6.6 экз./л, что при пересчете в сопоставимые с сетными ловами единицы измерения составляет 2900−6600 экз./м3. Нулевые значения отмечены в шести пробах, соответственно, частота встречаемости составила 83%. Размер науплиев в подавляющем большинстве был менее 200 мкм. Более крупные формы отмечены лишь в пяти пробах из 36 отобранных.
В вертикальном измерении науплии, как и остальные представители микропланктонной фракции, локализовались в основном в поверхностном слое 0–50 м, и только в Билле-фьорде численность науплиев в поверхностном слое была несколько меньше, чем в слое 50−100 м (рис. 6).
ОБСУЖДЕНИЕ
Полученные нами данные по составу и количественным характеристикам мезозоопланктона, основанные на ловах с помощью планктонных сетей, достаточно точно соответствуют ставшим классическими закономерностям сезонных изменений в пелагиали, описанным ранее (Raymont, 1983). Низкие значения общей численности, практически полное отсутствие организмов, находящихся на науплиальной и ранних копеподитных стадиях развития, а также преобладание зимующих стадий в популяциях главных видов-фитофагов (табл. 3), таких как представители рода Calanus, свидетельствуют о типично зимнем состоянии зоопланктонного сообщества. К этому можно добавить и минимальные показатели биомассы микропланктона, отмеченные на всех станциях и характерные для многих арктических акваторий именно в этот период года (Дружкова, 2011; Makarevich et al., 2012).
Также можно отметить отсутствие выраженной взаимосвязи между количественными показателями микропланктона и термохалинными характеристиками. Так, в акваториях Ис-фьорда и Грен-фьорда максимальные значения биомассы микропланктона регистрировали в поверхностном 50-метровом слое, где значения температуры и солености варьировали от 0.8 до 3°С и от 34 до 34.5‰ соответственно. В Билле-фьорде показатели наибольшего обилия приурочены к горизонту 75 м. Здесь значения температуры были отрицательными (–0.6°С), а соленость составляла 34.6‰. Численность науплиев копепод в батометрических ловах также не зависела от температуры и солености.
Методические различия не позволяют провести сравнение с данными по другим фьордам Шпицбергена в полном объеме. Но пересчет, произведенный в соответствии с методикой Кушинга с соавторами (Cushing et al., 1958), показал, что биомасса протистов в Ис-фьорде (в среднем 1.5 мг С/м2) имеет сопоставимые значения с показателями в Рип-фьорде (2 мг С/м2) (Błachowiak-Samołyk et al., 2015), поскольку основная роль в формировании биомассы принадлежит крупным формам. Сопоставимым был и вклад доминирующей группы (динофлагелляты) в общую биомассу, в Рип-фьорде он составил 50%, а в Ис-фьорде – в среднем 40%. Однако из-за преобладания мелких форм, которые не учитывались в нашем исследовании, общая численность в Рип-фьорде была значительно выше и составила 16.7 × 106 кл./м2 против 0.25–0.75 × 106 кл./м2 в Ис-фьорде.
Трофическая структура сообщества протистов характеризовалась доминированием гетеротрофной/миксотрофной группы, что типично для зимнего сукцессионного цикла (Макаревич, Дружкова, 2010). Гетеротрофы были представлены 18 видами, миксотрофы – 4 и автотрофы – 11. Трофический статус не определен для 7 видов, в том числе для 2-х, представленных только спорами, и 2-х пресноводных.
Дополнительный материал, основанный на анализе количества науплиев копепод в батометрических пробах, свидетельствует о значительно более высокой интенсивности протекания биологических процессов, чем это представлялось ранее. Так, в акватории Ис-фьорда средняя численность науплиев в водной толще, в зависимости от места отбора проб, варьировала в пределах от 2.9 до 6.6 экз./л, что при пересчете в экз./м3 соответствует значениям, в разы превышающим суммарную численность всего мезозоопланктона. Наши результаты хорошо соотносятся с данными, полученными в предыдущие годы в акватории Конгс-фьорда (Grenvald et al., 2016), где пробы отбирали планктонными сетями с размером ячеи 50, 64 и 200 мкм. Сходство отмечается как в количественных, так и в качественных показателях. Обилие науплиев размером менее 200 мкм, предположительно принадлежащих видам O. similis и Microcalanus sp., в сетях с ячеей 50 и 64 мкм в значительной степени превышало общую численность зоопланктона, пойманного сетью WP2 с ячеей 200 мкм, а в состав доминирующего комплекса в Конгс-фьорде, как и в Ис-фьорде, входили O. similis, Microcalanus sp., Pseudocalanus sp., Calanus sp. и Metridia longa. Более того, в обеих локациях большинство организмов концентрировалось в верхнем слое 0–50 м.
Как прямые (Lischka, Hagen, 2005; Darnis et al., 2012; Hobbs et al., 2020), так и косвенные (Arashkevich et al., 2002; Hirche, Kosobokova, 2011) свидетельства о повышенной биологической активности зоопланктона в зимнее время, основанные на имеющихся данных, позволяют очертить приблизительные временные границы периода активной репродукции мелких копепод во фьордах Шпицбергена. В акватории Конгс-фьорда в ноябре 1998−1999 гг. (Lischka, Hagen, 2005) в пробах, отобранных с помощью планктонной сети с ячеей 100 мкм, количество науплиев мелких копепод исчислялось десятками экземпляров в кубическом метре, что превышало этот показатель для некоторых весенних и летних месяцев. В литературе присутствуют противоположные мнения относительно уловистости данного типа сетей по отношению к организмам менее 200 мкм. Результаты одних исследований (Nichols, Thompson, 1991) свидетельствуют в пользу достаточности данного размера ячеи, в то время как другие (Makabe et al., 2012) указывают на недолов этой размерной группы в несколько раз по сравнению с сетью с ячеей 60 мкм. Если верно второе, то можно предположить, что реальное значение количества науплиев соответствовало сотням экз./м3. Максимальное обилие рассматриваемой группы организмов отмечено в декабре в Ис-фьорде (наши данные) и в январе в Конгс-фьорде (Grenvald et al., 2016), оно составляло тысячи экз./м3. Уже в марте в Конгс-фьорде численность науплиев была более чем в 2 раза ниже, чем в ноябре (Lischka, Hagen, 2005), а в Грен-фьорде в конце марта − начале апреля их средняя численность в батометрических пробах составляла 571 экз./м3 (Берченко, Олейник, 2016). Однако в этот период науплии были отмечены лишь в 25% проб, что свидетельствует о случайном характере обнаружения и значительной переоценке их численности при пересчете. В то же время, как отмечалось выше, в декабре частота встречаемости науплиев в пробах достигала 83%, они присутствовали в 30 пробах из 36, что говорит о закономерности данного феномена в акватории Ис-фьорда в этот период и репрезентативности полученных количественных характеристик.
Наши данные хорошо соотносятся и являются логичным продолжением той картины состояния сообщества микропланктона, которая отмечалась в осенний сезон в проливе Фрама (Svensen et al., 2011), полученной с использованием аналогичных методов исследования. Несмотря на сравнительно высокую численность, общее количество науплиев в наших сборах все же меньше, чем таковое в сентябре в прол. Фрама, что может свидетельствовать о постепенном снижении репродуктивных процессов в направлении осень–зима.
Исходя из вышесказанного, логично заключить, что наравне с естественными причинами высокий уровень репродуктивной активности представителей мелких копепод в зимний период, о котором свидетельствует обнаружение большого количества науплиев, может иметь и методическое объяснение, связанное с использованием разных способов отбора проб и увеличением числа исследований. Следовательно, определение единой методологической базы является приоритетной задачей для успеха дальнейших исследований процессов, протекающих в арктических экосистемах в зимний период.
Список литературы
Берченко И.В., Олейник А.А. К вопросу о продуктивности зоопланктонного сообщества Грен-фьорда (Ис-фьорд, Шпицберген) в зимний период // Комплексные исследования природы Шпицбергена и прилегающего шельфа. Выпуск 13. Материалы Всероссийской научной конференции с международным участием (Мурманск, 2–4 ноября 2016 г.). Ростов н/Д: Изд-во ЮНЦ РАН. 2016. С. 51–56.
Дружкова Е.И. Биопродуктивность и фитопланктонные сообщества Баренцева, Белого и Карского морей // Комплексные исследования больших морских экосистем России. Апатиты: Изд-во КНЦ РАН. 2011. С. 116–154.
Кольцова Т.И. Определение объема и поверхности клеток фитопланктона // Биол. науки. 1970. № 6. С. 114–120.
Макаревич П.Р., Дружков Н.В. Методические рекомендации по анализу количественных и функциональных характеристик морских биоценозов северных морей. Ч. I. Фитопланктон. Зоопланктон. Взвешенное органическое вещество. Апатиты: Изд-во КНЦ РАН. 1989. 50 с.
Макаревич П.Р., Дружкова Е.И. Сезонные циклические процессы в прибрежных планктонных альгоценозах северных морей. Ростов н/Д: Изд-во ЮНЦ РАН. 2010. 280 с.
Мещеряков Н.И. Особенности седиментогенеза в заливе Грен-фьорд (Западный Шпицберген) // Вестник Мурманского государственного технического университета. 2017. Т. 20. № 1–2. С. 272−279.
Arashkevich E., Wassmann P., Pasternak A., Riser C.W. Seasonal and spatial changes in biomass, structure, and development progress of the zooplankton community in the Barents Sea // J. Mar. Syst. 2002. V. 38. № 1–2. P. 125–145.
Arnkværn G., Daase M., Eiane K. Dynamics of coexisting Calanus finmarchicus, Calanus glacialis and Calanus hyperboreus populations in a high-Arctic fjord // Polar Biol. 2005. V. 28. № 7. P. 528–538.
Bathmann U.V., Noji T.T., Von Bodungen B. Copepod gra-zing potential in late winter in the Norwegian Sea – A factor in the control of spring phytoplankton growth? // Mar. Ecol. Prog. Ser. 1990. P. 225–233.
Berge J., Daase M., Renaud P.E. et al. Unexpected levels of biological activity during the polar night offer new perspectives on a warming Arctic // Curr. Biol. 2015. V. 25. № 19. P. 2555–2561.
Błachowiak-Samołyk K., Wiktor J.M., Hegseth E.N. et al. Winter Tales: the dark side of planktonic life // Polar Biol. 2015. V. 38. № 1. P. 23–36.
Cushing D.H., Humphrey G.F., Banse K., Laevastu T. Report of the committee on terms and equivalents // Rapp. P.-V. Réun. Commn. Int. Explor. Scient. Mer Méditerr. 1958. V. 144. P. 15–16.
Daase M., Varpe Ø., Falk-Petersen S. Non-consumptive mortality in copepods: occurrence of Calanus spp. carcasses in the Arctic Ocean during winter // J. Plankton Res. 2014. V. 36. № 1. P. 129–144.
Darnis G., Robert D., Pomerleau C. et al. Current state and trends in Canadian Arctic marine ecosystems: II. He-terotrophic food web, pelagic-benthic coupling, and biodiversity // Climatic Change. 2012. V. 115. № 1. P. 179–205.
Eilertsen H.C., Degerlund M. Phytoplankton and light during the northern high-latitude winter // J. Plankton Res. 2010. V. 32. № 6. P. 899–912.
Grenvald J.C., Callesen T.A., Daase M. et al. Plankton community composition and vertical migration during polar night in Kongsfjorden // Polar Biol. 2016. V. 39. № 10. P. 1879–1895.
Hillebrand H., Dürselen C.D., Kirschtel D. et al. Biovolume calculation for pelagic and benthic microalgae // J. Phycology. 1999. V. 35. № 2. P. 403–424.
Hirche H.J., Kosobokova K.N. Winter studies on zooplankton in Arctic seas: the Storfjord (Svalbard) and adjacent ice-covered Barents Sea // Mar. Biol. 2011. V. 158. № 10. P. 2359–2376.
Hobbs L., Banas N.S., Cottier F.R. et al. Eat or sleep: avai-lability of winter prey explains mid-winter and spring activity in an Arctic Calanus population // Front. Mar. Sci. 2020. V. 7. art. ID 541564.
Lee R.F., Hagen W., Kattner G. Lipid storage in marine zooplankton // Mar. Ecol.: Prog. Ser. 2006. V. 307. P. 273–306.
Lischka S., Hagen W. Life histories of the copepods Pseudocalanus minutus, P. acuspes (Calanoida) and Oithona similis (Cyclopoida) in the Arctic Kongsfjorden (Svalbard) // Polar Biol. 2005. V. 28. № 12. P. 910–921.
Makabe R., Tanimura A., Fukuchi M. Comparison of mesh size effects on mesozooplankton collection efficiency in the Southern Ocean // J. Plankton Res. 2012. V. 34. № 5. P. 432–436.
Makarevich P., Druzhkova E., Larionov V. Primary produ-cers of the Barents Sea // Diversity of Ecosystems. 2012. http://www.intechopen.com/books/diversity-of-ecosystems/primary-producers-of-the-barents-sea. Cited March 14, 2023.
Morata N., Søreide J.E. Effect of light and food on the metabolism of the Arctic copepod Calanus glacialis // Polar Biol. 2015. V. 38. № 1. P. 67–73.
Morata N., Michaud E., Włodarska-Kowalczuk M. Impact of early food input on the Arctic benthos activities during the polar night // Polar Biol. 2015. V. 38. № 1. P. 99–114.
Nichols J.H., Thompson A.B. Mesh selection of copepodite and nauplius stages of four calanoid copepod species // J. Plankton Res. 1991. V. 13. № 3. P. 661–671.
Nilsen F., Cottier F., Skogseth R., Mattson S. Fjord–shelf exchanges controlled by ice and brine production: the interannual variation of Atlantic Water in Isfjorden, Svalbard // Cont. Shelf Res. 2008. V. 28. № 14. P. 1838–1853.
Pedersen G., Tande K., Ottesen G.O. Why does a component of Calanus finmarchicus stay in the surface waters during the overwintering period in high latitudes? // ICES J. Mar. Sci. 1995. V. 52. № 3–4. P. 523–531.
Olenina I., Hajdu S., Edler L. et al. Biovolumes and size-classes of phytoplankton in the Baltic Sea // HELCOM Balt. Sea Environ. Proc. 2006. № 106. P. 144.
Raymont J.E. Plankton and Productivity in the Oceans: V. 2: Zooplankton. Oxford: Pergamon press. 1983.
Svensen C., Seuthe L., Vasilyeva Y. et al. Zooplankton distribution across Fram Strait in autumn: are small copepods and protozooplankton important? // Prog. Oceanogr. 2011. V. 91. № 4. P. 534–544.
Дополнительные материалы отсутствуют.