Биотехнология, 2022, T. 38, № 2, стр. 57-69
Сравнительный анализ состава и содержания гинзенозидов в каллусной культуре клеток и корне женьшеня обыкновенного, Panax ginseng
Д. Н. Балеев 1, *, В. И. Осипов 1, П. С. Савин 1, Ю. П. Байкова 1, Н. И. Сидельников 1
1 Всероссийский научно-исследовательский институт лекарственных
и ароматических растений
117216 Москва, Россия
* E-mail: dbaleev@gmail.com
Поступила в редакцию 20.10.2021
После доработки 20.01.2022
Принята к публикации 23.03.2022
- EDN: IUMWHV
- DOI: 10.56304/S0234275822020028
Аннотация
Основной целью исследования было изучение состава и относительного содержания гинзенозидов в каллусной культуре клеток Panax ginseng C.A. Mey. (штамм Pa.g(B)05VILAR), полученной из почек зрелого растения. Для сравнения использовали экстракт из корня женьшеня, произрастающего в Ботаническом саду ВИЛАР. Состав и относительное содержание гинзенозидов изучали методом высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией высокого разрешения. В корне женьшеня и каллусной культуре клеток обнаружили 40 и 33 гинзенозида, соответственно. Основные гинзенозиды принадлежат к группам протопанаксатриола, протопанаксадиола и олеанана. Использованный метод анализа позволил обнаружить ряд минорных гинзенозидов: Rg5, 20(R)-Rg2, Rg3, F1, Rb2 и Rd, обладающих биологической активностью, однако суммарное их содержание в корне выше, чем в каллусной культуре клеток. Изучение факторов регуляции биосинтеза гинзенозидов в суспензионной культуре клеток P. ginseng, позволит повысить продуктивность культуры и увеличить выход биологически активных гинзенозидов.
Женьшень – многолетнее растение, которое принадлежит к роду Panax семейства Araliaceae. Известно 17 видов данного рода, распространенных в Корее, Китае, Японии, США, Канаде, восточных Гималаях и России [1]. Корни женьшеня тысячи лет применяются для получения биологически активных адаптогенных препаратов, которые широко используется в восточной медицине для повышения устойчивости организма к физическим и биологическим стрессам [2, 3]. Наиболее часто используются такие виды как женьшень обыкновенный (Panax ginseng C.A. Mey.), американский (Panax quinquefolius L.) и китайский (Panax notoginseng (Burk.) F.H. Chen) [4].
Основными биологически активными соединениями корней женьшеня являются гинзенозиды или тритерпеновые гликозиды [5, 6]. В зависимости от типа агликона, гинзенозиды классифицируются на группы протопанаксадиолов, протопанаксатриолов и олеанановых сапонинов, которые также подразделяются на ряд подгрупп в соответствии с числом и положением углеводной части молекулы [1]. Неполярные свойства агликона и полярные свойства углеводных компонентов, обусловливают растворимость гинзенозидов как в воде, так и жирах, а поэтому обладают способностью достаточно легко проникать в клетку [7].
В женьшене обыкновенном идентифицировано около 200 гинзенозидов [8]. Около 90% общего содержания гинзенозидов в корнях женьшеня обыкновенного приходится на протопанаксадиолы Rb1, Rb2, Rc, Rd и протопанаксатриолы Re, Rf и Rg1 [9, 10]. Олеанановая группа представлена в основном гинзенозидом Ro [11] и реже гинзенозидами Rg2, Rg3, Rh1 и Rh2. [12]. Разработка и применение новых аналитических методов позволит открыть новые, еще не известные биологически активные соединения женьшеня.
В настоящее время основным источником гинзенозидов являются корни и корневища культурных растений женьшеня [11]. Однако длительный период развития растений и относительно низкое содержание гинзенозидов по сравнению с дикой формой растения, стимулировали использование культуры клеток in vitro в качестве альтернативного источника биологически активных соединений [13, 14]. Было показано, что клеточные культуры P. ginseng и P. japonicus способны синтезировать и накапливать многие биологически активные гинзенозиды, характерные для исходных растений [12, 15, 16].
Во Всероссийском Институте Лекарственных и Ароматических Растений (ВИЛАР, Москва) были получены и на протяжении многих лет поддерживаются каллусная и суспензионная культуры клеток женьшеня обыкновенного. Показано, что экстракты этих культур обладают адаптогенной активностью [17, 18], но состав синтезируемых метаболитов не был изучен. Поэтому основной целью данного исследования было определение состава и содержания биологически активных гинзенозидов в каллусной культуре клеток женьшеня обыкновенного с применением ВЭЖХ-МСВР. В качестве контроля использовали корень растения женьшеня, выращенного в Ботаническом саду ВИЛАР.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Реактивы
В экспериментах использовали ацетонитрил LiChrosolv® hypergrade для ЖХ-МС (Merck KGaA, Дармштадт, Германия). Муравьиная кислота, сахароза, 2,4-дихлорфеноксиуксусная кислота, кинетин, никотиновая кислота, тиамин, пиридоксин и 1R-(-)-10-камфорсульфоновая кислота были получены от Sigma-Aldrich (Steinheim, Германия). Этанол (99.5%, об./об.) фирмы Primalco (Rajamäki, Финляндия). Вода очищена системой Elgastat UHQ-PS (Elga, Карст, Германия).
Растительный материал
Объектом исследования была каллусная культура клеток женьшеня обыкновенного (P. ginseng, штамм Pa.g(B)05ВИЛАР), клеточная линия № 04868244-010-2011 из биоколлекции ВИЛАР, полученная в 2011 году из почки взрослого растения, растущего в Ботаническом саду ВИЛАР. Культура клеток стабильна и поддерживается в ВИЛАР методом пересева до настоящего времени. Анализ образцов проводили в 2014 году.
Каллусную культуру клеток выращивали на питательной среде Мурасиге-Скуга [19] с добавлением сахарозы (3%), а также витаминов и регуляторов роста (2,4-дихлорфеноксиуксусная кислота (2,4 ДХФУ), кинетин, никотиновая кислота, тиамин и пиридоксин) в концентрации 0.5 мг/л каждого соединения [20] (табл. 1). Коэффициент заполнения твердой питательной средой пробирок объемом 50 мл составлял 40%, от общего объема. Культивирование проводили в темноте при температуре 26 ± 1°C. Цикл выращивания культуры составлял 30 сут.
Таблица 1.
Состав среды для выращивания каллусной культуры клеток женьшеня Pa.g (В) 05ВИЛАР Table 1. The composition of the medium for growing callus culture of ginseng cells Pa.g (B) 05VILAR
| № п\п | Компонент питательной среды | Концентрация, мг/л |
|---|---|---|
| 1 | NH 4NO3 | 1650 |
| 2 | KNO3 | 1900 |
| 3 | KH2PO4 | 170 |
| 4 | CaCl2 плавл. | 330 |
| 5 | MgSO4⋅7H2O | 370 |
| 6 | FeSO4⋅7H2O | 27.8 |
| 7 | Трилон Б (Na-ЭДТА) | 37.3 |
| 8 | Н3ВО3 | 6.2 |
| 9 | MnSO4⋅4H2O | 22.3 |
| 10 | ZnSO4⋅7H2O | 8.6 |
| 11 | KI | 0.83 |
| 12 | NaMoO4⋅2H2O | 0.25 |
| 13 | CuSO4⋅5 H2O | 0.025 |
| 14 | CoCl2⋅6 H2O | 0.025 |
| 15 | Сахароза | 30 000 |
| 16 | 2,4-ДХФУ | 0.5 |
| 17 | Кинетин | 0.5 |
| 18 | Никотиновая кислота | 0.5 |
| 19 | Тиамин | 0.5 |
| 20 | Пиридоксин | 0.5 |
| 21 | Агар | 8000 |
Для характеристики каллусной культуры клеток определяли такие параметры как, жизнеспособность культуры, ростовой индекс и морфогенность. Жизнеспособность определяли методом микроскопии, рассчитывая процент не окрашиваемых 0.025%-ной синькой Эванса клеточных агрегатов от их общего количества. Учитывали не менее 150 агрегатов в трех повторностях. Для определения сухой массы 30-дневную каллусную культуру клеток высушивали при температуре 30°С.
Ростовой индекс (I) определяли по формуле:
где Xmax и X0 – максимальное и начальное значения содержания сухой биомассы.Морфогенность культуры определяли методом микроскопии на 30 сутки роста. В результате установлено, что каллусная культура клеток была не морфогенна, ее ростовой индекс 8–10 и содержание живых клеток 80–90%.
Состав и содержание метаболитов в 30-дневной культуре клеток сравнивали с метаболитами корня P. ginseng, выращенного в Ботаническом саду ВИЛАР.
Подготовка образцов
Образец высушенной культуры клеток каллуса массой 7.5 г измельчали и экстрагировали 70%-ным водным этанолом (соотношение сырье–растворитель, 1 : 10). Полученный экстракт упаривали в роторном испарителе (Hei-VAP Value, Heidolph, Германия) до получения сухого остатка. Экстракцию метаболитов корня женьшеня проводили в тех же условиях. Для ВЭЖХ-МСВР анализа сухие образцы экстрактов каллуса и корня (10 мг) растворяли в 1 мл 70%-ного этанола, содержащего внутренний стандарт (1R)-(-)-10-камфорсульфоновую кислоту (24 мкг/мл), и фильтровали (фильтр PTFE Clean 2, 0.45 мкм, Thermo Fisher Scientific, США).
ВЭЖХ-МСВР анализ
ВЭЖХ система Agilent 1200 (Agilent Technologies, США) включала micrOTOF-Q-MS (Bruker, США) спектрометр высокого разрешения и диодно-матричный детектор. Соединения разделяли на колонке XBridge C18 (100 × 2.1 mm i.d., 3.5 µm, Waters, Ирландия) в градиенте двух систем: (A) 0.2%-ный водный раствор муравьиной кислоты; (Б) 0.2%-ный раствор муравьиной кислоты в ацетонитриле. Условия ВЭЖХ: 0–5 мин, 2% Б в A; 5–50 мин, 2–30% Б в A (линейный градиент); 50–70 мин, 30–70% Б в A (линейный градиент); 70–80 мин, 70% Б. Скорость потока – 0.3 мл/мин; объем вводимого образца – 5 µл. Масс-спектрометрические условия: электроионизация в распыленном состоянии (ESI), регистрация отрицательных и положительных ионов в области 50–2000 m/z, напряжение на игле 4000 V, температура азота 200°С, скорость потока газа 8.0 л/мин. Регистрацию масс-спектрометрических данных и их последующую обработку проводили с использованием программы DataAnalysis 4.0 (Bruker).
Идентификация гинзенозидов
На основании точного измерения m/z значений ионов масс-спектра метаболита, определяли его моноизотопную массу и химическую формулу. Ошибка определения экспериментальной моноизотопной массы, при сравнении с расчетной, была менее 3 ppm для основных метаболитов и менее 6 ppm для метаболитов, присутствующих в низких концентрациях. Данные масс-спектрометрии (m/z значения иона [M–H]− и его аддуктов) применяли для идентификации или предварительной характеристики соединений, используя доступные базы данных METLIN [21] и HMDB (Human Metabolome Database) [22], а также данные, опубликованные в литературе [23–30].
Количественный анализ гензенозидов
Для сравнения содержания гинзенозидов в корне и каллусной культуре клеток использовали их относительное содержание в экстрактах, которое определяли по площади пика наиболее характерного и интенсивного иона (m/z) масс-спектра, нормализованного по внутреннему стандарту в расчете на 100 мг сухого экстракта.
Статистический анализ
Статистический анализ проводили с использованием пакета программ R [31]. Достоверность различий в содержании гинзенозидов анализировали с помощью парных t-критериев Стьюдента. Различия в каждой паре сравниваемых значений считали статистически значимыми при р ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
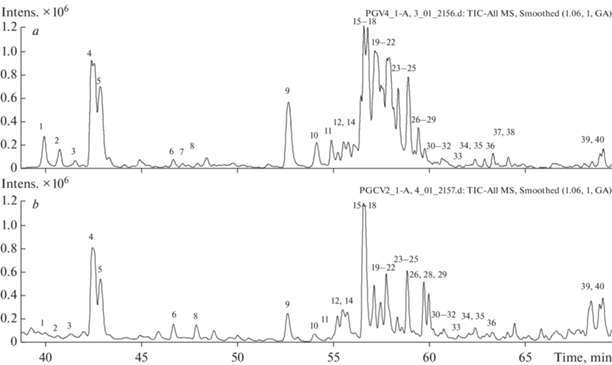
Для ВЭЖХ-МС анализа некоторых классов вторичных метаболитов растений, например, низкомолекулярных фенольных соединений, вполне достаточна регистрация только отрицательных ионов. Однако экстракт женьшеня характеризуется присутствием, большого числа разнообразных гликозидов тритерпеноидов, поэтому предварительно сравнивали ВЭЖХ-МСВР профили метаболитов женьшеня при отрицательной и положительной ионизации. В результате установлено, что отрицательная ионизация больше подходит для регистрации биологически активных гинзенозидов (рис. 1). Кроме того, масс-спектр метаболитов при отрицательной ионизации характеризуется более простым составом аддуктов и лучше подходит для идентификации. Это подтверждается и результатами других исследователей [27–29].
Рис. 1.
ВЭЖХ-МСВР профили метаболитов экстрактов корня женьшеня обыкновенного (a) и каллусной культуры клеток (b). Регистрация отрицательных ионов в режиме полного ионного тока (TIC). 1 – 20-O-Глюкогинзенозид-Rf, 2 – Нотогинзенозид R1, 3 – не идентифицирован, 4 – Гинзенозид Rg1, 5 – Гинзенозид Re, 6 – Нотогинзенозид A, 7 – Псевдогинзенозид Rc1, 8 – Гинзенозид La, 9 – Гинзенозид Rf, 10 – Нотогинзенозид R2, 11 – Нотогинзенозид R4, 12 – Тригидрокси-9-октадеценовая кислота, 13 – Нотогинзенозид Ra3, 14 – 20(R)-Гинзенозид Rg2 или Мединозид E, 15 – Квадрангулозид, 16 – Гинзенозид F1, 17 – Гинзенозид Ra2, 18 – Гинзенозид Rb1, 19 – Гинзенозид Rc, 20 – Гинзенозид Ra1, 21 – Гинзенозид Ro, 22 – Гинзенозид Rb2, 23 – Mалонил-гинзенозид Rb2, 24 – Хингенозид R1, 25 – Гинзенозид Rd, 26 – Maлонил-гинзенозид Rd, 27 – Гинзенозид Rs1, 28 – Tритерпен 1, 29 – Tритерпен 2, 30 – Нотогинзенозид R3, 31 – Псевдогинзенозид Rc1, 32 – Нотогинзенозид R6, N или M, 33 – Псевдогинзенозид Rc1, 34 – Нотогинзенозид T2, 35 – Нотогинзенозид T2, 36 –Tритерпен 3, 37 – 20(S)-Гинзенозид Rg3, 38 – 20(R)-Гинзенозид Rg3, 39 – Гинзенозид Rk1, 40 – Гинзенозид Rg5. Fig. 1. HPLC-HRMS profiles of P. ginseng metabolites of root (a) and callus cell culture (b). Total ion chromatogram (TIC) in negative ionization mode. 1 – 20-O-Glucoginsenoside-Rf, 2 – Notoginsenoside R1, 3 – Unknown, 4 – Ginsenoside Rg1, 5 – Ginsenoside Re, 6 – Notoginsenoside A, 7 – Pseudoginsenoside Rc1, 8 – Ginsenoside La, 9 – Ginsenoside Rf, 10 – Notoginsenoside R2, 11 – Notoginsenoside R4, 12 – Trihydroxy-9-octadecenoic acid, 13 – Notoginsenoside Ra3, 14 – 20(R)-Ginsenoside Rg2 or Medinoside E, 15 – Quadranguloside, 16 – Ginsenoside F1, 17 – Ginsenoside Ra2, 18 – Ginsenoside Rb1, 19 – Ginsenoside Rc, 20 – Ginsenoside Ra1, 21 – Ginsenoside Ro, 22 – Ginsenoside Rb2, 23 – Malonyl ginsenoside Rb2, 24 – Quinquenoside R1, 25 – Ginsenoside Rd, 26 – Malonyl-ginsenoside Rd, 27 – Ginsenoside Rs1, 28 – Triterpene 1, 29 ‒ Triterpene 2, 30 – Notoginsenoside R3, 31 – Pseudoginsenoside Rc1, 32 – Notoginsenoside R6, N or M, 33 – Pseudoginsenoside Rc1, 34 – Notoginsenoside T2, 35 – Notoginsenoside T2, 36 – Triterpene 3, 37 – 20(S)-Ginsenoside Rg3, 38‒ 20(R)-Ginsenoside Rg3, 39 – Ginsenoside Rk1, 40 – Ginsenoside Rg5.
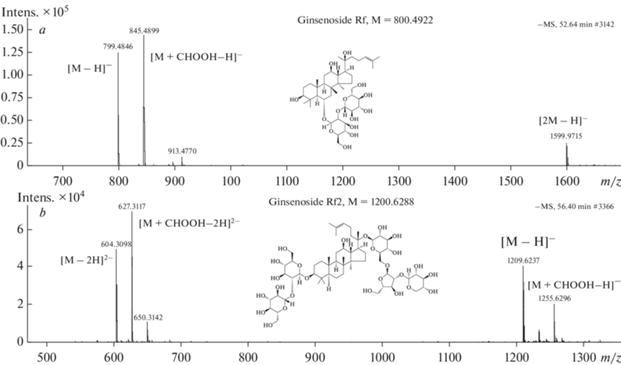
Электро-распылительная ионизация (ESI) является универсальным и мягким методом при ВЭЖХ-МСВР анализе вторичных метаболитов растений. При регистрации отрицательных ионов этим методом, в масс-спектре гинзенозидов обычно присутствует ярко выраженный ион депротонированной молекулы [М–Н]−, а также его аддукты ([М–2Н]2–, [2М–Н]–, [M + HCOOH–2H]2– и [M + HCOOH–H]–) и фрагменты (рис. 2).
Рис. 2.
Масс-спектры гинзенозида Rf (а) и гинзенозида Ra2 (b) каллусной культуры клеток женьшеня обыкновенного. Fig. 2. Mass spectra of ginsenoside Rf (a) and ginsenoside Ra2 (b) identified in the P. ginseng callus cell culture.
При изучении масс-спектров гинзенозидов основное внимание было направлено на определение m/z иона [М–Н]−. С этой целью исследовали изотопный состав m/z значения каждого аддукта. В качестве примера, на рис. 3 показаны данные для гинзенозида Rf (a, b и c) и гинзенозида Ra2 (d). Одно- и двухзарядные ионы определяли по различию m/z значения изотопных ионов (рис. 3).
Рис. 3.
Определение одно- и двухзарядных аддуктов иона [М–Н]− в масс-спектре гинзенозида Rf (a, b и c) и гинзенозида Ra2 (d) на основе различий m/z изотопных ионов. Fig. 3. Determination of single- and double-charged adducts of the ion [М-Н]− in the mass spectrum of ginsenoside Rf (a, b, c) and ginsenoside Ra2 (d) based on the differences in the masses of isotopic ions.

У однозарядных ионов, измеряемый интервал составляет около “1”, а у двухзарядных – “0.5”. Далее, моноизотопный ион [М–Н]− определяли среди других однозарядных аддуктов масс-спектра и использовали для расчета моноизотопной массы гинзенозида. Точное значение моноизотопной массы позволяет надежно идентифицировать гинзенозид, используя существующие базы масс-спектрометрических данных [21, 22], а также данные, опубликованные в литературе [23–30].
Изучение состава экстрактов корня и каллусной культуры клеток женьшеня обыкновенного позволило обнаружить 40 соединений, 36 из которых были идентифицированы (табл. 2).
В результате идентификации обнаружено присутствие 32 гинзенозидов и 2 малонил-гинзенозида (соединения 23 и 26). Было показано, что из 40 соединений корня P. ginseng, в каллусной культуре клеток присутствуют только 33 соединения. Судя по величине пиков метаболитов, основными гинзенозидами экстракта корня были протопанаксатриолы (Rg1, Re, Rf), протопанаксадиолы (Rb1, Rb2, Rd и хингенозид R1) и гинзенозид Ro из группы олеанана (рис. 1). Эти результаты согласуются с данными, полученными ранее [30, 32]. Наряду с гинзенозидами идентифицированы малонильные производные гинзенозидов Rg1 и Rd.
Таблица 2.
Биологически активные соединения, обнаруженные и идентифицированные в экстрактах корня и каллусной культуры клеток женьшеня обыкновенного методом ВЭЖХ-МСВР Table 2. Biologically active compounds detected and identified in the root and callus cell culture of Panax ginseng with application of HPLC-HRMS
| № | Объект* | Время (мин) | Масс-спектр (m/z) | Моноизотопная масса (Да) | Формула | Ошибка (ppm) |
Наименование | ||
|---|---|---|---|---|---|---|---|---|---|
| [M–H]– | аддукты | экспериментальная | рассчитанная | ||||||
| 1 | 1, 2 | 39.96 | 961.5388 | 1007.5432 [M + HCOOH–H]– | 962.5461 | 962.5450 | C48H82O19 | 1.14 | 20-O-Глюкогинзенозид-Rf 20-O-Glucoginsenoside-Rf |
| 2 | 1, 2 | 40.73 | 931.5283 | 977.531 [M + HCOOH–H]– | 932.5356 | 932.5345 | C47H80O18 | 1.22 | Нотогинзенозид R1 Notoginsenoside R1 |
| 3 | 1, 2 | 41.54 | 1141.5942 | 1187.6055 [M + HCOOH–H]–; 570.2953 [M–2H]2–; 593.2987 [M + HCOOH–2H]2–; 447.2217 [C21H23O10]– |
1142.6015 | 1142.6025 | C61H90O20 | –0.88 | Не идентифицировано |
| 4 | 1, 2 | 42.49 | 799.4859 | 845.4906 [M + HCOOH–H]– | 800.4932 | 800.4922 | C42H72O14 | 1.25 | Rg1 |
| 5 | 1, 2 | 42.88 | 945.5416 | 991.5470 [M + HCOOH–H]– | 946.5489 | 946.5501 | C48H82O18 | –1.27 | Re |
| 6 | 1, 2 | 46.66 | 1123.5869 | 1169.5977 [M + HCOOH–H]–; 584.2927 [M + HCOOH–2H]2–; 561.2885 [M–2H]2– |
1124.5942 | 1124.5978 | C54H92O24 | –3.20 | Нотогинзенозид A Notoginsenoside A |
| 7 | 1 | 47.10 | 987.5498 | 1031.5423 [M + HCOOH–H]– | 988.5571 | 988.5607 | C50H84O19 | –3.62 | Псевдогинзенозид Rc1 Pseudoginsenoside Rc1 |
| 8 | 1, 2 | 47.13 | 841.4953 | 885.4858 [M + HCOOH–H]– | 842.5026 | 842.5027 | C44H74O15 | –0.20 | La |
| 9 | 1, 2 | 52.64 | 799.4851 | 845.4899 [M + HCOOH–H]–; 1599.9714 [2M–H]– |
800.4924 | 800.4922 | C42H72O14 | 0.25 | Rf |
| 10 | 1, 2 | 54.12 | 769.4730 | 815.4789 [M + HCOOH–H]–; 1539.9509 [2M–H]– |
770.4803 | 770.4816 | C41H70O13 | –1.69 | Нотогинзенозид R2 Notoginsenoside R2 |
| 11 | 1, 2 | 54.84 | 1239.6372 | 1285.6402 [M + HCOOH–H]–; 619.3143 [M–2H]2–; 642.3173 [M + HCOOH–2H]2– |
1240.6445 | 1240.6452 | C59H100O27 | –0.56 | Нотогинзенозид R4 Notoginsenoside R4 |
| 12 | 1, 2 | 55.22 | 329.2328 | – | 330.2401 | 330.2406 | C18H34O5 | –1.51 | Тригидрокси-9-Октадеценовая кислота Trihydroxy-9-octadecenoic acid |
| 13 | 1 | 55.51 | 1239.6399 | 1285.6401 [M + HCOOH–H]–; 619.3158 [M–2H]2–; 642.3178 [M + HCOOH–2H]2– |
1240.6472 | 1240.6452 | C59H100O27 | 1.61 | Нотогинзенозид Ra3 Notoginsenoside Ra3 |
| 14 | 1, 2 | 55.86 | 783.4896 | 829.4831 [M + HCOOH–H]– | 784.4969 | 784.4972 | C42H72O13 | –0.50 | 20(R)-Rg2 |
| 15 | 1, 2 | 56.03 | 1105.5780 | 1151.5842 [M + HCOOH–H]–; 552.2845 [M–2H]2–; 575.2885 [M + HCOOH–2H]2– |
1106.5853 | 1106.5872 | C54H90O23 | –1.79 | Квадрангулозид Quadranguloside |
| 16 | 1 | 56.23 | 637.4312 | 683.4379 [M + HCOOH–H]– | 638.4385 | 638.4394 | C36H62O9 | –1.38 | F1 |
| 17 | 1 | 56.41 | 1209.6237 | 1255.6291 [M + HCOOH–H]–; 604.3097 [M–2H]2–; 627.3117 [M + HCOOH–2H]2– |
1210.6310 | 1210.6288 | C65H94O21 | 1.82 | Ra2 |
| 18 | 1, 2 | 56.58 | 1107.5946 | 1153.5984 [M + HCOOH–H]–; 553.2940 [M–2H]2–; 576.2967 [M + HCOOH–2H]2– |
1108.6019 | 1108.6029 | C58H98O26 | –0.90 | Rb1 |
| 19 | 1, 2 | 57.18 | 1077.5844 | 1123.5913 [M + HCOOH–H]–; 538.2889 [M–2H]2–; 561.2918 [M + HCOOH–H]2– |
1078.5917 | 1078.5924 | C53H90O22 | –0.65 | Rc |
| 20 | 1, 2 | 57.33 | 1209.6239 | 604.3104 [M–2H]2–; 627.3119 [M + HCOOH–2H]2– |
1210.6312 | 1210.6288 | C65H94O21 | 1.98 | Ra1 |
| 21 | 1, 2 | 57.49 | 955.4894 | 1912.9809 [2M–H]– | 956.4967 | 956.4981 | C48H76O19 | –1.46 | Ro |
| 22 | 1, 2 | 57.79 | 1077.5844 | 1123.5869 [M + HCOOH–H]–; 538.2884 [M–2H]2–; 561.2915 [M + HCOOH–2H]2– |
1078.5917 | 1078.5924 | C53H90O22 | –0.65 | Rb2 |
| 23 | 1, 2 | 58.14 | 1163.5808 | – | 1164.5881 | 1164.5928 | C56H92O25 | –4.04 | Малонил-гинзенозид Rb2 Malonyl ginsenoside Rb2 |
| 24 | 1, 2 | 58.37 | 1149.6030 | 1195.6091 [M + HCOOH–H]–; 574.2988 [M–2H]2–; 597.3014 [M + HCOOH–2H]2– |
1150.6103 | 1150.6135 | C56H94O24 | –2.78 | Хингенозид R1 Quinquenoside R1 |
| 25 | 1, 2 | 58.89 | 945.5410 | 991.5456 [M + HCOOH–H]– | 946.5483 | 946.5501 | C48H82O18 | –1.90 | Rd |
| 26 | 1, 2 | 59.18 | 1031.5433 | – | 1032.5506 | 1032.5505 | C51H84O21 | 0.10 | Малонил-гинзенозид Rd Malonyl ginsenoside Rd |
| 27 | 1 | 59.41 | 1119.5914 | 1165.5939 [M + HCOOH–H]–; 559.2022 [M–2H]2–; 582.2943 [M + HCOOH–2H]2– |
1120.5987 | 1120.6029 | C62H88O18 | –3.75 | Rs1 |
| 28 | 1, 2 | 59.76 | 1175.6163 | 1221.6227 [M + HCOOH–H]–; 587.3058 [M–2H]2–; 610.3095 [M + HCOOH–2H]2– |
1176.6236 | 1176.6232 | C65H92O19 | 0.27 | Тритерпен 1 Triterpene 1 |
| 29 | 1, 2 | 59.96 | 1175.6186 | 1221.6232 [M + HCOOH–H]–; 587.3067 [M–2H]2–; 610.310 [M + HCOOH–2H]2– |
1176.6259 | 1176.6232 | C65H92O19 | 2.23 | Тритерпен 2 Triterpene 2 |
| 30 | 1, 2 | 60.42 | 961.5341 | – | 962.5414 | 962.5450 | C48H82O19 | –3.74 | Нотогинзенозид R3 Notoginsenoside R3 |
| 31 | 1, 2 | 60.63 | 987.5510 | 1033.5528 [M + HCOOH–H]– | 988.5583 | 988.5607 | C50H84O19 | –2.43 | Псевдогинзенозид Rc1 Pseudoginsenoside Rc1 |
| 32 | 1, 2 | 60.89 | 961.5321 | – | 962.5394 | 962.5450 | C48H82O19 | –5.82 | Нотогинзенозид R6, N или M Notoginsenoside R6, N or M |
| 33 | 1, 2 | 61.51 | 987.5490 | 1033.5537 [M + HCOOH–H]– | 988.5563 | 988.5607 | C50H84O19 | –4.45 | Псевдогинзенозид Rc1 Pseudoginsenoside Rc1 |
| 34 | 1, 2 | 62.36 | 665.4246 | – | 666.4319 | 666.4343 | C37H62O10 | –3.60 | Нотогинзенозид T2 Notoginsenoside T2 |
| 35 | 1, 2 | 62.86 | 665.4241 | – | 666.4314 | 666.4343 | C37H62O10 | –4.35 | Нотогинзенозид T2 Notoginsenoside T2 |
| 36 | 1, 2 | 63.28 | 793.4353 | 1587.8794 [2M–H]– | 794.4426 | 794.4453 | C42H66O14 | –3.40 | Тритерпен 3 Triterpene 3 |
| 37 | 1 | 64.09 | 783.4858 | 829.4914 [M + HCOOH–H]– | 784.4931 | 784.4973 | C42H72O13 | –5.35 | 20(S)-Rg3 |
| 38 | 1 | 64.45 | 783.4858 | 829.4931 [M + HCOOH–H]– | 784.4931 | 784.4973 | C42H72O13 | –5.35 | 20(R)-Rg3 |
| 39 | 1, 2 | 68.02 | 765.4767 | 811.4806 [M + HCOOH–H]– | 766.4840 | 766.4867 | C42H70O12 | –3.52 | Rk1 |
| 40 | 1, 2 | 68.40 | 765.4783 | 811.4806 [M + HCOOH–H]– | 766.4856 | 766.4867 | C42H70O12 | –1.44 | Rg5 |
Примечание. * Объект: 1 – корень, 2 – каллусная культура клеток. Note. *Object: 1 – root, 2 – callus.В результате идентификации обнаружено присутствие 32 гинзенозидов и 2 малонил-гинзенозида (соединения 23 и 26). Было показано, что из 40 соединений корня P. ginseng, в каллусной культуре клеток присутствуют только 33 соединения. Судя по величине пиков метаболитов, основными гинзенозидами экстракта корня были протопанаксатриолы (Rg1, Re, Rf), протопанаксадиолы (Rb1, Rb2, Rd и хингенозид R1) и гинзенозид Ro из группы олеанана (рис. 1). Эти результаты согласуются с данными, полученными ранее [30, 32]. Наряду с гинзенозидами идентифицированы малонильные производные гинзенозидов Rg1 и Rd.
Сравнение профилей ВЭЖХ-МСВР экстрактов каллусной культуры клеток и корня показало различие в относительном содержании большинства метаболитов. По сравнению с корнем, каллусная культура клеток отличалась меньшим содержанием большинства гинзенозидов (рис. 1, табл. 3).
Таблица 3.
Относительное содержание гинзенозидов в экстракте корня и каллусной культуры клеток женьшеня обыкновенного. Содержание, площадь пика характерного m/z иона на 100 мг сухого экстракта Table 3. Relative content of ginsenosides in the root and callus cell culture of Panax ginseng, peak area of characteristic m/z ion per 100 mg of dry extract
| № | Время, мин | Название | Ион (m/z) |
Среднее содержаниеa | Разница (fold) | p-value | |
|---|---|---|---|---|---|---|---|
| корень | каллус | ||||||
| 1 | 39.96 | 20-O-Глюкогинзенозид-Rf 20-O-Glucoginsenoside-Rf |
1007.5 | 11.2 | 0.5 | 21.9 | *** |
| 2 | 40.73 | Нотогинзенозид R1 Notoginsenoside R1 |
977.5 | 7.7 | 0.3 | 26.1 | *** |
| 3 | 41.54 | Не идентифицировано | 593.3 | 21.6 | 3.6 | 6.0 | *** |
| 4 | 42.49 | Rg1 | 845.5 | 75.6 | 61.8 | 1.2 | * |
| 5 | 42.88 | Re | 991.5 | 44.0 | 32.6 | 1.4 | * |
| 6 | 46.66 | Нотогинзенозид A Notoginsenoside A |
584.3 | 19.3 | 47.2 | –2.5 | ** |
| 7 | 47.10 | Псевдогинзенозид Rc1 Pseudoginsenoside Rc1 |
1031.5 | 5.8 | 0.0 | – | – |
| 8 | 47.13 | La | 885.5 | 7.4 | 0.7 | 10.3 | *** |
| 9 | 52.64 | Rf | 845.5 | 29.2 | 11.1 | 2.6 | ** |
| 10 | 54.12 | Нотогинзенозид R2 Notoginsenoside R2 |
815.5 | 10.2 | 1.6 | 6.5 | *** |
| 11 | 54.84 | Нотогинзенозид R4 Notoginsenoside R4 |
642.3 | 5.8 | 0.1 | 83.5 | *** |
| 12 | 55.22 | Тригидрокси-9-Октадеценовая кислота Trihydroxy-9-octadecenoic acid |
329.2 | 85.7 | 214.2 | –2.5 | ** |
| 13 | 55.51 | Нотогинзенозид Ra3 Notoginsenoside Ra3 |
642.3 | 2.0 | 0.0 | – | – |
| 14 | 55.86 | 20(R)-Rg2 | 829.5 | 91.4 | 107.3 | –1.1 | n.s |
| 15 | 56.03 | Квадрангулозид, Quadranguloside | 575.3 | 1.0 | 5.9 | –5.0 | ** |
| 16 | 56.23 | F1 | 683.4 | 15.1 | 0.0 | – | – |
| 17 | 56.41 | Ra2 | 627.3 | 6.9 | 0.0 | – | – |
| 18 | 56.58 | Rb1 | 576.3 | 37.1 | 29.1 | 1.3 | * |
| 19 | 57.18 | Rc | 561.3 | 15.3 | 6.9 | 2.2 | ** |
| 20 | 57.33 | Ra1 | 627.3 | 21.0 | 7.2 | 2.9 | ** |
| 21 | 57.49 | Ro | 955.5 | 14.3 | 7.6 | 1.9 | * |
| 22 | 57.79 | Rb2 | 1077.6 | 17.6 | 3.5 | 5.0 | *** |
| 23 | 58.14 | Малонил-гинзенозид Rb2 Malonyl ginsenoside Rb2 |
1163.6 | 56.5 | 2.6 | 22.1 | *** |
| 24 | 58.37 | Хингенозид R1 Quinquenoside R1 |
597.3 | 92.4 | 9.4 | 9.8 | *** |
| 25 | 58.89 | Rd | 991.5 | 14.2 | 5.2 | 2.7 | ** |
| 26 | 59.18 | Малонил-гинзенозид Rd Malonyl ginsenoside Rd |
1031.5 | 30.9 | 7.5 | 4.1 | *** |
| 27 | 59.41 | Rs1 | 582.3 | 4.2 | 0.0 | – | – |
| 28 | 59.76 | Тритерпен 1 Triterpene 1 |
610.3 | 13.2 | 58.0 | –5.0 | *** |
| 29 | 59.96 | Тритерпен 2 Triterpene 2 |
610.3 | 1.4 | 58.9 | –50.0 | *** |
| 30 | 60.42 | Нотогинзенозид R3 Notoginsenoside R3 |
961.5 | 7.5 | 3.0 | 2.5 | ** |
| 31 | 60.63 | Псевдогинзенозид Rc1 Pseudoginsenoside Rc1 |
1033.6 | 16.2 | 0.7 | 22.7 | *** |
| 32 | 60.89 | Нотогинзенозид R6, N или M Notoginsenoside R6, N or M |
961.5 | 13.0 | 7.8 | 1.7 | ** |
| 33 | 61.51 | Псевдогинзенозид Rc1 Pseudoginsenoside Rc1 |
1033.6 | 4.0 | 0.5 | 8.6 | *** |
| 34 | 62.36 | Нотогинзенозид T2 Notoginsenoside T2 |
665.4 | 19.7 | 3.3 | 5.9 | *** |
| 35 | 62.86 | Нотогинзенозид T2 Notoginsenoside T2 |
665.4 | 38.5 | 6.5 | 5.9 | *** |
| 36 | 63.28 | Тритерпен 3 Triterpene 3 |
793.4 | 58.0 | 23.5 | 2.5 | ** |
| 37 | 64.09 | 20(S)-Rg3 | 829.5 | 31.2 | 0.0 | – | – |
| 38 | 64.45 | 20(R)-Rg3 | 829.5 | 9.5 | 0.0 | – | – |
| 39 | 68.02 | Rk1 | 811.5 | 9.7 | 2.5 | 3.9 | *** |
| 40 | 68.40 | Rg5 | 811.5 | 14.1 | 2.4 | 5.9 | *** |
Как показывают некоторые исследования, отношение групп протопанаксадиолы/протопанаксатриолы зависит от условий культивирования женьшеня: в корне преобладают диолы, тогда как в культуре in vitro – триолы [16]. Аналогичные результаты получены и в нашем исследовании. В корне содержание гинзенозидов из группы диолов было в 1.3 раза выше по сравнению с триолами, а в каллусной культуре клеток, наоборот, в 1.9 раза ниже. Отношение гинзенозидов Rb1/Rg1 часто используется для идентификации различных видов женьшеня. Например, у P. quinquefolius соотношение Rb1/Rg1 меньше 0.4, а у P. ginseng больше 1 [33]. В нашем исследовании соотношение Rb1/Rg1 в корне женьшеня было около 2, что типично для P. ginseng. Аналогичное соотношение было обнаружено и в каллусной культуре клеток, хотя есть данные о зависимости этого параметра от способа культивирования женьшеня [34].
В настоящее время большое внимание уделяется изучению минорных гинзенозидов, таких как Rg2, Rg3, Rh1, Rh2, F1, F2 и C-K [35, 36]. В корне женьшеня эти соединения обычно присутствуют в следовых количествах, или вообще отсутствуют [36, 37]. ВЭЖХ-МСВР анализ позволил обнаружить четыре минорных соединения (Rg2, Rg3, F1 и Rg5) в корне и два соединения (Rg2 и Rg5) в каллусной культуре клеток P. ginseng (табл. 2). Гинзенозиды 20(S)-Rg3 и 20(R)-Rg3 – эпимеры, показавшие высокую фармакологическую активность [38]. Они проявляют нейропротекторный эффект при нейротоксичности, вызванной глутаматом, благодаря механизмам, связанным с антиоксидантным действием и антиапоптозом, и могут быть использованы для лечения болезни Альцгеймера [39]. Rg3, Rg5 и F1 обладают антиканцерогенной, иммуностимулирующей и противовоспалительной активностью [3, 9, 38, 40]. Предполагается, что Rg2 может быть использован при лечении диабета 2 типа, поскольку он подавляет выработку глюкозы в печени за счет фосфорилирования GSK3β [41]. Гинзенозиды Rh2 и Rg3 запускают апоптоз опухолевых клеток, ингибируют их пролиферацию, инвазию опухоли и метастазирование [36].
Таким образом, при исследовании состава и содержания гинзенозидов в корне и в каллусной культуре клеток женьшеня обыкновенного (P. ginseng) из биоколлекции ВИЛАР методом ВЭЖХ-МСВР установлено, что в корне женьшеня присутствуют 40 соединений, среди которых основными были гинзенозиды Rg1, Re, Rf, Rd, Rb1, Ra1 и Rb2. Идентифицированы также минорные гинзенозиды Rg5, 20(R)-Rg2, эпимеры Rg3 и малонил-гинзенозиды Rb2 и Rd. В отличие от корня, каллусная культура клеток содержала всего 33 гинзенозида. Общее содержание биологически активных гинзенозидов в каллусной культуре клеток было ниже, чем в корне, а также отсутствовали важные гинзенозиды, такие как Rg3 и F1. Кроме того, было показано, что в каллусной культуре клеток преобладали гинзенозиды группы протопанаксатриола (Rg1 и Re), а в корне – группы протопанаксадиола (Rb1/Rb2 и Ra1). В настоящее время, изучаются факторы регуляции биосинтеза гинзенозидов в суспензионной культуре клеток P. ginseng, которые позволят повысить продуктивность культуры и увеличить выход биологически активных гинзенозидов.
Список литературы
Sharma S.K., Pandit M.K. A new species of Panax L. (Araliaceae) from Sikkim Himalaya, India. Syst. Bot., 2009, 34, 434–438. https://doi.org/10.1600/036364409788606235
Christensen L.P. Ginsenosides chemistry, biosynthesis, analysis, and potential health effects. Adv. Food Nutr. 2009, 55, 1–99. https://doi.org/10.1016/S1043-4526(08)00401-4
Kim J.H., Yi Y.-S., Kim M.Y., Cho J.Y. Role of ginsenosides, the main active components of Panax ginseng, in inflammatory responses and diseases. J. of Ginseng Res., 2017, 41, 435–443. https://doi.org/10.1016/j.jgr.2016.08.004
Yang W.-Z., Hu Y., Wu W.-Y., Ye M., Guo D.-A. Saponins in the genus Panax L. (Araliaceae): A systematic review of their chemical diversity. Phytochemistry, 2014, 106, 7–24. https://doi.org/10.1016/j.phytochem.2014.07.012
Ru W., Wang D., Xu Y., He X., Sun Y.-E., Qian L., Zhou X., Qin Y. Chemical constituents and bioactivities of Panax ginseng (C.A. Mey.). Drug Discov. Ther., 2015, 9, 23–32. https://doi.org/10.5582/ddt.2015.01004
Lee D.G., Lee J.S., Kim K.-T., Kim H.Y., Lee S. Analysis of major ginsenosides in various ginseng samples. J. Appl. Biol. Chem., 2019, 62, 87–91. https://doi.org/10.3839/jabc.2019.013
Attele A.S., Wu J.A., Yuan C.S. Ginseng pharmacology: multiple constituents and multiple actions. Biochem. Pharmacol., 1999, 58, 1685–1693. https://doi.org/10.1016/s0006-2952(99)00212-9
Chen W., Balan P., Popovich D.G. Comparison of ginsenoside components of various tissues of New Zealand forest-grown Asian ginseng (Panax ginseng) and American ginseng (Panax quinquefolium L.). Biomolecules, 2020, 10, 372. https://doi.org/10.3390/biom10030372
Kim J.H., Kwon S.K., Sung N.Y., Jung P.M., Choi J.I., Kim J.K. Effect of gamma irradiation on the conversion of ginsenoside Rb1 to Rg3. Radiat. Phys. Chem., 2012, 81, 1128–1131. https://doi.org/10.1016/j.radphyschem.2011.11.059
Park S.E., Na C.S., Yoo S.A., Seo S.H., Son H.S. Biotransformation of major ginsenosides in ginsenoside model culture by lactic acid bacteria. J. of Ginseng Res., 2017, 41, 36–42. https://doi.org/10.1016/j.jgr.2015.12.008
Kim Y., Zhang D., Yang D. Biosynthesis and biotechnological production of ginsenosides. Biotechnol. Adv., 2015, 33, 717–735. https://doi.org/10.1016/j.biotechadv.2015.03.001
Biswas T., Kalra A., Mathur A.K. Elicitors’ influenced differential ginsenoside production and exudation into medium with concurrent Rg3/Rh2 panaxadiol induction in Panax quinquefolius cell suspensions. Appl. Microbiol. Biotechnol., 2016, 100, 4909–4922. https://doi.org/10.1007/s00253-015-7264-z
Kim M., Shim C., Kim Y., Hong S., Park J., Han E., Kim S. Enhancement of seed dehiscence by seed treatment with Talaromyces flavus GG01 and GG04 in Ginseng (Panax ginseng). Plant Pathol., 2017, 33, 1–8. https://doi.org/10.5423/PPJ.OA.06.2016.0146
Lee J., Jo I., Kim J., Hong C., Kim Y., Kim D., Park Y. Improvement of seed dehiscence and germination in ginseng by stratification, gibberellin, and/or kinetin treatments. Hortic. Environ. Biotechnol., 2018, 59, 293–301. https://doi.org/10.1007/s13580-018-0039-6
Kochkin D.V., Kachala V.V., Shashkov A., Chizhov A.O., Chirva V.Y., Nosov A.M. Malonyl-ginsenoside content of a cell-suspension culture of Panax japonicus var. repens. Phytochemistry, 2013, 93, 18–26. https://doi.org/10.1016/j.phytochem.2013.03.021
Kochkin D.V., Galishev B.A., Glagoleva E.S., Titova M.V., Nosov A.M. Rare triterpene glycoside of ginseng (ginsenoside malonyl-Rg1) detected in plant cell suspension culture of Panax japonicus var. repens. Russ. J. Plant Physiol., 2017, 64(5), 649–656. https://doi.org/10.1134/s102144371705003x
Бушуева Г.Р., Леонидова Ю.А., Савина Т.А., Ферубко Е.В. Адаптогенная активность 30%-ной настойки из клеточной культуры женьшеня обыкновенного (Panax ginseng C.A. Mey). Вопросы биологической, медицинской и фармацевтической химии, 2014, 12, 35–36
Лупанова И.А., Цыбулько Н.С., Савина Т.А., Ферубко Е.В. Исследование биологической активности экстракта из биомассы женьшеня обыкновенного (Panax ginseng C.A. Mey) с применением специфических ферментных биотест-систем in vitro. Разработка и регистрация лекарственных средств, 2017, 3, 104–106
Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant., 1962, 15, 473–497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
Савина Т.А., Цыбулько Н.С. Паспорт каллусной культуры клеток женьшеня Pa.g (В) 05ВИЛАР № 04868244-010-2011, 2011, 5
Guijas C., Montenegro-Burke J.R., Domingo-Almenara X., Palermo A., Warth B., Hermann G., Koellensperger G., Huan T., Uritboonthai W., Aisporna A.E., Wolan D.W., Spilker M.E., Benton H.P., Siuzdak G. METLIN: A technology platform for identifying knowns and unknowns. Anal. Chem., 2018, 90, 3156–3164. https://doi.org/10.1021/acs.analchem.7b04424
Wishart D.S., Feunang Y.D., Marcu A. HMDB 4.0: the human metabolome database. Nucleic Acids Research, 2018, 46(D1), 608–617. https://doi.org/10.1093/nar/gkx1089
Wang X., Sakuma T., Asafu-Adjaye E., Shiu G.K. Determination of ginsenosides in plant extracts from Panax ginseng and Panax quinquefolius L. by LC/MS/MS. Anal. Chem., 1999, 71, 1579–1584. https://doi.org/10.1021/ac980890p
Chan T.W.D., But P.P.H., Cheng S.W., Kwok I.M.Y., Lau F.W., Xu H.X. Differentiation and authentication of Panax ginseng, Panax quinquefolius, and ginseng products by using HPLC/MS. Anal. Chem., 2000, 72, 1281–1287. https://doi.org/10.1021/ac990819z
Kite G., Howes M.-J., Leon C., Simmonds M. Liquid chromatography/mass spectrometry of malonyl-ginsenosides in the authentication of ginseng. Rapid Commun. Mass Spectrom., 2003, 17: 238–244. https://doi.org/10.1002/rcm.899
Fuzzati N. Analysis methods of ginsenosides. J. Chromatogr. B., 2004, 812, 119–133. https://doi.org/10.1016/j.jchromb.2004.07.039
Wei Y.-J., Li P., Shu B., Li H.J., Peng Y.-R., Song Y., Chen J., Yi L. Analysis of chemical and metabolic components in traditional Chinese medicinal combined prescription containing Radix Salvia miltiorrhiza and Radix Panax notoginseng by LC-ESI-MS methods. Biomed. Chromatogr., 2007, 21, 797–809. https://doi.org/10.1002/bmc.775
Angelova N., Kong H.W., Van der Heijden R., Yang S.Y., Choi Y.H., Kim H.K., Wang M., Hankemeier T., Van der Greef J., Xu G., Verpoorte R. Recent methodology in the phytochemical analysis of Ginseng. Phytochemical Analysis, 2008, 19, 2–16. https://doi.org/10.1002/pca.1049
Yi J.-H., Kim V.-Y., Kim Y.-C., Jeong W.-S., Bae D.-W., Hur J.-M., Jun M. Change of ginsenoside composition in Red ginseng processed with citric acid. Food Sci. Technol., 2010, 19, 647–653. https://doi.org/10.1016/j.jgr.2015.05.005
Wang H.-P., Zhang Y.-B., Yang X.-W., Yang X.-B., Xu W., Xu F., Cai S.-Q., Wang Y.-P., Xu Y.-H., Zhang L.-X. High-performance liquid chromatography with diode array detector and electrospray ionization ion trap time-of-flight tandem mass spectrometry to evaluate ginseng roots and rhizomes from different regions. Molecules, 2016, 21, 603. https://doi.org/10.3390/molecules21050603
R. Team. R: A language and environment for statistical computing. Vienna, Austria, R Foundation for Statistical Computing, 2011. (ISBN 3-900051-07-0).
Yang W., Qiao X., Li K., Fan J., Bo T., Guo D., Ye M. Identification and differentiation of Panax ginseng, Panax quinquefolium, and Panax notoginseng by monitoring multiple diagnostic chemical markers. Acta Pharm. Sin. B., 2016, 6, 568–575. https://doi.org/10.1016/j.apsb.2016.05.005
Kim D.H. Chemical diversity of Panax ginseng, Panax quinquifolium, and Panax notoginseng. J. of Ginseng Res., 2012, 36, 1–15. https://doi.org/10.5142/jgr.2012.36.1.1
Yu K.W., Murthy H.N., Hahn E.J., Paek K.Y. Ginsenoside production by hairy root cultures of Panax ginseng: influence of temperature and light quality. Biochem. Eng. J., 2005, 23, 53–56. https://doi.org/10.1016/j.bej.2004.07.001
Gwak Y.S., Han J.Y., Adhikari P.B. Heterologous production of a ginsenoside saponin (compound K) and its precursors in transgenic tobacco impairs the vegetative and reproductive growth. Planta, 2017, 245, 1105–1119. https://doi.org/10.1007/s00425-017-2668-x
Yan H., Jin H., Fu Y., Yin Z., Yin C. Production of rare ginsenosides Rg3 and Rh2 by endophytic bacteria from Panax ginseng. J. Agric. Food Chem., 2019, 67, 8493–8499. https://doi.org/10.1021/acs.jafc.9b03159
In G., Ahn N.G., Bae B.S., Han S.T., Noh K.B., Kim C.S. New method for simultaneous quantification of 12 ginsenosides in red ginseng powder and extract: in-house method validation. J. of Ginseng Res., 2012, 36, 205–210. https://doi.org/10.5142/jgr.2012.36.2.205
Choi P., Park J.Y., Kim T., Park S.-H., Kim H., Kang K.S., Ham J. Improved anticancer effect of ginseng extract by microwave-assisted processing through the generation of ginsenosides Rg3, Rg5 and Rk1. J. Funct. Foods., 2015, 14, 613–622. https://doi.org/10.1016/j.jff.2015.02.038
Li N., Liu B., Dluzen D.E., Jin Y. Protective effects of ginsenoside Rg2 against glutamate-induced neurotoxicity in PC12 cells. J. Ethnopharmacol., 2007, 111, 458–463. https://doi.org/10.1016/j.jep.2006.12.015
Kwon H.-J., Lee H., Choi G.-E. Ginsenoside F1 promotes cytotoxic activity of NK cells via insulin-like growth Factor-1-Dependent mechanism. Front. Immunol., 2018, 9, 2785. https://doi.org/10.3389/fimmu.2018.02785
Wang M., Li H., Liu W., Cao H., Hu X., Gao X., Xu F., Li Z., Hua H., Li D. Dammarane-type leads panaxadiol and protopanaxadiol for drug discovery: Biological activity and structural modification. Eur. J. Med. Chem., 2020, 189, 112087. https://doi.org/10.1016/j.ejmech.2020.112087
Дополнительные материалы отсутствуют.


