Биотехнология, 2022, T. 38, № 2, стр. 43-56
Биокаталитический синтез новых цефалоспоринов с использованием иммобилизованной синтетазы цефалоспоринов-кислот
А. В. Скляренко 1, И. А. Грошкова 1, *, Н. А. Горбунов 1, С. В. Яроцкий 1
1 Национальный исследовательский центр “Курчатовский институт”
(НИЦ – “Курчатовский институт”)
123182 Москва, Россия
* E-mail: ingagrosh@mail.ru
Поступила в редакцию 09.11.2021
После доработки 07.02.2022
Принята к публикации 23.02.2022
- EDN: UXGZGV
- DOI: 10.56304/S0234275822020089
Аннотация
С использованием иммобилизованной синтетазы цефалоспоринов-кислот осуществлены процессы биокаталитического ацилирования 1-метил-5-меркапто-1,2,3,4-тетразолил-7-аминоцефалоспорановой кислоты, представляющей собой β-лактамную часть таких антибиотиков как цефамандол, цефазафлур, цефотетан, цефоперазон. В качестве ацилирующих агентов использовали метиловые эфиры D‑манделовой кислоты, 1(H)-тетразолилуксусной кислоты, цианометилтиоуксусной кислоты, тиенилуксусной кислоты, D-фенилгицина и D-п‑оксифенилгицина. Методом кинетически-контролируемого синтеза получены цефамандол и шесть “химерных” соединений, несущих С3-модифицированное β‑лактамное ядро и ацильные части различных известных антибиотиков. Полученные в стандартных мягких условиях в водной среде реакционные смеси, содержащие “химерные” цефалоспорины, потенциально пригодны для оценки их антимикробной активности без выделения. Показана высокая эффективность использования синтетазы цефалоспоринов-кислот в процессах ацилирования 1‑метил-5-меркапто-1,2,3,4-тетразолил-7-аминоцефалоспорановой кислоты метиловыми эфирами 1(H)-тетразолилуксусной кислоты и цианометилтиоуксусной кислоты.
В настоящее время β-лактамные антибиотики занимают ведущее место в медицинской практике как эффективные препараты для лечения инфекционных заболеваний. Благодаря широкому спектру антимикробного действия, включающему активность против грамположительных и грамотрицательных аэробных и анаэробных бактерий, β‑лактамные антибиотики являются наиболее многочисленной группой применяемых антибактериальных средств [1, 2]. Учитывая проблемы, связанные с антибиотикорезистентностью микроорганизмов, ведется постоянная работа по созданию новых полусинтетических антибиотиков, в частности более устойчивых к действию β-лактамаз [3, 4]. Интересным подходом к данной проблеме является комбинаторная химия, которая позволяет путем направленной модификации β‑лактамов вводить функциональные группы уже известных антибиотиков, изменяющие определенные свойства природного или синтетического аналога. Это дает возможность создавать новые антимикробные препараты с улучшенными свойствами [5, 6]. Разработка подобных трансформаций химическими методами синтеза требует продолжительной индивидуальной отработки каждого процесса и нецелесообразна из-за использования токсичных реагентов, растворителей, а также необходимости выделения и очистки полученных продуктов из реакционных смесей перед тестированием на биологическую активность. Альтернативой химическому синтезу может быть использование биокаталитических трансформаций, протекающих в мягких условиях в водной среде [2, 7‒10].
Целью настоящей работы является изучение возможностей биокаталитического синтеза для создания новых “химерных” структур цефалоспориновых антибиотиков с использованием в качестве биокатализатора синтетазы цефалоспоринов-кислот (CASA, КФ 3,5,1,11) [11‒13], продуцируемой рекомбинантным штаммом Escherichia coli ВКПМ В‑12316. Фермент CASA, иммобилизованный путем ковалентного связывания с макропористым эпокси-активированным носителем (IECASA), ранее был использован нами для разработки высокоэффективных методов биокаталитического ацилирования 7‑амино-3-[2-метил-1,3,4-тиадиазол-5-ил)-тиометил]-3-цефем-4-карбоновой кислоты (TDA) и 1‑метил-5-меркапто-1,2,3,4-тетразолил-7-аминоцефалоспорановой кислоты (7‑ТМСА) с целью получения антибиотиков цефазолина и цефамандола, а также полупродуктов их химико-биокаталитического синтеза путем ацилирования 7‑аминоцефалоспорановой кислоты (7-ACA) [14‒16].
УСЛОВИЯ ЭКСПЕРИМЕНТА
Материалы
В работе использованы коммерческие образцы: 7-ТМСА (96.5%)122 Shandong Sihuan Pharmaceutical Co., Ltd., (Китай), натриевая соль цефамандола (99.0%) и МЕМА (99.0%) Sigma-Aldrich, (США), METzAA (98.0%) Sigma-Aldrich, MECMTAA (85.6%) и METAA (84.0%) Ranbaxy Laboratories, (Индия), MEPG гидрохлорид (98.5%), Lancaster Synthesis, (Великобритания), MEHPG гидрохлорид (97.0%), МА (99.0%) и TzAA (96.0%) Sigma-Aldrich, СMTAA (88.6%), Ranbaxy Laboratories, TAA (98.0%) Merck, (Германия), PG (99.0%), Acros Organics Lancaster, (Бельгия), HPG (98.0%), Sigma-Aldrich.
Основное оборудование
– Стеклянный реактор вместимостью 75 мл для проведения биокаталитических процессов с рубашкой для водяного обогрева, оборудованный механической мешалкой и снабженный системами поддержания температуры и рН.
– ВЭЖХ хроматограф фирмы Gilson (США), снабженный УФ-детектором.
– Компьютерное программное обеспечение МультиХром версии 3.х. для регистрации и обсчета хроматограмм.
– Хроматографическая колонка Spherisorb ODS, 250 × 4 мм с диаметром частиц 7.5 мкм Waters (США).
Получение биокатализатора IECASA
Биокатализатор для осуществления процессов синтеза β-лактамных продуктов получали путем иммобилизации CASA на макропористом эпокси-активированном носителе Seplite LX-1000EP (Sunresin New Materials, Китай) согласно разработанной ранее методике [16]. Исходным материалом для иммобилизации служил ферментный препарат CASA, полученный из биомассы высокопродуктивного рекомбинантного штамма E. сoli ВКПМ В‑12316 [16]. Синтетазная активность полученного образца IECASA, определенная по начальной скорости реакции синтеза CEZ [16] из TDA и METzAA, составила 417 ME/г влажного биокатализатора при содержании сухих веществ 37%.
За единицу синтетазной активности (1 МЕ) принимали количество катализатора, которое обеспечивает образование 1 мкмоля CEZ в минуту при его синтезе в растворе, содержащем 60 мМ TDA и 240 мМ МETzAA при рН 7.5 и 30°С.
В настоящем исследовании биокаталитические трансформации, направленные на получение “химерных” β‑лактамных соединений, осуществляли синтезом с ацильным переносом, называемым также кинетически-контролируемым синтезом [11, 14‒16], схема которого показана на рис. 1.
Рис. 1.
Схема кинетически-контролируемого синтеза β-лактамов путем биокаталитического ацилирования
7-TMCA.  .
Fig. 1. Scheme of kinetically controlled synthesis of β-lactams by biocatalytic acylation
of 7-TMCA.
.
Fig. 1. Scheme of kinetically controlled synthesis of β-lactams by biocatalytic acylation
of 7-TMCA. 
Биокаталитический синтез CFM и “химерных” соединений
В качестве ключевой (ацилируемой) аминокислоты (КА) использовали 7‑ТМСА, представляющую собой β‑лактамную часть таких антибиотиков как цефамандол (СFM), цефазафлур, цефотетан, цефоперазон. Ацилирующими агентами (АА) служили метиловые эфиры шести карбоновых кислот (КК), а именно: D-манделовой кислоты (МА), 1(H)-тетразолилуксусной кислоты (TzAA), цианометилтиоуксусной кислоты (CMTAA), тиенилуксусной кислоты (TAA), D-фенилгицина (PG), D-п‑оксифенилгицина (HPG), содержащие ацильные части различных цефалоспориновых антибиотиков (см. табл. 1).
Таблица 1.
Ацилирующие агенты и известные β-лактамные антибиотики на их основе Table 1. Acylating agents and known β-lactam antibiotics including corresponding acyl parts
| Ацилирующий агент | Антибиотики, включающие данную ацильную часть | |
|---|---|---|
| Метиловый эфир D-манделовой кислоты (MEМА) |  |
• Цефамандол • Цефоницид |
| Метиловый эфир 1(H)-тетразолилуксусной кислоты (METzAA) |  |
• Цефазолин • Цефтезол |
| Метиловый эфир цианометилтиоуксусной кислоты (MECMTAA) |  |
• Цефметазол |
| Метиловый эфир тиенилуксусной кислоты (METAA) |  |
• Цефалоридин • Цефокситим • Цефалотин |
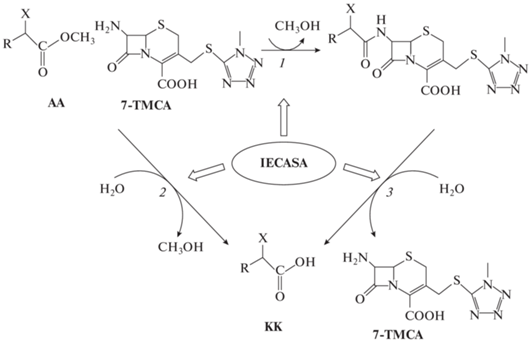
| Метиловый эфир D-фенилгицина (MEPG) | 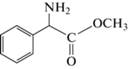 |
• Цефалоглицин • Цефалексин • Цефаклор |
| Метиловый эфир D-п‑оксифенилгицина (MEHPG) |  |
• Цефоперазон • Цефпрозил • Цефатризин • Цефадроксил |
Методика проведения синтеза подробно описана в работе [15] для синтеза CFM. Все процессы синтеза β-лактамов осуществляли при 30°С в 0.3 М фосфатно-натриевом буфере (ФБ) при одинаковых начальных концентрациях КА и АА: ${\text{C}}_{{{\text{7}} - {\text{TMCA}}}}^{^\circ }$ = = 60 мМ и ${\text{C}}_{{{\text{АA}}}}^{^\circ }$ = 200 мМ соответственно. Навеску 7‑ТМСА растворяли в ФБ при рН в диапазоне 7.3‒7.9, где растворимость КА составляет 80‒300 мМ [15], то есть превышает заданную начальную концентрацию ${\text{C}}_{{{\text{7}} - {\text{TMCA}}}}^{^\circ }$ = 60 мМ. В полученный раствор вносили АА в виде метилового эфира соответствующей КК (см. табл. 1) и после перемешивания в течение 3‒5 мин добавляли IECASA, начиная тем самым процесс синтеза. В тех случаях, когда растворимость АА была ниже заданной начальной концентрации ${\text{C}}_{{{\text{АA}}}}^{^\circ }$ = 200 мМ, процесс начинали при неполном растворении эфира. Содержание активного фермента в реакционной смеси варьировали в диапазоне CE = = 10‒20 МЕ/мл, при этом продолжительность процесса составляла от 60 до 220 мин. Процесс начинали при рН 7.2‒7.9, установленном в исходном растворе субстратов. В ходе синтеза происходило спонтанное снижение рН, связанное с образованием КК в ходе гидролиза АА и β-лактамного продукта (см. рис. 1). После достижения максимального выхода продукта при снижении рН до 6.0‒6.6 процесс заканчивали. Выбранный диапазон градиента рН соответствует оптимальным условиям функционирования и стабильности CASA [14, 16].
Контроль процессов биокаталитического синтеза CFM и “химерных” соединений.
Для исследования динамики биокаталитического синтеза в пробах, отбираемых из реакционных смесей по ходу процесса, определяли содержание четырех компонентов: целевого β‑лактамного продукта, КА, АА и КК методом ВЭЖХ в изократическом режиме. В качестве мобильной фазы использовали смесь, состоящую из 0.05 М фосфатно-аммонийного буфера, рН 4.0 и метанола. Содержание метанола в мобильной фазе и времена удерживания компонентов (RT) при анализе реакционных смесей представлены в табл. 2. Скорость потока мобильной фазы – 1.0 мл/мин. Детектирование пиков анализируемых веществ осуществляли спектрофотометрически при длине волны 218 нм. Концентрацию CFM в реакционной смеси, полученной при биокаталитическом синтезе, определяли по стандартному образцу натриевой соли CFM (Sigma-Aldrich). Ввиду отсутствия стандартных образцов синтезируемых “химерных” соединений для выбора условий их детекции и определения концентрации методом ВЭЖХ проводили предварительные пробные процессы синтеза соответствующего продукта в выбранных стандартных условиях (${\text{C}}_{{{\text{7}} - {\text{TMCA}}}}^{^\circ }$ = 60 мМ, ${\text{C}}_{{{\text{АA}}}}^{^\circ }$ = 200 мМ, CE = = 10‒20 МЕ/мл) в течение 30–45 мин. Образцы пробной реакционной смеси, отобранные через 30 мин и 45 мин проведения биокаталитического синтеза, использовали для выбора условий анализа методом ВЭЖХ. Подбирали концентрацию метанола в мобильной фазе, при которой в реакционной смеси через 30–45 мин процесса детектируется пик, отсутствующий в исходной реакционной смеси и увеличивающийся с течением времени. Его принимали за пик синтезируемого β-лактамного “химерного” соединения. Выбранные условия детекции β‑лактамных продуктов представлены в табл. 2. В пробной реакционной смеси методом ВЭЖХ определяли остаточную концентрацию 7-TMCA и рассчитывали концентрацию “химерного” соединения, исходя из предположения о соблюдении 100%-ого баланса по β‑лактаму. Пробную реакционную смесь использовали для построения калибровочной кривой по β-лактамному продукту.
Таблица 2.
Условия анализа методом ВЭЖХ реакционных смесей при биокаталитическом синтезе β-лактамных соединений Table 2. Conditions for HPLC analysis of reaction mixtures in the biocatalytic synthesis of β-lactam compounds
| Ожидаемый продукт синтеза | Определяемый компонент реакционной смеси | Содержание метанола в мобильной фазе, % (v/v) | RT, мин |
|---|---|---|---|
| CFM (TMCA_MA) |
7-TMCA | 5 | 11.6–12.0 |
| MA | 4.5–4.7 | ||
| MEMA | 35 | 7.0–7.3 | |
| CFM | 4.5–5.5 | ||
| Chimera 1 (TMCA_TzAA) | TzAA | 1 | 2.3–3.0 |
| METzAA | 11.0–11.5 | ||
| 7-TMCA | 15 | 5.2–5.7 | |
| Chimera 1 | 8.4–10.0 | ||
| Chimera 2 (TMCA_CMAA) | CMTAA | 15 | 4.5–4.7 |
| MECMTAA | 9.0–9.5 | ||
| 7-TMCA | 5.0–5.5 | ||
| Chimera 2 | 16.0–16.5 | ||
| Chimera 3 (TMCA_TAA) |
TAA | 12 | 9.5–9.7 |
| 7-TMCA | 6.2–6.5 | ||
| METAA | 35 | 14.5–14.8 | |
| Chimera 3 | 7.3–7.5 | ||
| Chimera 4 (TMCA_PG) |
PG | 11 | 2.8–3.2 |
| MEPG | 12.8–13.5 | ||
| 7-TMCA | 6.7–7.0 | ||
| Chimera 4 | 50 | 7.6–7.8 | |
| Chimera 5 (TMCA_HPG) |
HPG | 8 | 2.3–2.5 |
| MEHPG | 6.8–7.2 | ||
| 7-TMCA | 8.3–8.6 | ||
| Chimera 5 | 20.5–20.8 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Было получено шесть β‑лактамных продуктов, несущих ацильный остаток соответствующего АА, а именно, антибиотик CFM (TMCA_MA) и пять “химерных” цефалоспориновых соединений: Chimera 1 (TMCA_TzAA), Chimera 2 (TMCA_CMTAA), Chimera 3 (TMCA_TAA), Chimera 4 (TMCA_PG) и Chimera 5 (TMCA_HPG). Структура полученных “химерных” цефалоспоринов предположена, на основании известной специфичности фермента CASA при синтезе цефалоспоринов-кислот [11], механизма его действия в реакциях кинетически контролируемого синтеза [11, 14‒16] и по аналогии с результатами синтеза цефалоспорина-кислоты цефамандола, полученными в данной работе с использованием стандартного образца антибиотика.
При кинетически контролируемом синтезе (рис. 1), помимо образования целевого β‑лактамного продукта путем ацилирования аминогруппы КА с помощью АА, протекают две побочные ферментативные гидролитические реакции – гидролиз эфирной связи АА и гидролиз ациламидной связи β-лактамного продукта [14–17]. В результате в системе устанавливается кинетически-контролируемое равновесие, при котором выход β-лактамного продукта зависит от соотношения скоростей всех реакций [18, 19]. В конечной реакционной смеси после отделения гетерогенного биокатализатора помимо целевого β‑лактамного продукта присутствуют КА, АА и КК.
При проведении экспериментов по синтезу β-лактамов, катализируемому IECASA, осуществляли динамический контроль состава реакционных смесей методом ВЭЖХ по всем компонентам (КА, АА, β-лактамный продукт, КК). На рис. 2‒7 представлены кривые расхода 7-ТМСА и АА, кривые накопления целевого β-лактамного продукта и КК, а также балансы по β‑лактаму и по КК.
Рис. 2.
Изменение состава реакционной смеси (относительные концентрации, %) от времени при синтезе CFM, катализируемом IECASA, 1 – 7-ТМСА, 2 – CFM, 3 – баланс (%) по β-лактаму, 4 – МЕМА, 5 – MA, 6 – баланс (%) по MA, CE = 10 МЕ/мл, спонтанный градиент рН в диапазоне рН 7.7–6.4. Fig. 2. Change in the composition of the reaction mixture (relative concentrations, %) from time to time during the synthesis of CFM catalyzed by IECASA, 1 – 7-ТМСА, 2 – CFM, 3 – balance (%) for β-lactam, 4 – МЕМА, 5 – MA, 6 – balance (%) for MA, CE = 10 U/mL, spontaneous pH gradient in the pH range 7.7–6.4.

Рис. 3.
Изменение состава реакционной смеси (относительные концентрации, %) от времени при синтезе Chimеra 1 TMCA_TzAA, катализируемом IECASA. 1 – 7-ТМСА, 2 – Chimera 1, 3 – баланс (%) по β-лактаму, 4 – МЕTzAA, 5 – TzAA, 6 – баланс (%) по TzAA, CE =10 МЕ/мл, спонтанный градиент рН в диапазоне рН 7.9–6.5. Fig. 3. Change in the composition of the reaction mixture (relative concentrations, %) from time to time during the synthesis of Chimera 1 TMCA_TzAA catalyzed by IECASA, 1 – 7-ТМСА, 2 – Chimera 1, 3 – balance (%) for β-lactam, 4 – МЕTzAA, 5 – TzAA, 6 – balance (%) for TzAA, CE = 10 U/mL, spontaneous pH gradient in the pH range 7.9–6.5.
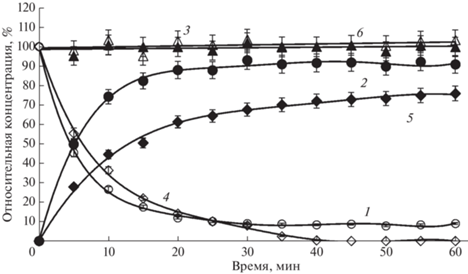
Рис. 4.
Изменение состава реакционной смеси (относительные концентрации, %) от времени при синтезе Chimera 2 TMCA_CMTAA, катализируемом IECASA. 1 – 7-ТМСА, 2 – Chimera 2, 3 – баланс (%) по β-лактаму, 4 – MECMTAA, 5 – CMTAA, 6 – баланс (%) по CMTAA, CE = 20 МЕ/мл, спонтанный градиент рН в диапазоне рН 7.6–6.6. Fig. 4. Change in the composition of the reaction mixture (relative concentrations, %) from time to time during the synthesis of Chimera 2 TMCA_CMTAA catalyzed by IECASA. 1 – 7-ТМСА, 2 – Chimera 2, 3 – balance (%) for β-lactam, 4 – MECMTAA, 5 – CMTAA, 6 – balance (%) for CMTAA, CE = 20 U/mL, spontaneous pH gradient in the pH range 7.6–6.6.

Рис. 5.
Изменение состава реакционной смеси (относительные концентрации, %) от времени при синтезе Chimera 3 TMCA_TAA, катализируемом IECASA. 1 – 7-ТМСА, 2 – Chimera 3, 3 – баланс (%) по β-лактаму, 4 – METAA, 5 – TAA, 6 – баланс (%) по TAA, CE = 20 МЕ/мл, спонтанный градиент рН в диапазоне рН 7.2–6.0. Fig. 5. Change in the composition of the reaction mixture (relative concentrations, %) from time to time during the synthesis of Chimera 3 TMCA_TAA catalyzed by IECASA. 1 – 7-ТМСА, 2 – Chimera 3, 3 – balance (%) for β-lactam, 4 – METAA, 5 – TAA, 6 – balance (%) for TAA, CE = 20 U/mL, spontaneous pH gradient in the pH range 7.2–6.0.
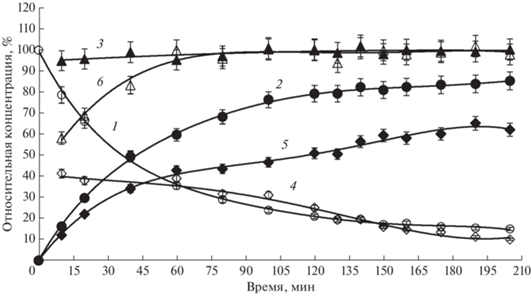
Рис. 6.
Изменение состава реакционной смеси (относительные концентрации, %) от времени при синтезе Chimera 4 TMCA_PG, катализируемом IECASA. 1 – 7-ТМСА, 2 – Chimera 4, 3 – баланс (%) по β-лактаму, 4 – MEPG, 5 – PG, 6 – баланс (%) по PG, CE = 20 МЕ/мл, спонтанный градиент рН в диапазоне рН 6.8–6.2. Fig. 6. Change in the composition of the reaction mixture (relative concentrations, %) from time to time during the synthesis of Chimera 4 TMCA_PG catalyzed by IECASA. 1 – 7-ТМСА, 2 – Chimera 4, 3 – balance (%) for β-lactam, 4 – MEPG, 5 – PG, 6 – balance (%) for PG, CE = 20 U/mL, spontaneous pH gradient in the pH range 6.8–6.2.
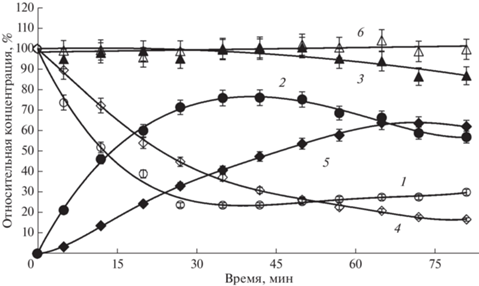
Рис. 7.
Изменение состава реакционной смеси (относительные концентрации, %) от времени при синтезе Chimera 5 TMCA_HPG, катализируемом IECASA. 1 – 7-ТМСА, 2 – Chimera 5, 3 – баланс (%) по β-лактаму, 4 – MEHPG, 5 – HPG, 6 – баланс (%) по HPG, CE = 20 МЕ/мл, спонтанный градиент рН в диапазоне рН 7.3–6.4. Fig. 7. Change in the composition of the reaction mixture (relative concentrations, %) from time to time during the synthesis of Chimera 5 TMCA_HPG catalyzed by IECASA. 1 – 7-ТМСА, 2 – Chimera 4, 3 – balance (%) for β-lactam, 4 – MEPG, 5 – PG, 6 – balance (%) for PG, CE = 20 U/mL, spontaneous pH gradient in the pH range 7.3–6.4.

Кривые накопления β-лактамных продуктов и КК на рис. 2‒7 представляют собой относительные концентрации (%), рассчитанные по отношению к ${\text{C}}_{{{\text{ТМСА}}}}^{^\circ }$. Баланс по β-лактаму рассчитывали как сумму относительных концентраций 7‑ТМСА и β-лактамного продукта, а баланс по КК ‒ как сумму относительных концентраций β-лактамного продукта, АА и КК.
Кривые накопления β-лактамных продуктов на рис. 2‒7 (кривая 2) имеют плато различной протяженности и отражают зависимость от времени степени трансформации 7‑ТМСА в целевой продукт, то есть выхода β-лактамного продукта по отношению к КА.
Для сопоставления эффективности изучаемых биокаталитических процессов были выбраны следующие критерии: максимальный выход продукта синтеза и удельная начальная скорость его накопления.
Максимальный выход β-лактамного продукта (ηмакс, %) рассчитывали как средний результат по всем точкам на плато зависимости относительной концентрации целевого продукта от времени (рис. 2‒7, кривая 2). Этот показатель характеризует эффективность процесса в целом (см. рис. 1) и определяется соотношением скоростей синтетазной (трансформация 1) и обеих гидролитических реакций (трансформации 2 и 3), катализируемых ферментом. На величине максимального выхода β‑лактамного продукта может негативно сказываться протекание неконтролируемых побочных процессов, выявляемых на основании отсутствия в системе баланса по β‑лактаму (рис. 2‒7, кривая 3) и/или по КК (рис. 2‒7, кривая 6) в условиях полного растворения обоих субстратов. Собственно синтетазную способность IECASA в изучаемых процессах ацилирования 7‑TMCA оценивали в условиях, когда гидролитические процессы еще не оказывают существенного влияния на реакцию образования ациламидной связи β‑лактамного продукта, а именно по удельной начальной скорости синтеза ($V_{{{\text{уд}}}}^{^\circ }$, мМ/мин МЕ). Этот параметр рассчитывали как отношение начальной скорости накопления β‑лактамного продукта, определенной по начальному участку соответствующей кривой накопления (рис. 2‒7, кривая 2), отнесенной к содержанию фермента в реакционной смеси. На рис. 8 представлены кривые накопления β-лактамных продуктов для всех изученных в данной работе процессов биокаталитического синтеза, катализируемого IECASA. Рассчитанные на основании этих кривых параметры, характеризующие эффективность биокаталитических процессов, представлены в табл. 3. Оцениваемая по начальной удельной скорости накопления продукта синтетазная способность IECASA при ацилировании 7‑ТМСА ($V_{{{\text{уд}}}}^{^\circ }$, мМ/мин МЕ) падает в 12 раз в ряду эфиров: METzAA, MEMA, MEHPG, MEPG, MECMTAA, METAA. При этом эффективность процесса биокаталитического синтеза в целом, оцениваемая по максимальному достигаемому выходу целевого β-лактама (ηмакс, %), снижается в ряду ацилирующих агентов MECMTAA, METzAA, METAA, MEPG, MEHPG, MEMA от 96 до 60%. Анализ реакционных смесей не только по целевому продукту, но и по КА, АА и КК с расчетом балансов (рис. 2‒7) позволил, помимо определения параметров эффективности ηмакс и $V_{{{\text{уд}}}}^{^\circ }$, выявить особенности каждого из изученных процессов синтеза β-лактамных продуктов, объясняющие несовпадение синтетазной способности биокатализатора и эффективности процесса биокаталитического синтеза в целом.
Рис. 8.
Динамика накопление продуктов биокаталитического ацилирования 7-ТМСА, катализируемого IECASA, различными АА. 1 – CFM, 2 – Chimera 1 TMCA_TzAA, 3 – Chimera 2 TMCA_CMTAA, 4 – Chimera 3 TMCA_TAA, 5 – Chimera 4 TMCA_PG, 6 – Chimera 5 TMCA_HPG, 30°C, 0,3 М ФБ, CE = 10–20 МЕ/мл, спонтанный градиент рН, ${\text{C}}_{{{\text{7}} - {\text{TMCA}}}}^{^\circ }$ = 60 мМ, X° = 3.3 M/M. Fig. 8. Dynamics of accumulation of the product of biocatalytic acylation of 7-TMCA, catalyzed by IECASA, various АА. 1 – CFM, 2 – Chimera 1 TMCA_TzAA, 3 – Chimera 2 TMCA_CMTAA, 4 – Chimera 3 TMCA_TAA, 5 – Chimera 4 TMCA_PG, 6 – Chimera 5 TMCA_HPG, 30°C, 0.3 M PB, CE = 10–20 U/mL, spontaneous pH gradient, ${\text{C}}_{{{\text{7}} - {\text{TMCA}}}}^{^\circ }$ = 60 мМ, X° = 3.3 M/M.

Таблица 3.
Результаты экспериментов по синтезу “химерных” соединений и цефамандола, катализируемому IECASA Table 3. Results of experiments on the synthesis of “chimera” compounds and cefamandole catalyzed by IECASA
| CFM и ожидаемые β-лактамные “химерные” продукты | CE, МЕ/мл | Плато максимального выхода, мин | ηмакс, % | $V_{{{\text{уд}}}}^{^\circ }$, мМ/мин МЕ |
Побочные процессы |
|
|---|---|---|---|---|---|---|
 |
CFM (TMCA_МА) |
10 | 27–42 | 60.3 ± 1.5 | 0.22 ± 0.01 | Нет |
 |
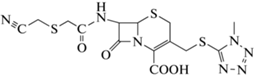
Chimera 1 (TMCA_TzAA) | 10 | 30–60 | 91.4 ± 1.6 | 0.59 ± 0.03 | Нет |
 |
Chimera 2 (TMCA_CMTAA) | 20 | 100–220 | 96.4 ± 2.0 | 0.067 ± 0.003 | Нет |
 |
Chimera 3 (TMCA_TAA) | 20 | 140–205 | 83.2 ± 2.2 | 0.050 ± 0.003 | Нет |
 |
Chimera 4 (TMCA_PG) | 20 | 35–50 | 75.8 ± 1.0 | 0.13 ± 0.006 | 1 п/п* |
 |
Chimera 5 (TMCA_HPG) | 20 | 25–35 | 70.9 ± 1.0 | 0.12 ± 0.006 | 2 п/п* |
Выход CFM при его биокаталитическом синтезе достигает лишь 60%, несмотря на высокую синтетазную способность IECASA при ацилировании 7-TMCA c использованием MEMA в качестве АА (табл. 3). При этом кривая накопления CFM (рис. 2, кривая 2 и рис. 8, кривая 1) имеет выраженный максимум с непродолжительным плато максимального выхода (от 30 до 40 мин процесса). Далее концентрация β‑лактамного продукта снижается, а концентрация 7‑TMCA увеличивается (рис. 2, кривые 2 и 1), что свидетельствует о неблагоприятном для биокаталитического ацилирования 7‑TMCA соотношении скоростей синтетазного (рис. 1, трансформация 1) и обоих гидролитических процессов (рис. 1, трансформации 2 и 3). Кроме того, на протекание процесса биокаталитического синтеза CFM оказывает влияние низкая растворимость MEMA, который полностью растворяется лишь к 20 минуте процесса. До этого времени на кривой расхода АА (рис. 2, кривая 4) наблюдается плато, уровень которого соответствует растворимости МЕМА в условиях процесса, то есть при 30°С в 0.3 М ФБ в присутствии 7-TMCA и образующихся CFM и MA. Растворимость MEMA, рассчитанная по этим данным, составляет около 110 мМ, что близко к его растворимости при 30°С в 0.3 М ФБ, определенной методом насыщения, которая составляет 130 мМ [15]. Результатом неполного растворения MEMA в начале процесса является отсутствие баланса не только по МА, но и по β‑лактаму (рис. 2, кривые 6 и 3), что свидетельствует о том, что часть 7‑ТМСА также выпадает в осадок в присутствии нерастворенных кристаллов МЕМА. После растворения обоих субстратов (через 20 мин протекания процесса) балансы достигают 100%, то есть неконтролируемые побочные процессы в системе отсутствуют.
Продолжительные плато на кривых накопления продукта, наблюдаемые при синтезе Chimera 1, Chimera 2 и Chimera 3 (рис. 8, кривые 2, 3 и 4) свидетельствуют о том, что в этих случаях скорость реакции биокаталитического синтеза продукта (рис. 1, трансформация 1), катализируемого IECASA, преобладает над скоростью его биокаталитического гидролиза (рис. 1, трансформация 3). При этом скорости гидролиза используемых АА (рис. 1, трансформация 2) также низки по сравнению со скоростями синтеза соответствующих продуктов, что позволяет достичь высоких выходов предполагаемых целевых β‑лактамов (от 83 до 95%) при использовании METAA, METzAA и MECMTAA в качестве АА (табл. 3). При получении Chimera 1 высокая удельная начальная скорость его синтеза обеспечивает быстрое достижение равновесия в биокаталитическом процессе (рис. 8, кривая 2) и высокий выход продукта. При синтезе Chimera 2 и Chimera 3 высокие выходы продуктов достигаются несмотря на низкие значениями параметра $V_{{{\text{уд}}}}^{^\circ }$ (табл. 3) за счет очень низкой скорости гидролитических реакций относительно скорости собственно синтеза, но для достижения состояния равновесия требуется длительное время (рис. 8, кривые 3 и 4).
При синтезе Chimera 1 наблюдается баланс как по β‑лактаму, так и по TzAA на протяжении всего процесса (рис. 3, кривые 3 и 6), что свидетельствует об отсутствии неконтролируемых побочных реакций при ацилировании 7-TMCA метиловым эфиром TzAA.
На процессы биокаталитического синтеза Chimera 2 и Chimera 3 влияет низкая растворимость МЕСМТАА и METAA, о чем свидетельствуют кривые расхода соответствующих АА (рис. 4 и 5, кривые 4) и отсутствие баланса по КК в начале процессов синтеза (рис. 4 и 5, кривые 6). Заметим, что присутствие в реакционной смеси в начале процессов не полностью растворенных МЕСМТАА или METAA, являющихся жидкостями, а не кристаллическими веществами, на балансе по β‑лактаму практически не сказывается (рис. 4 и 5, кривые 3). Наличие балансов по КК после полного растворения АА, а также по β‑лактаму в течение всего процесса при синтезе Chimera 2 и Chimera 3 позволяют сделать вывод об отсутствии неконтролируемых побочных процессов при ацилировании 7-TMCA метиловыми эфирами СМТАА и TAA.
Процессы биокаталитического ацилирования 7-TMCA метиловыми эфирами аминокислот PG и HPG ведут к получению “химерных” соединений Chimera 4 и Chimera 5, относящихся к классу аминоцефалоспоринов, в отличие от рассмотренных выше процессов синтеза β-лактамов, относящихся к классу цефалоспоринов-кислот [11]. Удельная начальная скорость синтетазных реакций ацилилирования 7-TMCA метиловыми эфирами PG и HPG, катализируемых IECASA, достаточно высока (табл. 3), однако, процессы синтеза Chimera 4 и Chimera 5 осложнены протеканием побочных реакций, о чем свидетельствует падение балансов по β-лактаму по ходу процессов (рис. 6 и 7, кривая 3). При этом методом ВЭЖХ в реакционных смесях детектируются побочные продукты: по крайней мере, один в случае синтеза Chimera 4 и, по крайней мере, два в случае синтеза Chimera 5 (табл. 3), Кроме того, начальная стадия процесса синтеза Chimera 5 осложнена низкой растворимостью MEHPG (рис. 7). Таким образом, наличие выраженного максимума на кривых накопления продукта при синтезе Chimera 4 и Chimera 5 (рис. 8, кривые 5 и 6) является следствием не только относительно интенсивного биокаталитического гидролиза ациламидной связи в этих продуктах, но также и протекания побочных неконтролируемых процессов, снижающих степень трансформации КА в целевой продукт до 70‒75% (табл. 3).
Таким образом, продемонстрирована возможность получения “химерных” цефалоспоринов в мягких стандартных условиях в водной среде с использованием в качестве биокатализатора IECASA. Высокая эффективность использования этого иммобилизованного фермента в процессах ацилирования 7‑ТМСА метиловыми эфирами TzAA и CMTAA является следствием низкой скорости реакций ферментативного гидролиза ацилирующего агента и β-лактамного продукта относительно скорости собственно синтеза соответствующих “химерных” цефалоспоринов-кислот, а также отсутствия неконтролируемых побочных процессов.
Справедливость предположения о структуре полученных “химерных” продуктов, основанного на известной специфичности и схеме действия CASA [11, 14‒16], а также на аналогии с результатами синтеза цефамандола, полученными в данной работе с использованием стандартного образца антибиотика, подтверждается наличием баланса по остаткам соответствующих карбоновых кислот при биокаталитическом синтезе всех полученных цефалоспоринов. Биокаталитическое ацилирование 7-TMCA методом ацильного переноса, приводящее к получению “химерных” цефалоспоринов-кислот, протекает без образования детектируемых побочных продуктов. Получаемые реакционные смеси потенциально пригодны для изучения антимикробной активности синтезированных β-лактамных продуктов без их выделения, поскольку эти смеси представляют собой водные растворы, содержащие синтезированный продукт в концентрации более 12 000 мкг/мл, что на 2‒4 порядка превосходит концентрации цефалоспориновых антибиотиков, используемые для определения in vitro их активности в отношении грамм-положительных и грамм-отрицательных микроорганизмов [20].
В ходе дальнейшей работы для тех “химерных” соединений, которые покажут высокую антимикробную активность и/или необычный спектр действия при исследовании реакционных смесей, полученных биокаталитическим синтезом, будут разработаны методы выделения и очистки индивидуальных соединений и проведено исследование их структуры принятыми в органической химии инструментальными методами.
Список литературы
Ныс П.С., Курочкина В.Б., Скляренко А.В., Вейнберг Г.А. Беталатамные соединения. Взаимосвязь структуры и биологической активности. Антибиотики и химиотерапия, 2000, 45(11), 36‒42.
Rodriguez-Herrera R., Puc L.E.C., Sobrevilla J.M.V., et al. Enzymes in the Pharmaceutical Industry for β-Lactam Antibiotic Production. In: Enzymes in Food Biotechnology - Production, Applications, and Future Prospects [Ed. M. Kuddus]. Acad. Press, 2018, 36, 627‒643. https://doi.org/10.1016/B978-0-12-813280-7.00036-0
Gaurav K., Karmakar S., Kundu S., Kundu K., Design, Development and Synthesis of Novel Cephalosporin Group of Antibiotics. In: Antibiotic Resistant Bacteria - A Continuous Challenge in the New Millennium [Ed. Dr. Marina Pana]. InTech., 2012, 487‒502. https://doi.org/10.5772/29658
Theuretzbacher U. Resistance drives antibacterial drug development. Curr. Opin. Pharmacol., 2011. 11(5), 433‒438. https://doi.org/10.1016/j.coph.2011.07.008
Kurochkina V.B., Satarova D.E., Nys P.S. Combinatorial enzymology. Synthesis of novel betalactam libraries. Moscow University Chemistry Bulletin. Biocatalysis, 2000, 41(6), 139‒143.
Курочкина В.Б., Ныс П.С. Новые беталактамные структуры. Проблемы конструирования. Антибиотики и химиотерапия, 2002, 2, 29‒37.
Hamed R.B., Gomez-Castellanos R.J., Henry L., et al. The enzymes of b-lactam biosynthesis. Nat. Prod., Rep., 2013, 30(1), 21‒107. https://doi.org/10.1039/c2np20065a
Rajasekar V.W. Enzyme enabled antibiotic production: going “green” in manufacturing. Enz. Eng., 2016, 5(1), 138‒139. https://doi.org/10.4172/2329-6674.1000138
Sklyarenko A.V., Kurochkina V.B., Egorov A.M. Enzymatic transformation and synthesis of beta-lactam antibiotics. In: New research on biotechnology in biology and medicine [Ed. A.M. Egorov, G.Zaikov]. Nova Science Publishers, 2006, 73‒86.
Arroyo M., De la Mata I., García J.-L., et al. Biocatalysis for Industrial Production of Active Pharmaceutical Ingredients (APIs), Biotechnology of Microbial Enzymes, 2017, 17, 451‒473. https://doi.org/10.1016/B978-0-12-803725-6.00017-0
Sklyarenko A.V., Eldarov M. A., Kurochkina V.B., Yarotsky S.V. Enzymatic synthesis of β-lactam acids (review). Appl. Biochem. Microbiol., 2015, 51(6), 627‒640. https://doi.org/10.1134/S0003683815060150
Эльдаров М.А., Скляренко А.В., Думина М.В., и др. Рекомбинантная синтетаза цефалоспоринов-кислот: оптимизация экспрессии в клетках E. coli, иммобилизация и использование для биокаталитического синтеза цефазолина. Биомедицинская химия, 2015, 61(5), 646‒651. https://doi.org/10.18097/PBMC20156105646
Kurochkina V.B., Sklyarenko A.V. Enzymatic synthesis of beta-lactam antibiotics. Analytical review. In: Biotechnology: state of the art and prospects for development [Ed. G.E. Zaikov]. Nova Science Publishers, 2008, 20, 175‒204.
Скляренко А.В., Грошкова И.А., Сидоренко А.И., Яроцкий С.В. Альтернативный синтез цефазолина с использованием синтетазы цефалоспоринов-кислот. Прикл. Биохим. Микробиол., 2020, 56(5), 1‒13. https://doi.org/10.31857/S055510992005013X
Скляренко А.В., Грошкова И.А., Крестьянова И.Н., Яроцкий С.В. Альтернативные пути синтеза цефамандола с использованием биокаталитического ацилирования, катализируемого иммобилизованной синтетазой цефалоспоринов-кислот. Прикл. Биохим. Микробиол., 2022, 58(3), 253–263. https://doi.org/10.31857/S0555109922030126
Wang Lu, Sklyarenko A.V., Duanhua Li, et al. Enzymatic synthesis of cefazolin using immobilized recombinant cephalosporin-acid synthetase as the biocatalyst. Bioprocess Biosyst. Eng., 2018, 41(12), 1851‒1867. https://doi.org/10.1007/s00449-018-2007-z
Курочкина В.Б., Скляренко А.В., Ферментативный синтез бета-лактамных антибиотиков. Антибиотики и химиотерапия, 2005, 50(5‒6), 39‒58.
Deaguero A.L., Blum J.K., Bommarius A.S. Biocatalytic synthesis of β-lactam antibiotics. In: Encyclopedia of Industrial Biotechnology: bioprocess, bioseparation, and cell technology, [Ed. M.C. Flickinger]. John Wiley & Sons, 2010, 1‒32. https://doi.org/10.1002/9780470054581.eib640
Sheldon R.A., Brady D. The limits to biocatysis: pushing the envelope. ChemComm., 2018, 54, 6088‒6104. https://doi.org/10.1039/c8cc02463d
Craig W.A., Andes D.R. Cephalosporins. In: Mandel, Douglas and Bennet’s Principles and Practice of Infectious Diseases [Ed. J.E. Bennett, R. Dolin, M.J. Blaser]. Philadelphia: Elsevier Saunders, 2015, 380‒399.
Дополнительные материалы отсутствуют.


