Биотехнология, 2022, T. 38, № 2, стр. 3-13
Получение и свойства рекомбинантных форм ксилоглюканазы 74-го семейства гликозидгидролаз из гриба Trichoderma reesei
А. В. Гусаков 1, *, Д. А. Климов 1, Е. Г. Кондратьева 2, О. А. Синицына 1, А. М. Рожкова 2, П. В. Волков 2, И. А. Шашков 2, А. П. Синицын 1, 2
1 Химический факультет, Московский государственный университет
имени М.В. Ломоносова
119991 Москва, Россия
2 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
* E-mail: avgusakov@enzyme.chem.msu.ru
Поступила в редакцию 15.12.2021
После доработки 03.02.2022
Принята к публикации 23.02.2022
- EDN: VHBDHK
- DOI: 10.56304/S0234275822020041
Аннотация
Проведены клонирование и экспрессия полноразмерной эндо-процессивной ксилоглюканазы из гриба Trichoderma reesei (TrXeg74A), а также каталитического домена фермента (TrXeg74A-CD) в реципиентном штамме Penicillium verruculosum B1-537, являющимся высокоэффективным продуцентом целлюлаз. Уровень секреции белка после культивирования полученных рекомбинантных штаммов в лабораторном ферментере составил 35.4 и 31.4 г/л, при этом секреция TrXeg74A составила не менее 30% от общего количества белка, тогда как TrXeg74A-CD экспрессировался в гораздо меньшей степени. После выделения и очистки обеих форм рекомбинантного фермента были изучены их свойства. TrXeg74A и TrXeg74A-CD характеризовались сходной степенью процессивности при действии на ксилоглюкан из тамаринда, близкими по значению константами Михаэлиса (0.35–0.38 г/л), сходными с таковой для нативного фермента (0.30 г/л), в то же время каталитическая константа для TrXeg74A-CD была примерно в полтора раза выше соответствующего параметра для полноразмерной ксилоглюканазы. Полученные новые рекомбинантные штаммы P. verruculosum могут быть полезными при создании композиционных ферментных препаратов для эффективного гидролиза возобновляемого лигноцеллюлозного сырья.
Ксилоглюкан – это разветвленный структурный полисахарид сложного строения, который находится в первичной стенке растений и относится к классу гемицеллюлоз. Ксилоглюкан заполняет пространство между микрофибриллами целлюлозы, являясь связующим полисахаридом и способствуя повышению прочности клеточной стенки. Основная цепь молекулы ксилоглюкана состоит из 300–3000 остатков D-глюкопиранозы, соединенных β-1,4-гликозидными связями и замещенных (до 75%) остатками α-D-ксилозы в положении O-6 гликозидного кольца. В свою очередь некоторые из остатков ксилозы могут быть связаны с остатками β-D-галактозы или α-L-арабинозы; реже встречаются остатки α-L-фукозы в качестве заместителя [1, 2].
В природе биодеградацию ксилоглюкана осуществляют различные ферменты, катализирующие расщепление как основной цепи полисахарида, так и гидролизующие боковые остатки моносахаридов [1–3]. В составе ферментных комплексов, применяемых в биотехнологических процессах конверсии возобновляемого лигноцеллюлозного сырья, важную роль играют ксилоглюканазы, поскольку они облегчают доступ целлюлаз – ключевых ферментов таких мультиферментных систем – к поверхности целлюлозы [1, 4]. Специфичные ксилоглюканазы, гидролизующие основную цепь ксилоглюкана, относятся к различным семействам гликозидгидролаз; из них особый интерес представляют входящие в состав 74-го семейства [5–8]. Ферменты этого семейства подразделяют на две основные группы: эндо-диссоциативные ксилоглюканазы (КФ 3.2.1.151), действующие неупорядоченным способом на молекулу полисахарида (при этом происходит диссоциация фрагментов полимера после каждого каталитического акта), и эндо-процессивные ксилоглюканазы (КФ 3.2.1.155), для которых после первичной атаки на ксилоглюкан по эндо-типу диссоциации не происходит, и фермент последовательно отщепляет олигосахаридные блоки, содержащие, как правило, по 4 гликозидных остатка в основной цепи, по так называемому процессивному механизму [5–9]. Механизм действия эндо-процессивных ксилоглюканаз напоминает таковой для целлобиогидролаз 6-го и 7-го семейства, которые являются типичными представителями экзо-деполимераз [5, 10].
Ксилоглюканаза из гриба Trichoderma reesei (TrXeg74A, также известная как Cel74A) является типичным представителем эндо-процессивных ферментов. Она состоит из каталитического домена и целлюлозосвязывающего модуля (ЦСМ), связанных между собой гибким пептидным линкером [5]. При этом стоит отметить, что далеко не все ксилоглюканазы имеют в своей структуре ЦСМ. Последний является важным структурным элементом большинства ферментов, гидролизующих целлюлозу (эндоглюканаз и целлобиогидролаз), однако в случае ксилоглюканаз, как и других гемицеллюлаз, роль ЦСМ не ясна. Согласно литературным данным [4] TrXeg74A способна проявлять высокую эффективность как вспомогательный компонент целлюлазного комплекса при биодеградации лигноцеллюлозной биомассы.
В данной работе с целью получения новых продуцентов ферментных препаратов, обладающих повышенной осахаривающей способностью, были клонированы и экспрессированы две формы этого фермента в реципиентном штамме гриба Penicillium verruculosum B1-537, являющимся высокоэффективным продуцентом целлюлаз [11], а также изучены свойства рекомбинантных ферментов после их выделения и очистки.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Клонирование и экспрессия TrXeg74A и TrXeg74A-CD
Полноразмерный ген cel74A (код GenBank: AY281371.1), а также его укороченная форма, кодирующие TrXeg74A и TrXeg74A-CD, соответственно, были амплифицированы методом ПЦР с использованием геномной ДНК гриба T. reesei, выделенной при помощи набора DNeasy Plant Mini Kit (QIAGEN, CША). Для амплификации использовались олигонуклеотидные последовательности, представленные ниже:
(1)
${\text{XGTr - fwd}}{\kern 1pt} :~\,\,\,\,{\text{CAAACAGAAGCAACCGACACAATGAAGGTCTCTCGAGTCCTTGCCCT,\;}}$ПЦР проводили с использованием Pfu-полимеразы (Thermo Fisher Scientific, США) в стандартных условиях, рекомендованных фирмой-производителем. Полученные ПЦР-продукты размером 2517 п.о. – праймеры (1) и (2) – и 2229 п.о. – праймеры (1) и (3), соответственно, были клонированы в вектор pCBHI [12] по методике независимого лигирования [13]. Полученные плазмиды pCBHI-XG и pCBHI-ΔXG были трансформированы в штамм Escherichia coli MACHI T1R (Thermo Fisher Scientific) для дальнейшей наработки ДНК. Отсутствие мутаций, инсерций и делеций в наработанной ДНК было доказано секвенированием по методу Сэнгера в обоих направлениях (ООО “Синтол”, Россия).
Трансформацию реципиентного штамма P. verruculosum B1-537, ауксотрофного по гену niaD, кодирующему нитратредуктазу, проводили по CaCl2-ПЭГ модифицированной методике [14]. Трансформанты серий P. verruculosum TrXeg74A и P. verruculosum TrXeg74A-CD отбирали на селективных агаризованных средах с 10 мМ нитратом натрия.
Скрининг трансформантов проводили в качалочных колбах со 100 мл стандартной ферментационной среды (в г/л): МКЦ – 40; дрожжевой экстракт – 10; КН2РО4 – 15; (NH4)2SO4 – 5; MgSO4⋅7H2O – 0.3; СaCl2⋅2H2O – 0.3. Для каждого из вариантов рекомбинантной ксилоглюканазы для скрининга было выбрано по 18 клонов. В качестве контроля использовали реципиентный штамм P. verruculosum B1-537. Отбор трансформантов проводили через 144 ч культивирования при 30°С по критерию увеличения ксилоглюканазной активности в культуральной жидкости грибных штаммов в сравнении с контролем.
Отобранные трансформанты культивировали в течение 144 ч в лабораторном ферментере объемом 1 л (ООО “Проинтех”, Россия), используя стандартную среду для P. verruculosum [15].
Выделение и очистка ферментов
Для выделения и очистки рекомбинантных форм TrXeg74A и TrXeg74A-CD из культуральных жидкостей, полученных путем ферментации выбранных клонов в 1 л лабораторном ферментере, биомассу отделяли на центрифуге Hettich Zentrifugen D-78532 (Hettich, ФРГ) при 8200 g в течение 5 мин, и к супернатантам добавляли сухой сульфат аммония (80% от насыщения при 0°С) для осаждения белка. Полученный осадок белка из 35 мл супернатанта культуральной жидкости перерастворяли в 7 мл 0.02 М Na-ацетатного буфера, pH 5.0, и аликвоты полученного раствора (1.5 мл) после центрифугирования при 14100 g в течение 5 мин (Eppendorf AG 22331, Германия), наносили на колонку (0.7 × 30 см) с Bio-Gel P-60 (Bio-Rad Laboratories, США,) для обессоливания и отделения низкомолекулярных белков гель-фильтрацией. Обе формы фермента относятся к высокомолекулярным белкам, теоретические массы TrXeg74A и TrXeg74A-CD составляют 85 и 76 кДа, соответственно. Элюирование проводили 0.02 М ацетатным буфером, рН 5.0, при скорости потока 0.1 мл/мин.
Обессоленные образцы высокомолекулярных фракций после гель-фильтрации, содержащие 50–90 мг белка, фракционировали с помощью анионообменной хроматографии на колонке Mono Q объемом 10 мл (GE Healthcare, Швеция), используя хроматограф среднего давления NGC Chromatography System (Bio-Rad Laboratories). Перед нанесением на колонку рН в образцах предварительно доводили до 6.8 с помощью 1 М Bis-Tris. Элюирование белков осуществляли 0.02 М Bis-Tris/HCl буфером, pH 6.8, в градиенте NaCl от 0 до 0.25–0.4 М при скорости потока 4 мл/мин. Фракции, содержащие ксилоглюканазную активность, далее подвергали гидрофобной хроматографии на колонках Source 15 Isopropyl (GE Healthcare) объемом 10 мл в случае выделения TrXeg74A или 1 мл при очистке TrXeg74A-CD. Элюирование белков осуществляли 0.05 М Na-ацетатным буфером, pH 5.0, в обратном градиенте сульфата аммония от 1.7 до 0 М.
Концентрацию белка определяли по модифицированному методу Лоури [16], используя в качестве стандарта бычий сывороточный альбумин.
Чистоту белков во фракциях после хроматографии контролировали с помощью электрофореза в полиакриламидном геле (12%) на приборе Mini Protean II (Bio-Rad Laboratories). Белковые полосы в гелях окрашивали красителем Кумасси бриллиантовым голубым R-250 (Ferak, Германия).
Идентификация ферментов
Идентификацию ферментов проводили путем обработки трипсином кусочков соответствующих полос геля после электрофореза с последующим картированием полученных пептидов методом МАЛДИ масс-спектрометрии [17], используя масс-спектрометр UltrafleXtreme (Bruker Daltonik GmbH, ФРГ). Полученные данные анализировали с помощью онлайн-сервиса FindPept (https://web.expasy.org/findpept/). Для поиска N-связанных гликанов использовали программу GlycoMod (https://web.expasy.org/glycomod/).
Определение активности и кинетических параметров действия ферментов
Ксилоглюканазную, β-глюканазную и КМЦазную активности определяли по методике, основанной на определении методом Шомоди-Нельсона [18] концентрации образующихся в результате ферментативной реакции восстанавливающих сахаров (ВС) из 0.5% ксилоглюкана из тамаринда (Megazyme, Австралия), β-глюкана ячменя и натриевой соли карбоксиметилцеллюлозы (КМЦ, Sigma, США) при 50°С, pH 5.0 (0.1 М Na-ацетатный буфер); время реакции составляло 10 мин (5 мин в случае КМЦ) [19].
Для оценки степени процессивности ксилоглюканаз применяли вискозиметрический метод [20], адаптированный для использования в качестве субстрата ксилоглюкана из тамаринда и основанный на способности ферментов, уравненных в вискозиметре по ксилоглюканазной активности (определенной по образованию ВС, см. выше), в разной степени уменьшать вязкость раствора субстрата в зависимости от механизма действия – процессивного или диссоциативного. Для определения изменения вязкости раствора ксилоглюкана в результате ферментативной реакции использовали вискозиметр Оствальда, помещенный в стеклянный термостатируемый при 40°С сосуд. В вискозиметр вносили 5 мл рабочего раствора субстрата с концентрацией 3.5 г/л в 0.1 М Na-ацетатном буфере рН 5.0, выдерживали при 40°С в течение 8–10 мин с тем, чтобы добиться постоянного времени истечения исходного раствора (которое составляло 130–140 с). Затем вносили в вискозиметр 0.1 мл раствора фермента с активностью 0.1 ед/мл (при этом активность в самом вискозиметре составляла 0.002 ед/мл) и быстро перемешивали смесь с помощью резиновой груши, запуская таким образом ферментативную реакцию. После этого проводили 7 измерений времени истечения раствора для 7 вариантов длительности реакции, фиксируя времена с помощью двух секундомеров [20]. Время реакции ($t_{r}^{i}$) рассчитывали по следующей формуле:
где ti – время, прошедшее от начала реакции до начала i-го измерения, Тi – время истечения раствора субстрата при i-м измерении. Результаты представляли в виде зависимости удельной вязкости раствора субстрата от времени реакции. Удельную вязкость рассчитывали по формуле:Кинетические параметры изучаемых ферментов определяли при 50°С и pH 5.0 по начальным скоростям образования ВС из ксилоглюкана, варьируя концентрацию субстрата в реакционной смеси от 0.4 до 5 мг/мл. Для каждой рабочей смеси методом Шомоди-Нельсона [18] определяли концентрацию ВС относительно контроля (раствор субстрата той же концентрации, но без фермента). На основании этих данных определяли скорости реакции (мкМ/мин) и кинетические параметры действия фермента (Km, Vmax) в соответствии с уравнением Михаэлиса-Ментен, используя нелинейную регрессию по методу Левенберга-Маркуардта в программе Microcal Origin 6.0. Из полученных величин Vmax вычисляли значения kcat по формуле kcat = Vmax/[E]. Концентрацию фермента [E] в реакционной смеси рассчитывали по поглощению при длине волны 280 нм (A280) с использованием коэффициента экстинкции белка, предсказанного программой ProtPram с сайта ExPASy (https://web.expasy.org/protparam/). Для полноразмерной TrXeg74A эта величина составила 200 900 М–1 см–1 и 187 700 М–1 см–1 для TrXeg74A-CD – каталитического домена фермента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение рекомбинантных форм TrXeg74A
Клонирование и экспрессию рекомбинантных форм ксилоглюканазы из гриба T. reesei (полноразмерной TrXeg74A и каталитического домена фермента TrXeg74A-CD без ЦСМ и линкера) в реципиентном штамме P. verruculosum B1-537 проводили под промотором гена cbh1 реципиента с использованием либо собственного сигнального пептида фермента, либо сигнального пептида ЦБГ I P. verruculosum. В результате скрининга и отбора клонов по уровню ксилоглюканазной активности в сравнении с исходным контрольным штаммом B1-537 после культивирования в колбах для последующего получения препаратов полноразмерной TrXeg74A в лабораторном ферментере был выбран клон, полученный с использованием собственного сигнального пептида целевого фермента, тогда как для наработки препарата TrXeg74A-CD был отобран клон, экспрессирующий каталитический домен ксилоглюканазы с сигнальным пептидом ЦБГ I. Результаты культивирования выбранных клонов после 6 сут ферментации приведены в табл. 1.
Таблица 1.
Содержание ферментов в культуральных жидкостях клонов, продуцирующих TrXeg74A и TrXeg74A-CD, после 6 сут выращивания в лабораторном ферментере Table 1. The content of enzymes in culture fluids of clones producing TrXeg74A and TrXeg74A-CD after 6 days of cultivation in a laboratory fermenter
| Препарат | Белок, мг/мл | Ксилоглюканаза | КМЦаза | Ксиланаза | |||
|---|---|---|---|---|---|---|---|
| ед/мл | ед/мг белка | ед/мл | ед/мг белка | ед/мл | ед/мг белка | ||
| TrXeg74A | 35.4 | 468 | 13.2 | 129 | 3.6 | 187 | 5.3 |
| TrXeg74A-CD | 31.4 | 175 | 5.6 | 206 | 6.6 | 461 | 14.7 |
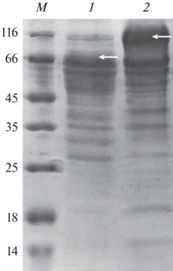
В обоих случаях была получена высокая секреция внеклеточного белка – свыше 30–35 г/л, однако уровень ксилоглюканазной активности, как общей (в расчете на мл культуральной жидкости), так и удельной (на мг белка), был значительно выше в случае препарата полноразмерной ксилоглюканазы. В нем, однако, заметно уменьшился уровень целлюлазной (КМЦазной) и ксиланазной активностей по сравнению с препаратом, содержащим TrXeg74A-CD. Это вполне объяснимо, поскольку общее содержание TrXeg74A в культуральной жидкости, согласно данным электрофореза (рис. 1), можно оценить, как примерно 30% от общего секретируемого белка, следовательно, в данном случае значительные ресурсы продуцента были направлены именно на секрецию целевого рекомбинантного фермента.
Рис. 1.
Электрофорез белков из культуральных жидкостей, содержащих рекомбинантные TrXeg74A-CD (1) и TrXeg74A (2). Полосы, соответствующие целевым ферментам, присутствие которых было подтверждено масс-спектрометрическим анализом, отмечены стрелками. М – маркеры молекулярной массы белков (кДа). Fig. 1. Electrophoresis of proteins from culture fluids containing recombinant TrXeg74A-CD (1) and TrXeg74A (2). The bands corresponding to the target enzymes, the presence of which was confirmed by mass spectrometric analysis, are marked with arrows. M – markers of the molecular weight of proteins (kDa).
Выделение и очистка TrXeg74A и TrXeg74A-CD
После осаждения сульфатом аммония белков из культуральных жидкостей, полученных в лабораторном ферментере, перерастворения осадка в минимальном количестве 0.02 М Na-ацетатного буфера (pH 5.0) и обессоливания белковые образцы, содержащие TrXeg74A и TrXeg74A-CD, фракционировали с помощью анионообменной хроматографии на колонке Mono Q. Профиль элюции для образца с полноразмерной TrXeg74A показан на рис. S1a . Основная часть ксилоглюканазной активности была сосредоточена во фракциях 10–20. Согласно данным электрофореза (рис. S2 ) во фракции 10 находилась высокоочищенная, близкая к гомогенности TrXeg74A. Во фракциях 11–20 в качестве второго мажорного компонента присутствовала целлобиогидролаза I (ЦБГ I) P. verruculosum (на рис. S2 этому ферменту соответствует полоса в районе 66 кДа).
Для отделения ЦБГ I и минорных белковых примесей от полноразмерной TrXeg74A фракции 11–15 объединили, добавили сульфат аммония до концентрации 1.7 М, и полученную смесь подвергли гидрофобной хроматографии на колонке Source 15 Isopropyl. Профиль элюции белков в обратном градиенте соли представлен на рис. S3a . Согласно определению ксилоглюканазной активности целевой фермент элюировался во фракциях 62–72 в виде второго большого и симметричного пика при концентрации сульфата аммония 0.2–0.3 М. После обессоливания объединенных фракций 65–69 на колонке с Bio-Gel P-60 был получен образец очищенной рекомбинантной TrXeg74A, данные электрофореза для которой показаны на рис. 2 (дорожка 2).
Рис. 2.
Электрофорез очищенных TrXeg74A-CD (1) из фракции 61 после гидрофобной хроматографии (рис. S3b ) и TrXeg74A (2) из объединенной фракции 65–69 после гидрофобной хроматографии (рис. S3a ). М – маркеры молекулярной массы белков (кДа). Fig. 2. Electrophoresis of purified TrXeg74A-CD (1) from fraction 61 after the hydrophobic-interaction chromatography (Fig. S3b ) and TrXeg74A (2) from combined fraction 65–69 after the hydrophobic-interaction chromatography (Fig. S3a ). M – markers of the molecular weight of proteins (kDa).

Несмотря на то, что на указанной дорожке можно выделить две интенсивные белковые полосы в высокомолекулярной области геля, отмеченные стрелками, в обоих случаях масс-спектрометрический анализ подтвердил наличие в них целевого фермента (данные представлены ниже).
При фракционировании анионообменной хроматографией белкового образца, содержащего каталитический домен рекомбинантного фермента (TrXeg74A-CD), ксилоглюканазная активность оказалась рассредоточенной по фракциям 20–44 (рис. S1b ). Для дальнейшей очистки целевого продукта по 1 мл из указанных фракций объединили, добавили сульфат аммония до концентрации соли 1.7 М, и подвергли смесь гидрофобной хроматографии на колонке Source 15 Isopropyl (рис. S3b ). Согласно результатам определения ксилоглюканазной активности, данным электрофореза и масс-спектрометрического анализа, целевой продукт (TrXeg74A-CD) содержался в последнем пике (фракции 60–62), выходящем при нулевой концентрации сульфата аммония. Результаты электрофореза для белка из фракции 61 приведены на рис. 2 (дорожка 1).
Идентификация и анализ рекомбинантных форм ксилоглюканазы методом масс-спектрометрии
Идентификацию ферментов проводили методом пептидного “фингерпринта” после обработки трипсином белковых полос с геля после электрофореза, используя времяпролетную МАЛДИ масс-спектрометрию [17]. Во всех случаях, включая анализ полос после разделения белков из культуральных жидкостей (показанных стрелками на рис. 1), фракции 10 (рис. S2 ), а также очищенных форм ксилоглюканазы TrXeg74A и TrXeg74A-CD (рис. 2), в соответствующих масс-спектрах наблюдали от 31 до 39 пиков пептидов, совпадающих по массе с теоретическими триптическими пептидами из TrXeg74A. В качестве примера на рис. S4 и S5 показаны масс спектры трипсиновых гидролизатов белков из полос геля, приведенных на рис. 2. Таблицу, показывающую соответствие пиков триптических пептидов из масс-спектров аминокислотной последовательности ксилоглюканазы TrXeg74A, можно найти в ранее опубликованной работе (для нативного фермента) [5].
Помимо немодифицированных триптических пептидов, с помощью программы GlycoMod с сайта ExPASy (https://web.expasy.org/glycomod/) в масс-спектрах также были найдены пики, соответствующие гликопептидам, при этом N-связанные гликаны различного строения были обнаружены на обоих потенциальных сайтах N-гликозилирования – Asn213 и Asn417 (табл. 2).
Таблица 2.
Гликопептиды и структуры N-связанных гликанов, обнаруженные в масс-спектрах трипсиновых гидролизатов различных форм рекомбинантной TrXeg74A Table 2. Glycopeptides and structures of N-linked glycans found in the mass spectra of tryptic hydrolysates of various forms of recombinant TrXeg74A
| Пептид (сайт N-гликозилирования) | m/z | Структура гликана | Где обнаруженa |
|---|---|---|---|
| Ile206–Lys237 (Asn213) | 3398.7 | GlcNAc | TrXeg74A-CD (КЖ) TrXeg74A-CD TrXeg74A (КЖ) |
| 4574.1 | (Man)6(GlcNAc)2 | TrXeg74A (КЖ) | |
| His416–Arg459 (Asn417) | 4695.2 | GlcNAc | Во всех формах кроме TrXeg74A (КЖ) |
| 5546.5 | (Man)4(GlcNAc)2 | TrXeg74A (КЖ) | |
| 5708.6 | (Man)5(GlcNAc)2 | TrXeg74A (КЖ) | |
| 5870.6 | (Man)6(GlcNAc)2 | TrXeg74A (КЖ) | |
| 6032.7 | (Man)7(GlcNAc)2 | TrXeg74A (КЖ) TrXeg74Ab |
|
| 6194.7 | (Man)8(GlcNAc)2 | TrXeg74A (КЖ) TrXeg74Ab |
|
| 6356.8 | (Man)9(GlcNAc)2 | TrXeg74A (КЖ) |
Примечание: a КЖ – ферменты из полос электрофоретического геля (рис. 1) после разделения белков, содержащихся в соответствующих культуральных жидкостях (КЖ); b фермент, содержащийся в верхней полосе геля, отмеченной стрелкой на рис. 2 (дорожка 2). Note: a samples with parentheses mean enzymes from the bands of the electrophoretic gel (Fig. 1) after separation of proteins contained in the corresponding culture liquids; b the enzyme contained in the upper band of the gel, marked with an arrow in Fig. 2 (lane 2).
В большинстве случаев указанные остатки аспарагина были модифицированы единичным остатком N-ацетилглюкозамина (GlcNAc). В полноразмерной TrXeg74A, содержащейся в свежей культуральной жидкости соответствующего рекомбинантного штамма P. verruculosum, также был обнаружен гликопептид Ile206–Lys237, в котором остаток Asn213 модифицирован высокоманнозным гликаном (Man)6(GlcNAc)2. Кроме того, в этом же образце анализ масс-спектра в высокомолекулярной области (пиков с низкой интенсивностью) показал присутствие серии гомологичных высокоманнозных олигосахаридов состава (Man)4–9(GlcNAc)2 и на втором возможном сайте N-гликозилирования белка (Asn417) в пептиде His416–Arg459. Это наглядно видно на рис. S6 , где серия пиков, отстоящих друг от друга ровно на 162 Да (массу ангидроманнозного остатка), соответствует этому пептиду, модифицированному указанными гликанами. Подобные серии гомологичных высокоманнозных олигосахаридов характерны как для других ферментов T. reesei, так и для ферментов, секретируемых грибом P. verruculosum [21–24]. Они образуются в результате тримминга – последовательного отщепления маннозных остатков от некого исходного высокомолекулярного высокоманнозного гликана – под действием α-маннозидаз, тогда как N-связанные единичные остатки GlcNAc образуются в результате действия N-гликозидаз, находящихся в культуральной жидкости гриба.
Как и следовало ожидать, C-концевой пептид TrXeg74A, находящийся в ЦСМ фермента (с m/z 1266), был обнаружен только в масс-спектрах полноразмерной ксилоглюканазы (рис. S4, S5 ). Первоначально нами было сделано предположение, что нижняя белковая полоса на рис. 2 (дорожка 2) соответствует форме TrXeg74A, в которой в результате ограниченного протеолиза произошло отщепление ЦСМ, однако присутствие пика с m/z 1266 в масс-спектре (рис. S4b ) свидетельствует о наличии ЦСМ. По-видимому, различие в молекулярных массах двух форм полноразмерной TrXeg74A (рис. 2) являлось следствием отличий в гликозилировании белка, поскольку только в масс-спектре трипсинового гидролизата белка из верхней полосы были обнаружены пики (с m/z 6032 и 6194), соответствующие гликопептидам, несущим высокоманнозные гликаны (табл. 2).
В качестве резюме, аминокислотная последовательность зрелой TrXeg74A, в которой выделены все пептиды и гликопептиды, обнаруженные в масс-спектрах трипсиновых гидролизатов разных форм фермента, приведена на рис. 3.
Рис. 3.
Аминокислотная последовательность зрелого белка TrXeg74A. Жирным шрифтом выделены пептиды, совпадающие по массе с теоретическими триптическими пептидами и идентифицированные с помощью онлайн сервиса FindPept (https://web.expasy.org/findpept/); подчеркнуты гликопептиды, содержащие N-связанные гликаны, которые были идентифицированы с помощью онлайн сервиса GlycoMod (https://web.expasy.org/glycomod/); сайты N-гликозилирования выделены тенью. Линкер, соединяющий каталитический домен фермента с ЦСМ, набран курсивом. Fig. 3. Amino acid sequence of mature protein TrXeg74A. The peptides identified using the online service FindPept (https://web.expasy.org/findpept/) that match the theoretical tryptic peptides are shown in bold; glycopeptides containing N-linked glycans, which were identified using the online service GlycoMod (https://web.expasy.org/glycomod/) are underlined, N-glycosylation sites are shaded. The linker connecting the catalytic domain of the enzyme to the CBM is shown in italics.

Субстратная специфичность и кинетические параметры действия ферментов
Удельные активности TrXeg74A и TrXeg74A-CD по отношению к ксилоглюкану из тамаринда, β-глюкану ячменя и КМЦ приведены в табл. 3. Как видно из представленных данных, удельные активности двух полноразмерных форм фермента по отношению к специфическому субстрату (ксилоглюкану) были достаточно близки (28–30 ед/мг), при этом активность каталитического домена (TrXeg74A-CD) была несколько выше (35 ед/мг). Для всех ферментов удельные активности по отношению к β-глюкану и КМЦ были примерно на порядок ниже, что вообще характерно для специфичных ксилоглюканаз 74-го семейства [5, 25]. Несмотря на то, что ранее выделенная нативная TrXeg74A-nat [5], представляла собой смесь нескольких форм фермента (как с ЦСМ, так и без него), она обладала несколько более высокой удельной активностью по отношению к ксилоглюкану по сравнению с рекомбинантными формами. Однако в старом исследовании [5] для определения активности был использован более чувствительный (бицинхонинатный) метод определения ВС, чем и может быть вызвано некоторое расхождение в измеряемых активностях.
Таблица 3.
Удельные активности TrXeg74A и TrXeg74A-CD (ед/мг белка) по отношению к различным полисахаридным субстратам (5 мг/мл, pH 5.0, 50°С) Table 3. Specific activities of TrXeg74A and TrXeg74A-CD (units/mg of protein) toward various polysaccharide substrates (5 mg/mL, pH 5.0, 50°С)
| Фермент | Ксилоглюкан | β-глюкан | КМЦ |
|---|---|---|---|
| TrXeg74Aa | 30 ± 2 | 2.3 ± 0.4 | 1.6 ± 0.3 |
| TrXeg74Ab | 28 ± 2 | 5.2 ± 1.1 | 4.7 ± 1.2 |
| TrXeg74A-CD | 35 ± 2 | 1.6 ± 0.3 | 2.0 ± 0.4 |
| TrXeg74A-natc | 45 ± 5 | 3.5 ± 0.3 | 2.6 ± 0.2 |
Примечание: a фракция 10 после ионообменной хроматографии (см. рис. S1a и S2 ); b обессоленные фракции 65–69 после гидрофобной хроматографии (см. рис. S3a и рис. 2); c смесь разных форм нативного фермента (литературные данные [5]). Note. a fraction 10 after ion exchange chromatography (see Figs. S1a and S2 ); b desalted fractions 65–69 after hydrophobic chromatography (see Fig. S3 and Fig. 2); c mixture of different forms of the native enzyme (literature data [5]).
Все исследуемые ферменты, включая ранее выделенную TrXeg74A-nat [5], характеризовались близкими по значению константами Михаэлиса, которые варьировали в диапазоне 0.30–0.38 г/л (табл. 4).
Таблица 4.
Кинетические параметры действия ксилоглюканаз в реакции гидролиза ксилоглюкана (pH 5.0, 50°С) Table 4. Kinetic parameters of xyloglucanases in reaction of xyloglucan hydrolysis (pH 5.0, 50°С)
| Фермент | Km, г/л | kcat, c–1 |
|---|---|---|
| TrXeg74Aa | 0.36 ± 0.03 | 26 ± 2 |
| TrXeg74Ab | 0.38 ± 0.07 | 30 ± 2 |
| TrXeg74A-CD | 0.35 ± 0.08 | 43 ± 3 |
| TrXeg74A-natc | 0.30 ± 0.06 | 55 ± 4 |
Примечание: a фракция 10 после ионообменной хроматографии (см. рис. S1a и S2 ); b обессоленные фракции 65–69 после гидрофобной хроматографии (см. рис. S3a и рис. 2); c смесь разных форм нативного фермента (литературные данные [5]). Note. a fraction 10 after ion exchange chromatography (see Figs. S1a and S2 ); b desalted fractions 65–69 after hydrophobic chromatography (see Fig. S3 and Fig. 2); c mixture of different forms of the native enzyme (literature data [5]).
В то же время рекомбинантная форма каталитического домена TrXeg74A-CD обладала примерно в полтора раза более высокой каталитической константой по сравнению с рекомбинантной полноразмерной ксилоглюканазой. По-видимому, наличие ЦСМ и гликозилированного линкера в полноразмерном ферменте способствует замедлению скорости процессинга полимерной цепи ксилоглюкана в активном центре ксилоглюканазы за счет возможного взаимодействия указанных структурных элементов белка с полимерным субстратом. Ранее подобные взаимодействия, влияющие на активность и кинетические параметры ферментов-карбогидраз, были обнаружены для N-связанных гликанов, входящих в структуру целлобиогидролаз 6-го и 7-го семейства, а также эндоглюканазы 5-го семейства гликозидгидролаз [22–24].
Исследование процессивности ферментов
Для оценки процессивности ксилоглюканаз изучали их способность уменьшать вязкость раствора полимерного субстрата в вискозиметре Оствальда. Сущность использованного метода заключается в том, что, если уравнять разные ферменты по активности, определяемой по образованию ВС в ходе ферментативной реакции (числу расщепляемых связей в полимере в единицу времени), то ферменты, действующие по эндо-диссоциативному механизму, будут неупорядоченным образом расщеплять молекулы ксилоглюкана, диссоциируя и переходя на другие участки той же самой или другой молекулы ксилоглюкана, быстро снижая при этом вязкость раствора. Напротив, ферменты, действующие по эндо-процессивному механизму, после первичной атаки на полимерный субстрат по эндо-типу будут последовательно отщеплять короткие олигосахаридные фрагменты, продолжая действовать на ту же самую молекулу полимерного субстрата, и вязкость будет при этом падать незначительно. Для сравнения в качестве фермента, действующего по эндо-диссоциативному механизму, использовали очищенную ЭГ I P. verruculosum, обладающую высокой ксилоглюканазной активностью [26]. Стоит отметить, что похожий подход был использован для исследования процессивности мутантных форм ксилоглюканазы MtXgh74 из Myceliophthora thermophila [27].
Результаты экспериментов по определению изменения вязкости раствора ксилоглюкана в ходе реакции под действием TrXeg74A, TrXeg74A-CD и ЭГ I приведены на рис. 4.
Рис. 4.
Изменение удельной вязкости раствора ксилоглюкана (3.5 г/л) под действием различных ферментов (40°C, pH 5.0). Активность ферментов в вискозиметре по ксилоглюкану – 0.002 ед/мл. TrXeg74A-1 – фракция 10 после анионообменной хроматографии (рис. S2 ); TrXeg74A-2 – обессоленная объединенная фракция 65–69 после гидрофобной хроматографии (рис. 2); TrXeg74A-CD – фракция 61 после гидрофобной хроматографии (рис. 2); EG I – ЭГ I P. verrucu-losum [26]. Fig. 4. Changes in the specific viscosity of xyloglucan solution (3.5 g/L) under the action of various enzymes (40°C, pH 5.0). The activity of enzymes in the viscometer against xyloglucan was 0.002 units/ml. TrXeg74A-1 – fraction 10 after anion exchange chromatography (Fig. S2 ); TrXeg74A-2 – desalted combined fraction 65–69 after hydrophobic-interaction chromatography (Fig. 2); TrXeg74A-CD – fraction 61 after hydrophobic-interaction chromatography (Fig. 2); EG I – EG I P. verruculosum [26].

Для ряда ферментов на рисунке представлены данные по двум и трем измерениям вязкости (повторностям), соответственно. Как видно из представленных результатов, обе формы рекомбинантной ксилоглюканазы снижали вязкость раствора ксилоглюкана в ходе ферментативной реакции практически одинаково, демонстрируя таким образом сходную процессивность, тогда как ЭГ I (EG I), действующая по эндо-диссоциативному механизму, драматически снижала вязкость субстрата уже на самых первых минутах реакции.
Таким образом, проведенные эксперименты подтвердили, что, как и ожидалось, полноразмерная рекомбинантная TrXeg74A и ее каталитический домен действуют на полимерный субстрат по эндо-процессивному механизму, как и нативный фермент, процессивность которого была продемонстрирована ранее другим методом, а именно с помощью определения изменения молекулярно-массового распределения полимерного субстрата в ходе ферментативной реакции [5].
В заключение необходимо отметить, что полученные новые рекомбинантные штаммы P. verruculosum могут быть полезными при создании композиционных ферментных препаратов для гидролиза возобновляемого лигноцеллюлозного сырья с повышенной осахаривающей способностью. В особенности это касается штамма, экспрессирующего полноразмерную TrXeg74A с уровнем секреции не менее 30% от общей концентрации белка, составляющей не менее 35 г/л.
Список литературы
Rashmi R., Siddalingamurthy K.R. Microbial xyloglucanases: a comprehensive review. Biocatal. Biotransf., 2018, 36(4), 280–295. https://doi.org/10.1080/10242422.2017.1417394
Zavyalov A.V., Rykov S.V., Lunina N.A., Sushkova V.I., Yarotsky S.V., Berezina O.V. Plant polysaccharide xyloglucan and enzymes that hydrolyze it. Russ. J. Bioorg. Chem., 2019, 45(7), 845–859. https://doi.org/10.1134/S1068162019070148
Attia M.A., Brumer H. Recent structural insights into the enzymology of the ubiquitous plant cell wall glycan xyloglucan. Curr. Opin. Struct. Biol., 2016, 40(5), 43–53. https://doi.org/10.1016/j.sbi.2016.07.005
Lopes D.C.B., Carraro C.B., Silva R.N., de Paula R.G. Molecular characterization of xyloglucanase cel74a from Trichoderma reesei. Int. J. Mol. Sci., 2021, 22, 4545. https://doi.org/10.3390/ijms22094545
Grishutin S.G., Gusakov A.V., Markov A.V., Ustinov B.B., Semenova M.V., Sinitsyn A.P. Specific xyloglucanases as a new class of polysaccharide-degrading enzymes. Biochim. Biophys. Acta – Gen. Subj., 2004, 1674(3), 268–281. https://doi.org/10.1016/j.bbagen.2004.07.001
Matsuzawa T., Yaoi K. GH74 xyloglucanases: structures and modes of activity. Trends Glycosci. Glycotechnol., 2016, 28, E63–E70. https://doi.org/10.4052/tigg.1510.1E
Arnal G., Stogios P.J., Asohan J., Skarina T., Savchenko A., Brumer H. Structural enzymology reveals the molecular basis of substrate regioselectivity and processivity of an exemplar bacterial glycoside hydrolase family 74 endo-xyloglucanase. Biochem. J., 2018, 475(24), 3963–3978. https://doi.org/10.1042/BCJ20180763
Arnal G., Stogios P.J., Asohan J., Attia M.A., Skarina T., Viborg A.H., Henrissat B., Savchenko A., Brumer H. Substrate specificity, regiospecificity, and processivity in glycoside hydrolase family 74. J. Biol. Chem., 2019, 294(36), 13233–13247. https://doi.org/10.1074/jbc.RA119.009861
Gusakov A.V. Additional sequence and structural characterization of an endo-processive GH74 xyloglucanase from Myceliophthora thermophila and the revision of the EC 3.2.1.155 entry. Biochim. Biophys. Acta – Gen. Subj., 2020, 1864(3), 129511. https://doi.org/10.1016/j.bbagen.2020.129511
Teeri T.T. Crystalline cellulose degradation: new insight into the function of cellobiohydrolases. Trends Biotechnol., 1997, 15(5), 160–167. https://doi.org/10.1016/S0167-7799(97)01032-9
Sinitsyn A.P., Sinitsyna O.A., Zorov I.N., Rozhkova A.M. Exploring the capabilities of the Penicillium verruculosum expression system for the development of producers of enzymes for the effective degradation of renewable plant biomass: a review. Appl. Biochem. Microbiol., 2020, 56(6), 638–646. https://doi.org/10.1134/S0003683820060162
Volkov P.V., Gusakov A.V., Rubtsova E.A., Rozhkova A.M., Matys V.Y, Nemashkalov V.A., Sinitsyn A.P. Properties of a recombinant GH49 family dextranase heterologously expressed in two recipient strains of Penicillium species. Biochimie, 2019, 157, 123–130. https://doi.org/10.1016/j.biochi.2018.11.010
Aslanidis C., de Jong P.J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Res., 1990, 18(20), 6069–6074. https://doi.org/10.1093/nar/18.20.6069
Aleksenko A.Y., Makarova N.A., Nikolaev I.V., Clutterbuck A.J. Integrative and replicative transformation of Penicillium canescens with a heterologous nitrate-reductase gene. Curr. Genet., 1995, 28(5), 474–477. https://doi.org/10.1007/BF00310818
Sinitsyn A.P., Osipov D.O., Rozhkova A.M., Bushina E.V., Dotsenko G.S., Sinitsyna O.A., Kondrat’eva E.G., Zorov I.N., Okunev O.N., Nemashkalov V.A., Matys V.Y., Koshelev A.V. The production of highly effective enzyme complexes of cellulases and hemicellulases based on the Penicillium verruculosum strain for the hydrolysis of plant raw materials. Appl. Biochem. Microbiol., 2014, 50(8), 761–772. https://doi.org/10.1134/S0003683814080055
Peterson G.L. Review of the Folin phenol protein quantitation method of Lowry, Rosebrough, Farr and Randall. Anal. Biochem., 1979, 100(2), 201–220. https://doi.org/10.1016/0003-2697(79)90222-7
Gusakov A.V., Semenova M.V., Sinitsyn A.P. Mass spectrometry in the study of extracellular enzymes produced by filamentous fungi. J. Anal. Chem., 2010, 65(14), 1446–1461. https://doi.org/10.1134/S1061934810140030
Nelson N. A photometric adaptation of the Somogyi method for the determination of sugars. J. Biol. Chem., 1944, 153, 375–379.
Синицына О.А., Бухтояров Ф.Е., Гусаков А.В., Окунев О.Н., Беккаревич А.О., Винецкий Ю.П., Синицын А.П. Выделение и свойства основных компонентов внеклеточного ферментного комплекса Penicillium canescens. Биохимия, 2003, 68(11), 1494–1505.
Гусаков А.В., Марков А.В., Гришутин С.Г., Семенова М.В., Кондратьева Е.Г., Синицын А.П. Вискозиметрический метод определения общей эндодеполимеразной активности пектиназ. Биохимия, 2002, 67(6), 815–822.
Stals I., Sandra K., Devreese B., van Beeumen J., Claeyssens M. Factors influencing glycosylation of Trichoderma reesei cellulases. II. N-glycosylation of Cel7A core protein isolated from different strains. Glycobiology, 2004, 14(8), 725–737. https://doi.org/10.1093/glycob/cwh081
Dotsenko A.S., Gusakov A.V., Volkov P.V., Rozhkova A.M., Sinitsyn A.P. N-Linked glycosylation of recombinant cellobiohydrolase I (Cel7A) from Penicillium verruculosum and its effect on the enzyme activity. Biotechnol. Bioeng., 2016, 113(2), 283–291. https://doi.org/10.1002/bit.25812
Dotsenko A.S., Gusakov A.V., Rozhkova A.M., Sinitsyna O.A., Nemashkalov V.A., Sinitsyn A.P. Effect of N-linked glycosylation on the activity and other properties of recombinant endoglucanase IIa (Cel5A) from Penicillium verruculosum. Protein Eng. Des. Sel., 2016, 29(11), 495–501. https://doi.org/10.1093/protein/gzw030
Gusakov A.V., Dotsenko A.S., Rozhkova A.M., Sinitsyn A.P. N-Linked glycans are an important component of the processive machinery of cellobiohydrolases. Biochimie, 2016, 132(1), 102–108. https://doi.org/10.1016/j.biochi.2016.11.004
Sinitsyna O.A., Fedorova E.A., Pravilnikov A.G., Rozhkova A.M., Skomarovsky A.A., Matys V.Yu., Bubnova T.M., Okunev O.N., Vinetsky Yu.P., Sinitsyn A.P. Isolation and properties of xyloglucanases of Penicillium sp. Biochemistry (Moscow), 2010, 75(1), 41–49. https://doi.org/10.1134/S0006297910010062
Morozova V.V., Gusakov A.V., Andrianov R.M., Pravilnikov A.G., Osipov D.O., Sinitsyn A.P. Cellulases of Penicillium verruculosum. Biotechnol. J., 5(8), 871–880. https://doi.org/10.1002/biot.201000050
Berezina O.V., Rykov S.V., Polyakova A.K., Bozdaganyan M.E., Sidochenko A.V., Baudrexl M., Schwarz W.H., Zverlov V.Z., Yarotsky S.V. Strategic aromatic residues in the catalytic cleft of the xyloglucanase MtXgh74 modifying thermostability, mode of enzyme action, and viscosity reduction ability. Appl. Microbiol. Biotechnol., 2021, 105(4), 1461–1476. https://doi.org/10.1007/s00253-021-11106-3
Дополнительные материалы
- скачать ESM.docx
- Приложение 1. Рис. S1. - Рис. S6.
Инструменты
Биотехнология



