Биотехнология, 2022, T. 38, № 2, стр. 14-25
Сравнительный анализ свойств рекомбинантных эндоинулиназы, экзоинулиназы, сахаразы и α-галактозидазы С
О. А. Синицына 1, *, Е. А. Рубцова 2, Д. О. Осипов 2, Е. Г. Кондратьева 2, М. В. Семенова 2, А. И. Королев 1, Е. В. Ярошенко 3, А. М. Рожкова 2, В. А. Немашкалов 4, А. П. Синицын 1, 2
1 Химический факультет, Московский государственный университет
имени М.В. Ломоносова
119991 Москва, Россия
2 Федеральный исследовательский центр “Фундаментальные
основы биотехнологии” Российской академии наук
119071 Москва, Россия
3 ООО “ИстАгро Дон”, ИЦ Сколково
143005 Москва, Россия
4 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина
Российской академии наук
142290 Пущино, Московская область, Россия
* E-mail: oasinitsyna@gmail.com
Поступила в редакцию 08.12.2021
После доработки 14.04.2022
Принята к публикации 18.04.2022
- EDN: SWAPEQ
- DOI: 10.56304/S0234275822020077
Аннотация
В результате клонирования генов inuA, inu1, aglC и fopA, кодирующих эндоинулиназу (эндоИНУ), экзоинулиназу (экзоИНУ), α-галактозидазу С (АГЛС) и сахаразу (САХ), в реципиентный штамм Penicillium verruculosum B1-537 (ΔniaD) получены рекомбинантные штаммы-продуценты, способные с высоким выходом продуцировать целевые рекомбинантные ферменты (32‒50% от общего содержания внеклеточного белка). Получены и охарактеризованы ферментные препараты эндоИНУ, экзоИНУ, АГЛС и САХ. С помощью хроматографических методов выделены гомогенные (по данным электрофореза в полиакриламидном геле) эндоИНУ, экзоИНУ, САХ и АГЛС с молекулярной массой 62, 56, 67 и 76 кДа соответственно. Гомогенная эндоИНУ имела высокую удельную активность по инулину топинамбура (56 ед/мг); экзоИНУ обладала активностью по инулину (17 ед/мг), сахарозе (850 ед/мг), раффинозе (41 ед/мг) и стахиозе (15 ед/мг); САХ ‒ по сахарозе (10.5 ед/мг), раффинозе и стахиозе (3.8 и 1.4 ед/мг соответственно); АГЛС характеризовалась наличием активности по раффинозе и стахиозе (31 и 30 ед/мг соответственно), не проявляла сахаразной активности, но была высокоактивна по отношению к синтетическому субстрату п-нитрофенил-α-D-галактозиду (311 ед/мг). Определены кинетические параметры гидролитической активности гомогенных ферментов на соответствующих субстратах (kcat и Кm). Температурный оптимум эндоИНУ составил 50‒55°С, экзоИНУ – 55‒65°С, АГЛС – 65°С, САХ – 35°С. ЭндоИНУ проявляла максимум активности при рН 6.5; экзоИНУ – при рН 4.5, АГЛС – при рН 4.5‒5.0, а САХ – при рН 5.5‒6,0. Изучена термостабильность ферментов при различной температуре. ЭндоИНУ эффективно гидролизовала инулин с образованием фруктоолигосахаридов со степенью полимеризации 3‒8. ЭкзоИНУ количественно конвертировала инулин в глюкозо-фруктозный сироп (ГФС) с соотношением Глу : Фру = 1 : 3, а также сахарозу в ГФС с соотношением Глу : Фру примерно 1 : 0.63 (САХ гидролизовала сахарозу с таким же соотношением продуктов). Галактоолигосахариды сои (раффиноза и стахиоза) превращались в сахарозу и моносахариды (глюкозу, галактозу и фруктозу) под действием АГЛС, а совместное действие САХ и АГЛС приводило к полной конверсии до моносахаридов как раффинозы и стахиозы, так и сахарозы. Обработка галактоолигосахаридов ЭкзоИНУ приводила к такому же результату. Полученный фермент ЭкзоИНУ можно рассматривать в качестве перспективного для биотехнологического применения вследствие его широкой субстратной специфичности – он может быть использован как для получения ГФС из инулина и сахарозы, так и для деструкции галактоолигосахаридов сои.
Ферменты находят широкое применение в пищевой промышленности для переработки продуктов сельского хозяйства [1, 2]. Среди них можно выделить группу карбогидраз, имеющих близкую групповую субстратную специфичность и гидролизующих α- и β-гликозидные связи в различных олиго- и полисахаридах. В эту группу входят эндоинулиназа (эндоИНУ), экзоинулиназа (экзоИНУ), сахараза (САХ) и α-галактозидаза С (АГЛС).
Эндоинулиназа (2,1-β-D-фруктанфруктаногидролаза, КФ 3.2.1.7, семейство гликозилгидролаз 32, GH32) гидролизует по неупорядоченному механизму внутренние связи полифруктана (инулина) топинамбура, цикория, агавы и других инулинсодержащих растений с образованием в качестве основных продуктов фруктоолигосахаридов (ФОС), которые используются для получения продуктов функционального и лечебного назначения [3].
Экзоинулиназа (2,1-β-D-фруктанфруктогидролаза, КФ 3.2.1.80, GH32) гидролизует по процессивному механизму концевые β-2,1-фруктозидные связи инулина, а также сахарозу и применяется для производства из топинамбура, цикория, агавы и других инулинсодержащих растений фруктозы и глюкозо-фруктозных сиропов (ГФС) с повышенным содержанием фруктозы. Получаемые с помощью экзоИНУ сахара могут служить сырьем для производства широкого круга продуктов микробиологического синтеза: этанола, бутанола, молочной, лимонной и фумаровой кислот и др. [3, 4].
Сахараза (инвертаза, β-фруктофуранозидаза, КФ 3.2.1.26, GH32) гидролизует 1,2-β-D-гликозидные связи сахарозы с образованием глюкозы и фруктозы, а также катализирует гидролиз 1,2-β-гликозидных связей галактоолигосахаридов. САХ применяют для гидролиза (инверсии) сахарозы и получения ГФС [5].
α-Галактозидаза С (КФ 3.2.1.22, GH36С) гидролизует концевые невосстанавливающие α-D-галактозидные связи природных галактоолигосахаридов, наиболее распространены из которых раффиноза α-D-Гал-p-(1 → 6)-α-D- Глю-p-(1 → 2)-β-D-Фру-f и стахиоза α-D-Гал-p-(1 → 6)-α-D-Гал-p-(1 → 6)-α-D-Глю-p-(1 → 2)-β-D-Фру-f, а также синтетические субстраты. Галактоолигосахариды присутствуют в сое и других бобовых, используемых в качестве компонентов кормов животных и птицы, практически не усваиваются организмом животных и птицы, вызывают метеоризм, снижение усвояемости питательных веществ и гипертрофию кишечника. В связи с этим для увеличения питательной ценности кормов необходимо их удаления или деструкция – это и есть практическое применение АГЛС [6, 7].
На основе реципиентного штамма Penicillium verruculosum B1-537 (ΔniaD) нами созданы высокоактивные штаммы-продуценты экзоИНУ, эндоИНУ, САХ и АГЛС. Представлялось целесообразным провести сравнительный анализ активности, состава и свойств ферментных препаратов (ФП), полученных с помощью этих штаммов-продуцентов, а также свойств выделенных в гомогенном состоянии соответствующих ферментов и определить возможности их использования в различных областях биотехнологии.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Реактивы
В качестве субстратов в работе использовали инулин топинамбура (“Реахим”, Россия), сахарозу, раффинозу, стахиозу, п-нитрофенил-α-D-Гал (пНФГ) (Sigma-Aldrich, США).
Для приготовления буферных растворов и ферментационных сред использовали реактивы марок хч, чда и осч производства “Хеликон” и “Реахим” (Россия), а также Pharmacia (Швеция) и Sigma-Aldrich.
Генетические конструкции
Все генетические конструкции были разработаны по единой схеме и состояли из последовательно соединенных нуклеотидных последовательностей, соответствующих промоторному региону гена cbh1 целлобиогидролазы-1 P. verruculosum, полноразмерному целевому гену и терминаторной области этого гена. Регуляторные области гена cbh1 были амплифицированы ранее [8] и на их основе разработаны базовые векторы серии pCBHI для клонирования и экспрессии гетерологичных генов [8–12]. Нуклеотидные последовательности, соответствующие полноразмерным целевым генам эндо ИНУ А (inuА), экзоИНУ (inu1), САХ (fopA) и АГЛС (aglC), амплифицировали методом ПЦР; в качестве матрицы использовали геномные ДНК штаммов Aspergillus sp. Геномные ДНК этих штаммов выделяли с помощью набора фирмы QIAGEN (США) по стандартным протоколам. Амплифицированные целевые гены встраивали в вектор pCBHI с использованием методики независимого лигирования [13]. Таким образом были получены четыре конструкции для трансформации реципиентного штамма, отсутствие мутаций в этих конструкциях подтвердили секвенированием по методу Сэнгера в обоих направлениях нуклеотидной последовательности [14].
Трансформация реципиентного штамма
Трансформацию штамма P. verruculosum 537 (ΔniaD) и получение протопластов проводили по методике, описанной ранее [8]. В качестве котрансформирующей использовали плазмиду pSTA10, несущую ген нитратредуктазы, который обеспечивал комплементацию дефектного гена niaD в реципиентном штамме, что позволяло вести отбор трансформантов на среде с нитратом натрия.
Полученные трансформанты проанализированы на наличие и уровень биосинтеза целевых ферментов, а также концентрацию внеклеточного белка в культуральной жидкости (КЖ) после ферментации в колбах Эрленмейера (по методике [15]). Отобранные наиболее продуктивные по целевой активности трансформанты использованы для наработки сухих ФП после ферментации в 1-литровых ферментерах фирмы “Проинтех” (Россия) по методике [15]. Сухие ФП получали на лиофильной сушилке Virtis Benchtop 9L Pro (SP Scientific, США).
Контролем служил сухой ФП, полученный с помощью реципиентного штамма P. verruculosum 537 (ΔniaD).
Определение активности ферментов
Активность ФП и гомогенных ферментов по отношению к инулину, раффинозе, стахиозе и сахарозе определяли по начальной скорости гидролиза этих субстратов при их концентрации в реакционной смеси 5 г/л, при 50°С и рН 5.0 (время реакции 10 мин). Активность выражали в международных единицах: 1 единица соответствует образованию 1 мкмоль продукта (восстанавливающих сахаров, ВС) за 1 мин при действии ферментов на соответствующий субстрат; ВС определяли методом Шомоди‒Нельсона (см. в работе [16]).
Активность по отношению к пНФГ (0.9 мМ в реакционной смеси) определяли по скорости образования п-нитрофенола в качестве продукта при 50°С и рН 5.0 (время реакции 10 мин). Реакцию останавливали раствором 1 М Na2CO3. За единицу активности принимали количество фермента, необходимое для образования 1 мкмоль п-нитрофенола за 1 мин [16].
Содержание белка
Содержание белка в ФП определяли по методу Лоури, используя в качестве стандарта БСА [17].
Электрофорез в полиакриламидном геле (ЭФ-ПААГ)
Электрофорез в денатурирующих условиях проводили на приборе Miniprotean Tetra cell с источником питания Model 300Xi (Bio-Rad Laboratories, США) по протоколу производителя. Для окрашивания белков в геле использовали краситель Coomassie-Brilliant Blue R-250 (Ferrak, Германия). В качестве маркеров молекулярной массы белков (20‒120 кДа) использовали коммерчески доступную смесь (#26612, Thermo Fisher Scientific, США).
Идентификация ферментов
Идентификацию ферментов проводили методом пептидного картирования после расщепления белка, содержащегося в соответствующей полосе геля после ЭФ-ПААГ, с помощью трипсина (Promega, США). MALDI-масс-спектрометрию трипсинового гидролизата проводили на времяпролетном масс-спектрометре UltrafleXtreme (Bruker Daltonik GmbH, Германия) в Центре коллективного пользования “Промышленные биотехнологии” Федеральный исследовательский центр “Фундаментальные основы биотехнологии” РАН (Россия). Полученные масс-спектры триптических пептидов анализировали с помощью программы MASCOT (http://www.matrixscience.com), а также сопоставляли с продуктами протеолиза белков in silico, полученными с использованием программы PeptideMass (http://expasy.org/tools/peptide-mass.html), исходя из известных аминокислотных последовательностей целевых ферментов.
Состав ФП
Для определения состава ФП проводили денситометрический анализ электрофореграмм ФП с помощью программы GelAnalyzer 2010a.
рН-профиль активности
Определение pH-профиля активности гомогенных ферментов и ФП проводили, измеряя их активность в диапазоне значений pH от 2.5 до 7.5, с шагом 0.5 единиц рН (при 50°С) по соответствующим субстратам: инулину для экзоИНУ и эндоИНУ, сахарозе для САХ и пНФГ для АГЛС. Для приготовления буферных растворов с заданными значениями pH использовали 0.1 М цитрат-фосфатный буфер. Результаты измерений отображали в процентах от максимального значения активности в рН-оптимуме.
Температурный профиль активности
Определение температурного профиля активности гомогенных ферментов и ФП проводили, измеряя их активность по соответствующим субстратам (см. пункт “рН-профиль активности”) при различных температурах (в диапазоне 4‒80°C, с шагом 5‒10°C) при рН 5.0. Результаты измерений отображали в процентах от максимального значения активности в температурном оптимуме.
Стабильность ферментов
Для определения стабильности гомогенных ферментов и ФП их растворы инкубировали при различных значениях температуры (при рН 5.0), отбирая через заданные промежутки времени (15‒30 мин) аликвоты реакционной смеси. Активность ферментов оценивали на соответствующих субстратах, как указано выше.
Результаты отображали в виде зависимости остаточной активности (в процентах от исходной) от времени инкубации при определенном значении температуры.
Кинетические параметры
Кинетические константы ферментов определяли, используя следующие концентрации субстратов в реакционной смеси: 1‒10 г/л для инулина, 0.018‒0.090 М для сахарозы, 0.45‒8.10 М для пНФГ ‒ и гомогенных ферментов: 0.034 мг/мл эндоИНУ, 0.28 мг/мл экзоИНУ, 0.36 мг/мл САХ и 0.12 мг/мл АГЛС. Эксперименты проводили при 50°С и рН 5.0. Значения констант уравнения Михаэлиса‒Ментен получали в результате обработки экспериментальных данных в координатах Лайнуивера‒Берка.
Ферментативный гидролиз инулина, сахарозы и галактоолигосахаридов сои
Гидролиз инулина (100 г/л в реакционной смеси) проводили при 50°С и рН 5.0 (0.1 М ацетатный буфер) при постоянном перемешивании на магнитной мешалке (250 об/мин). В предварительных экспериментах была подобрана оптимальная доза ферментов, которая составила: 5 единиц активности (ед) на 1 г субстрата для эндоИНУ и 0.5 ед/г субстрата для экзоИНУ.
Гидролиз сахарозы (200 г/л в реакционной смеси) проводили при 50°С и рН 5.0. рН контролировали с помощью лимонной кислоты при постоянном перемешивании на магнитной мешалке (250 об/мин). В предварительных экспериментах было показано, что для САХ оптимальной является доза 25 ед/г субстрата.
В качестве источника галактоолигосахаридов использовали экструдированный соевый шрот (ЭСШ; ООО “Фуд Индастриз”, Россия), полученный с помощью двухшнекового экструдера (Werner & Pfleiderer Continua, Германия) при 120°С. В предварительных экспериментах были выбраны следующие условия ферментативной обработки ЭСШ: 40°С, рН 5.0, гидромодуль 1 : 1, периодическое перемешивание; при этом для экзоИНУ и АГЛС доза 5 мг белка на 1 г ЭСШ (по сухой массе) была оптимальной.
Анализ углеводов
Для анализа продуктов гидролиза инулина, сахарозы и галактоолигосахаридов использовали ВЭЖХ (Agilent Technologies, США) с электрохимическим детектором ESA Coulochem III (Conquer Scientific, США) и системой компьютерной регистрации. В качестве неподвижной фазы использовался анионообменную колонку Carbopak PA100 (Thermo Fischer Scientific) со 100 мМ NaOH в качестве подвижной фазы. Элюирование проводили в градиенте концентраций ацетата натрия ‒ от 0 до 500 мМ ‒ в течение 20 мин. Калибровочные графики строили по глюкозе, галактозе, фруктозе, сахарозе, раффинозе, стахиозе (Sigma-Aldrich и Merck, Германия). Растворы, использовавшиеся в качестве элюентов для хроматографии, фильтровали через мембранный фильтр с диаметром пор 0.45 мкм (Millipore, США) и тщательно дегазировали. Перед проведением хроматографического анализа пробы предварительно центрифугировали при 14 000 g в течение 4 мин.
Выделение ферментов в гомогенном виде
Для выделения целевых белков использовали жидкостную хроматографию на приборе NGC Chromatography Systems (Bio-Rad Laboratories) с УФ-детектором. Белок (100 мг в 10 мл) осаждали из раствора 80%-ным (от насыщения) раствором (NH4)2SO4, обессоливали на колонке с BioGel Р4 (Bio-Rad Laboratories) и наносили на анионообменную колонку Source 15Q объемом 10 мл (Pharmacia), уравновешенную буфером 0.02 М Трис-HCl (рН 6.8). Связавшиеся с носителем белки элюировали в линейном градиенте концентраций NaCl (от 0 до 0.4 М) со скоростью 5 мл/мин. Во фракциях анализировали наличие целевой ферментативной активности и проводили ЭФ-ПААГ.
Далее фракции, содержащие целевые ферменты, подвергали гидрофобной хроматографии на колонке Source 15 Isopropyl объем 10 мл (Pharmacia). Образец предварительно “засаливали” (NH4)2SO4 до концентрации 1.7 М и наносили на колонку, уравновешенную 0.05 М Na-ацетатным буфером (рН 5.0), содержащим 1.7 М (NH4)2SO4. Связавшиеся с носителем белки элюировали в обратном линейном градиенте (NH4)2SO4 ‒ от 1.7 до 0 М ‒ при скорости 1.5 мл/мин. Во фракциях анализировали наличие целевой ферментативной активности и проводили ЭФ-ПААГ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение штаммов-продуцентов
Для получения рекомбинантных штаммов-продуцентов целевых ферментов в качестве реципиентного использовали штамм P. verruculosum B1-537 (ΔniaD). Для обеспечения экспрессии целевых генов генетические конструкции содержали целевые кодирующие последовательности, связанные с сильным индуцибельным промотором и терминатором гена cbh1 – целлобиогидролазы-1, одного из основных ферментов, продуцируемых P. verruculosum [9].
В результате трансформации реципиентного штамма плазмидой, содержащей гетерологичный ген эндоИНУ А (inuА) Aspergillus niger (62 кДа, pI 2.8), был создан высокоактивный штамм-продуцент эндоИНУ ‒ P. verruculosum-эндоИНУ. При культивировании этого штамма в лабораторных 1-литровых ферментерах в КЖ содержалось более 400 ед/мл эндоинулиназной активности, определенной при использовании инулина топинамбура в качестве субстрата.
Трансформация реципиентного штамма плазмидой, содержащей гетерологичный ген экзоИНУ-1 (inu1) A. awamori (экзоИНУ, 56 кДа, pI 4.3), привела к созданию высокоактивного штамма-продуцента экзоИНУ P. verruculosum-экзоИНУ. При культивировании этого штамма в лабораторных 1-литровых ферментерах в КЖ содержалось более 2500 ед/мл экзоинулиназной активности (по инулину топинамбура).
С использованием плазмиды, содержащей гетерологичный ген aglC АГЛС A. niger (76 кДа, pI 4.8), был создан высокоактивный штамм-продуцент АГЛС P. verruculosum-АГЛС, с помощью которого при культивировании в лабораторных 1-литровых ферментерах в КЖ получали около 28 000 ед/мл α-галактозидазной активности, определенной с использованием пНФГ в качестве субстрата.
Наконец, с использованием плазмиды, содержащей гетерологичный ген fopA САХ A. oryzae (67 кДа, pI 6.2), был создан высокоактивный штамм-продуцент САХ P. verruculosum-САХ, при культивировании которого в лабораторных ферментерах получали около 400 ед/мл сахаразной активности в КЖ.
Активность ферментных препаратов
Лабораторные ФП представляли собой лиофильно высушенные КЖ, полученные с помощью соответствующих штаммов-продуцентов в 1-литровых ферментерах. Активности сухих ФП эндоИНУ, экзоИНУ, САХ, АГЛС, а также ФП, произведенного с помощью реципиентного штамма P. verruculosum 537 (ΔniaD) (контроль), представлены в табл. 1.
Таблица 1.
Активность ферментных препаратов Table 1. The activity of enzyme preparations
| Номер | Препарат | Белок, мг/г | Ферментативная активность, ед/мг | ||||
|---|---|---|---|---|---|---|---|
| субстраты | |||||||
| инулин | сахароза | раффиноза | стахиоза | пНФГ | |||
| 3.420Н | Контроль, В1-537 | 873 ± 15 | 39 ± 3 | 8 ± 0,5 | 17 ± 1 | 25 ± 2 | 26 ± 2 |
| 3.615.1 | ЭндоИНУ | 269 ± 10 | 12 900 ± 100 | 78 ± 4 | 235 ± 10 | 72 ± 2 | 7 ± 1 |
| 3.413.1 | ЭкзоИНУ | 467 ± 12 | 29 300 ± 200 | 59 000 ± 300 | 36 400 ± 200 | 9290 ± 50 | 137 ± 7 |
| 3.368.Н | САХ | 405 ± 12 | 41 ± 3 | 4240 ± 50 | 1540 ± 20 | 550 ± 15 | 53 ± 4 |
| 3.518.3 | АГЛС | 399 ± 12 | 74 ± 4 | 25 ± 2 | 12 400 ± 100 | 12 100 ± 100 | 124 300 ± 500 |
ФП эндоИНУ проявлял высокую гидролитическую активность при использовании в качестве субстрата инулина топинамбура и низкую по отношению к сахарозе, галактоолигосахаридам и пНФГ.
По сравнению с другими ФП экзоИНУ характеризовался наиболее высокой активностью по отношению к инулину топинамбура, сахарозе, раффинозе и стахиозе и низкой относительно пНФГ.
ФП САХ с низкой эффективностью гидролизовал инулин топинамбура, с высокой ‒ сахарозу и снижающуюся в ряду раффиноза, стахиоза, пНФГ.
ФП АГЛС проявлял высокую и практически одинаковую активность по отношению к раффинозе и стахиозе, крайне высокую к пФНГ и очень низкую к инулину топинамбура и сахарозе.
Отметим, что контрольный ФП, полученный с помощью реципиентного штамма, проявлял низкую активность по отношению к использованным для проверки активности рекомбинантных ФП субстратам.
В табл. 2 приведены удельные активности полученных ФП (ед/мг белка). Самая высокая удельная активность по отношению к инулину топинамбура зарегистрирована для ФП экзоИНУ, для ФП эндоИНУ она на 23% ниже. Самая высокая сахаразная удельная активность зарегистрирована для ФП экзоИНУ среди исследуемых нами ФП, причем она заметно превышала таковую для ФП САХ. Кроме того, ФП экзоИНУ проявлял существенно более высокую удельную активность по отношению к раффинозе и стахиозе, чем ФП АГЛС. Удельная активность последнего была максимальна в отношении синтетического субстрата, пНФГ, среди исследованных ФП.
Таблица 2.
Удельная активность ферментных препаратов Table 2. Specific activity of enzyme preparations
| Номер | Препарат | Удельная гидролитическая активность, ед/мг белка | ||||
|---|---|---|---|---|---|---|
| субстраты | ||||||
| инулин | сахароза | раффиноза | стахиоза | пНФГ | ||
| 3.420Н | Контроль, В1-537 | 0.04 ± 0.003 | 0.01 ± 0.001 | 0.020 ± 0.001 | 0.030 ± 0.002 | 0.030 ± 0.002 |
| 3.615.1 | ЭндоИНУ | 48 ± 3 | 0.29 ± 0.03 | 0.87 ± 0.05 | 0.27 ± 0.03 | 0.030 ± 0.002 |
| 3.413.1 | ЭкзоИНУ | 63 ± 4 | 126 ± 7 | 78 ± 5 | 20 ± 2 | 0.29 ± 0.03 |
| 3.368.Н | САХ | 0.100 ± 0.005 | 11.0 ± 0.5 | 3.8 ± 0.3 | 1.4 ± 0.1 | 0.13 ± 0.01 |
| 3.518.3 | АГЛС | 0.19 ± 0.01 | 0.060 ± 0.004 | 31 ± 3 | 30 ± 3 | 312 ± 10 |
Состав ферментных препаратов
На рис. 1 приведены результаты анализа белкового состава ФП эндоИНУ, экзоИНУ, САХ, АГЛС с помощью ЭФ-ПААГ, а также контрольного ФП, полученного на основе реципиентного штамма. Электрофореграммы рекомбинантных ФП характеризуются наличием мажорных полос, соответствующих молекулярным массам целевых рекомбинантных ферментов (и существенно отличаются от электрофореграммы ФП реципиентного штамма).
Рис. 1.
Электрофоретический анализ ферментных препаратов. Электрофореграмма ФП: 1 – экзоИНУ, 2 – эндоИНУ, 3 – АГЛС, 4 – САХ, 5 – контроль (ФП, полученный в реципиентном штамме P. verruculosum B1-537 (ΔniaD)). М – маркеры молекулярной массы белков. На треках 1–4 стрелками отмечены целевые рекомбинантные ферменты. На треке 5: а – β-глюкозидаза; б – целлобиогидролаза-1 (ЦБГ1, тяжелая форма); в – ЦБГ1 (легкая форма); г – ЦБГ2 (тяжелая форма); д – ЦБГ2 (легкая форма); е – эндоглюканаза-2 (ЭГ2). Fig. 1. Electrophoretic analysis of enzyme preparations (EP). 1 – exoinulinase (exoINU), 2 – endoinulinase (endoINU), 3 – α-galactosidase C (AGLC), 4 – sucrose (SUC), 5 – control (EP produced by the recipient strain P. verruculosum B1-537 (ΔniaD)). M ‒ protein molecular mass markers. Target recombinant enzymes are marked by arrows on tracks 1‒4; on track 5: a – β-glucosidase; b – cellobiohydrolase-1 (CBH1, a heavy form); c – CBH1 (a light form); d – CBH2 (a heavy form); e ‒ CBH2 (a light form); f – endoglucanase-2 (EG2).
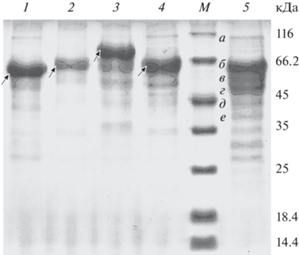
Белковые полосы, соответствующие целевым ферментам, вырезали, обрабатывали трипсином, полученные гидролизаты исследовали с помощью MALDI-TOF-масс-спектрометрии. Установлено, что полосы на электрофореграмме (рис. 1), соответствующие 62, 56, 67 и 76 кДа, принадлежат соответственно эндоИНУ, экзоИНУ, САХ и АГЛС (данные не приведены).
Компонентный состав сухих рекомбинантных и контрольного ФП, определенный методом денситометрического анализа электрофореграмм, полученных с помощью ЭФ-ПААГ, приведен в табл. 3. Отметим, что контрольный ФП, полученный на основе реципиентного штамма, содержал значительное количество целлобиогидролаз (ЦБГ1 и ЦБГ2) – 60% от общего белка, в его состав входили также эндоглюканазы (ЭГ, 12%) и другие ферменты (28%). Состав рекомбинантных ФП существенно изменился по сравнению с контролем из-за наличия в них целевых рекомбинантных ферментов. Так, содержание эндоИНУ в соответствующем ФП составило около 40% (от общего белка), экзоИНУ в ФП – 50%, САХ в ФП – около 30%, АГЛС в ФП – 40%. Содержание собственных ферментов реципиентного штамма в рекомбинантных ФП было снижено (ЦБГ суммарно – до 40‒45%, ЭГ суммарно – до 6‒8%, других ферментов – до 3‒20%). Изменение состава рекомбинантных ФП с точки зрения наличия в них значительного количества целевых ферментов хорошо коррелирует с уровнем их активности по специфическим субстратам.
Таблица 3.
Содержание ферментов в различных ФП Table 3. Enzyme content in various enzyme preparations
| Штамм-продуцент ФП | Содержание фермента, % от общего белка | ||||||
|---|---|---|---|---|---|---|---|
| эндоИНУ | экзоИНУ | САХ | АГЛС | ЦБГ | ЭГ | другие | |
| P. verruculosum В1-537 | – | – | – | – | 60 | 12 | 28 |
| P. verruculosum-эндоИНУ | 38 | – | – | – | 45 | 6 | 13 |
| P. verruculosum-экзоИНУ | 50 | – | 40 | 7 | 3 | ||
| P. verruculosum-САХ | – | – | 32 | – | 40 | 8 | 20 |
| P. verruculosum-АГЛС | – | – | – | 40 | 40 | 7 | 13 |
Выделение и свойства гомогенных ферментов
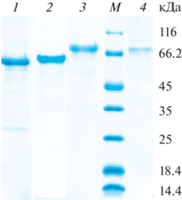
Гомогенные целевые ферменты выделяли из соответствующих ФП. На первой стадии проводили фракционирование предварительно обессоленных ФП на анионообменнике Source 15Q. Фракции, обладающие целевыми активностями, использовали для выделения гомогенных ферментов с помощью гидрофобной хроматографии на колонке Source 15 Isopropyl. В результате целевые ферменты были получены в гомогенном виде (рис. 2).
Рис. 2.
Электрофоретический анализ гомогенности целевых белков. Электрофореграммы очищенных ферментов: 1 – экзоИНУ, 2 – эндоИНУ, 3 – АГЛС, 4 – САХ. М – белки-маркеры молекулярной массы. Fig. 2. Electrophoretic analysis of homogeneous enzymes. Electropherograms of purified enzymes: 1 ‒ exoINU, 2 ‒ endoINU, 3 ‒ AGLC, 4 ‒ SUC. M ‒ protein molecular mass markers.
Удельная активность гомогенных ферментов по отношению к различным субстратам приведена в табл. 4. Удельная активность эндоИНУ по отношению к инулину топинамбура была примерно в 3 раза выше, чем таковая для экзоИНУ. Удельная активность экзоИНУ по сахарозе была в 50 раз выше, чем активность этого же фермента по инулину. Важно заметить, что удельная активность гомогенной САХ по сахарозе в 13 раз ниже, чем для экзоИНУ. Удельная активность экзоИНУ по раффинозе и стахиозе была сопоставима с таковой для АГЛС. Отметим также высокое значение удельной активности АГЛС по пНФГ. В целом, данные по удельной активности гомогенных ферментов находятся в полном соответствии с данными, приведенными в табл. 1 и 2, характеризующими активности соответствующих ФП.
Таблица 4.
Удельная активность гомогенных ферментов Table 4. Specific activity of the homogeneous enzymes
| Фермент | Удельная гидролитическая активность*, ед/мг белка | ||||
|---|---|---|---|---|---|
| субстраты | |||||
| инулин | сахароза | раффиноза | стахиоза | пНФГ | |
| ЭндоИНУ | 56 ± 3 | 0 | 0 | 0 | 0 |
| ЭкзоИНУ | 17 ± 1 | 850 ± 20 | 41 ± 2 | 15 ± 1 | 0 |
| САХ | 0 | 78 ± 4 | 0 | 0 | 0 |
| АГЛС | 0 | 0 | 20 ± 1 | 27 ± 1 | 387 ± 11 |
В ходе исследования определены кинетические параметры гидролиза соответствующих субстратов гомогенными ферментами (табл. 5). Значение параметра kcat/Km, характеризующего эффективность гидролиза потенциального субстрата, для экзоИНУ по инулину было почти на порядок выше, чем для эндоИНУ. При использовании сахарозы в качестве субстрата значение kcat/Km для экзоИНУ более чем в 300 раз превосходило таковое для САХ. Обращает на себя внимание очень высокое значение kcat/Km для АГЛС при использовании пНФГ в качестве субстрата.
Таблица 5.
Значения кинетических параметров для гомогенных ферментов Table 5. Values of kinetic parameters for the homogeneous enzymes
| Параметрa | ЭндоИну (по инулину) |
ЭкзоИну (по инулину) |
ЭкзоИну (по сахарозе) |
САХ (по сахарозе) |
АГЛС (по пНФГ) |
|---|---|---|---|---|---|
| kcat, c‒1 | 60 ± 3 | 82 ± 4 | 760 ± 30 | 0.34 ± 0.02 | 773 ± 18 |
| Km, г/л, М b | 39 ± 2 | 5.2 ± 0.3 | 0.10 ± 0.01 | 0.014 ± 0.001 | 0.001 ± 0.0001 |
| kcat/Km, л г‒1 с‒1, М‒1 с‒1c | 1.5 ± 0.1 | 15.8 ± 1.0 | 7600 ± 50 | 24.3 ± 1.5 | 773 000 ± 500 |
Примечание: а Реакции проводили при 50°С и рН 5.0; b г/л – для гидролиза инулина, М – для гидролиза сахарозы и пНФГ; c л г‒1 с‒1 – для гидролиза инулина, М‒1 с‒1 – для гидролиза сахарозы и пНФГ. Note: а The reactions were carried out at 50°C and pH 5.0, b g/L – for inulin hydrolysis, М – for sucrose and pNPhG hydrolysis, c (g/L)‒1 s‒1 – for inulin hydrolysis, M‒1 s‒1 – for sucrose and pNPhG hydrolysis.
Температурный оптимум эндоИНУ составил 50‒55°С (табл. 6); значение Т80 (диапазон температуры, в котором активность была не менее 80% от максимальной) составило 40‒60°С. Температурный оптимум экзоИНУ наблюдали при 55‒65°С (Т80 45‒70°С), АГЛС – при 60°С (Т80 45‒62°С), а самое низкое значение Топт (35°С) зарегистрировано для САХ (Т80 30‒40°С).
Таблица 6.
Оптимальные значения температуры и рН для гомогенных ферментов* Table 6. Optimal temperature and pH values for the homogeneous enzymes*
| Фермент | Топт, °С | Т80, °С | рНопт | рН80 |
|---|---|---|---|---|
| ЭндоИНУ | 50‒55 | 40‒60 | 6.5 | 6.0‒7.0 |
| ЭкзоИНУ | 55‒65 | 45‒70 | 4.5 | 4.0‒5.5 |
| АГЛС | 60 | 45‒62 | 4.5‒5.0 | 4.0‒6.0 |
| САХ | 35 | 30‒40 | 5.5‒6.0 | 5.0‒6.5 |
* Примечание: Зависимость активности ферментов от температуры определяли при рН 5.0; зависимость от рН – при температуре 50°С. Субстраты: инулин для экзоИНУ и эндоИНУ, сахароза для САХ и пНФГ для АГЛС. *Note: The dependence of enzyme activity on temperature was determined at pH 5.0; dependence on pH was determined at 50°C. Substrates: inulin for exoINU and endoINU, sucrose for SUC, and pNPhG for AGLC.
Все исследованные ферменты проявляли максимальную гидролитическую активность в нейтральной и слабокислой области. Наибольшую активность для эндоИНУ регистрировали при рН 6.5; значение рН80 (диапазон рН, в котором активность была не менее 80% от максимальной) составляло 6.0‒7.0. рН-оптимум экзоИНУ составил 4.5 (рН80 4.0‒5.5); рН-оптимум для АГЛС находился в диапазоне 4.5‒5.0 (рН80 4.0‒6.0), для САХ – 5.5‒6.0 (рН80 5.0‒6.5).
Отметим, что значения температурных и рН-оптимумов, а также значения Т80 и рН80 для гомогенных ферментов и соответствующих ФП совпадали.
Таким образом, исследуемые гомогенные ферменты и соответствующие ФП характеризовались значениями Т80 в близких диапазонах, это же касалось и значений рН80 (за исключением САХ ‒ фермента, для которого температурный оптимум был ниже, чем для других ферментов).
Нами изучена стабильность гомогенных ферментов при различной температуре (табл. 7). ЭндоИНУ проявляла относительно высокую стабильность: при инкубировании раствора фермента при температуре 40 и 50°С его активность практически не изменялась в течение 180 мин и уменьшалась до 40 и 30% от исходной при температуре 60 и 70°С соответственно. Активность экзоИНУ сохранялась практически на исходном уровне (90‒100%) в течение 180 мин при 40‒50°С и снижалась до 65 и 10% от исходной при 60 и 70°С соответственно. Фермент АГЛС оказался менее стабильным: через 180 мин инкубации при температуре 40‒50°С его активность снижалась до 30‒20% от исходной, при 60°С ‒ до 7%, а при 70°С наблюдалась полная инактивация. Фермент САХ проявлял очень низкую стабильность: при инкубировании в течение 15 мин при 40°С сохранялось 30% исходной активности, после 5 мин при 50°С ‒ 5% активности, а при более высоких температурах фермент был нестабилен.
Таблица 7.
Стабильность гомогенных ферментов при различной температуре (рН 5.0)* Table 7. Stability of the homogeneous enzymes at different temperatures (pH 5.0)*
| Фермент | Температура, °С | Остаточная активность после 3 ч инкубации, % |
|---|---|---|
| ЭндоИНУ | 40 | 100 |
| 50 | 100 | |
| 60 | 40 | |
| 70 | 30 | |
| ЭкзоИНУ | 40 | 100 |
| 50 | 90 | |
| 60 | 65 | |
| 70 | 10 | |
| АГЛС | 40 | 30 |
| 50 | 20 | |
| 60 | 7 | |
| 70 | – | |
| САХ | 40 | 30 (15 мин) |
| 50 | 5 (5 мин) | |
| 60 | ‒ | |
| 70 | ‒ |
Отметим, что параметры, характеризующие термостабильность гомогенных ферментов и соответствующих ФП, совпадали.
При обработке инулина топинамбура (100 г/л) гомогенным ферментом эндоИНУ (5 ед/г субстрата) при 50°С и рН 5.0 в течение 3 ч происходил полный гидролиз субстрата. По данным ВЭЖХ, продуктами гидролиза были преимущественно ФОС со степенью полимеризации 3‒8 и в меньшем количестве ФОС с более высокой степенью полимеризации. Кроме того, в реакционной смеси идентифицировали сахарозу (в невысокой концентрации), фруктозу и глюкозу (рис. 3). Исходный субстрат содержал ФОС, сахарозу, фруктозу и глюкозу в низкой концентрации.
Рис. 3.
ВЭЖХ-анализ продуктов реакции, образующихся из инулина топинамбура под действием гомогенной эндоИНУ. Реакционную смесь: 100 г/л инулина, 5 единиц активности эндоИНУ на 1 г субстрата ‒ инкубировали при 50°С и рН 5.0 в течение 3 ч. 1 ‒ инулин, 2 – продукты гидролиза инулина. Fig. 3. HPLC analysis of products formed from topinambur inulin treated with homogeneous endoINU. The reaction mixture, 100 g/L inulin and 5 units of endoinulinase activity per 1 g substrate, was incubated at 50°C and pH 5.0 for 3 h. 1 ‒ inulin, 2 ‒ products of inulin hydrolysis.
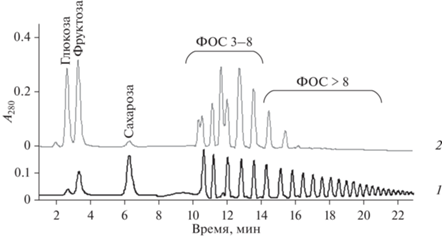
При 50°С и рН 5.0 гомогенный фермент экзоИНУ (0.5 ед/г субстрата) за 3 ч количественно гидролизовал инулин топинамбура (100 г/л) с образованием ГФС с соотношением Глю : Фру примерно 1 : 3 (данные ВЭЖХ не приведены). В тех же условиях проведения реакции при использовании в качестве субстрата сахарозы (200 г/л) фермент экзоИНУ (25 единиц сахаразной активности на 1 г субстрата) количественно конвертировал сахарозу в ГФС с соотношением Глю : Фру примерно 1 : 0.63 (данные ВЭЖХ не приведены). Таким образом, ГФС, полученный из инулина, был существенно обогащен фруктозой по сравнению с продуктом, полученным из сахарозы.
Гомогенный фермент САХ, как и экзоИНУ, количественно конвертировал сахарозу (200 г/л, 25 единиц сахаразной активности на 1 г субстрата, 50°С, рН 5.0) в течение 3 ч с получением ГФС, аналогичного по составу полученному под действием экзоИНУ (из-за меньшей термостабильности САХ процесс проводили при температуре ниже, чем в случае экзоИНУ; кроме того, расход САХ по массе был примерно в 11 раз выше, чем экзоИНУ из-за различий в удельной сахаразной активности двух ферментов; см. табл. 4).
Для исследования возможностей использования соответствующих гомогенных ферментов для конверсии галактоолигосахаридов сои в качестве сырья был использован ЭСШ (обработку ЭСШ проводили в течение 6 ч при 40°С и рН 5.0 при концентрации каждого фермента 5 мг/г субстрата). Продукты ферментативной обработки ЭСШ анализировали методом ВЭЖХ.
Исходный образец ЭСШ содержал в своем составе стахиозу, раффинозу, сахарозу, а также моносахариды (глюкозу и фруктозу) (табл. 8). Обработка ЭСШ ферментом АГЛС приводила к практически полной деструкции раффинозы и стахиозы, образованию моносахаридов (глюкозы, фруктозы и галактозы) и значительного количества сахарозы (АГЛС не обладает сахаразной активностью, см. табл. 4). Совместное применение АГЛС и САХ приводило к полной конверсии до моносахаридов как раффинозы и стахиозы, так и сахарозы (табл. 8). Отметим, что использование только САХ приводило к гидролизу сахарозы, но не меняло содержания в ЭСШ раффинозы и стахиозы, так как САХ не гидролизует эти олигосахариды (табл. 4). Наконец, обработка ЭСШ только экзоИНУ давала тот же результат, как и совместное действие АГЛС и САХ: полная деструкция раффинозы, стахиозы и сахарозы до моносахаридов (табл. 8).
Таблица 8.
Состав сахаров в ферментативных гидролизатах ЭСШ под действием гомогенных ферментов Table 8. The composition of sugars in enzymatic hydrolysates of extruded soybean meal (ESM) under the action of homogeneous enzymes
| Ферменты | Содержание сахаров, мг/г ЭСШa | |||
|---|---|---|---|---|
| моносахаридыb | сахароза | раффиноза | стахиоза | |
| Контроль | 9.9 | 75.8 | 17.2 | 58.1 |
| АГЛС | 86.6 | 90.5 | 0.3 | 0.8 |
| АГЛС + САХ | 186.1 | 0.2 | 0.1 | 0.3 |
| САХ | 89.0 | 0.2 | 17.1 | 58.0 |
| ЭкзоИНУ | 186.3 | 0.2 | 0.1 | 0.3 |
Таким образом, можно заключить, что экзоИНУ, вследствие широкой специфичности и высокой гидролитической активности, представляет собой наиболее ценный с точки зрения применения в биотехнологии ферментный препарат. Экзоинулиназа эффективно гидролизует инулин, а также проявляет высокую α-галактозидазную и сахаразную активность. В связи с этим фермент может быть с одинаковым успехом использован для получения глюкозо-фруктозного сиропа из инулина, для инверсии сахарозы, а также для деструкции галактоолигосахаридов сои и борьбы с антипитательными факторами кормов сельскохозяйственных животных и птиц.
Список литературы
Handbook of Food Enzymology. Eds J.R. Whitaker, A.G.J. Voragen, D.W.S. Wong. N.Y.: CRC Press, 2002, 1108 p. https://doi.org/10.1201/9780203910450
Chi Z.-M., Zhang T., Cao T.-S., et al. Biotechnological potential of inulin for bioprocesses. Biores. Tech., 2011, 102(6), 4295‒4303. https://doi.org/10.1016/j.biortech.2010.12.086
Волков П.В., Синицына О.А., Федорова Е.А. и др. Выделение и свойства рекомбинантных инулиназ Aspergillus sp. Биохимия, 2012, 77(5), 611‒621. https://doi.org/10.1134/S0006297912050094
Холявка М.Г. Исследование физико-химических, структурно-функциональных свойств инулиназ и закономерностей формирования ими надмолекулярных комплексов в условиях различного микроокружения. Дис. д-ра биол. наук, Воронежский государственный университет, Воронеж, 2018.
Quenmeau Y., Jarosz S., Lewandowski B., Fitremann J. Sucrose chemistry and applications of sucrochemicals. Adv. Carbohydr. Chem. Biochem., 2007, 61, 217‒292. https://doi.org/10.1016/S0065-2318(07)61005-1
Синицына О.А., Федорова Е.А., Вакар И.М. и др. Выделение и свойства β-галактозидаз Penicillium canescens. Биохимия, 2008, 73(1), 127–138. https://doi.org/10.1134/S000629790801015x
Soybean and Nutrition. Ed. H.A. El-Shemy. Croatia: InTech, 2011, 486 p. https://doi.org/10.5772/1008
Синицын А.П., Синицына О.А., Рожкова А.М. Получение промышленно важных ферментов на основе экспрессионной системы гриба Penicillium verruculosum. Биотехнология, 2020, 36(6), 17‒34. https://doi.org/10.21519/0234-2758-2020-36-6-17-34
Синицын А.П., Рожкова А.М., Зоров И.Н. и др. Рекомбинантный штамм мицелиального гриба Penicillium verruculosum (варианты) и способ получения ферментного препарата и его использование (варианты). Патент RU 2646136 C2, Опубл. 01.03.2018.
Синицын А.П., Рожкова А.М., Синицына О.А. и др. Генетическая конструкция для обеспечения экспрессии целевых гомологичных и гетерологичных генов в клетках мицелиального гриба Penicillium verruculosum, используемого в качестве хозяина, способ получения штамма гриба Penicillium verruculosum и способ получения ферментного препарата. Патент RU 2378372 С2, Опубл. 10.01.2010.
Volkov P.V., Gusakov A.V., Rubtsova E.A., et al. Pro-perties of recombinant GH49 family dextranase heterologously expressed in two recipient strains of Penicillium species. Biochimie, 2019, 157, 123‒130. https://doi.org/10.1016/j.biochi.2018.11.010
Volkov P.V., Rubtsova E.A., Rozhkova A.M., et al. Properties of recombinant endo-β-1,6-glucanase from Trichoderma harzianum and its application in the pustulan hydrolysis. Carbohydr. Res., 2021, 499, 108211. https://doi.org/10/1016/j.carres.2020.108211
Aslanidis C., de Jong, P.J. Ligation-independent cloning of PCR products (LIC-PCR). Nucleic Acids Res., 1990, 18, 6069–6074. https://doi.org/10.1093/nar/18.20.6069
Sanger F., Coulson A. R., Barrell B. G., et al. Cloning in single-stranded bacteriophage as an aid to rapid DNA sequencing. J. Mol. Biol., 1980, 143, 161–178. https://doi.org/10.1016/0022-2836(80)90196-5
Синицын А.П., Рубцова Е.А., Шашков И.А. и др. Получение и свойства новых биокатализаторов, предназначенных для разрушения некрахмальных растительных полисахаридов. Катализ в промышленности, 2017, 17(4), 331‒338. https://doi.org/10.18412/1816-0387-2017-4-331-338
Cиницын А.П., Черноглазов В.М., Гусаков А.В. Методы исследования и свойства целлюлолитических ферментов. В сб.: Итоги науки и техники. Серия Биотехнология. Москва: ВИНИТИ, 1990, 25, 30–37.
Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика. Москва: Мир, 1991, 544 с.
Дополнительные материалы отсутствуют.


