Биология внутренних вод, 2019, № 1, стр. 86-95
Нарушение равновесия в микробиоценозе кишечника Danio rerio (Hamilton, 1882) и угнетение защитных механизмов под воздействием никельсодержащих наночастиц
В. А. Багиров 1, Е. А. Сизова 2, 3, *, Е. П. Мирошникова 3, И. А. Гавриш 2, А. В. Коновалов 4
1 Федеральный научный центр животноводства – ВИЖ им. акад. Л.К. Эрнста
142132 Московская область, пос. Дубровицы, д. 60, Россия
2 Федеральный научный центр биологических систем и агротехнологий Российской академии наук,
460000 Оренбург, ул. 9-го Января, д. 29, Россия
3 Оренбургский государственный университет
460013 Оренбург, пр. Победы, д. 13, Россия
4 Ярославский научно-исследовательский институт животноводства и кормопроизводства Федерального научного центра кормопроизводства и агроэкологии им. В.Р. Вильямса
150517 Ярославская обл., Ярославский район, пос. Михайловский, ул. Ленина, д. 1, Россия
* E-mail: Sizova.L78@yandex.ru
Поступила в редакцию 13.11.2016
После доработки 12.05.2017
Принята к публикации 08.04.2017
Аннотация
Изучено состояние антиоксидантной системы и микробиоценоза кишечника Danio rerio (Hamilton, 1822) при внесении в среду обитания наночастиц никеля и его оксида. Установлено, что токсический эффект наночастиц развивается по пути индукции окислительного стресса и сопровождается качественной реорганизацией микробиоценоза кишечника и угнетением защитных механизмов. Низкая дозовая нагрузка и кратковременный контакт тест-объекта с наноформами никеля приводят к активизации системы антиоксидантной защиты организма в ответ на образование свободных радикалов. Хронические условия и высокие дозы истощают антиоксидантную систему организма на фоне гиперпродукции свободных радикалов при окислительном стрессе. Установлено изменение видового разнообразия микроорганизмов, в частности замена Citrobacter и Enterobacter на Rhodobacter и Methylobacterium (при внесении наночастиц оксида никеля) и Bacillus, Acinetobacter и Rhodobacter (наночастиц никеля), т.е. замещение нормальной микрофлоры желудочно-кишечного тракта транзиторной. Повышение в среде обитания количества никеля в форме наночастиц неизбежно приводит к их кумуляции в теле гидробионтов с выраженностью эффекта при хронических условиях.
ВВЕДЕНИЕ
Проблема влияния наночастиц металлов на живые системы стала актуальной в последние десятилетия в связи с их широким применением в промышленности [33]. Особый комплекс физико-химических свойств и характеристик биологического действия наночастиц и наноматериалов, радикально отличающихся от свойств этого же вещества или материала в форме сплошных фаз или макроскопических дисперсий, характеризует их как новый вид материалов и продукции с обязательной оценкой потенциального риска для окружающей среды и здоровья человека [6]. Размер таких частиц обеспечивает многократное возрастание их суммарной поверхности и проникающей способности и дает значительные возможности для коррекции различных патологических процессов, в то же время представляя опасность для сохранности структуры и функции нормальных клеток и тканей. Поскольку многие металлы оказывают влияние на функциональное состояние организма, в том числе антиоксидантной системы, вызывает обеспокоенность тот факт, что наночастицы в технологическом цикле производства неизбежно попадают в почву и, вымываясь, могут переноситься в водоемы [27]. Поэтому изучение влияния наночастиц на жизнедеятельность водных организмов, показателей их физиологического статуса и возможности использования для биоиндикации и биоремедиации антропогенно загрязненных водоемов имеет научную и практическую значимость. Широкий спектр живых организмов позволяет с учетом всех токсикологических особенностей соединений исследовать их биологическую активность [1]. Имеются данные об исследовании ряда наночастиц in vitro [32]. Однако для никеля их недостаточно [40], несмотря на признание его приоритетным загрязнителем биосферы [10].
Цель работы – определение эколого-токсических эффектов наночастиц никеля и оксида никеля в водной среде с использованием рыб Danio rerio в качестве тест-объекта.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использованы наночастицы никеля (Ni-НЧ) и оксида никеля (NiO-НЧ), полученные методом электрического взрыва проводника в атмосфере (“Передовые порошковые технологии”, Россия): Ni-НЧ размером 70 нм, с удельной поверхностью (Sуд) 4.6–6.0 м2/г, Ζ-потенциалом 25 ± 0.5 мВ, дозой 1.0 мг/дм3; NiO-НЧ – 94 нм, (Sуд) 12 м2/г, 29 ± 0.5 мВ, 1.3 мг/дм3.
Для выполнения эксперимента из 330 особей использовали 105 особей Danio rerio (вид пресноводных лучеперых рыб семейства карповых) возрастом 1 мес. В течение 21 сут (предварительный этап эксперимента) их содержали в условиях аквариума объемом 300 л. Затем методом пар-аналогов формировали семь групп по 15 экз., помещая каждую в отдельный аквариум объемом 10 л, в воду которого 1 раз в 7 сут добавляли исследуемые наночастицы в форме лиозолей с кормом для рыб (личинки комаров сем. Chironomidae) [30]: для I группы дозировкой – 0.01 мг/дм3 (n) Ni-НЧ, для II – 0.1 мг/дм3 (10 n) Ni-НЧ, III – 1 мг/дм3 (100 n) Ni-НЧ, IV – 0.013 мг/дм3 (n) NiO-НЧ, V – 0.13 мг/дм3 (10 n) NiO-НЧ, VI – 1.3 мг/дм3 (100 n) NiO-НЧ; VII группа – контроль (без добавления наночастиц). Для подготовки лиозолей наночастицы подвергали диспергированию (УЗДН-2Т, “НПП Академприбор”, Россия) при f – 35 кГц, 300 Вт, A – 10 мкА, 30 мин. Основной учетный период эксперимента длился 84 сут.
Во время эксперимента средние значения тестируемых свойств воды были следующие: температура – 22 ± 2°С, рН 7.3 ± 0.07, растворенный кислород 5 ± 0.2 мг/л. Режим содержания обеспечивал 12 ч света/12 ч темноты. Рыб кормили 1 раз в 2 сут. Условия выращивания и содержания объектов исследования соответствовали правилам OECD [29].
Использование животных и экспериментальные исследования выполняли в соответствии с Российским регламентом, 1987 (Приказ МЗ СССР № 755 от 12.08.1977) и The Guide for Care and Use of Laboratory Animals (National Academy Press, Washington, D.C., 1996).
Определение активности ферментов антиоксидантной системы и продуктов перекисного окисления липидов (ПОЛ) проводили через 7, 14 и 84 сут после гомогенизирования Danio rerio (“TissueLyser LT”, “Qiagen N.V.”, Германия) и приготовления вытяжки. Для этого к 1 объему гомогената добавляли 9 объемов трис-буферного раствора, ммоль/л: (трис-HCl – 50, дитиотреитол DTT – 1.0, EDTA – 1.0, сахароза – 250, рН 7.5). После центрифугирования (10 мин при 15000 об./мин) отбирали супернатант, в котором измеряли содержание малонового диальдегида (МДА, нмоль/мл) [12], и активность ключевых ферментов антиоксидантной системы – каталазы (КТ, КФ 1.11.1.6, мкМ Н2О2/мин) и супероксиддисмутазы (СОД, КФ 1.15.1.1, % ингибирования адреналина), используя автоматический биохимический анализатор СS-T240 (“Dirui Industrial Co., Ltd.”, Китай) и коммерческие биохимические наборы для ветеринарии (“Randox Laboratories, Ltd.”, Великобритания).
Исследования проводили в лаборатории “Агроэкология техногенных наноматериалов” и Испытательном центре Всероссийского научно-исследовательского института мясного скотоводства (аттестат аккредитации RA. RU.21ПФ59 от 02.12.2015).
Метагеномный анализ содержимого кишечника рыб проводили в Центре коллективного пользования “Персистенции микроорганизмов” Института клеточного и внутриклеточного симбиоза Уральского отделения РАН. Оценка микробного биоразнообразия включала: отбор проб, выделение, очистку и измерение концентраций ДНК, проведение полимеразной цепной реакции (ПЦР), валидацию и нормализацию библиотек с последующим секвенированием на платформе высокопроизводительного секвенатора второго поколения “MiSeq Illumina”, США.
После вскрытия рыб, кишечники помещали в стерильные микропробирки типа “эппендорф” (Nuova Aptaca S.R.L., Италия), замораживали и хранили при –70°C, затем использовали для выделения очищенных препаратов ДНК [2].
После выделения и очистки измеряли концентрацию ДНК в растворе двумя методами – на приборах Nanodrop (“Thermo Scientific”, USA) для построения кривых оптической плотности ДНК и оценки показателя ОП (260)/ОП (280) и Qubit 2.0 (“Invitrogen/Life Technologies”, USA) для определения концентрации в нг/мкл. Концентрацию ДНК измеряли три раза: первый – после выделения ДНК, второй – после проведения первой ПЦР со специфичными 16S прокариотическими праймерами и третий раз – после второй ПЦР с адаптерами и индексами протоколов Nextera XT. Дальнейший анализ микрофлоры осуществляли методом метагеномного секвенирования.
Объединение ридов (R1 и R2) проводили с использованием программы PEAR (Pair-End AssembeR, PEAR v0.9.8, April 9, 2015) при следующих параметрах: минимальное перекрытие – 40 пн (Minimum overlap – 40 bp), p-value – 0.001, качество Q = 30 (http://www.exelixis-lab.org/web/software/pear) [41]. Фильтрацию, дерепликацию, удаление химерных последовательностей, кластеризацию, сортировку (отсечки singletons), удаление контаминации проводили с использованием программы USEARCH v8.0. Для фильтрации применяли алгоритм fastq_filter, с минимальной длиной сиквенса 415 пн; минимальное качество прочтения Q = 15), для репликации – алгоритм derep prefix, для кластеризации и удаления химерных последовательностей – алгоритм cluster otus (http://drive5.com/usearch) [18]. Для визуализации использовали ресурс VAMPS (Visualization and Analysis of Microbial Population Structures https://vamps.mbl.edu/) [23].
Концентрацию никеля в тканях тела Danio rerio определяли в лаборатории АНО “Центр биотической медицины”, Москва (аттестат аккредитации ГСЭН.RU.ЦАО.311, регистрационный номер в Государственном реестре РОСС RU. 0001.513118) методом масс-спектрометрии с индуктивно связанной плазмой (МС-ИСП) на квадрупольном масс-спектрометре Elan 9000 (Perkin Elmer, США).
Статистический анализ проводили путем сравнения опытных групп с контрольной, используя SPSS 19.0 программного обеспечения (IBM Corporation) и Statistica 10. Статистически значимыми считали значения с p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выживаемость и показатели антиоксидантного статуса Danio rerio. В ходе эксперимента (84 сут) Ni-НЧ и NiO-НЧ оказали влияние на выживаемость тест-объекта (табл. 1). Увеличение концентраций NiО-НЧ сопровождалось снижением выживаемости Danio rerio на 56-е сут эксперимента при максимальной дозировке (100 n), с последующим прогрессивным снижением численности (рис. 1). Эквивалентные концентрации Ni-НЧ не вызвали подобного токсического эффекта. В контроле выживаемость была 100%.
Таблица 1.
Влияние Ni-НЧ и NiO-НЧ на выживаемость Danio rerio
| Время эксперимента, сут | Дозировка, мг/дм3 | ||
|---|---|---|---|
| n | 10 n | 100 n | |
| 7 | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ |
| 28 | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ |
| 56 | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{NOEC}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{LOEC}}}}$ |
| 84 | $\frac{{{\text{NOEC}}}}{{{\text{Tox}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{Tox}}}}$ | $\frac{{{\text{NOEC}}}}{{{\text{Tox}}}}$ |
Рис. 1.
Динамика численности Danio rerio при внесении в среду NiО-НЧ в дозах: 1 – 0.013 мг/дм3, 2 – 0.13 мг/дм3, 3 – 1.3 мг/дм3. Выживаемость в контроле 100%. По оси ординат – численность, по оси абсцисс – время экспозиции.
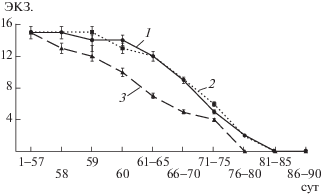
Анализ активности МДА в организме Danio rerio не показал его критического увеличения, лишь к концу эксперимента с Ni-НЧ (табл. 2) значение МДА превышало контрольное.
Таблица 2.
Показатели МДА в теле Danio rerio
| Дозы, мг/дм3 | МДА (нмоль/мл) | ||
|---|---|---|---|
| 7 сут | 14 сут | 84 сут | |
| n | $\frac{{0.569 \pm 0.036}}{{0.596 \pm 0.007}}$ | $\frac{{0.346 \pm 0.006}}{{0.481 \pm {{{0.015}}^{{\text{a}}}}}}$ | ${{\frac{{0.541 \pm 0.005}}{--}}^{{\text{a}}}}$ |
| 10 n | $\frac{{0.615 \pm 0.004}}{{0.481 \pm 0.009}}$ | $\frac{{0.423 \pm 0.001}}{{0.135 \pm {{{0.007}}^{{\text{a}}}}}}$ | ${{\frac{{0.963 \pm 0.007}}{--}}^{{\text{a}}}}$ |
| 100 n | $\frac{{0.423 \pm 0.006}}{{0.557 \pm 0.015}}$ | $\frac{{0.347 \pm 0.005}}{{0.365 \pm 0.008}}$ | ${{\frac{{0.953 \pm 0.001}}{--}}^{{\text{b}}}}$ |
| Контроль | 0.691 ± 0.005 | 0.461 ± 0.008 | 0.311 ± 0.111 |
Примечание. Над чертой – Ni-НЧ, под чертой – NiO-НЧ. “–” – гибель организма. Здесь и в табл. 3 при сравнении экспериментальных образцов с контрольными: a p < 0.05; b p < 0.01.
Семисуточная экспозиция Danio rerio в среде с возрастающими концентрациями наночастиц привела к подавлению выработки ферментов антиоксидантной защиты. Так, активность СОД в опыте была ниже контрольной для NiO-НЧ на 49%, Ni-НЧ – на 67% (табл. 3).
Таблица 3.
Активность супероксиддисмутазы и каталазы в вытяжках Danio rerio
| Дозы | СОД, % | КT, мкМ Н2О2/мин | ||||
|---|---|---|---|---|---|---|
| 7 сут | 14 сут | 84 сут | 7 сут | 14 сут | 84 сут | |
| Ni-НЧ | ||||||
| n | 48.7 ± 0.9b | 51.3 ± 2.2 | 95.6 ± 1.2b | 122.3 ± 1.2b | 72.7 ± 2.4b | 33.7 ± 1.5a |
| 10 n | 24.7 ± 4.6b | 67.9 ± 1.1b | 25.9 ± 8.0a | 100.6 ± 0.9b | 100.2 ± 3.3b | 33.7 ± 1.6a |
| 100 n | 23.3 ± 2.3b | 40.0 ± 3.4 | 20.1 ± 1.5b | 85.1 ± 0.8b | 93.9 ± 2.7b | 33.8 ± 1.0a |
| Контроль | 70.6 ± 0.5 | 47.6 ± 0.6 | 59.3 ± 1.8 | 14.6 ± 1.4 | 16.2 ± 0.3 | 23.1 ± 0.8 |
| NiO-НЧ | ||||||
| n | 60 ± 5.9 | 96.9 ± 2.0b | – | 164.0 ± 1.5b | 65.6 ± 2.6b | – |
| 10 n | 10.2 ± 1.5b | 81.6 ± 2.1b | – | 105.1 ± 0.7b | 109.0 ± 3.1b | – |
| 100 n | 36.2 ± 4.6b | 26.8 ± 2.3b | – | 30.1 ± 1.1b | 94.8 ± 2.5b | – |
| Контроль | 70.6 ± 0.5 | 47.6 ± 0.6 | 59.3 ± 1.8 | 14.6 ± 1.4 | 16.2 ± 0.3 | 23.1 ± 0.8 |
Увеличение экспозиции до 14 сут вызвало возрастание активности СОД при минимальной (n) и средней (10 n) дозовых нагрузках, причем максимальная разница (103%, p < 0.05) отмечена для NiО-НЧ при дозировке n. Высокие концентрации NiО-НЧ (100 n) привели к ингибированию активности СОД, следовательно, отсутствию антиоксидантной защиты организма.
Активность КТ в вытяжках Danio rerio в эксперименте значительно превышала показатели в контроле. Низкий (n) и средний (10 n) уровень дозировки индуцировал активность КТ на первом этапе эксперимента (7 сут), стимулируя работу антиоксидантной системы. Увеличение экспозиции до 84 сут угнетало работу систем, приводя к снижению активности КТ. Высокий дозовый уровень (100 n) вызывал ингибирование активности фермента уже на первом этапе эксперимента (7 сут), усугубляя процесс, по мере приближения эксперимента к завершению, с разовым повышением на этапе 14 сут.
Таким образом, низкая дозовая нагрузка и кратковременный контакт тест-объекта с наноформами никеля приводят к активизации системы антиоксидантной защиты организма в ответ на образование свободных радикалов. Хронические условия и высокие дозы истощают антиоксидантную систему организма на фоне гиперпродукции свободных радикалов при ОС.
Анализ концентрации никеля в теле Danio rerio показал достоверно значимое ее отличие от аналогичного показателя у контрольных особей (рис. 2). Так, уровень естественной концентрации Ni в течение эксперимента имел незначительные колебания (0.696–1.17 мкг/г). Резкое увеличение уровня Ni (разница с контролем 849%, p < 0.05) в теле рыб на седьмые сутки эксперимента зафиксировано в ответ на присутствие в среде только NiО-НЧ, с последующим уменьшением показателей ниже уровня контроля к 14-м сут. Система гомеостатического регулирования микроэлементов обеспечила постоянство уровня металла в организме и снизила его количество до уровня контроля к 14-м сут.
Рис. 2.
Динамика концентрации никеля в теле Danio rerio (мкг/г) при внесении в среду НЧ: 1 – контроль; 2 – Ni-НЧ 100 n (1.0 мг/дм3); 3 – NiO-НЧ 100 n (1.3 мг/дм3).
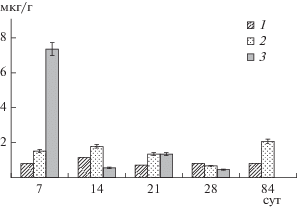
Дальнейшее увеличение экспозиции эксперимента (21, 28-м сут) не привело к пиковым отличиям концентрации никеля в опытных и контрольных образцах, величина которой на 21-е сут превысила контроль на 95.1% (p < 0.05), к 28 – снизилась на 44.3% (p < 0.05). Контакт тест-объекта с Ni-НЧ характеризовался волнообразным изменением значений концентрации никеля. За первые 3 нед эксперимента отмечено накопление никеля в теле Danio rerio при разнице с контролем на 7-е сут 95.7% (p < 0.05), на 14-е – 52.9%, на 21-е сут – 92.2% (p < 0.05). Хронические условия эксперимента увеличили разницу с контролем до 160.7% (p < 0.01), что привело к отложению в Danio rerio 17.25% никеля, поступившего в форме Ni-НЧ. Таким образом, по скорости и реакционности развития эффектов доминируют NiО-НЧ, поэтому их можно характеризовать как остротоксичные. Ni-НЧ обладают способностью к кумуляции, проявляя хронический токсический эффект.
Микробиоценоз кишечника Danio rerio. Таксономический анализ показал, что у контрольных рыб микробиоценоз кишечника Danio rerio в основном состоял из представителей филума Proteobacteria при относительно небольшой численности Firmicutes и Actinobacteria. Использование в питании рыб наночастиц значительно изменило состав микробиоценоза (табл. 4). В кишечнике рыб, получавших NiО-НЧ, на фоне снижения численности представителей Proteobacteria до 21% численность Firmicutes, Actinobacteria (грамположительные бактерии) повысилась в 2.18 и 6.79 раза, соответственно. Отмечено появление Fusobacteria (менее 2%), не обнаруженного в контроле. В кишечнике рыб, получавших Ni-НЧ, численность представителей Proteobacteria снизилась в 1.5 раза.
Таблица 4.
Таксономический состав микрофлоры (% общего числа бактерий) кишечника рыб Danio rerio после воздействия никельсодержащих наночастиц
| Филум | Класс | Семейство | Род | Вид |
|---|---|---|---|---|
| Контроль | ||||
| Proteobacteria (93%) |
Gammaproteobacteria (82%) |
Plesiomonas (10.6%) |
– | |
| Aeromonadaceae (8.76%) |
Tolumonas (8.75%) |
T. auensis (8.75%) |
||
| Pseudomonadaceae (4.88%) |
Pseudomonas (4.88%) |
P. panipatensis (2.33%) |
||
| Alphaproteobacteria (6.33%) |
Rhodobacteraceae (2.23%) |
– | – | |
| Betaproteobacteria (3.87%) |
Comamonadaceae (3.32%) |
– | – | |
| Firmicutes (2.49%) |
Clostridia (2%) |
– | – | – |
| Enterobacteriaceae (59.2%) |
Enterobacter (16.3%) |
E. soli (14.2%) |
||
| Citrobacter (25.6%) |
C. werkmanii (8.34%) |
|||
| C. freundii (11.7%) |
||||
| Другие (4.5%) | Другие (5.8%) | Другие (21.6%) | Другие (42.6%) | Другие (63%) |
| Через 28 сут контакта с NiО-НЧ | ||||
| Proteobacteria (20.6%) |
Alphaproteobacteria (4.97%) |
– | – | – |
| Gammaproteobacteria (14.9%) |
Moraxellaceae (10.8%) |
Acinetobacter (10.8%) |
А. baumannii (5.33%) |
|
| A. gerneri (3.73%) |
||||
| Actinobacteria (5.62%) |
Actinobacteria (5.43%) |
– | – | – |
| Firmicutes (8.76%) |
Bacilli (7.54%) |
Bacillaceae (2.99%) |
Bacillus (2.92%) |
– |
| Другие (5.59%) | Другие (8.53%) | Другие (38.7%) | Другие (47%) | Другие (90.9%) |
| Через 28 сут контакта с Ni-НЧ | ||||
| Proteobacteria (56.1%) |
Alphaproteobacteria (46.1%) |
Rhodobacteraceae (21.1%) |
Rhodobacter (13.6%) |
– |
| Xanthobacteraceae (10.4%) |
Labrys (9.2%) |
– | ||
| Methylobacteriaceae (3.95%) |
Methylobacterium (3.95%) |
M. marchantiae (2.4%) |
||
| Rhodospirillaceae (3.62%) |
Roseospira (3.41%) |
– | ||
| Gammaproteobacteria (8.28%) |
– | – | – | |
| Actinobacteria (25.2%) |
Actinobacteria (24.3%) |
Mycobacteriaceae (10.2%) |
Mycobacterium (10.2%) |
– |
| Planctomycetes (4.62%) |
Planctomycetia (4.62%) |
Planctomycetaceae (2.63%) |
– | – |
| Chlamydiae (4.16%) |
Chlamydiia (4.16%) |
Parachlamydiaceae (3.65%) |
– | – |
| Firmicutes (3.05%) |
– | – | – | – |
| Другие (5.59%) | Другие (8.53%) | Другие (38.7%) | Другие (47%) | Другие (97.6%) |
В кишечниках контрольных рыб основная численность бактерий приходилась на классы Gammaproteobacteria, Alphaproteobacteria, Betaproteobacteria (филум Proteobacteria), доля других классов была 5.8% общей численности (по убыванию – Clostridia, Actinobacteria, Planctomycetia и Bacilli). В опытной группе с NiО-НЧ уменьшалось число представителей класса Alphaproteobacteria (в 1.27 раза меньше, чем в контроле), численность бактерий класса Gammaproteobacteria заметно снизилась (в 6.16 раза) по сравнению с контрольной группой, на фоне повышения численности представителей классов Actinobacteria и Bacilli (в 6.66 и 6.37 раза соответственно). Отмечено появление бактерий классов Fusobacteria и Verrucomicrobia.
По сравнению с контролем, в группе с Ni-НЧ в десятикратно снизилась численность доминирующего класса Gammaproteobacteria. Далее по убыванию численности расположились классы Alphaproteobacteria и Actinobacteria и незафиксированные в контроле классы Verrucomicrobia и Fusobacteria. Следует отметить возрастание количества актинобактерий и бацилл, а также бактерий класса Fusobacteria (грамотрицательной анаэробной палочки) в обеих опытных группах по сравнению с контролем (не отмечены в таблице ввиду ≤2% численности).
Среди выявленных семейств доминирующее положение в кишечниках контрольных рыб занимало сем. Enterobacteriaceae, в меньшем количестве были представлены Aeromonadaceae, Pseudomonadaceae, причем аэромонады и псевдомонады традиционно считаются условно-патогенными микроорганизмами, а энтеробактерии составляют большую часть кишечной микрофлоры в норме [14]. Другие семейства были малочисленными (21.6% общего числа бактерий), по убыванию – Comamonadaceae (3.32%), Rhodobacteraceae (2.23%) и Rhizobiaceae. Наличие в рационе рыб NiО-НЧ сопровождалось 18-кратным, по сравнению с контролем, ростом численности сем. Rhodobacteraceae класса Alphaproteobacteria. Зафиксированы новые сем. Moraxellaceae и Bacillaceae, не обнаруженные в контроле.
В группе с Ni-НЧ численность сем. Rhodobacteraceae возросла в 5.7 раза. Зафиксировано также появление семейств, не обнаруженных в контрольном образце (Bacillaceae, Staphylococcaceae, Ectothiorhodospiraceae) и описанных в литературе как патогенные микроорганизмы для рыб [37].
В контроле состав кишечной микробиоты был представлен преимущественно родами Citrobacter (C. freundii, C. werkmanii) и Enterobacter (E. soli). В опыте с NiО-НЧ (см. табл. 4) доминировали роды Acinetobacter (A. baumannii и A. gerneri) и Bacillus на фоне скудного качественного состава микроорганизмов.
В опыте с Ni-НЧ преобладали роды Rhodobacter (R. gluconicum и R. ovatus), Methylobacterium (M. marchantiae) и Mycobacterium (см. табл. 4).
Cледует отметить, что в хроническом эксперименте (84 сут) изменения качественного состава микробиоценоза кишечника рыб, возможно, играют существенную роль в выживаемости тест-объектов, т. к. их контакт с NiO-НЧ привел к гибели всех животных, а с Ni-НЧ – 50 ± 9%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Развитие окислительных процессов под воздействием наночастиц может демонстрировать уровень ПОЛ, оцениваемый по накоплению МДА [7]. В эксперименте не установлено критическое его увеличение в организме Danio rerio и лишь хроническое действие Ni-НЧ привело к повышению уровня МДА. Подобная картина отмечена при изучении наночастиц Ag [17]. По-видимому, только хроническая экспозиция Danio rerio с Ni-НЧ приводит к развитию окислительных повреждений.
Причиной накопления МДА в тканях рыб может служить как усиление образования перекисей, так и снижение активности ферментов антиоксидантной защиты в ответ на хроническое воздействие наночастиц металлов [13]. Однако не только накопление МДА служит маркером развития ОС (оксидативный стресс), определенная роль в этом процессе отводится диеновым конъюгатам и другим активным продуктам, реагирующим с тиобарбитуровой кислотой [9]. Возможно, накопление именно этих продуктов стало причиной развития ОС и гибели тест-организмов при внесении в среду NiО-НЧ, как одного из металлов переменной валентности и индукторов ОС [39].
Одну из первых линий защиты клеток от агрессивного действия свободных радикалов, в том числе и перекисных, обеспечивают ферменты СОД, КТ и др. [4]. Динамика активности ферментов антиоксидантной защиты имела дозозависимый характер. Высокие концентрации NiО-НЧ (100 n) привели к ингибированию активности СОД, и, следовательно, к нарушению антиоксидантной защиты организма. При введении наночастиц оксида алюминия в культуру клеток CHSE-214 эмбрионов чавычи отмечено снижение активности СОД, КТ с последующей деформацией клеток, их распадом и гибелью [36]. Усиление активности КТ при низком и среднем дозовом уровне на фоне острого воздействия может рассматриваться как адаптационно-приспособительная реакция организма на развитие ОС, что подтверждает токсический эффект наночастиц. Одна из возможных причин снижения активности КТ – гиперпродукция свободных радикалов при ОС и истощение антиоксидантной системы организма [20].
Причинно-следственная связь в развитии подобного эффекта в организме гидробионтов выявлена для наночастиц Cu, Mo, MoO3, Ni, Ag и SiO2 и обусловлена механизмом непрямого генотоксического воздействия через образование эндогенных мутагенов, активных форм кислорода и продуктов перекисного окисления липидов. Генотоксическая активность этих продуктов хорошо известна, как и причины, вызывающие их гиперпродукцию: индукция “прооксидантных” ферментов ксантиноксидазы, НАДФ-Н-оксидазы, альдегидоксидазы, дигидрооротатдегидрогеназы, микросомальных монооксигеназ, повреждение электрон-транспортной цепи митохондрий, ингибирование и истощение ферментативных и неферментативных звеньев антиоксидантной защиты, избыток металлов переменной валентности или недостаток хелаторов металлов, воспаление и некоторые другие [21, 22].
Мнение об опосредованности генотоксичности наночастиц через окислительный стресс имеет прямые подтверждения. Так, в наноформе вещества, особенно металлы, истощают антиоксидантную защиту организма, вызывают увеличение выхода маркеров ОС, в том числе окислительных повреждений ДНК [34, 38].
В эксперименте зафиксировано резкое повышение уровня Ni в теле Danio rerio на седьмые сутки экспозиции при наличии в среде только NiО-НЧ. Данное обстоятельство, возможно, обусловлено хорошей растворимостью NiО, быстрым переходом ионов никеля с поверхности наночастиц в водную среду и поступлением их в организм рыб. Последующее снижение показателей – результат работы системы гомеостатического регулирования микроэлементов, обеспечивающего постоянство уровня металла в организме. Кроме того, существуют данные, что D. rerio способен адаптироваться к действию наночастиц [29, 42].
Кишечная микрофлора рыб играет важную защитную роль в организме [24], участвуя в пищеварении и в метаболическом регулировании процессов в целом [14]. Качественный анализ микробиоценоза рыб имеет большое значение, поскольку доминирование условно-патогенной и патогенной микрофлоры на фоне ослабления защитных сил макроорганизма может привести к началу эпизоотии [37].
Проведенные метагеномные исследования позволили уточнить полученные классическими методами микробиологии данные по составу микробиоценоза желудочно-кишечного тракта рыб. По различным оценкам классические подходы позволяют культивировать от 3% [31] до 4.8% [19] общей бактериальной популяции кишечника рыб, что не позволяет традиционными методами достаточно полно исследовать разнообразие реально существующей в кишечнике микрофлоры [35].
Нормальная микрофлора кишечника рыб представлена преимущественно грамотрицательными бактериями, в то время как преобладание грамположительной микрофлоры в опыте с наночастицами может указывать на замещение автохтонной микрофлоры аллохтонной, чаще всего обнаруживаемой в воде [3]. Данное наблюдение может свидетельствовать о нарушении равновесия в микробиоценозе кишечника рыб и угнетении защитных механизмов, в норме препятствующих колонизации чужеродной микрофлорой.
В эксперименте выявлено появление класса Fusobacteria – грамотрицательной анаэробной палочки, вызывающей тканевый некроз [11]. Требуется более детальное изучение роли этих микроорганизмов, так как, по данным работы [15], она может быть представителем кишечной микрофлоры рыб в норме. В таком же подходе нуждаются представители бактериопланктона класса Verrucomicrobia [25].
В пищеварительном тракте рыб в норме преобладают роды Escherihia, Klebsiella, Proteus, Serratia, Alcaligines, Eikenella, Bacteroides, Citrobacter freundii, Hafnia alvei и др. [16]. В то же время в эпилимнионе ≤50% видового разнообразия составляют актинобактерии [28], а в гиполимнионе зарегистрирована Verrucomicrobia [26].
Установлено, что внесение наночастиц никеля и оксида никеля влияет на микрофлору кишечника рыб и приводит к замещению собственной микрофлоры транзиторной, в том числе условно-патогенной и патогенной. По-видимому, в стрессовых условиях бактерии слабее закрепляются в кишечнике рыб, что может сопровождаться их элиминацией. Возможно, это происходит из-за сползания слизи, вместе с которой удаляется существующая микрофлора и оставшиеся в кишечном содержимом бактерии (в том числе и патогенные) колонизируют поверхность энтероцитов. Комплексное взаимодействие между хозяином и кишечной микрофлорой позволяет одним штаммам бактерий колонизировать кишечник, в то время как другие перевариваются или вызывают инфекцию. Наночастицы металлов обладают олигодинамическим действием, т.е. даже в малых концентрациях способны оказывать бактерицидное и бактериостатическое действие. Например, наночастицы никеля в концентрации 1 мг/мл за 30 и 60 мин воздействия вызывали почти полную гибель бактерий [8].
Исследование кишечной микрофлоры рыб актуально, т.к. изменения в микробиоценозе кишечника под воздействием нанoчастиц носят негативный характер, приводя к ослаблению роста, высокой подверженности рыб заболеваниям и повышенной смертности. Стрессы различного происхождения, неизбежные при интенсивном культивировании, еще более усугубляют ситуацию [5].
Выводы. Токсический эффект наночастиц у Danio rerio развивается по пути индукции окислительного стресса и качественной реорганизации микробиоценоза кишечника. Низкая дозовая нагрузка и кратковременный контакт тест-объекта с наноформами никеля приводят к активизации системы антиоксидантной защиты организма в ответ на образование свободных радикалов. Хронические условия и высокие дозы истощают антиоксидантную систему организма на фоне гиперпродукции свободных радикалов при ОС. Установлено изменение качественного состава микроорганизмов, в частности замена Citrobacter и Enterobacter на Bacillus и Acinetobacter (при внесении NiО-НЧ) и на Rhodobacter, Mycobacterium и Methylobacterium (при внесении Ni-НЧ), т.е. замещение нормальной микрофлоры желудочно-кишечного тракта транзиторной. Повышение в среде обитания количества никеля в форме наночастиц неизбежно приводит к его кумуляции в теле гидробионтов с выраженностью эффекта при хронических условиях.
Работа выполнена при финансовой поддержке Российского научного фонда, проект № 14-36-00023.
Список литературы
Амосова А.А., Амосов Е.А., Козулина А.С. Экспериментальная оценка тест-системы для исследования острой токсичности различных загрязнителей окружающей среды в лабораторных условиях // Изв. Самар. науч. центра РАН. 2014. № 5(2). С. 1042–1044.
Андронов Е.Е., Пинаев А.Г., Першина Е.В., Чижевская Е.П. Выделение ДНК из образцов почвы (методические указания). СПб.: ГНУ ВНИИСХМ РАСХН, 2011. 27 с.
Бузолева Л.С., Калитина Е.Г., Безвербная И.П., Кривошеева А.М. Микробные сообщества поверхностных прибрежных вод бухты Золотой Рог в условиях высокого антропогенного загрязнения // Океанология. 2008. Т. 48. № 6. С. 882–888.
Бурлакова Е.Б., Храпова Н.Г. Перекисное окисление липидов мембран и природные антиоксиданты // Успехи химии. 1998. Т. 52. № 9. С. 540–558.
Бурлаченко И.В. Актуальные вопросы безопасности комбикормов в аквакультуре. М.: Всерос. НИИ озер. и реч. рыб. хоз-ва, 2008. С. 126–155.
Двоскин Я.Г. Химическая безопасность и основы профилактической токсикологии: Метод. пособие. М., 2003. 51 с.
Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Свободнорадикальные процессы в норме и при заболеваниях сердечно-сосудистой системы // Кардиология. 2000. Т. 40. № 7. С. 48–61.
Мамонова И.А., Бабушкина И.В. Экспериментальное исследование антибактериального действия наночастиц никеля на клинические штаммы Pseudomonas aeruginosa // Биол. науки. 2012. № 2. С. 174–178.
Меньшикова Е.Б., Зенков Н.К., Шергин С.М. Биохимия окислительного стресса. Оксиданты и антиоксиданты. Новосибирск: СО РАМН, 1994. 203 с.
Обущенко С.В., Гнеденко В.В. Мониторинг содержания микроэлементов и тяжелых металлов в почвах Самарской области // Международный журнал прикладных и фундаментальных исследований. 2014. № 7. С. 30–34.
Паршуков А.Н. Микробиоценоз радужной форели в садковых хозяйствах Карелии: Дис. … канд. биол. наук. Петрозаводск, 2011. 182 с.
Стальная И.Д., Гарищвили Т.Г. Методы определения малонового диальдегида с помощью тиобарбитуровой кислоты. Современные методы в биохимии. М.: Медицина, 1977. 392 с.
Ates M., Arslan Z., Demir V. et al. Accumulation and toxicity of CuO and ZnO nanoparticles through waterborne and dietary exposure of goldfish (Carassius auratus) // Environ. Toxicol. 2015. V. 30. № 1. P. 119–128.
Austin B. The bacterial microflora of fish // The Sci. World J. 2002. V. 2. P. 558–572.
Bennett K.W., Eley A. Fusobacteria: new taxonomy and related diseases // J. Med. Microbiol. 1993. V. 39. № 4. P. 246–254.
Cahill M.M. Bacterial flora of fishes: A review // Microb. Ecol. 1990. V. 19. № 1. P. 21–41.
Choi J.E., Kim S., Ahn J.H. et al. Induction of oxidative stress and apoptosis by silver nanoparticles in the liver of adult zebrafish // Aquat. Toxicol. 2010. V. 100. № 2. P. 151–159.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. № 9. P. 2460–2461.
Fidopiastis P.M. Microbial activity in the gut of an herbivorous marine fish // Masters Abstracts International. 1996. V. 34. № 3. 1102 p.
Ganesan S., Anaimalai Thirumurthi N., Raghunath A. et al. Acute and sub-lethal exposure to copper oxide nanoparticles causes oxidative stress and teratogenicity in zebrafish embryos // J. Appl. Toxicol. 2016. V. 36. № 4. P. 554–567.
Govindasamy R., Rahuman A.A. Histopathological studies and oxidative stress of synthesized silver nanoparticles in Mozambique tilapia (Oreochromis mossambicus) // J. Environ. Sci. 2012. V. 24. № 6. P. 1091–1098.
Hao L., Wang Z., Xing B. Effect of sub-acute exposure to TiO2 nanoparticles on oxidative stress and histopathological changes in juvenile carp (Cyprinus carpio) // J. Environ. Sci. 2009. V. 21. № 10. P. 1459–1466.
Huse S.M., Mark Welch D.B., Voorhis A. et al. VAMPS: a website for visualization and analysis of microbial population structures // BMC Bioinformatics. 2014. V. 15. 41 p. doi 10.1186/1471-2105-15-41
Jankauskiene R. Defence mechanisms in fish: Lactobacillus genus bacteria of intestinal wall in feeding and hibernating carps // Ekologija. 2000. V. 1. P. 3–6.
Larsen A.M., Mohammed H.H., Arias C.R. Characterization of the gut microbiota of three commercially valuable warm water fish species // J. Appl. Microbiol. 2014. V. 116. № 6. P. 1396–1404.
Lindström E.S., Vrede K., Leskinen E. Response of a member of the Verrucomicrobia, among the dominating bacteria in a hypolimnion, to increased phosphorus availability // J. Plankton Res. 2004. V. 26. № 2. P. 241–246.
Moore M.N. Do nanoparticles present ecotoxicological risks for the health of the aquatic environment? // Environ. Int. 2006. V. 32. P. 967–976.
Newton R.J. Jones S. E., Eiler A. et al. A guide to the natural history of freshwater lake bacteria // Microbiol. Mol. Biol. Rev. 2011. V. 75. P. 14–49.
OECD, Guideline for Testing of Chemicals, Guideline 203 // Fish, Acute Toxicity Test., Paris: Organization of Economic Cooperation, Development, 1992. 9 p.
Piccinetti C.C., Montis C., Bonini M.et al. Transfer of silica-coated magnetic (Fe3O4) nanoparticles through food: a molecular and morphological study in zebrafish // Zebrafish. 2014. V. 11. № 6. P. 567–579.
Ringo E., Lodemel J.B., Myklebust R. et al. Epithelium-associated bacteria in the gastrointestinal tract of Arctic charr (Salvelinus alpinus L.). An electron microscopical study // J. Appl. Microbiol. 2001. V. 90. P. 294–300.
Shah V., Taratula O., Garbuzenko O.B. et al. Genotoxicity of Different Nanocarriers: Possible Modifications for the Delivery of Nucleic Acids. Current Drug Discovery Technologies. 2013. V. 10. № 1. P. 8–15.
Shahravan A., Desai T., Matsoukas T. Passivation of Aluminum Nanoparticles by Plasma-Enhanced Chemical Vapor Deposition for Energetic Nanomaterials // ACS applied materials & interfaces. 2014. V. 10. № 6. P. 7942–7947.
Shvedova A.A., Pietroiusti A., Fadeel B., Kagan V.E. Mechanisms of carbon nanotube-induced toxicity: focus on oxidative stress // Toxicol. Appl. Pharmacol. 2012. V. 261. № 2. P. 121–133.
Spanggaard B., Jørgensen F., Gram L., Huss H.H. Antibiotic resistance in bacteria isolated from three freshwater fish farms and an unpolluted stream in Denmark // Aquaculture. 1993. V. 115. № 3–4. P. 195–207.
Srikanth K., Mahajan A., Pereira E. et al. Aluminium oxide nanoparticles induced morphological changes, cytotoxicity and oxidative stress in Chinook salmon (CHSE-214) cells // J. Appl. Toxicol. 2015. V. 35. № 10. P. 1133–1140.
Sugita H., Miyajima C., Deguchi Y. The vitamin B12 producing ability of the intestinal microflora of freshwater fish // Aquaculture. 1992. V. 10. P. 267–276.
Trpkovic A., Todorovic-Markovic B., Trajkovic V. Toxicity of pristine versus functionalized fullerenes: mechanisms of cell damage and the role of oxidative stress // Arch. Toxicol. 2012. V. 86. № 12. P. 1809–1827.
Wan R., Mo Y., Feng L., Chien S. et al. DNA damage caused by metal nanoparticles: involvement of oxidative stress and activation of ATM // Chem. Res. in Toxicol. 2012. V. 25. P. 1402–1411.
Yausheva E., Sizova E., Lebedev S. et al. Influence of zinc nanoparticles on survival of worms Eisenia fetida and taxonomic diversity of the gut microflora // Environ. Sci. Pollut. Res. 2016. V. 23. P. 13 245–13 254. doi 10.1007/s11356-016-6474-y
Zhang J., Kobert K., Flouri T., Stamatakis A. PEAR: A fast and accurate Illumina Paired-End reAd mergeR // Bioinformatics. 2014. V. 30. № 5. P. 614–620.
Zhang W., Sun X., Chen L. et al. Toxicological effect of joint cadmium selenium quantum dots and copper ion exposure on zebrafish // Environ. Toxicol. Chem. 2012. V. 31. № 9. P. 2117–2123.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


