Биология внутренних вод, 2019, № 2-1, стр. 93-98
Влияние гербицида Раундап на температурные характеристики мальтазы слизистой оболочки кишечника молоди рыб
А. А. Филиппов 1, И. Л. Голованова 1, *, М. С. Смирнов 2
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Ярославская обл., Некоузский р-н, пос. Борок, Россия
2 Ярославский государственный университет им. П.Г. Демидова
150000 Ярославль, ул. Советская, д. 14, Россия
* E-mail: golovanova5353@mail.ru
Поступила в редакцию 20.10.2017
После доработки 02.11.2017
Принята к публикации 07.12.2017
Аннотация
В экспериментах in vitro исследована активность и температурные характеристики (температурная зависимость, энергия активации Еакт, температурный коэффициент Q10) мальтазы в слизистой оболочке кишечника молоди судака, окуня, плотвы и карпа в присутствии гербицида Раундап в концентрации 25 мкг/л. Сила и направленность эффекта зависят от вида рыб и температуры инкубации. Раундап не влияет на температурный оптимум мальтазы (60°С у окуня и судака, 50°С у плотвы и карпа). Более низкая относительная активность фермента в диапазоне температуры жизнедеятельности (0–30°С) у исследованных видов рыб (исключая окуня) свидетельствует о снижении эффективности гидролиза мальтозы в присутствии Раундапа, а более низкие значения Еакт – об адаптивных изменениях этого показателя.
ВВЕДЕНИЕ
В естественных условиях гидробионты подвергаются действию целого ряда антропогенных факторов, в том числе и химической природы. Гербициды, содержащие глифосат (N-(phosphonomethyl) glycine), широко используются для уничтожения сорняков в сельском хозяйстве, лесоводстве и садоводстве по всему миру [10], что создает риск потенциального загрязнения близлежащих водоемов. В поверхностных водах концентрация глифосата не превышает 10‒15 мкг/л, в районах непосредственного применения гербицида достигает 700 мкг/л [21]. Широкое применение глифосата обусловлено высокой эффективностью действия, хорошей биоразлагаемостью (период полураспада в воде составляет 7‒14 сут, в донных отложениях водоемов ‒ до 120 сут), а также культивированием растений, генетически устойчивых к этому гербициду [10, 16]. Раундап, созданный на основе изопропиламиновой соли глифосата, используется и для борьбы с сорной растительностью на открытых оросительных и сбросных каналах [1], что создает прямую угрозу его воздействия на гидробионтов.
Согласно данным World Health Organization [26] и результатам ряда работ [16, 19, 22, 25], острая токсичность глифосата и Раундапа для животных и человека крайне низка. Однако появляется все больше данных, свидетельствующих о нарушении различных функций у бактерий, микроводорослей, беспозвоночных, низших и высших позвоночных [11, 12, 14, 16, 20, 23]. У рыб, служащих хорошим биоиндикатором состояния водной среды, Раундап изменяет физиолого-биохимический статус организма [5, 12, 24], вызывает мутагенный и генотоксический эффекты [13, 17]. Значения полулетальных концентраций (ЛК50) Раундапа, вызывающие гибель 50% тест-организмов за 96 ч, варьируют от 2 до 55 мг/л, в зависимости от вида рыб, стадии жизненного цикла и условий эксперимента [16].
Поскольку эффективность питания рыб в значительной мере зависит от состояния ферментных систем пищеварительного тракта, необходимо обладать знаниями о воздействии Раундапа на пищеварительные гидролазы. Ранее эффекты Раундапа на активность гликозидаз (ферментов, гидролизующих углеводы) в кишечнике молоди рыб были изучены лишь в диапазоне температур жизнедеятельности [2]. Известно, что различные антропогенные факторы могут изменять не только активность, но и кинетические, а также температурные характеристики гликозидаз кишечника рыб [3, 4]. Влияние глифосатсодержащих гербицидов на температурные характеристики указанных ферментов ранее не исследовали.
Цель работы – изучить температурные характеристики мальтазы слизистой оболочки кишечника молоди рыб при действии гербицида Раундап in vitro.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования – молодь судака Sander lucioperca (L.) массой 3.17 ± 0.11 г (35 экз.), окуня Perca fluviatilis L. массой 1.67 ± 0.20 г (10 экз.), плотвы Rutilus rutilus (L.) массой 0.80 ± 0.06 г (16 экз.), отловленных в прибрежной зоне Рыбинского водохранилища, а также молодь карпа Cyprinus carpio (L.) массой 8.83 ± 1.32 г (6 экз.), выращенного на стационаре полевых и экспериментальных работ Института биологии внутренних вод РАН. Рыб доставляли в лабораторию в течение 1–2 ч после поимки, обездвиживали, помещали на стекло ледяной бани. Кишечник изымали и освобождали его от содержимого (химуса). Слизистую оболочку средней части кишечника снимали пластмассовым скребком и перемешивали. Для получения достаточного количества гомогенатов использовали суммарные пробы от 2–7 экз. одного вида и считали их за одну биологическую повторность (n). При помощи стеклянного гомогенизатора готовили гомогенаты с добавлением охлажденного до 2–4°С раствора Рингера для холоднокровных животных (110 ммоль NaCl, 1.9 ммоль KCl, 1.3 ммоль CaCl2, pH 7.4) в соотношении 1 : 19. Затем их дополнительно разбавляли раствором Рингера в 2 (судак), 8 (окунь) и 20 раз (плотва и карп). Гомогенаты предварительно выдерживали в растворе Раундапа в концентрации 25 мкг/л в соотношении 1 : 1 (в контроль вместо гербицида добавляли равное количество раствора Рингера) в течение 1 ч. Раствор субстрата (мальтоза в концентрации 50 ммоль/л) готовили на таком же растворе Рингера. Инкубацию гомогената и субстрата проводили в течение 20 мин при температуре от 0 до 70°С с интервалом в 10°С, рН 7.4 при непрерывном перемешивании.
Для приготовления растворов токсиканта использовали коммерческий препарат гербицида, имеющий торговое название “Раундап” (произведен и расфасован ЗАО “Август” (Россия) по лицензии фирмы “Монсанто Европа С.А.” (Бельгия)). Средство представляет собой 36%-ный водный раствор глифосата, возможные инертные ингредиенты, усиливающие действие активного элемента или облегчающие проникновение гербицида, в аннотации не указаны.
Для определения активности мальтазы глюкозооксидазным методом применяли набор для клинической биохимии “Фотоглюкоза” (“Импакт”, Россия). Ферментативную активность в каждой точке определяли в пяти повторностях с учетом фона (изначальное количество гексоз в гомогенате) и выражали в микромолях продуктов реакции, образующихся за 1 мин инкубации в расчете на 1 г влажной массы ткани (мкмоль/(г · мин)). Температурный оптимум активности мальтазы определяли в диапазоне температуры инкубации 0–70°С с шагом в 10°С. Значения энергии активации (Еакт) определяли графическим методом Аррениуса, значения Q10 – по общепринятой методике.
Результаты представлены в виде средних и их ошибок (M ± m). Нормальность распределения исследуемых показателей проверяли с помощью теста Шапиро–Уилка. Достоверность различий оценивали с помощью однофакторного анализа (ANOVA, LSD-тест) при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При стандартной температуре 20°С активность мальтазы у плотвы в присутствии Раундапа на 16% выше контроля, у других видов статистически значимые изменения отсутствуют (рис. 1). Определение ферментативной активности в широком диапазоне температуры инкубации (0–70°С) показало, что температурный оптимум мальтазы у судака и окуня равен 60°С, у плотвы и карпа – 50°С (рис. 1). В присутствии Раундапа температурный оптимум не меняется, значительных изменений активности мальтазы в диапазоне температуры жизнедеятельности (0–30°С) у исследованных видов рыб (исключая плотву) также не выявлено. Однако относительная активность мальтазы в присутствии гербицида ниже (у окуня выше), чем в контроле. Так, у судака, плотвы и карпа относительная активность фермента при 0°С находится в диапазоне 7−14%, при 10°С − 16−20%, при 20°С − 23−24%, в присутствии Раундапа − 6−14, 13−18 и 17−21% максимальной активности соответственно. В зоне высоких значений температуры (50–60°С) активность мальтазы у судака и карпа в присутствии Раундапа выше по сравнению с контролем (у плотвы лишь в зоне температурного оптимума), у окуня, напротив, ниже. В зоне постмаксимальных значений температуры (70°С) активность мальтазы у плотвы и карпа в присутствии Раундапа ниже, у судака и окуня выше, чем в контроле. При этом относительная активность мальтазы при температуре 70°С у окуня и судака – 41 и 52%, у плотвы и карпа − 24 и 36% максимальной активности. В присутствии Раундапа у первых двух видов она выше на 48 и 15%, у двух вторых ниже на 21 и 19% соответственно.
Рис. 1.
Активность мальтазы (мкмоль/(г · мин)) слизистой оболочки кишечника судака (а), плотвы (б), окуня (в) и карпа (г) в широком диапазоне температуры инкубации: 1 – концентрация Раундапа 0 мкг/л (контроль), 2 – концентрация Раундапа 25 мкг/л.
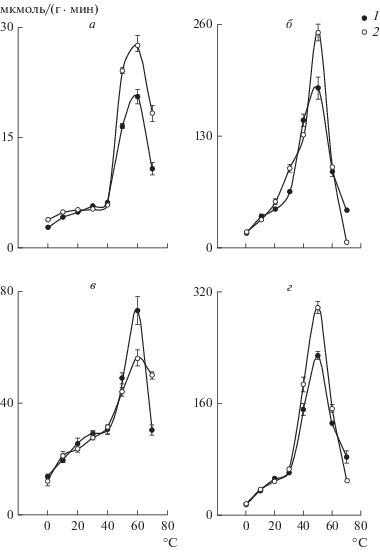
Наиболее высокие значения температурного коэффициента Q10 у всех исследованных видов выявлены в диапазоне температуры 0–10°С (табл. 1). При этом у карпа и плотвы значения показателя в 1.3–1.7 раза выше, чем у окуня и судака. В присутствии Раундапа значения Q10 в диапазоне температуры 0–10°С у всех исследованных видов ниже (у окуня выше) по сравнению с контролем, в диапазоне температуры 0–20°С – лишь у судака и карпа.
Таблица 1.
Значения Q10 мальтазы слизистой оболочки кишечника молоди рыб в присутствии Раундапа in vitro
| Вид рыбы | Диапазон температуры, °С | ||
|---|---|---|---|
| 0–10 | 0–20 | 0–30 | |
| Судак | $\frac{{1.5}}{{1.2}}$ | $\frac{{1.3}}{{1.2}}$ | $\frac{{1.3}}{{1.1}}$ |
| Окунь | $\frac{{1.4}}{{1.7}}$ | $\frac{{1.4}}{{1.4}}$ | $\frac{{1.3}}{{1.3}}$ |
| Плотва | $\frac{{2.0}}{{1.7}}$ | $\frac{{1.6}}{{1.7}}$ | $\frac{{1.5}}{{1.7}}$ |
| Карп | $\frac{{2.4}}{{2.2}}$ | $\frac{{1.8}}{{1.7}}$ | $\frac{{1.6}}{{1.6}}$ |
При исследовании Еакт мальтазы у всех видов отмечен излом на графике Аррениуса: у судака и карпа при 10°С, у окуня – при 20°С, у плотвы – при 10 и 20°С (рис. 2). Значения Еакт мальтазы при низкой температуре у судака и окуня в 1.8–2.5 раза ниже, чем у карпа и плотвы (табл. 2). В присутствии Раундапа значения Еакт в зоне температуры 0–10°С у всех исследованных видов (исключая окуня) ниже, чем в контроле, при этом у окуня перегиб на графике Аррениуса отмечен при температуре 10°С, у плотвы перегибы отсутствуют.
Рис. 2.
График Аррениуса для мальтазы слизистой оболочки кишечника судака (а), плотвы (б), окуня (в) и карпа (г): 1 – концентрация Раундапа 0 мкг/л (контроль), 2 – концентрация Раундапа 25 мкг/л; по оси абсцисс – величина, обратная абсолютной температуре – 1/Т ∙ (105), по оси ординат – lg(V ∙ 105), где V – скорость ферментативной реакции, ммоль/(г ∙ мин).
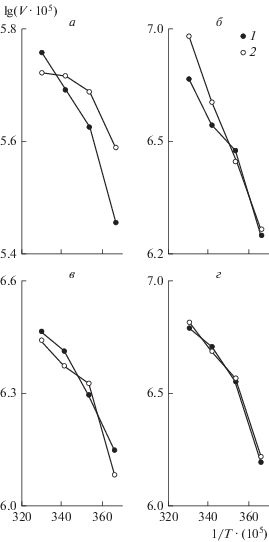
Таблица 2.
Энергия активации мальтазы (ккал/моль) слизистой оболочки кишечника молоди рыб в диапазоне температуры жизнедеятельности (0–30°С) в присутствии Раундапа in vitro
| Вид рыбы | Энергия активации, ккал/моль | Точка перегиба на графике Аррениуса, °С | |
|---|---|---|---|
| до точки перегиба | после точки перегиба | ||
| Судак | $\frac{{6.0}}{{3.3}}$ | $\frac{{2.6}}{{1.2}}$ | $\frac{{10}}{{10}}$ |
| Окунь | $\frac{{4.9}}{{8.0}}$ | $\frac{{1.5}}{{2.4}}$ | $\frac{{20}}{{10}}$ |
| Плотва | $\frac{{10.6/3.4}}{{8.6}}$ | $\frac{{3.4/6.5}}{{8.6}}$ | $\frac{{10/20}}{{{\text{Н е т }}}}$ |
| Карп | $\frac{{13.1}}{{12.2}}$ | $\frac{{4.6}}{{4.9}}$ | $\frac{{10}}{{10}}$ |
ОБСУЖДЕНИЕ РУЗУЛЬТАТОВ
Температурные показатели (температурный оптимум, термостабильность, энергия активации, температурный коэффициент) – важные характеристики ферментов как гомойотермных, так и пойкилотермных животных [8]. Причем ферменты пойкилотермных животных способны функционировать при температуре, близкой к 0°С, когда ферменты теплокровных утрачивают активность [8, 15, 18]. Температурный оптимум одноименных ферментов у рыб обычно сдвинут к более низким температурам по сравнению с теплокровными животными [6, 8]. Относительная активность и величина Eакт ферментов, осуществляющих начальные этапы гидролиза полисахаридов, зависят от биологии вида: у рыб, питающихся в зимний период, относительная активность α-амилазы выше, а Eакт значительно ниже по сравнению с видами, не способными активно питаться при низкой температуре [7, 8, 18].
Температурные характеристики кишечных гликозидаз у рыб могут изменяться при действии некоторых антропогенных факторов [3, 4]. Так, у лещей, выловленных в более загрязненном участке Рыбинского водохранилища (Шекснинский плес), Еакт мальтазы слизистой оболочки кишечника в зоне температуры жизнедеятельности (0–30°С) выше (эффективность гидролиза дисахаридов ниже), чем у особей из более чистого Моложского плеса [4]. При этом у лещей из более чистого района излом на графике Аррениуса отсутствует, из загрязненного − отмечен при 20°С. Относительная активность мальтазы в зоне температуры 0−20°С у рыб Моложского плеса была 24−40%, Шекснинского плеса − лишь 13−27% максимальной, что свидетельствует об ухудшении условий функционирования в зоне антропогенного загрязнения [4].
Изучение влияния повышения температуры воды со скоростью 50°С/ч на амилолитическую активность (отражающую суммарную активность ферментов, гидролизующих крахмал – α-амилазы КФ 3.2.1.1, глюкоамилазы КФ 3.2.1.3 и мальтазы КФ 3.2.1.20) слизистой оболочки кишечника серебряного карася Carassius carassius (L.) выявило смещение температурного оптимума до 30°С по сравнению с 60°С у рыб контрольной группы (без нагрева), отражающее уменьшение термостабильности ферментов при резком повышении температуры среды [3].
В нашей работе впервые показано, что Раундап в концентрации 25 мкг/л, встречающейся в воде и донных отложениях в районах непосредственного применения гербицида [9, 21], может изменять не только активность, но и температурные характеристики мальтазы слизистой оболочки кишечника молоди рыб. Сила и направленность изменений изученных показателей зависят от температуры среды инкубации и вида рыб. Активность мальтазы в присутствии Раундапа в диапазоне температуры жизнедеятельности повышается лишь у плотвы, при более высокой температуре инкубации (50–60°С) – у судака, плотвы и карпа (у окуня снижается). В зоне постмаксимальных значений температуры активность мальтазы у плотвы и карпа в присутствии Раундапа ниже, у судака и окуня выше, чем в контроле, что свидетельствует о разной термоустойчивости фермента в присутствии гербицида. Наибольшее снижение термостабильности мальтазы в присутствии Раундапа отмечено у карпа и плотвы: относительная активность мальтазы при температуре 70°С достигает 17 и 3% максимальной активности соответственно.
Более низкие значения Еакт у молоди окуня и судака по сравнению с плотвой и карпом свидетельствуют о более высокой эффективности гидролиза мальтозы у рыб ихтиофагов, способных питаться при температуре, близкой к 0°С. Эти результаты хорошо согласуются с данными, полученными на взрослых рыбах [18]. В присутствии Раундапа Еакт снижается у судака в диапазоне температуры 0–30°С, у карпа – 0–20°С, у плотвы – 0–10°С, у окуня – 10–20°С, свидетельствуя об адаптивных изменениях этого показателя при действии гербицида. Снижение значений температурного коэффициента Q10, отражающее снижение эффективности гидролиза мальтозы, в присутствии Раундапа отмечено при температуре <10°С у всех исследованных видов, у судака – в диапазоне температуры 0–30°С.
Выводы. В условиях in vitro гербицид Раундап в концентрации 25 мкг/л вызывает разнонаправленные изменения активности и температурных характеристик (Еакт, коэффициента Q10) мальтазы слизистой оболочки кишечника молоди судака, окуня, плотвы и карпа. Сила и направленность эффекта зависят от вида рыб и температуры инкубации. Температурный оптимум мальтазы у исследованных видов рыб в присутствии Раундапа не меняется. Однако относительная активность фермента у исследованных видов рыб (исключая окуня) в диапазоне температур жизнедеятельности в присутствии Раундапа, как правило, ниже, чем в контроле. При низкой температуре значения Еакт и температурного коэффициента Q10 в присутствии Раундапа снижаются у всех видов, исключая окуня. У судака и карпа излом на графике Аррениуса, указывающий на скачкообразное изменение энергии активации, отмечен при температуре 10°С, как в контроле, так и в присутствии Раундапа. У окуня перегиб на графике Аррениуса выявлен при температуре 20°С в контроле и 10°С в присутствии Раундапа, у плотвы – лишь при температуре 10 и 20°С в контроле. Более низкие значения Q10 и относительной активности фермента в диапазоне температуры 0–20°С свидетельствуют о снижении эффективности гидролиза мальтозы, а более низкие значения Еакт – об адаптивных изменениях этого показателя в присутствии Раундапа.
Список литературы
Брежнев В.И. Механизированный способ борьбы с сорной растительностью на открытых мелиоративных каналах гербицидом Раундап: Автореф. дис. … уч. степ. к.т.н. Новочеркасск, 2004. 24 с.
Голованова И.Л., Аминов А.И. Влияние гербицида Раундап на активность гликозидаз молоди рыб и их кормовых объектов при различных значениях температуры и pH // Вестн. Астрахан. гос. тех. ун-та. Серия: Рыб. хоз-во. 2013. № 1. С. 129–134.
Голованова И.Л., Голованов В.К. Пищеварительные гликозидазы рыб в условиях повышения температуры среды (обзор) // Тр. Ин-та биологии внутр. вод РАН. 2015. № 72(75). С. 52–59.
Голованова И.Л., Филиппов А.А. Характеристика гликозидаз кишечника лещей Аbramis brama (L.) из участков Рыбинского водохранилища с различной антропогенной нагрузкой // Тр. Карельск. науч. центра РАН. 2012. № 2. С. 63–69.
Жиденко А.А., Мищенко Т.В., Кривопиша В.В. Реакция карповых рыб на действие глифосата // Наук. зап. Терноп. нац. пед. ун-та. Сер. биол. 2015. Т. 64. № 3–4. С. 227–230.
Кузьмина В.В. Физиолого-биохимические основы экзотрофии рыб. М.: Наука, 2005. 300 с.
Пономарев В.И. Характеристика процессов пищеварения у рыб европейского Cевера: Автореф. дис. … канд. биол. наук. Сыктывкар, 1993. 19 с.
Уголев A.M., Кузьмина В.В. Пищеварительные процессы и адаптации у рыб. СПб.: Гидрометеоиздат, 1993. 238 с.
Aparicio V.C., De Geronimo E., Marino D. et al. Environmental fate of glyphosate and aminomethylphosphonic acid in surface waters and soil of agricultural basins // Chemosphere. 2013. V. 93. № 9. P. 1866–1873.
Benbrook C.M. Trends in glyphosate herbicide use in the United States and globally // Environ. Sci. Eur. 2016. V. 28. № 3. P. 1–15.
Cattaneo R., Clasen B., Loro V.L. et al. Toxicological responses of Cyprinus carpio exposed to a commercial formulation containing glyphosate // Bull. Environ. Contam. Toxicol. 2011. V. 87. № 6. P. 597–602.
Fan J.Y., Geng J.J., Ren H.Q. et al. Herbicide Roundup and its constituents cause oxidative stress and inhibit acetylcholinesterase in liver of Carassius auratus // J. Environ. Sci. and Health. 2013. Part B. V. 48. P. 844−850.
Filho J.D.S., Sousa C.C.N., Da Silva C.C. et al. Mutagenicity and genotoxicity in gill erythrocyte cells of Poecilia reticulata exposed to a glyphosate formulation // Bull. Environ. Contam. Toxicol. 2013. V. 91. P. 583–587.
Gasiner C., Dumont C., Benachour N. et al. Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines // Toxicology. 2009. V. 262. P. 184–191.
Gelman A.G., Kuz’mina V.V., Drabkin V., Gladman M. Temperature adaptations of fish digestive enzymes // Feeding and digestive functions in fishes. Enfield (NF), Jersey; Plymouth: Sci. Publ., 2008. P. 155–226.
Giesy J.P., Dobson S., Solomon K.R. Ecotoxicological risk assessment for Roundup herbicide // Rev. Environ. Contam. Toxicol. 2000. V. 167. P. 35–120.
Kier L.D., Kirkland D.J. Review of genotoxicity studies of glyphosate and glyphosate-based formulations // Crit. Rev. Toxicol. 2013. V. 43. № 4. P. 283–315.
Kuz’mina V.V. Digestion in fish. A new view. Balty: LAP Lambert Acad. Publ., 2017. 310 p.
Le Mer C., Roy R.L., Pellerin J. et al. Effects of chronic exposures to the herbicides atrazine and glyphosate to larvae of the threespine stickleback (Gasterosteus aculeatus) // Ecotoxicol. Environ. Safety. 2013. V. 89. P. 174–181.
Lushchak O.V., Kubrak O.I., Storey J.M. et al. Low toxic herbicide Roundup induces mild oxidative stress in goldfish tissues // Chemosphere. 2009. V. 52. № 7. P. 932–937.
Struger J., Thompson D., Staznik B. et al. Occurrence of Glyphosate in surface waters of southern Ontario // Bull. Environ. Contam. Toxicol. 2008. V. 80. P. 378–384.
Tsui M.T.K., Chu L.M. Environmental fate and non-target impact of glyphosate-based herbicide (Roundup) in a subtropical wetland // Chemosphere. 2008. V. 71. P. 439–446.
Vera M.S., Fiori E.D., Lagomarsino L. et al. Direct and indirect effects of the glyphosate formulation Glifosato Atanor on freshwater microbial communities // Ecotoxicology. 2012. V. 21. № 7. P. 1805–1816.
Webster T.M.U., Santos E.M. Global transcriptomic profiling demonstrates induction of oxidative stress and of compensatory cellular stress responses in brown trout exposed to glyphosate and Roundup // BMC Genomic. 2015. V. 16. № 32. P. 1–14.
Williams G.M., Kroes R., Munro I.C. Safety evaluation and risk assessment of herbicide Roundup and its active ingredient, glyphosate, for humans // Reg. Toxicol. Pharmacol. 2000. V. 31. P. 117–165.
World Health Organization (WHO), Environmental health criteria 159 – Glyphosate. International Programme on Chemical Safety. 1994.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


