Биология внутренних вод, 2019, № 2-1, стр. 87-92
Уровень тиреоидных и половых стероидных гормонов у кумжи Salmo trutta L. в реках Карелии
Д. С. Павлов 1, Е. В. Ганжа 1, Н. Н. Немова 2, Е. Д. Павлов 1, *, А. Е. Веселов 2, М. А. Ручьёв 2
1 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Ленинский проспект, д. 33, Россия
2 Карельский научный центр РАН
185910 Петрозаводск, ул. Пушкинская, д. 11, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 05.09.2018
После доработки 06.10.2018
Принята к публикации 11.10.2018
Аннотация
Выявлена связь уровня тироксина и половых стероидных гормонов в крови кумжи с ее принадлежностью к той или иной реке и с возрастом. Установлено, что концентрация исследованных гормонов в крови молоди и половозрелых самцов кумжи из р. Алатс-оя (бассейн Ладожского озера) значительно ниже, чем в крови рыб из рек Орзега и Шокша (бассейн Онежского озера). Показано, что концентрация тиреоидных гормонов в крови кумжи с возрастом изменяется незначительно. Уровень половых стероидных гормонов, напротив, значительно возрастает к наступлению половой зрелости.
ВВЕДЕНИЕ
Кумжа Salmo trutta L. считается чрезвычайно пластичным видом, что отражается и в разнообразии реализуемых жизненных стратегий, и в соответствующих им экологических формах вида [15]. Гормональная регуляция во многом способствует адаптации кумжи к изменяющимся условиям среды. Известно, что одна из значимых функций тиреоидных гормонов – адаптация особи к условиям обитания [9, 12, 22, 23]. На фоне адаптации рыб к биотопу идет процесс их полового созревания, который регулируется многими факторами, в том числе половыми стероидными гормонами. При благоприятных условиях обитания, сопряженных с быстрым ростом, кумжа может достигать половой зрелости уже в возрасте 1+ и 2+ [14]. К настоящему времени имеющиеся в литературе сведения о гормональном статусе кумжи из разных популяций немногочисленны. Синтез и концентрация гормонов в организме корректируют жизненный цикл особи.
Цель работы – выявить связь уровня тиреоидных и половых стероидных гормонов в крови кумжи с ее обитанием в той или иной реке и возрастом достижения половой зрелости.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал собирали с 24-го по 29-е августа 2015 г. на трех реках, относящихся к бассейнам Онежского (реки Орзега и Шокша) и Ладожского (р. Алатс-оя) озер. Длина р. Орзега 15 км, водосборная площадь 46.1 км2, истоком реки служат болота в районе оз. Орзегское. Река Шокша имеет бóльшую протяженность (23 км) и водосборную площадь 115.0 км2, ее исток – оз. Крюково. Скат проходной формы кумжи в Балтийское море из Онежского озера затруднен из-за зарегулирования стока р. Свирь (плотины двух ГЭС). Река Алатс-оя значительно удалена от рек Орзега и Шокша (~250 км), ее длина 14 км. Исток – оз. Алатунлампи [2]. Река Алатс-оя впадает в р. Янис, которая ниже по течению (район пос. Ляскеля) перекрыта плотиной (рыбоход отсутствует). Плотина блокирует возврат половозрелой проходной формы кумжи на нерест в р. Алатс-оя. Смолтификация молоди происходит во всех трех реках, но половозрелая проходная форма встречается только в реках Орзега и Шокша.
Кумжу разного возраста отлавливали щадящим методом с использованием электролова (Fa-2, Норвегия) – 92 экз. из р. Орзеги, 18 экз. из р. Шокши и 69 экз. из р. Алатс-оя. В период проведения работ в исследованных реках смолты и половозрелые проходные особи не встречались. Были отловлены пестрятки (103 экз.), половозрелые резидентные особи разного возраста (36 экз.), в том числе самцы старшего возраста (≥2+) (10 экз.), а также рано созревающие самцы (23 экз.) и самки (3 экз.) в возрасте 1+ и 2+.
Кровь отбирали при помощи шприца объемом 1 мл3 из хвостовой вены рыб, центрифугировали в течение 5 мин при скорости 5000 об./мин. Полученную плазму переливали в стерильные пробирки и хранили в морозильной камере при –25°С. Методом иммуноферментного анализа с использованием тест-наборов производства фирмы DRG (ФРГ) на приборе Mindray MR 96A (КНР) определяли концентрацию трийодтиронина (Т3), тироксина (Т4), тестостерона (Ts) и эстрадиола-17β (E).
У рыб измеряли длину тела по Смитту (FL) и массу тела, определяли пол (по анатомическому строению половых желез при вскрытии) и принадлежность к той или иной экологической группе: пестрятки (молодь кумжи), рано созревающие рыбы (половозрелые особи с гонадами на поздних стадиях зрелости) и кумжа старшего возраста. К рано созревающей кумже относили рыб по трем критериям: стадия развития половых желез (IV–V), длина тела (самцы FL < 18 см, самки FL < 21 см) и возраст, который определяли по чешуе (самцы 1+ и 2+ , самки 2+).
Статистическую обработку материала выполняли по индивидуальным показателям с использованием дисперсионного, дискриминантного, кластерного анализов, корреляционного анализа Спирмена, а также t-критерия Стьюдента и U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характеристика исследованных рыб. Пестрятки характеризовались окраской серого цвета с оливковым оттенком и с ярко выраженными черными поперечными полосами вдоль тела. Рано созревающая кумжа по окраске не отличалась от пестряток, но половые железы (гонады) таких рыб были более развиты (IV стадия против II–III). Окраска половозрелой кумжи старшего возраста оливковая с темным оттенком на дорсальной стороне тела до светлого на вентральной. По всему телу яркие красные пятна чередовались с небольшими черными пятнами неправильной формы.
Возрастная структура и биологические показатели кумжи. Пестрятки и рано созревающая кумжа часто имеют сходный возраст – 1+ и 2+ (см. табл. 1). Половозрелые самцы старшего возраста (2+–5+) были пойманы только в реках Орзега и Шокша. Рано созревающие самцы из этих же рек, в основном встречались в возрасте 2+. В р. Алатс-оя, напротив, отловлены рано созревающие самцы только младшего возраста (1+). Появление половозрелых самцов у кумжи к возрасту 1+ отмечали и ранее [7, 8, 21]. Раннее половое созревание самок кумжи – достаточно редкое явление, однако в р. Алатс-оя пойманы три половозрелые самки в возрасте 2+. Появление рано созревающих самцов и самок кумжи указывает на благоприятные условия для их питания и роста в р. Алатс-оя. На атлантическом лососе Salmo salar L. показано [13], что рост рыб обратно коррелирует с возрастом достижения ими половой зрелости. На примере нерки Oncorhynchus nerka (Walbaum, 1792) установлено [1], что снижение пищевой конкуренции в популяции приводит к увеличению доли рано созревающих особей. При этом самцы достигают половой зрелости раньше самок, что авторы объясняют бóльшими энергетическими затратами организма на оогенез по сравнению со сперматогенезом.
Таблица 1.
Половая и возрастная структуры, длина и масса тела кумжи из исследованных рек
| Река | Пол, возраст | Длина, см | Масса, г | n, экз. |
|---|---|---|---|---|
| Пестрятки | ||||
| Орзега | ♂, 1+ | $\frac{{10.9 \pm 0.25}}{{10.6--11.1}}$ | $\frac{{13.4 \pm 1.60}}{{11.8--15.0}}$ | 2 |
| ♂, 2+ | $\frac{{14.2 \pm 0.40}}{{11.5--16.3}}$ | $\frac{{32.1 \pm 2.12}}{{18.1--46.8}}$ | 13 | |
| ♀, 1+ | 11.1 | 13.8 | 1 | |
| ♀, 2+ | $\frac{{14.6 \pm 0.25}}{{12.7--18.1}}$ | $\frac{{30.5 \pm 1.70}}{{20.1--60.2}}$ | 27 | |
| Шокша | ♂, 1+ | $\frac{{13.5 \pm 0.75}}{{11.8--15.7}}$ | $\frac{{25.9 \pm 4.91}}{{15.7--42.4}}$ | 5 |
| ♀, 1+ | $\frac{{14.0{\text{ }} \pm {\text{ }}0.41}}{{12.8--16.0}}$ | $\frac{{27.0 \pm 2.99}}{{20.1--42.4}}$ | 7 | |
| ♀, 2+ | 17.3 | 54.8 | 1 | |
| Алатс-оя | ♂, 1+ | $\frac{{13.0 \pm 0.29}}{{10.8--15.3}}$ | $\frac{{23.4 \pm 1.70}}{{13.4--38.9}}$ | 19 |
| ♀, 1+ | $\frac{{12.9 \pm 0.24}}{{9.8--14.8}}$ | $\frac{{23.1 \pm 1.21}}{{9.9--33.5}}$ | 27 | |
| ♀, 2+ | 20.0 | 39.8 | 1 | |
| Рано созревающие особи | ||||
| Орзега | ♂, 2+ | $\frac{{15.3 \pm 0.30}}{{13.9--16.8}}$ | $\frac{{40.4 \pm 2.47}}{{29.3--55.1}}$ | 10 |
| ♂, 3+ | 17.8 | $\frac{{65.5 \pm 1.40}}{{64.1--66.9}}$ | 2 | |
| Шокша | ♂, 2+ | 17.7 | 60 | 1 |
| Алатс-оя | ♂, 1+ | $\frac{{13.5 \pm 0.21}}{{124--14.5}}$ | $\frac{{29.1 \pm 1.67}}{{19.6--37.4}}$ | 10 |
| ♀, 2+ | $\frac{{20.3 \pm 0.33}}{{20.0--21.0}}$ | $\frac{{88.1 \pm 4.30}}{{80.8--95.7}}$ | 3 | |
| Половозрелые самцы старшего возраста | ||||
| Орзега | ♂, 3+ | $\frac{{20.1 \pm 0.30}}{{19.8--20.4}}$ | $\frac{{86.6 \pm 3.25}}{{83.3--89.8}}$ | 2 |
| ♂, 4+ | $\frac{{22.5 \pm 0.55}}{{21.2--23.9}}$ | $\frac{{120.1 \pm 6.86}}{{99.6--128.4}}$ | 4 | |
| Шокша | ♂, 2+ | $\frac{{22.4 \pm 0.85}}{{21.5--23.2}}$ | $\frac{{128.4 \pm 13.00}}{{115.4--141.4}}$ | 2 |
| ♂, 3+ | 24.4 | 161.1 | 1 | |
| ♂, 5+ | 33.2 | 360.0 | 1 | |
Дисперсионный анализ материала, представленного в табл. 1, показал, что длина и масса рыб достоверно (p < 0.001) связаны с их экологической группой, возрастом и принадлежностью особи к той или иной реке.
У молоди кумжи в возрасте 1+ из р. Орзеги длина и масса тела были меньше (p < 0.05 по t-критерию Стьюдента), чем у особей того же возраста из рек Шокши и Алатс-оя (см. табл. 1). Рано созревающие самцы по сравнению с пестрятками из р. Орзеги того же возраста (2+) обладали бóльшей массой и длиной тела, (p < 0.05 по t-критерию Стьюдента). В р. Алатс-оя у рано созревающих самцов в возрасте 1+ также отмечена большая масса тела (p < 0.01) по сравнению с пестрятками. Это согласуется с гипотезой, что рано созревающие особи растут быстрее, чем рыбы с нормальной скоростью гаметогенеза [5, 10, 17, 19].
Уровень тиреоидных и половых стероидных гормонов в крови кумжи. По данным дисперсионного анализа концентрации всех исследованных гормонов в крови коррелировали (р < 0.001) с возрастом особи и ее принадлежностью к той или иной реке. Кроме того, уровень тироксина (T4) и тестостерона (Ts) в крови был связан (р < 0.05 и р < 0.001 соответственно) с принадлежностью кумжи к экологической группе. Концентрация Ts в крови зависела и от пола особи (р < 0.001).
Дискриминантный анализ показал, что половые стероидные гормоны и тироксин характеризуют (р < 0.001 для T4 и Ts; р < 0.01 для E) принадлежность особи к той или иной экологической группе.
По данным корреляционного анализа Спирмена концентрация в крови T3 положительно коррелирует с таковой T4 в организме (ps = 0.65)11, а концентрации T4 и Ts – с концентрацией E в крови (ps = 0.64 и ps = 0.70 соответственно).
Уровень Т3 у самок и самцов пестряток из р. Орзеги достоверно выше, чем у особей той же экологической группы из р. Шокши (р <0.05 здесь и далее по U-критерию Манна–Уитни) (рис. 1а). Концентрация тиреоидных гормонов у пестряток из р. Орзеги выше (р < 0.001 и р < 0.01 для самцов по T3), чем у таковых из р. Алатс-оя (рис. 1а, 1б). У рано созревающих самцов из р. Орзеги по сравнению с особями этой экологической группы из р. Алатс-оя значительно выше (р < 0.001) уровень Т3 и T4 в крови (в ~1.7 и 2.0 раза соответственно). В р. Алатс-оя у пестряток самцов уровень T4 в крови выше (р < 0.05), чем у рано созревающих самцов. Минимальные величины концентраций тиреоидных гормонов в крови зарегистрированы у кумжи из р. Алатс-оя.
Рис. 1.
Уровень трийодтиронина (T3) (а), тироксина (T4) (б) тестостерона (Ts) (в) и эстрадиола-17β (E) (г) в крови кумжи из исследованных рек: I – Орзега, II – Шокша, III – Алатс-оя; 1 – пестрятки ♀, 2 – пестрятки ♂, 3 – половозрелые рыбы старшего возраста , 4 – рано созревающие ♂, 5 – рано созревающие ♀.
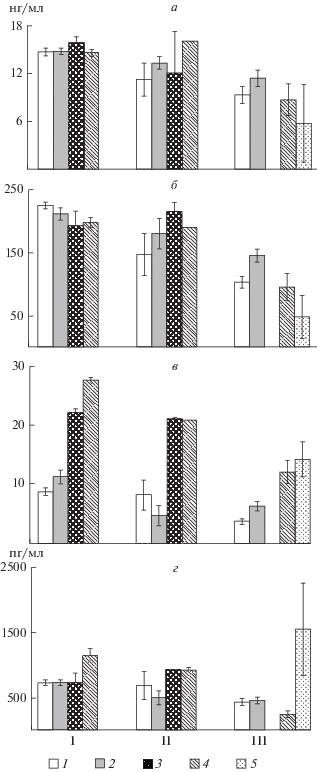
Уровень половых стероидных гормонов у кумжи исследованных рек зависит от степени зрелости их гонад. Пестрятки с гонадами, находящимися на II стадии зрелости, как правило, имеют более низкие концентрации Ts и E, чем половозрелые особи (IV стадия).
Концентрация Тs у самцов пестряток из р. Орзеги выше (р < 0.05), чем у особей этой экологической группы из р. Шокши (рис. 1в). Уровень половых стероидных гормонов у пестряток из р. Орзеги выше (р < 0.001 и р < 0.01 для самцов по Ts), чем у таковых из р. Алатс-оя (рис. 1в, 1г). У рано созревающих самцов из р. Орзега, по сравнению с особями той же экологической группы из р. Алатс-оя, значительно выше (р < 0.001) уровень Тs и E в крови – в ~2.3 и 4.8 раза соответственно. В р. Алатс-оя у пестряток самцов уровень E в крови выше (р < 0.05), чем у рано созревающих самцов из той же реки. Как и для тиреоидных гормонов, минимальные значения концентраций половых стероидных гормонов в крови характерны для кумжи из р. Алатс-оя (за исключением концентрации E у рано созревающих самок).
Кластерный анализ показал, что по концентрациям T3, T4, Ts, E в крови кумжа из р. Алатс-оя максимально (100%) удалена от особей из других двух рек – Орзеги и Шокши (рис. 2а). На уровне 63% (от максимального различия) разделяются рыбы из рек бассейна Онежского озера.
Рис. 2.
Кластерный анализ (метод одиночной связи) содержания T3, T4, Ts, E в крови кумжи по рекам (а), экологическим группам (б), возрасту (в). Остальные обозначения, как на рис. 1 (было поймано всего три карликовые самки, поэтому они (5) не вошли в кластер). По оси ординат – евклидово расстояние, % максимального.
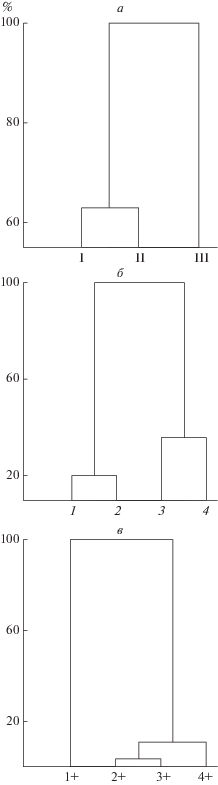
По уровню исследованных гормонов максимально удалены пестрятки (1 – самки, 2 – самцы) и половозрелые особи (старший возраст (3) и рано созревающие самцы (4)) (рис. 2б). Также максимально расходятся рыбы возраста 1+ и особи старшего возраста (рис. 2в).
Полученные результаты свидетельствуют, что у пестряток (самок и самцов) и рано созревающих самцов кумжи из р. Алатс-оя (бассейн оз. Ладожское) по сравнению с особями из рек Орзега и Шокша (бассейн оз. Онежское) зарегистрированы самые низкие значения тиреоидных и половых стероидных гормонов. Похожие результаты [3] получены и по концентрациям ионов Na+ и Cl– в крови у кумжи из тех же рек – у рыб из р. Алатс-оя они были самыми низкими. Различия по содержанию ионов в крови рыб ранее авторы связывали с различным ионным составом воды в реках. С другой стороны, низкие уровни гормонов у рыб сходных экологических групп и возрастов, но обитающих в удаленных несвязанных между собой реках (разные бассейны) могут указывать как на морфологические, так и, возможно, на генетические различия рассматриваемых популяций. Известно, что кумжа, обитающая в одной реке, имеет, как правило, один генотип, но при этом особи из разных популяций могут характеризоваться определенными генетическими различиями [14]. Такое явление связывают с обособленным положением популяций относительно друг друга – отсутствием возможности скрещивания между их представителями. Не исключено, что обнаруженные в исследовании значительные различия в уровне гормонов в крови кумжи из р. Алатс-оя и рыб из рек Орзега и Шокша вызваны изолированностью популяции р. Алатс-оя из-за плотины на р. Янис (невозможности захода из Ладожского озера в реку производителей кумжи проходной формы). Сравнительно низкие концентрации исследованных гормонов у пестряток из р. Алатс-оя, вероятно, обусловлены тем, что определенная их доля уже в возрасте 2+ достигнет половой зрелости. Известно, что рано созревающая кумжа по сравнению с обыкновенными производителями характеризуется более низким уровнем стероидных гормонов [20]. Следовательно, у рано созревающих особей он может быть заблаговременно ниже, чем у пестряток того же возраста. С другой стороны, концентрация тестостерона и эстрадиола-17β в крови у рано созревающих самцов из р. Орзеги заметно выше, чем у производителей из этой же реки, достигающих половой зрелости позднее. Концентрация как половых стероидных [4, 6, 18], так и тиреоидных гормонов [11, 16] во многом определяется условиями обитания. Об этом свидетельствуют и данные проведенного в работе кластерного анализа – рыбы из р. Алатс-оя максимально обособлены по уровню гормонов от особей из двух других рек.
Выводы. Уровень как тиреоидных, так и половых стероидных гормонов в крови кумжи во многом определяется обитанием особей в той или иной реке, а также связан с их возрастом. Наибольшие различия по уровню исследованных гормонов наблюдаются при сравнении популяций кумжи из рек разных бассейнов. В отличие от остальных исследованных гормонов концентрация в крови трийодтиронина не зависит от экологической группы кумжи.
Список литературы
Варнавская Н.В., Варнавский В.С. О биологии карликовой формы нерки озера Дальнего (Камчатка) // Биол. моря. 1988. № 2. С. 16–23.
Государственный водный реестр. http://textual.ru/gvr.
Павлов Е.Д., Павлов Д.С. Cравнение содержания ионов Na, K, Ca и Cl в крови кумжи Salmo trutta из разных рек // Докл. РАН. 2018 . Т. 481. № 3. С. 336–339.
Arantes F.P., Santosa H.B., Rizzo E. et al. Influence of water temperature on induced reproduction by hypophysation, sex steroids concentrations and final oocyte maturation of the “curimatã-pacu” Prochilodus argenteus (Pisces: Prochilodontidae) // Gen. Comp. Endocrinol. 2011. V. 172. № 3. P. 400–408. https://doi.org/10.1016/j.ygcen.2011.04.007
Bohlin T., Dellefors C., Faremo U. Probability of first sexual maturation of male parr in wild sea-run brown trout (Salmo trutta) depends on condition factor 1 yr in advance // Can. J. Fish. and Aquat. Sci. 1994. V. 51. P. 1920–1926. https://doi.org/10.1139/f94-193
Ciereszko R.E., Dabrowski K., Ciereszko A. Effects of temperature and photoperiod on reproduction of female yellow perch Perca flavescens: Plasma concentrations of steroid hormones, spontaneous and induced ovulation, and quality of eggs // J. World Aquacult. Soc. 1997. V. 28. № 4. P. 344–356. https://doi.org/10.1111/j.1749-7345.1997.tb00281.x
Cucherousset J., Ombredane D., Charles K. et al. A continuum of life history tactics in a brown trout (Salmo trutta) population // Can. J. Fish. and Aquat. Sci. 2005. V. 62. № 7. P. 1600–1610. https://doi.org/10.1139/f05-057
Dellefors C., Faremo U. Early sexual maturation in males of wild sea trout, Salmo trutta L., inhibits smoltification // J. Fish Biol. 1988. V. 33. P. 741–749. https://doi.org/10.1111/j.1095-8649.1988.tb05519.x
Dolomatov S.I., Kubyshkin A.V., Kutia S.A., Zukow W. Role of thyroid hormones in fishes // J. Health Sci. 2013. V. 3. № 9. P. 279–296.
Fleming I.A. Reproductive strategies of atlantic salmon: Ecology and evolution // Rev. Fish Biol. Fish. 1996. V. 6. P. 379–416. https://doi.org/10.1007/BF00164323
Hellqvist A., Schmitz M., Mayer I., Borg B. Seasonal changes in expression of LH and FSH in male and female three-spined stickleback, Gasterosteus aculeatus // Gen. Comp. Endocrinol. 2006. V. 145. № 3. P. 263–269. https://doi.org/10.1016/j.ygcen.2005.09.012
Hoar W.S. Endocrine factors in the ecological adaptation of fishes // Comp. Endocrinol. N.Y.: John Wiley and Sons, 1959. P. 1–23.
Hutchings J.A., Jones M.E.B. Life history variation in growth rate thresholds for maturity in atlantic salmon // Can. J. Fish. and Aquat. Sci. 1998. V. 55. № 1. P. 22–47. https://doi.org/10.1139/d98-004
Jonsson B., Jonsson N. Ecology of atlantic salmon and brown trout: habitat as a template for life histories. Dordrecht; Heidelberg; L.; N.Y.: Springer, 2011. V. 33. 680 p. https://doi.org/10.1007/978-94-007-1189-1
Jonsson B., Jonsson N., Brodtkorb E., Ingebrigtsen P.-J. Life-history traits of brown trout vary with the size of small streams // Funct. Ecol. 2001. V.15. № 3. P. 310–317. https://doi.org/10.1046/j.1365-2435.2001.00528.x
Martyniuk C.J., Kroll K.J., Porak W.F. et al. Seasonal relationship between gonadotropin, growth hormone, and estrogen receptor mRNA expression in the pituitary gland of largemouth bass // Gen. Comp. Endocrinol. 2009. V. 163. № 3. P. 306–317. https://doi.org/10.1016/j.ygcen.2009.04.028
Metcalfe N.A. The interaction between behavior and physiology in determining life history patterns in atlantic salmon (Salmo salar) // Can. J. Fish and Aquat. Sci. 1998. V. 55. P. 93–103. https://doi.org/10.1139/d98-005
Miranda L.A., Strüssman C.A., Somoza G.M. Effects of light and temperature conditions on the expression of GnRH and GtH genes and levels of plasma steroids in Odontesthes bonariensis females // Fish Physiol. Biochem. 2009. V. 35. P. 101–108. https://doi.org/10.1007/s10695-008-9232-3
Morgan I.J., Metcalfe N.B. Deferred costs of compensatory growth after autumnal food shortage in juvenile salmon // Proc. Royal Soc. Lond. B-Biol. Sci. 2001. V. 268. P. 295–301. https://doi.org/10.1098/rspb.2000.1365
Olsón K.H., Torbjörn J.J., Mayer I. et al. Spawning behaviour and sex hormone levels in adult and precocious brown trout (Salmo trutta L.) males and the effect of anosmia // Chemoecology. 1998. V. 8. P. 9–17.
Pavlov D.S., Kostin V.V., Nechaev I.V. et al. Hormonal status in different phenotypic forms of black sea trout Salmo trutta labrax // J. Ichthyol. 2010. V. 50. № 11. P. 985–996. https://doi.org/10.1134/S0032945210110032
Peter V.S., Peter M.C. The interruption of thyroid and interrenal and the inter-hormonal interference in fish: does it promote physiologic adaptation or maladaptation? // Gen. Comp. Endocrinol. 2011. V. 174. № 3. P. 249–258. https://doi.org/10.1016/j.ygcen.2011.09.018
Sage M. The evolution of thyroidal function in fishes // Amer. Zool. 1973. V. 13. P. 899–905.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


