Биология внутренних вод, 2020, № 2, стр. 129-136
Копепода Eurytemora caspica (Crustacea, Calanoida) в водохранилищах рек Волги и Камы
Н. М. Сухих a, *, В. И. Лазарева b, В. Р. Алексеев a
a Зоологический институт Российской академии наук
Санкт-Петербург, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: Susikh1@mail.ru
Поступила в редакцию 01.03.2019
После доработки 29.07.2019
Принята к публикации 23.09.2019
Аннотация
В 2013 г. из северной части Каспийского моря описан новый вид Eurytemora caspica Sukhikh et Alekseev, 2013. Тщательный морфологический анализ сборов Eurytemora из бассейна р. Волги первоописателями вида показал, что на протяжении всего исследованного водосбора действительно обитает вид E. caspica, а не E. affinis, как считалось ранее. Сам вид E. affinis не обнаружен. Анализ участка митохондриального гена цитохром оксидазы 1 (СОI) подтвердил видовой статус исследуемых популяций из Каспийского моря и ряда других участков Волжского бассейна. По нашим данным E. caspica широко распространена в бассейне р. Волги от дельты реки на юге до устья р. Камы (55°12′ с.ш.) на севере, а по р. Каме – до середины Камского водохранилища у слияния рек Иньвы и Косьвы (58°52′ с.ш.). В течение летнего периода численность рачка в разных участках Волго-Камского бассейна колебалась от единичных находок до нескольких тыс. экз./м3.
ВВЕДЕНИЕ
До недавнего времени считалось, что Eurytemora affinis (Poppe, 1880) – широко распространенный вид, населяющий пресные и солоноватые воды Европы, Азии и Северной Америки (Боруцкий и др., 1991; Lee, 1999). Его типовое местонахождение – р. Эльба (Германия). Морфологически вид очень изменчив и сложен в определении, сразу после его описания выделен ряд подвидов из европейских водоемов, в том числе Балтийского моря, сформировавших группу “affinis” (E. a. hirundo Giesbrecht, 1881; E. a. hirundoides Nordquist, 1888; E. a. hispida (Nordquist, 1888); Eurytemora а. inermis (Boeck, 1864) и E. a. raboti Richard, 1897) (Boxshall, 2019; Razouls et al., 2005–2019; Sukhikh et al., 2016). Впоследствии три подвида были переописаны как самостоятельные виды – E. raboti (Richard, 1897), E. hirundo (Giesbrecht, 1881) и E. hirundoides (Nordquist, 1888) (Boxshall, 2019; Razouls et al., 2005–2019). Позже на основе детальных морфологических исследований E. hirundo и E. hirundoides сведены в синоним E. affinis (Busch, Brenning, 1992; Castel, Feurtet, 1993; Wilson, 1959).
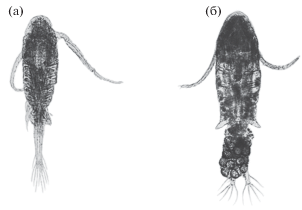
Генетические и морфологические исследования последних лет показали, что в Северной Америке под наименованием E. affinis обитает несколько видов. Один из них E. carolleeae Alekseev et Souissi, 2011 описан из водоемов Атлантического побережья США (Alekseev, Souissi, 2011). Показано (Vasquez et al., 2016), что несколько десятилетий назад именно этот вид вселился в Великие озера, а не каспийская Eurytemora, как считали ранее. Морфологический анализ популяции E. cf. affinis из самого Каспийского моря и сравнение его с другими представителями рода Eurytemora также выявили новый для науки вид, который описан как E. caspica Sukhikh et Alekseev, 2013 (Sukhikh, Alekseev, 2013) (рис. 1). В 2015 г. В.И. Лазаревой впервые установлено, что в водохранилищах Средней и Нижней Волги обитает также вид E. caspica (Лазарева и др., 2018б), который ранее определяли как E. affinis.
Рис. 1.
Внешний вид самца (a) и самки (б) Eurytemora caspica из типового местонахождения в Каспийском море (по: Sukhikh, Alekseev, 2013).
Цель работы – анализ распространения и обилия E. caspica в пределах Волжского бассейна, а также доказательство методами морфологии и молекулярной генетики единства его популяций из Каспийского моря и бассейна р. Волги.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом послужили сборы В.И. Лазаревой летом 2015–2017 гг. по р. Волге от г. Астрахань до верховьев Иваньковского водохранилища вблизи г. Тверь и по р. Каме от ее устья до верховьев Камского водохранилища у г. Березники, а также сборы В.Р. Алексеева в июле 2009 г. из р. Волги у г. Астрахань.
Пробы отбирали преимущественно в пелагиали (>130 станций), в 2017 г. дополнительно обследовали устьевые области крупных притоков. Подробное описание точек отбора проб, общей схемы работ и гидрофизических параметров вод водохранилищ приведено в работе Лазаревой и др. (2018б). Ракообразных учитывали в тотальных сборах зоопланктона сетью Джеди (диаметр входного отверстия 12 см, сито с диагональю ячеи 105 мкм), облавливали весь столб воды от дна до поверхности водоема. Сборы фиксировали 4%-ным формалином и просматривали в лаборатории под стереомикроскопом StereoDiscovery-12 (Carl Zeiss, Jena). Таксономическую идентификацию видов рода Eurytemora проводили с использованием работ Боруцкого и др. (1991) и Сухих и Алексеева (Sukhikh, Alekseev, 2013).
Материал для генетических исследований фиксировали 96%-ным этанолом. В анализе использованы шесть особей E. caspica, собранных в дельте р. Волги – у г. Астрахань (46°23′ с.ш., 48°02′ в.д.), а также в водохранилищах Саратовское – у г. Балаково (52°06′ с.ш., 47°47′ в.д.), Куйбышевское – у сел Ундоры (54°36′ с.ш., 48°26′ в.д.) и Атабаево (55°12′ с.ш., 49°22′ в.д.) и Камское – у г. Добрянка (58°26′ с.ш., 56°24′ в.д.).
Для амплификации участка гена митохондриального гена цитохром оксидазы 1 (COI) размером 542 пн применяли стандартные праймеры COIH 2198 (5′ TAAACTTCAGGGTGACCAAAAAATCA 3′) и COIL 1490 (5′ GGTCAACAAATCATAAAGATATTGG 3′) (Folmer et al., 1994). Использовался следующий температурный профиль полимеразной цепной реакции (ПЦР): начальная денатурация 5 мин при 94°С, следующие пять циклов по схеме 90°C (30 с), 45°C (60 с), 72°C (90 с), затем 27 циклов по схеме 90°C (30 с), 55°C (45 с), 72°C (60 с) и конечная элонгация 5 мин при 72°С (Sukhikh et al., 2016).
Секвенирование проводили в обе стороны на автоматическом секвенаторе ABI 3130 (Applied Biosystems) с применением тех же праймеров, которые использовались для амплификации. Нуклеотидные последовательности выравнивали с помощью программы BioEdit 7.2 (Hall, 1999) по алгоритму Clustal W (Thompson et al., 1994) и редактировали вручную.
Филогенетическую реконструкцию выполняли по алгоритму ближайшего связывания (NJ) с использованием модели Maximum Composite Likelihood в пакете программ: MEGA X (Kumar et al., 2018). В качестве статистического теста применяли метод бутстрепа с использованием 1000 псевдорепликаций.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологический анализ. В пробах из рек Волги и Камы E. affinis не обнаружена. E. caspica отличается от близкородственных видов E. affinis и E. carolleeae по ряду морфологических признаков: форме мандибул, генитального сегмента, сегментации фуркальных щетинок и щетинок плавательных конечностей, а также по вооружению пятой пары ног (Р5) у самцов и самок (рис. 2).
Рис. 2.
Основные различия между видами Eurytemora affinis (Poppe, 1880) (а–д), E. carolleeae (е–к), E. caspica (л–п), E. lacustris (р–т), E. velox (у–х): а, е, л, р, у – генитальный сегмент самки; б, ж, м, с, ф – дистальный сегмент пятой пары ног (P5) и маленький шипик (указан стрелкой); в, з, н, т, х – пятая пара ног (Р5) самца (в овале форма левого базиподита); г, и, о – мандибулы самцов и самок (стрелкой указан разрыв между зубцами); д, к, п – щетинки плавательных ног (стрелкой указана сегментация); a–к, м–о – фото и рисунки Н.М. Сухих (а, в, е, и – по: Alekseev, Souissi, 2011, м, н, о – по: Sukhikh, Alekseev, 2013); л–п – фото В.И. Лазаревой; р–т – по: Kiefer, 1978; у–х – по: Dussart, 1967.

Морфологически каспийский вид занимает промежуточное положение между европейской E. affinis и американской E. carolleeae (ближе к первой), такая картина совпадает с топологией ветвей на филогенетическом дереве (рис. 3). По форме мандибул, генитального сегмента самок и левого базиподита Р5 самцов, отсутствию четкого сегментирования щетинок плавательных ног и каудальных ветвей E. caspica приближается к E. affinis (рис. 2а, 2в–д, 2л, 2н–п). Особи E. caspica сходны с E. carolleeae по оснащению волосками абдоминального сегмента и каудальных ветвей самок, а также по размеру маленького шипика на дистальном членике Р5 самок, который <10% длины ближайшего шипа (рис. 2ж, 2м).
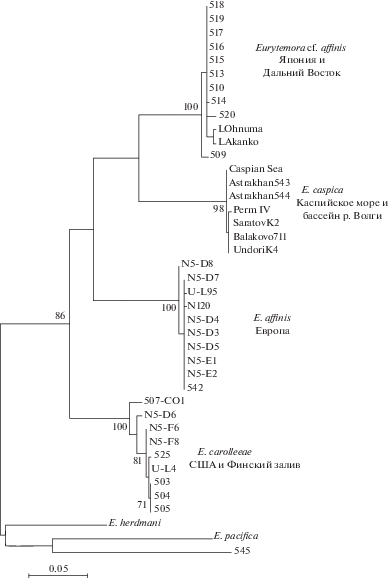
Рис. 3.
Филогенетическое дерево, построенное методом максимального правдоподобия с использованием модели Тамура Неи по данным 41 нуклеотидной последовательности участка гена CO1 видов рода Eurytemora (542 пн): Eurytemora cf. affinis из озер Японии и прибрежья о. Сахалин; E. caspica из северной части Каспийского моря, дельты рек Волги и Камы; E. affinis из эстуариев Европы (реки Эльба, Сена и Шельда, Финский залив); E. carolleeae (атлантическое побережье США, Финский залив). Цифрами даны индексы (в %) бутстрэп-анализа (значения ≤70% не указаны), размерность шкалы – в % нуклеотидных замен. В качестве внешней группы использованы E. herdmani Thompson et Scott, 1897 и E. pacifica Sato, 1913.
Самки E. lacustris отличаются от E. caspica отсутствием боковых выростов на последнем грудном сегменте (рис. 2л, 2р) и расположением внутреннего выроста первого членика экзоподита пятой пары под углом 90° к членику (рис. 2м, 2с). Самцы этих двух видов различаются по количеству члеников экзоподита правой Р5, по форме этого сегмента, а также по форме апикального конца второго членика экзоподита левой Р5 (рис. 2н, 2т).
Самки E. caspica и E. velox различаются по форме и направлению боковых выростов последнего грудного сегмента (рис. 2л, 2у), а также по количеству шипов на наружном крае первого членика экзоподита Р5 (рис. 2м, 2ф). Самцы этих двух видов различимы по количеству члеников экзоподита правой Р5, а также по их форме (рис. 2н, 2х).
Генетический анализ. Анализ участка митохондриального гена цитохром оксидазы 1 (COI) размером 542 пн подтвердил видовой статус популяции E. caspica из Каспийского моря. Уровень различий с E. affinis составил 15%, а с E. carolleeae – 19.7%. Анализ участка гена COI у шести рачков E. caspica из рек Волги и Камы указал на обитание здесь именно этого вида. Все особи из перечисленных точек образовали одну кладу (рис. 3), различия внутри клады составляли 0.002%, что соответствует всего двум нуклеотидным заменам. Все полученные сиквенсы относились к трем гаплотипам. Рачки из Каспийского моря и р. Волги у г. Астрахань образуют первый гаплотип, из Камского водохранилища – второй, из водохранилищ р. Волги – третий. Все полученные последовательности размещены в международной базе данных GenBank под номерами MN271657–MN271660; KC627339; KC627342.
Распространение и некоторые характеристики популяций. В августе 2015–2017 гг. E. caspica была обычным (обнаружена в 30–79% проб) обитателем пелагиали Куйбышевского и Волгоградского водохранилищ, а также незарегулированного участка р. Волги ниже г. Волгоград; в Саратовском водохранилище вид отсутствовал (табл. 1). Вверх по р. Волге E. caspica проникла только до устья р. Камы (55°12′ с.ш.). Летом 2016 г. E. caspica впервые отмечена во всех водохранилищах Камского каскада (Лазарева и др., 2018а, 2018б), самая северная находка в Камском водохранилище – у слияния рек Иньва и Косьва (58°52′ с.ш.). В пелагиали Воткинского и Камского водохранилищ вид встречался фактически повсеместно (>80% проб). Его численность сильно варьировала по акватории исследованных водоемов (табл. 1). Высокие значения (>1 тыс. экз./м3) зарегистрированы в Волго-Камском плесе Куйбышевского водохранилища, средних участках Воткинского и Волгоградского водохранилищ.
Таблица 1.
Встречаемость и обилие Eurytemora caspica в водохранилищах рек Волги и Камы в августе 2015–2017 гг.
| Показатель | Водохранилища | ||||||
|---|---|---|---|---|---|---|---|
| Км | Вт | Нк | К | С | В | НВ | |
| Встречаемость | +++ | +++ | ++ | ++ | – | ++ | ++ |
| Численность, экз./м3 | 120–820 | 5–3050 | 20–180 | 5–5710 | – | 10–1580 | 10–50 |
| Длина*, мм/♀, | 1.1–1.3 | 1.1–1.2 | 1.0–1.2 | 1.0–1.1 | – | 0.9–1.2 | 1.0 |
| ♂ | 1.0–1.1 | 1.0–1.1 | 1.0 | 0.8–0.9 | – | 0.8–1.1 | 0.8–1.0 |
| Число яиц/♀ | 8–20 | 15–30 | 10–20 | 8–25 | – | 7–15 | 13–30 |
| Расстояние от Каспия, км | 2430–2600 | 2165–2420 | 1905–2160 | 1400–1900 | 1060–1390 | 530–1050 | 10–520 |
Примечание. Водохранилища: Км – Камское, Вт – Воткинское, Нк – Нижнекамское, К – Куйбышевское, С – Саратовское, В – Волгоградское, НВ – незарегулированые участки р. Волги ниже плотины Волжской ГЭС. Встречаемость: “+++” – встречается в большинстве проб (>80%), “++” – обычен (30–79% проб), “–” – не обнаружен. * Длина тела от верхнего края головы до основания апикальных щетинок фурки.
В августе 2015–2017 гг. взрослые размножающиеся особи формировали 10–60% численности популяций E. caspica. Линейные размеры половозрелых рачков варьировали от водоема к водоему (табл. 1), наиболее крупные самки и самцы (длина тела ≥1 мм) зарегистрированы в Камском и Воткинском водохранилищах, самые маленькие – в Куйбышевском водохранилище и незарегулированных участках р. Волга. Согласно данным Сухих и Алексеева (Sukhikh, Alekseev, 2013), особи из северного Каспия были тоже маленькими (♀ 0.90–0.98 мм, ♂ 0.88–0.96 мм).
Максимальная индивидуальная плодовитость (в среднем 23 ± 5 яиц в яйцевом мешке) зарегистрирована у сравнительно крупных рачков из р. Камы. У самок в р. Волгe она была наибольшей (15 ± 1) в Куйбышевском водохранилище, в Волгоградском водохранилище снижалась до 11 ± 2. На незарегулированном участке реки ниже г. Волгоград E. caspica фактически не размножалась. Отмечены в основном (70% численности) взрослые самцы и неполовозрелые самки, однако, немногочисленные размножающиеся особи характеризовались высокой плодовитостью (в среднем 21 ± 4 яиц).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что Eurytemora cf. affinis появилась в планктоне Куйбышевского водохранилища в начале 1980-х годов, а с 1984 г. вид уже доминировал среди калянид в первой половине лета (Тимохина, 2000). В 2000-х годах он отмечен как обычный (встречаемость >40%) в Саратовском водохранилище (Попов, 2007). Летом 2015 г. по сборам в Куйбышевском и Саратовском водохранилищах этот вид впервые определен как E. caspica (Лазарева и др., 2018а, 2018б).
Тщательный морфологический анализ особей Eurytemora из рек Волги и Камы первоописателями вида показал повсеместное обитание E. caspica, а не E. affinis, как считали ранее (Бычек, 2008; Popov, 2011; Тимохина, 2000). Морфологическая изменчивость среди исследованных популяций минимальна. Различия среди популяций проявляются только в укрупнении размеров особей обоих полов при продвижении с юга на север от Каспийского моря к Камскому водохранилищу. Имеются данные (Биологические инвазии…, 2004), что линейные размеры видов-вселенцев часто оказываются больше или меньше, чем в нативном местообитании, укрупнение особей ракообразных наблюдают в высококормных условиях при слабом прессе рыб. Также возможно, что мы наблюдаем закономерное укрупнение рачков при расселении их в водоемы с более низкой температурой воды.
С укрупнением размеров тела отмечена и некоторая тенденция к увеличению плодовитости самок. Известно, что плодовитость (масса яиц или отрожденных особей) животных зависит от массы самки (Алимов, 2015), у ракообразных масса яиц и их количество прямо пропорциональны размеру самки, за исключением старых особей, способность к размножению которых невелика (Иванова, 1985; Калинкина, Пименова, 2003; Рубахина, 2000).
Относительно недавнее расселение вида по Волжскому бассейну подтверждается и нашими результатами генетического анализа: на протяжении >3000 км Северного Каспия, рек Волги и Камы встречено всего три гаплотипа, которые отличаются друг от друга парой нуклеотидов. Результаты исследования участка гена COI указывают на единство вида среди всех исследованных популяций, а полученные последовательности ДНК формируют общую кладу на филогенетическом дереве. Различия внутри клады при этом минимальны.
Генетические исследования Eurytemora из Каспийского моря впервые проведены Ли (Lee, 1999) в рамках исследования филогеографии тогда еще единого вида E. affinis для всей Палеарктики. В приведенной работе проанализирован единственный рачок из северной части Каспийского моря. Для него было получено по одной последовательности участков митохондриальных генов 16SrRNA и COI. Последняя ДНК-последовательность также использована в данной работе.
Полученные данные полностью соответствуют этой картине и расширяют ее. Увеличение количества проанализированных ракообразных позволило выделить две клады: дальневосточную и каспийскую. Показано, что каспийская Eurytemora – ближайший родственник видов этого рода на Дальнем Востоке России и в Японии. Различия между кладами составили 13.2% нуклеотидных замен, тогда как таковые с E. carolleeae и E. affinis достигали >15%. Возможно, дальневосточная E. cf. affinis – тоже самостоятельный вид, для описания которого требуется тщательный морфологический анализ.
Область распространения E. caspica, по-видимому, значительно шире, чем удалось установить. Знакомство с рисунками ракообразных черноморского бассейна, любезно предоставленными Л.В. Самчишиной (Институт зоологии им. И.И. Шмальгаузена НАН Украины), позволяет предположить, что E. caspica встречается в Черном и Азовском морях (Самчишина, 2005). Анализ рисунков и фотографий из определителя Calanoida (Crustacea: Copepoda) Казахстана и сопредельных территорий (Крупа и др. 2016) указывает на то, что исследуемый вид, вероятно, обитает и на территории Казахстана, по крайней мере, в Северо-Восточном Каспии.
Из других видов рода вместе с E. caspica в Куйбышевском, Камском и Воткинском водохранилищах в небольших количествах (<500 экз./м3) отмечена E. velox (Lilljeborg, 1853) (Лазарева и др., 2018а, 2018б). Для Куйбышевского и Саратовского водохранилищ указана еще E. lacustris (Poppe, 1887) (Бычек, 2008; Попов, 2007; Тимохина, 2000; Popov, 2011). Также этот вид отмечен В.Р. Алексеевым в 1978 г. в летних пробах из временных водоемов, связанных с дельтой р. Волги. Однако летом 2015–2017 гг. E. lacustris в реках Волге и Каме не обнаружена (Лазарева и др., 2018а, 2018б). С учетом связи волжского и балтийского бассейнов через Волго-Балтийский канал можно ожидать проникновения в р. Волгу балтийской E. affinis и американского вселенца E. carolleeae. Для идентификации самок и самцов пяти видов Eurytemora (E. lacustris, E. affinis, E. caspica, E. velox и E. carolleeae), обсуждаемых в настоящей работе, приведен определительный ключ.
Ключ для определения видов рода Eurytemora по самкам
1. Последний грудной сегмент без боковых выростов. Внутренний вырост первого членика экзоподита пятой пары расположен под углом 90° к членику.…………………………………….…… E. lacustris
– Последний сегмент тела с крупными боковыми выростами ……….…………………..……………………… 2
2. Боковые выросты последнего грудного сегмента направлены назад, почти параллельно брюшку. Наружный край первого членика экзоподита пятой пары с одним шипом .......…………….E. velox
– Боковые выросты последнего грудного сегмента широко расставлены в стороны. Наружный край первого членика экзоподита пятой пары с двумя шипами ……………………………………………... 3
3. Маленький шипик на пятой паре ног значительно длиннее ширины ближайшего латерального шипа и составляет примерно 15–30% его длины …………………....................…………… E. affinis
– Маленький шипик на пятой паре ног составляет ~10% или меньше длины ближайшего латерального шипа. Длина маленького шипика меньше ширины ближайшего латерального шипа в месте его прикрепления….…………………………..…………….....4
4. Мандибулы с более или менее равномерно расположенными зубцами, наружный зубец не отставлен или незначительно отставлен от остального ряда зубцов. Щетинки каудальных ветвей и плавательных конечностей без четких сегментоподобных разделений. Генитальный сегмент без выростов или с незначительными выростами……............……………………….. E. caspica
– Мандибулы с наружным зубцом, хорошо отделенным от остального ряда зубцов разрывом. Щетинки каудальных ветвей и плавательных конечностей с четкими сегментоподобными разделениями. Генитальный сегмент с боковыми выростами в верхней части…................… E. carolleeae
Ключ для определения видов рода Eurytemora по самцам
1. Экзоподит правой ноги пятой пары состоит из трех члеников……………………..................… E. velox
– Экзоподит правой ноги пятой пары состоит из двух члеников………….…………………………………… 2
2. Второй членик экзоподита левой ноги дистально лопатообразно расширен, апикальный конец без явной выемки, разделяющей его на 2 лопасти ........…… ………………….........................……............ E. lacustris
– Второй членик экзоподита левой ноги с апикальным концом, разделенным глубокой выемкой на две лопасти. ………………………………………. 3
3. Базиподит левой ноги пятой пары прямоугольной формы..………................……………. E. carolleeae
– Базиподит левой ноги пятой пары треугольной формы……………………………...................…………… 4
4. Второй членик экзоподита правой ноги пятой пары дистально сужен, в проксимальной части вздут, отношение максимальной ширины к минимальной ширине сегмента >4. Передняя поверхность последнего сегмента абдомена и каудальных ветвей покрыта мелкими шипиками (иногда их только несколько)……………… E. affinis
– Второй членик экзоподита правой ноги пятой пары незначительно сужен дистально, соотношение максимальной ширины к минимальной ширине сегмента <3.5………......................... E. caspica
Выводы. Таким образом, в 2015–2017 гг. в водохранилищах рек Волга и Кама обнаружены два вида рода Eurytemora: E. velox и E. caspica, ни в одной из проанализированных проб не найдена E. affinis. Южной границей ареала вида E. caspica, по-видимому, служит Северный Каспий, откуда был описан этот вид. Северная граница распространения E. caspica проходит по средней части Камского водохранилища, в р. Волге этот вид не отмечен выше устья р. Камы. Анализ литературных данных позволяет предполагать, что ареал E. caspica охватывает также бассейны Черного и Азовского морей.
Список литературы
Алимов А.Ф. 2015. Некоторые закономерности плодовитости у животных // Успехи современной биологии. Т. 135. № 3. С. 227.
Биологические инвазии в водных и наземных экосистемах. 2004. Москва: Товарищество науч. изданий КМК.
Боруцкий Е.С., Степанова Л.А., Кос М.С. 1991. Определитель Calanoida пресных вод СССР. Ленинград: Наука.
Бычек Е.А. 2008. Новые виды Polyphemoidea для волжских водохранилищ // Российский журнал биологических инвазий. № 1. С. 2.
Иванова М.Б. 1985. Продукция планктонных ракообразных в пресных водах. Ленинград: Зоол. ин-т АН СССР. 222 с.
Калинкина Н.М., Пименова И.В. 2003. Выращивание лабораторных культур ветвистоусых рачков Daphnia magna Straus и Simocephalus serrulatus Koch // Водная среда Карелии: исследования, использование и охрана. Петрозаводск: Изд-во Карельск. науч. центра РАН. С. 103.
Крупа Е.Г., Доброхотова О.В., Стуге Т.С. 2016. Фауна Calanoida (Crustacea: Copepoda) Казахстана и сопредельных территорий. Алматы: Etalon Print.
Лазарева В.И., Сабитова Р.З., Быкова С.В. и др. 2018а. Распределение летнего зоопланктона в каскаде водохранилищ Волги и Камы // Тр. Ин-та биол. внутр. вод РАН. Вып. 83(86). С. 62.
Лазарева В.И., Сабитова Р.З., Соколова Е.А. 2018б. Особенности структуры и распределения позднелетнего (август) зоопланктона в водохранилищах Волги // Тр. Ин-та биол. внутр. вод РАН. Вып. 82(85). С. 28.
Попов А.И. 2007. Некоторые данные по видовому составу и структуре зоопланктона Саратовского водохранилища // Известия Самарского научного центра РАН. Т. 9. № 4. С. 1013.
Рубахина С.Г. 2000. Особенности биологии массовых видов амфипод на литорали Белого моря: Автореф. дис. … канд. биол. наук. Петрозаводск: Петрозаводский гос. ун-т.
Самчишина Л.В. 2005. Эколого-фаунистические и морфологические аспекты исследования пресноводных и солоновато-водных Calanoida (Crustacea, Copepoda) Украины: Дис. … канд. биол. наук НАН Украины. Киев: Ин-т зоологии им. И.И. Шмальгаузена.
Тимохина А.Ф. 2000. Зоопланктон как компонент экосистемы Куйбышевского водохранилища. Тольятти: Ин-т экологии волжского бассейна РАН.
Alekseev V.R., Souissi A. 2011. A new species within the Eurytemora affinis complex (Copepoda: Calanoida) from the Atlantic Coast of USA, with observations on eight morphologically different European populations // Zootaxa. V. 2767. P. 41.
Boxshall G. 2019. Eurytemora affinis (Poppe, 1880) // World of Copepods database; http://www.marinespecies.org (Accessed 13 February 2019).
Busch A., Brenning U. 1992. Studies on the status of Eurytemora affinis (Poppe, 1880) (Copepoda, Calanoida) // Crustaceana. V. 62. P. 13.
Castel J., Feurtet A. 1993. Morphological variations in the estuarine copepod Eurytemora affinis as a response to environmental factors // Proceedings of the twenty-seventh European marine biology symposium. Dublin, Ireland, P. 179.
Dussart B. 1967. Les Copepodes dese aux continentalesd’ Europe occidentale, Tome 1: Calanoides et Harpacticoides. Paris: BoubLe et Cie.
Folmer O., Black M., Hoeh W. et al. 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. V. 3. P. 294.
Hall T.A. 1999. Bioedit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucleic Acids Res. V. 41. P. 95.
Kiefer F. 1978. Freilebende Copepoda. Das Zooplankton der Binnengewässer. Stuttgart: Schweizerbart.
Kumar S., Stecher G., Li M. et al. 2018. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Molecular Biology Evolution. V. 35. P. 1547.
Lee C.E. 1999. Rapid and repeated invasions of fresh water by the copepod Eurytemora affinis // Evolution. V. 53. P. 1423.
Nordquist O. 1888. Die Calaniden Finlands // Bidrag till kannedom af Finlands Natur och Folk. V. 47. P. 46.
Popov A.I. 2011. Alien species of zooplankton in Saratov Reservoir (Russia, Volga River) // Rus. J. Biol. Invasions. V. 2. Issue 2–3. P. 126.
Razouls C., de Bovée F., Kouwenberg J., Desreumaux N. 2005–2019. Diversité et répartition géographique chez les Copépodes planctoniques marins. Sorbonne Université, CNRS$ http://copepods.obs-banyuls.fr.
Sukhikh N.M., Alekseev V.R. 2013. Eurytemora caspica sp. nov. from the Caspian Sea – one more new species within the E. affinis complex (Copepoda: Calanoida, Temoridae) // Proceedings of the Zoological Institute RAS. V. 317. № 1. P. 85.
Sukhikh N.M., Souissi A., Souissi S. et al. 2016. Genetic and morphological heterogeneity among populations of Eurytemora affinis (Crustacea: Copepoda: Temoridae) in European waters // C.R. Biol. V. 339. P. 197.
Thompson J.D., Higgins D.J., Gibson T.J. 1994. CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice // Nucleic Acids Res. V. 22. P. 4673.
Vasquez A.A., Hudson P.L., Fujimoto M. et al. 2016. Eurytemora carolleeae in the Laurentian Great Lakes revealed by phylogenetic and morphological analysis // J. Great. Lakes Res. V. 42. № 4. P. 802.
Wilson M.S. 1959. Calanoida // Freshwater Biol. New York: John Wiley and Sons. P. 738.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


