Биология внутренних вод, 2020, № 4, стр. 382-391
Влияние умеренного гиперосмотического стресса на ультраструктуру и показатели энергетического метаболизма Chlorella vulgaris (Chlorophyta)
А. Ю. Алябьев a, И. Н. Андреева a, *, А. А. Пономарева a, В. В. Сальников a, М. А. Суслов a
a Казанский институт биохимии и биофизики Федерального исследовательского центра
“Казанский научный центр Российской академии наук”
Казань, Россия
* E-mail: andreyeva@kibb.knc.ru
Поступила в редакцию 14.06.2018
После доработки 06.02.2019
Принята к публикации 10.12.2019
Аннотация
Проведено сравнение ответной реакции пресноводной водоросли Chlorella vulgaris Beijer. на количественно одинаковое изменение тоничности ростовой среды, вызванное внесением осмотиков различной природы (NaCl и сахароза). При увеличении осмотичности ростовой среды (вне зависимости от природы осмотика) первоначально наблюдалось усиление термогенеза и снижение поглощения кислорода культурой хлореллы. В дальнейшем отмечена качественно различная реакция хлореллы на действие экви-осмотичных концентраций NaCl и сахарозы. При повышенном солевом фоне теплопродукция и фотосинтетическая активность, по сравнению с контролем, были снижены, а интенсивность дыхания была близка к контролю, тогда как в присутствие сахарозы культура имела более высокий уровень термогенеза, дыхания и фотосинтеза. Хлористый натрий не вызывал значимых изменений в ультраструктуре хлореллы и не приводил к достоверным изменениям диффузионного затухания намагниченности воды. При действии сахарозы выявлено изменение формы клеток, указывающее на циторриз. Величина среднего эффективного коэффициента диффузии воды (по данным ЯМР) снижалась, что также свидетельствует об уменьшении размеров клеток. Сахароза действовала на хлореллу как непроникающее осмотически активное вещество. Для пресноводной микроводоросли хлореллы токсическое действие NaCl в условиях умеренного солевого стресса, по-видимому, представляет меньшую угрозу, чем частичное обезвоживание, вызываемое сахарозой.
ВВЕДЕНИЕ
Одноклеточная зеленая водоросль Chlorella vulgaris Beijer. широко распространена в природе и представляет собой важный элемент экосистемы пресных водоемов. Будучи полноценным растительным организмом, она может служить моделью для изучения жизнедеятельности отдельной растительной клетки, в том числе приспособительных (адаптивных) возможностей при изменении условий обитания. Хлорелла представляет собой удобный объект как для исследования фундаментальных проблем, так и для решения задач прикладного характера, в частности, экологического контроля состояния пресных водоемов, разработки пищевых добавок и получения биотоплива третьего поколения (Camuel et al., 2017; Chen et al., 2015). В настоящее время хлореллу, наряду с другими микроводорослями, рассматривают в качестве ресурса для пополнения кормовой базы животноводства, для промышленного производства, белков, аминокислот, витаминов, липидов и других физиологически активных соединений (Макарова и др., 2009; Almeida et al., 2017; Skjanes et al., 2013).
Осмотические процессы имеют большое значение во взаимоотношении растений с окружающей средой, а также для отдельных клеток многоклеточного организма, для которых таковой будет внутренняя среда организма. Но, безусловно, основная роль осмотических процессов состоит в поддержании жизнедеятельности одноклеточных водорослей, обитающих в постоянно изменяющихся условиях окружающей водной среды.
Высокое содержание NaCl в окружающей среде неблагоприятно влияет на растение, причем организм испытывает при этом действие как высокого осмотического давления среды, так и токсичности соли (Веселов и др., 2007; Пронина, 2000). В условиях гиперосмотического солевого стресса проникновение в клетку ионов натрия позволяет ей удерживать воду. Позже, по мере накопления осмопротекторов, уравновешивающих осмотичность внутри- и внеклеточной среды, клетка выводит натрий против градиента концентрации (Балнокин, 1993).
Известно, что сахароза действует на клетки растений не только как осмотик, но и является продуктом их собственного метаболизма, энергетическим субстратом дыхательного метаболизма, а также может накапливаться клетками в качестве осмопротектора. Однако действие на растительную клетку экзогенной сахарозы неоднозначно. С одной стороны, в клетке существует механизм трансмембранного переноса сахарозы (Bush, 1993; Sauer, 2007), что позволяет потреблять экзогенную сахарозу через глюкозу, образующуюся после гидролиза сахарозы, связанными с клеточной стенкой инвертазами (Weschke et al., 2003). С другой стороны, сахарозу традиционно используют в экспериментах как непроникающее осмотически активное вещество для создания дефицита влаги (Грязнов, Сиротина, 2000; Полевой и др., 2001). Предполагается также, что сахароза способна выполнять сигнальную функцию (Rolland, 2002).
В ответ на любое внешнее воздействие в клетке включается каскад ранних неспецифических процессов, которые служат основой для главных механизмов адаптации (Колупаев, Карпец, 2012), что определяет особый интерес к изучению реакции организма в начальный период воздействия стрессового фактора. Дальнейшее развитие событий зависит от интенсивности воздействия и адаптивных возможностей организма (Шакирова, 2001; Яковец, 2009).
Цель работы – провести сравнительный анализ влияния, одинакового по силе, но разного по природе гиперосмотического стресса (не выходящего за пределы адаптационных возможностей организма), на ультраструктуру клеток и показатели, характеризующие энергетический метаболизм Chlorella vulgaris.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служила Chlorella vulgaris Beijer. (Chlorophyta) из Коллекции института ботаники (Санкт-Петербург). Культуру хлореллы выращивали в жидкой среде Тамийя (Tamiya et al., 1953) при рН 7, T = 28°С и при постоянной продувке воздухом. Интенсивность освещения была 155 мкмоль фотонов/(м2 с) в режиме 12/12 ч. Рост культуры оценивали по оптической плотности при 540 нм на фотоколориметре КФК-2МП (Россия).
Осмотический стресс создавали добавлением в культуральную среду NaCl (х.ч., “Экрос”) до конечной концентрации 0.1–0.3 М и сахарозы (х.ч., “Реахим”) до конечной концентрации 0.1–0.6 М.
Клетки хлореллы фиксировали по описанной ранее методике (Loseva et al., 2007) и просматривали на электронном микроскопе JEM-1200EX (Jeol, Япония). Анализ изменений ультраструктуры клеток проводили на основании трех аналитических повторностей, просматривали 150–200 клеток хлореллы. Размер клеток анализировали с помощью программ Image J и Microsoft Excel 7, рассчитывали среднее значение и ошибку среднего. Достоверность различий данных оценивали, используя t-критерий Стьюдента (р < 0.05).
Влияние гиперосмотического стресса на транспорт воды у хлореллы контролировали диффузионным методом ЯМР по величине среднего эффективного коэффициента диффузии воды в биомассе хлореллы; использовали технику спин-эхо с импульсным градиентом магнитного поля (Анисимов, Раткович, 1992). Измерения проводили на ядерно-магнитном релаксометре на частоте протонного резонанса 19.1 МГц с использованием цифрового приемопередающего комплекса “Spin-Track” (Resonance Systems Ltd., Йошкар-Ола) с накоплением сигналов намагниченности и фазовым циклированием. В экспериментах использовали трехимпульсную последовательность стимулированного эхо (Tanner, 1970). Схема эксперимента заключалась в регистрации диффузионных затуханий намагниченности воды от образца (биомассы хлореллы), представляющих зависимость относительной амплитуды сигнала спин-эхо (фактор R) от длительности и амплитуды импульсов градиента магнитного поля, и времени между градиентными импульсами td (время диффузии) (Анисимов и др., 2004). Dэф определяли по наклону начального участка диффузионного затухания экстраполируемого экспонентой (Valiullin, Skirda, 2001).
Теплопродукцию (термогенез) хлореллы определяли методом прямой микрокалориметрии (Wadso, 1994) на микрокалориметре LKB Bio Activity Monitor BAM (Thermometric AB Jarfalla, Швеция).
Интенсивность дыхания и фотосинтеза хлореллы оценивали по поглощению/выделению кислорода полярографическим методом с помощью электрода Кларка (Зеленский, 1986).
Статистическую обработку результатов проводили с использованием программы OriginPro 7 (р = 0.05; 0.01) На графиках представлены средние значения из пяти и более экспериментов с указанием среднего квадратичного отклонения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В условиях проведенных нами экспериментов сахароза не обеспечивала поддержание гетеротрофного роста хлореллы (рис. 1а), что позволило рассматривать ее по отношению к хлорелле только как осмотически активное вещество.
Рис. 1.
Влияние условий культивирования на рост хлореллы: а – влияние состава среды и освещенности на гетеротрофный рост хлореллы (по оси ординат – оптическая плотность культуры Е540 нм; по оси абсцисс – время эксперимента); б – влияние осмотичности ростовой среды на суточный прирост культуры хлореллы (по оси ординат – % исходной плотности культуры). 1 – контроль (среда Тамийя, при освещении), 2 – среда Тамийя, без освещения, 3 – среда Тамийя с глюкозой (10 г/л), без освещения, 4 – среда Тамийя с сахарозой (10 г/л), без освещения.
** Достоверные отличия от контроля при р < 0.05.
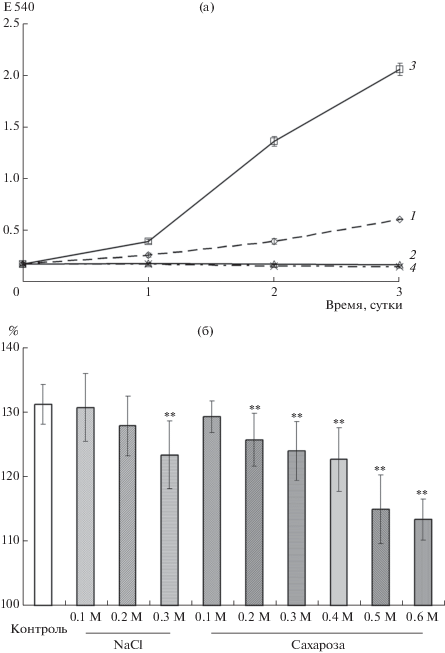
Присутствие в ростовой среде NaCl оказывало влияние на рост хлореллы в зависимости от концентрации соли (Alyabyev et al., 2007). Повышение осмотичности среды после внесения и NaCl, и сахарозы приводило к снижению суточного прироста хлореллы, которое имело концентрационную зависимость. Причем, как фактор осмотичности, сахароза оказывала бо́льшее воздействие на суточный прирост культуры, чем NaCl (рис. 1б). Присутствие в ростовой среде NaCl в концентрации 0.1 и 0.2 М не влияло на рост культуры, тогда как экви-осмотичные концентрации сахарозы (0.2 и 0.4 М) вызывали достоверное снижение суточного прироста.
Далее сравнивали действие NaCl в концентрации 0.2 М (находящейся, согласно ранее полученным нами данным (Alyabyev et al., 2007), в пределах адаптационных возможностей культуры) и сахарозы в экви-осмотичной концентрации 0.4 М.
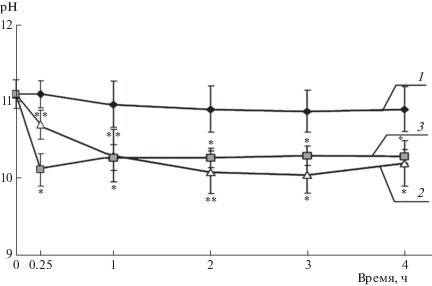
Внесение исследуемых осмотиков приводило к снижению рН культуральной жидкости (рис. 2) и на протяжении всего времени наблюдения (4 ч) рН в опытных вариантах оставалась ниже, чем в контроле.
Рис. 2.
Влияние осмотиков на рН культуральной среды хлореллы. 1 – контроль, 2 – 0.2 М NaCl, 3 – 0.4 М сахароза.
* Достоверные отличия от контроля при р < 0.01.
** р < 0.05.
На рис. 3 представлены электронно-микроскопические фотографии, иллюстрирующие реакцию хлореллы на гиперосмотический стресс. Клетки хлореллы, выращенные на стандартной жидкой среде Тамийя, были округлой формы размером 3–5 мкм. Оболочка клеток плотно прилегала к плазматической мембране. Основной объем клетки занимал хроматофор с периноидом. Ламеллы в хроматофоре располагались параллельными рядами плотно друг к другу, между ними находились крахмальные зерна. Хроматофор часто огибал ядро, в котором выделена зона ядрышка. По периферии клетки располагались мелкие митохондрии. В цитоплазме присутствовали многочисленные метаболические вакуоли, содержимое которых могло быть неоднородным (рис. 3, контроль 1–4 ч). В течение инкубации хлореллы в контрольной среде средний размеры клеток (диаметр) не изменялся и составлял от 3.36 ± 0.54 мкм (1 ч) до 3.39 ± 0.34 мкм (4 ч).
Рис. 3.
Изменения ультраструктуры клеток хлореллы в условиях гиперосмотического стресса при действии 0.4 М сахарозы и 0.2 М NaCl в течение 1‒4 ч. кз – крахмальные зерна, кс – клеточная стенка, мв – метаболические вакуоли, п – пиреноид, хр – хроматофор, я – ядро. Масштаб – 1 мкм.
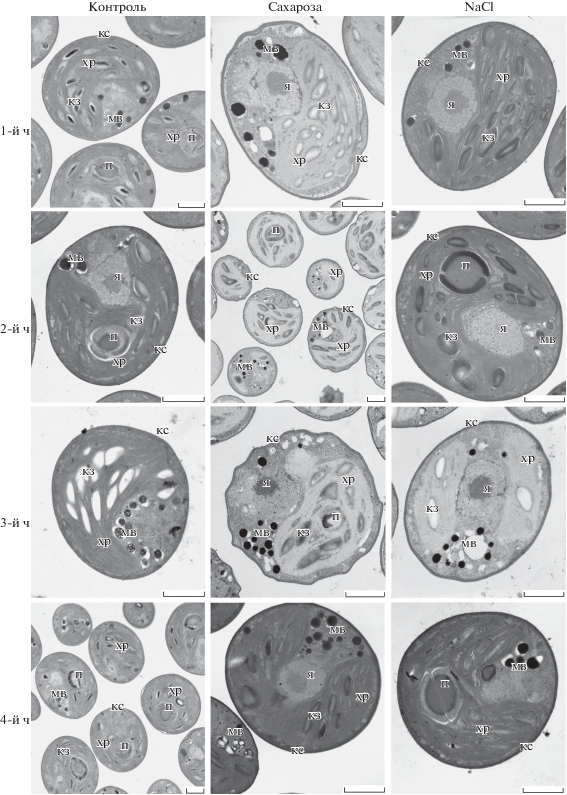
При гиперосмотическом стрессе, вызванном внесением в растущую культуру водоросли сахарозы, наблюдалось изменение формы клетки, указывающее на циторриз. Контур индивидуальных клеток становился неровным (рис. 3, сахароза 1–3-й ч), что было следствием уменьшения объема (сжатие) протопласта из-за оттока воды и соответствующего искривления клеточной стенки. Ко 2-му ч происходили изменения в ультраструктуре хроматофора: наблюдали его “разрыхление” из-за увеличения межламеллярного расстояния. Сам хроматофор был более светлым по сравнению с таковым в контроле за счет снижения контрастности его мембран (рис. 3, сахароза 2–3-й ч). К 4-му ч большинство клеток вновь приобретали округлую форму с ровным контуром (рис. 3, 4-й ч), что свидетельствовало об уравновешивании осмотичности внутри- и внеклеточной среды. При этом, однако, наблюдалось достоверное (p <0.05) изменение размера клеток. Средний размер клеток при длительной инкубации в среде Тамийя был 3.4 ± 0.34 мкм, в присутствии сахарозы – 3.08 ± 0.56 мкм.
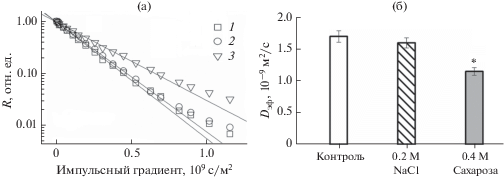
Рис. 4.
Влияние осмотиков на диффузионные параметры водного переноса в биомассе хлореллы. а – диффузионное затухание намагниченности воды (R) в биомассе хлореллы после действия осмотика (по оси абсцисс величина импульсного градиента магнитного поля); б – средний эффективный коэффициент диффузии воды (Dэф) в биомассе хлореллы.
* Достоверные различия при р < 0.05.
Повышение осмотичности среды культивирования при внесении NaCl не вызывало значительных морфологических изменений клеток хлореллы (рис. 3, NaCl 1–4-й ч).
Влияние гиперосмотического стресса на транспорт воды у хлореллы контролировали диффузионным методом ЯМР по величине Dэф. При действии сахарозы в концентрации 0.4 М к 4-му ч этот показатель уменьшался в 1.5 раза относительно контроля, в то время как действие NaCl не приводило к достоверным изменениям Dэф (рис. 4). В плотном осадке хлореллы основной вклад в сигнал намагниченности дают молекулы внутриклеточной воды, диффузионное движение которых при скорости диффузии 80 м/с ограничено размерами клеток. Таким образом, снижение Dэф в варианте опыта с сахарозой также свидетельствует об уменьшении размеров клеток, очевидно, из-за выхода воды из клеток во внешний раствор осмотика.
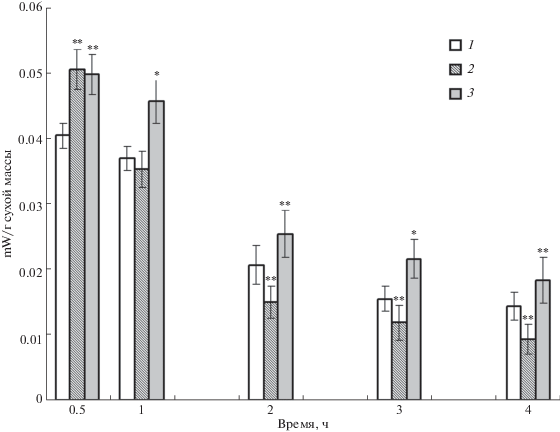
Изменение осмотичности ростовой среды затрагивало основные энергопродуцирующие процессы хлореллы – дыхание и фотосинтез (рис. 5). Внесение в растущую культуру хлореллы и NaCl, и сахарозы в первые 10–20 мин вызывало снижение поглощения ею кислорода (рис. 5а). Затем в течение 1 ч дыхание хлореллы восстанавливалось. При действии NaCl в течение последующих 3 ч интенсивность поглощения кислорода была близка к контролю, а в варианте с сахарозой повышалась на 20–30% (рис. 5а).
Рис. 5.
Влияние гиперосмотического стресса на энергопродуцирующие процессы хлореллы. а – интенсивность поглощения кислорода (дыхание); б – интенсивность выделения кислорода (фотосинтез). 1 – контроль, 2 – 0.2 М NaCl, 3 – 0.4 М сахароза. * – достоверные различия с контролем при р < 0.01, ** – при р < 0.05.
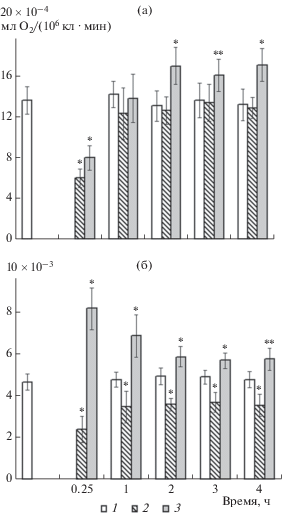
Фотосинтетическая активность хлореллы при действии гиперосматического стресса проявляла качественно различную реакцию (рис. 5б). Первичная реакция хлореллы на внесение NaCl проявлялась в уменьшении на ~50% выделения кислорода, тогда как на сахарозу культура отвечала столь же существенным увеличением интенсивности фотосинтеза. В дальнейшем разница между контрольным и опытными вариантами количественно уменьшалась, но качественно оставалась той же. При действии NaCl выделение кислорода было снижено в течение всех четырех часов инкубации на 20–35%, при добавлении сахарозы – превышало контроль на 10–20% (рис. 5б).
Повышение тоничности среды оказывало влияние и на интегральный показатель уровня клеточного метаболизма – термогенез. Первичная реакция хлореллы на внесение осмотиков проявлялась в увеличении теплопродукции в первые 35–45 мин (рис. 6). В дальнейшем наблюдалась качественно различная реакция хлореллы на действие экви-осмотичных концентраций NaCl и сахарозы – при повышенном солевом фоне отмечалось снижение термогенеза по сравнению с контролем, тогда как в присутствии сахарозы культура сохраняла более высокий уровень теплопродукции (рис. 6).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Chlorella vulgaris способна расти автотрофно, осуществляя классический фотосинтез, и гетеротрофно на среде, содержащей экзогенный источник углерода и энергии, в частности, глюкозу (Авилов, 1963; Андреева, 1975). В условиях проведенных нами экспериментов сахароза, в отличие от глюкозы, не обеспечивала поддержание гетеротрофного роста исследуемой культуры хлореллы, что позволило рассматривать ее как осмотический фактор среды.
Повышение осмотичности окружающей среды в тканях многоклеточных растений вызывает плазмолиз – полный или частичный отход протопласта от клеточной стенки, сжимающегося из-за выхода воды. В случае свободноживущих одноклеточных растительных организмов, имеющих, подобно хлорелле, клеточную стенку, картина плазмолиза может быть различной. Поскольку клеточная стенка не фиксирована снаружи, возможен как классический вариант с отхождением от клеточной стенки уменьшившегося в объеме протопласта (плазмолиз), так и сжатие всего объема клетки, включая клеточную стенку (циторриз) (Алехина и др., 2005). Наблюдаемое в первые часы действия сахарозы изменение формы клеток хлореллы отражает процесс циторриза за счет оттока воды из клеток и полностью согласуется с данными ЯМР-диффузии и подтверждает предположение, что, в отличие от ионного осмотика NaCl, сахароза действует на хлореллу как непроникающее осмотически активное вещество. Последующее восстановление формы клеток свидетельствует об уравновешивании осмотичности внутри- и внеклеточной среды, что согласуется с динамикой процесса адаптации к осмотическому стрессу. По данным работы Балнокина (1993), в этот период достигается максимум накопления клеткой осмолитов, уравновешивающих осмотичность внутриклеточного содержимого с осмотичностью окружающей среды. Таким образом, NaCl в концентрации 0.2 М не вызывал видимых морфологических изменений в клетках хлореллы и не оказывал влияния на обводненность клеток, тогда как 0.4 М сахароза не проникала в клетки хлореллы, а приводила к оттоку воды, циторризу и изменению ультраструктуры клеток.
Засоление неблагоприятно влияет на многие основные процессы жизнедеятельности растений (Kebeish et al., 2014). В условиях проведенных нами экспериментов NaCl ингибирует фотосинтетическую активность и дыхание хлореллы уже с первых минут воздействия, не вызывая явных изменений в динамике диффузионных параметров водного переноса и ультраструктуре клеток. При засолении растение испытывает влияние как высокого осмотического давления среды, так и токсичности солей. Однако осмотический фактор имеет большое значение при очень сильном засолении. При меньшей степени засоления, когда сохраняется возможность поглощения воды, неблагоприятное действие солей определяется их токсичностью (Пронина, 2000). При повышении тоничности среды вследствие внесения NaCl, растение начинает поглощать Na+ и Cl– для поддержания падающего осмотического потенциала. Увеличение концентрации этих ионов в цитоплазме нарушает клеточный метаболизм из-за возникающего ионного дисбаланса и токсичности ионов натрия (Палладина, 1999; Пронина, 2000). Процесс фотосинтеза особенно чувствителен к солевому стрессу, поскольку изолированные хлоропласты даже галофильных организмов обладают невысокой устойчивостью к NaCl (Балнокин и др., 1979). Длительное (в течение всех 4 ч инкубации) сохранение пониженной фотосинтетической активности может быть следствием затруднения вывода Na+ из клеток хлореллы в условия эксперимента: выведение ионов натрия из растительной клетки осуществляется универсальным Na+/H+-антипортером, функционирующим в мембранах как растительных, так и животных клеток; этот процесс блокируется сочетанием высокой солености и щелочной рН внеклеточной среды (Попова и др., 2000).
В отличие от солевого, сахарозный стресс после кратковременного первичного падения потребления кислорода в дальнейшем повышал уровень дыхания и фотосинтеза изучаемой культуры. Наблюдаемое в эксперименте стимулирование фотосинтетического выделения кислорода могло быть следствием закисления ростовой среды при внесении сахарозы в растущую культуру хлореллы, так как ранее нами было показано временное стимулирующее действие снижения рН на фотосинтез микроводорослей (Alyabyev et al., 2011).
Гиперосмотический стресс, вызванный внесением в ростовую среду сахарозы, нарушает водообмен клеток с окружающей средой; хлорелла оказывается в условиях относительного водного дефицита. Следует отметить, что наблюдающаяся в наших экспериментах реакция культуры хлореллы на эту своеобразную “засуху” сходна с таковой высших растений, у которых при неглубокой и/или непродолжительной “засухе” интенсивность фотосинтеза также несколько возрастает (Жолкевич и др., 1989). Отмеченное в наших экспериментах усиление дыхательного обмена и термогенеза хлореллы при сахарозном стрессе может быть следствием общей интенсификации метаболизма, определяемой условиями молекулярного краудинга в клетке, усилением эффекта “исключенного объема” (Чеботарева, 2007), вызванного в данном случае как обезвоживанием протопласта, так и накоплением осмопротектора. Изучение несубстратного действия сахарозы представляет несомненный интерес как один из возможных аспектов влияния на растения водного дефицита.
Проведенное нами ранее (Alyabyev et al., 2007) исследование действия NaCl на культуру клеток хлореллы, показало, что внесение в ростовую среду NaCl в концентрации >0.4–0.5 М существенно снижало термогенез и угнетало рост культуры (вплоть до полного прекращения). Тогда как при длительном культивировании (до 5 сут) на среде, содержащей 0.05–0.2 М NaCl, наблюдалось некоторое увеличение прироста культуры и усиление ее теплопродукции. Анализ полученных ранее результатов (Alyabyev et al., 2007), а также сравнение реакции хлореллы на действие экви-осмотичных концентраций хлористого натрия и сахарозы, позволил рассматривать усиление термогенеза в качестве первичной адаптивной реакции хлореллы на гиперосмотический стресс в условиях, не выходящих за пределы адаптивных возможностей организма. Можно также заключить, что первоначальное увеличение теплопродукции хлореллы на фоне сниженного дыхания в ответ на действие стрессора следует рассматривать как показатель начавшегося адаптационного процесса.
Выводы. Изучение ответной реакции растущей культуры Chlorella vulgaris на увеличение осмотичности ростовой среды в начальный период воздействия (до 4 ч) показало, что при адаптации хлореллы к сахарозному стрессу, в отличие от солевого, происходят характерные изменения в ультраструктуре клеток, связанные с процессом циторриза, и общая интенсификация энергетического метаболизма. Усиление дыхания, фотосинтеза и повышенный термогенез водоросли, отмеченные в условиях сахарозного стресса, указывают на более высокую, по сравнению с условиями солевого стресса, энергетическую “цену адаптации” хлореллы к нарушению водного обмена. Рассматривая суточный прирост культуры и динамику изменения ультраструктуры клеток, как интегральные показатели адаптации хлореллы к изменению окружающей среды, следует отметить более выраженное ингибиторное действие сахарозы по сравнению с NaCl, взятых в экви-осмотичных концентрациях. По-видимому, для Chlorella vulgaris токсическое действие NaCl в условиях умеренного солевого стресса представляет меньшую проблему, чем частичное обезвоживание, вызываемое в условиях эксперимента сахарозой.
Список литературы
Авилов И.А. 1963. Использование различных источников углерода водорослями рода Chlorella в темноте // Вестник Ленинградского государственного университета. Сер. биол. Т. 15. № 3. С. 62.
Алехина Н.Д., Балнокин Ю.В., Гавриленко В.Ф. и др. 2005. Физиология растений. Москва: Издательский центр “Академия”.
Андреева В.М. 1975. Род Chlorella. Ленинград: Наука.
Анисимов А.В., Раткович С. 1992. Транспорт воды в растениях. Исследование импульсным методом ЯМР. Москва: Наука.
Анисимов А.В., Ионенко И.Ф., Романов А.В. 2004. Метод спин-эхо ЯМР в исследованиях трансляционной диффузии воды селективно по апопласту, цитоплазматическому и вакуолярному симпласту растений // Биофизика. Т. 49. № 5. С. 891.
Балнокин Ю.В. 1993. Ионный гомеостаз и осморегуляция у галотолерантных микроводорослей // Физиол. раст. Т. 40. № 4. С. 567.
Балнокин Ю.В., Строгонов Б.П., Кукаева Е.А., Медведев А.В. 1979. Защитная функция клеток Dunaliella при высоких концентрациях NaCl в среде // Физиол. раст. Т. 26 № 3. С. 552.
Веселов Д.С., Маркова И.В., Кудоярова Г.Р. 2007. Реакция растений на засоление и формирование солеустойчивости // Усп. совр. биол. Т. 127. № 5. С. 482.
Грязнов В.П., Сиротина Л.В. 2000. Практикум по физиологии растений. Белгород: Белгородский гос. ун-т.
Жолкевич В.Н., Гусев Н.А., Капля А.В. и др. 1989. Водный обмен растений. Москва: Наука.
Зеленский М.И. 1986. Полярографическое определение кислорода в исследовании фотосинтеза и дыхания. Ленинград: Наука.
Колупаев Ю.Е., Карпец Ю.В. 2012. Ранние реакции растений на действие стрессоров: повреждение, сигналинг, защита? // Вiсник Харькiвського нацiонального аграрного университету. Серiя бiологiя. Вып. 2. № 26. С. 6.
Макарова Е.И., Отурина И.П., Сидякин А.И. 2009. Прикладные аспекты применения микроводорослей – обитателей водных экосистем // Экосистем, их оптимиз. охр. Вып. 20. С. 120.
Палладина Т.А. 1999. Роль протонных насосов плазмалеммы и тонопласта в устойчивости растений к солевому стрессу // Усп. совр. биол. Т. 119. № 5. С. 451.
Полевой В.В., Чиркова Т.В., Лутова Л.А. 2001. Практикум по росту и устойчивости растений. Санкт-Петербург: Изд-во Санкт-Петербург. ун-та.
Попова Л.Г., Шумкова Г.А., Андреев И.М., Балнокин Ю.В. 2000. Na+-зависимая электрогенная АТФаза плазматической мембраны галотолерантной микроводоросли Dunaliella maritimа // Докл. РАН. Т. 375. № 4. С. 544.
Пронина Н.Б. 2000. Экологические стрессы. Москва: Изд-во МСХА.
Чеботарева Н.А. 2007. Влияние молекулярного краудинга на ферменты гликогенолиза // Усп. биол. хим. Т. 47. С. 233.
Шакирова Ф.М. 2001. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем.
Яковец О.Я. 2009. Фитофизиология стресса. Минск: Белорус. гос. ун-т.
Almeida H.N., Calixto G.Q., Chagas B.M.E. et al. 2017. Characterization and pyrolysis of Chlorella vulgaris and Arthrospira platensis: potential of bio-oil and chemical production by Py-GC/MS analysis // Environ. Sci. Pollut. Res Int. Apr 17. https://doi.org/10.1007/s11356-017-9009-2
Alyabyev A.Ju., Loseva N.L., Gordon L.Kh. et al. 2007. The effect of changes in salinity on the energy yielding processes of Chlorella vulgaris and Dunaliella maritima cells // Thermochimica Acta. V. 458. P. 65.
Alyabyev A., Andreyeva I., Rachimova G. 2011. Influence of pH shift and salting on the energetics of microalgae Chlorella vulgaris and Dunaliella maritima // J. Therm. Anal. Calorim. V. 104. P. 201.
Bush D.R. 1993. Proton-coupled sugar and amino acid transporters in plants // Annu. Rev. Physiol. Plant Mol. Biol. V. 44. P. 513.
Camuel A., Guieysse B., Alcántara C., Béchet Q. 2017. Fast algal eco-toxicity assessment: Influence of light intensity and exposure time on Chlorella vulgaris inhibition by atrazine and DCMU // Ecotoxicol. Environ. Safety. V. 140. P. 141.
Chen W.H., Lin B.J., Huang M.Y., Chang J.S. 2015. Thermochemical conversion of microalgal biomass into biofuels: a review // Bioresour Technol. V. 184. P. 314.
Kebeish R., El-Ayouty Y., Hussein A. 2014. Effect of salinity on biochemical traits and photosynthesis-related gene transcription in Chlorella vulgaris // Egypt. J. Bot. V. 54. № 2. P. 281.
Loseva N.L., Alyabyev A.Ju., Gordon L.K. 2007. The effect of AgNO3 on the bioenergetic processes and the ultrastructure of Chlorella and Dunaliella cells exposed to different saline conditions // Thermochimica Acta. V. 458. P. 71.
Rolland F., Moore B., Sheen J. 2002. Sugar sensing and signaling in plants // Plant Cell. V. 14. P. 185.
Sauer N. 2007. Molecular physiology of higher plant sucrose transporters // FEBS Lett. V. 581. № 12. P. 2309.
Skjanes K., Rebours C., Lindblad P. 2013. Potential for green microalgae to produce hydrogen, pharmaceuticals and other high value products in a combined process // Crit. Rev. Biotechnol. V. 33. № 2. P. 172.
Tamiya H., Ywamura T., Shibata K. et al. 1953. Correlation between photosynthesis and light-dependent metabolism in the growth of Chlorella // Biochim. Biophys. Acta. № 1. P. 25.
Tanner J.E. 1970. Use of the stimulated echo in NMR diffusion studies // J. Chem. Phys. V. 52. P. 2523.
Valiullin R., Skirda V. 2001. Time dependent self-diffusion coefficient of molecules in porous media // J. Chem. Phys. V. 114. № 1. P. 452.
Wadso I. 1994. Microcalorimetry of aqueous and biological systems // Experimental thermodinamics. Solution calorimetry. IV. London: Blackwell Sci. Publ. P. 267.
Weschke W., Panitz R., Gubatz S. et al. 2003. The role of invertases and hexose transporters in controlling sugar ratios in maternal and filial tissues of barley caryopses during early development // Plant J. V. 33. P. 395.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод