Биология внутренних вод, 2020, № 4, стр. 315-324
Планктонное сообщество крупного эвтрофного водохранилища в период аномально высокой температуры воды
А. И. Копылов a, *, В. И. Лазарева a, Н. М. Минеева a, Е. А. Заботкина a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: kopylov@ibiw.ru
Поступила в редакцию 10.01.2018
После доработки 27.11.2018
Принята к публикации 23.05.2019
Аннотация
В эвтрофном Чебоксарском водохранилище повышение температуры воды летом 2010 г. до аномально высокой для Средней Волги 27–29°С привело к значительному росту (в 2–14 раз) биомассы отдельных компонентов планктона (фитопланктона, бактериопланктона, простейших, зоопланктона) и сообщества в целом. Общая биомасса планктона достигала рекордной величины 3 г C/м3 для глубоководных водоемов Верхней и Средней Волги. На бо́льшей части акватории водохранилища наблюдалось “цветение” воды цианобактериями. Выявлены различия структуры планктонного сообщества, соотношения продукции фитопланктона и бактериопланктона между речным и озеровидным участками водохранилища. Одновременно на разных участках водохранилища наблюдались автотрофная (в речном участке) и гетеротрофная (в нижней озеровидной части) стадии развития планктонного сообщества. Функционирование планктонного сообщества при температуре воды, превышающей обычный летний прогрев почти на 9°C, привело к ухудшению качества воды водохранилища.
ВВЕДЕНИЕ
С начала XXI в. в большом количестве работ приведен анализ влияния изменения климата на состояние пресноводных экосистем (Mooij et al., 2005; O’Neil et al., 2012; Paerll, Huisman, 2009; Sipkay et al., 2009; The Impact…, 2010). Вызванные потеплением изменения в экосистемах озер и водохранилищ выражаются в трансформации циклов биогенных элементов (C, N, P), увеличении растворенного в воде органического вещества, снижении прозрачности и содержания кислорода в гиполимнионе, а также усилении биоинвазий и росте интенсивности процессов эвтрофирования в неглубоких ди- или полимиктических водоемах умеренного пояса (Adrian et al., 2009; Schindler, 2009).
В водохранилищах р. Волги с 1976 г. отмечена устойчивая тенденция к повышению средней за май–октябрь температуры воды (Законнова, Литвинов, 2016). В 2001−2012 гг. в Верхней и Средней Волге выявлен существенный рост биомассы и продукции фитопланктона, в том числе – цианобактерий, преобладание летнего максимума развития фитопланктона над весенним, изменения в структуре и динамике планктонного сообщества (Корнева и др., 2012; Лазарева и др., 2012).
В современный период часто происходят аномальные климатические явления, высокую вероятность таковых прогнозируют в ближайшем будущем (Второй…, 2014). Одним из них было очень жаркое лето 2010 г., когда на территории европейской России в течение 40 сут сохранялась солнечная погода при аномально высокой (превышение нормы +3.6°С) температуре воздуха (Доклад…, 2011). В результате температура воды в Чебоксарском водохранилище во второй половине июля превышала таковую при обычном термическом режиме, в среднем на 8.7°C (Лазарева и др., 2012). Повышение температуры воды вызвало значительное увеличение численности и биомассы фито-, зоо- и бактериопланктона (Копылов и др., 2012; Лазарева и др., 2012). Однако анализа структуры и функционирования всего планктонного сообщества после воздействия аномально высокой температуры воды не проводили.
Цель работы – оценить общую биомассу планктонного сообщества и вклад основных компонентов в ее формирование; выявить особенности пространственного распределения по акватории Чебоксарского водохранилища структурно-функциональных характеристик планктонного сообщества в период аномально высокой температуры воды.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эвтрофное Чебоксарское водохранилище расположено внутри волжского каскада, его относят к очень крупным (длина 340 км, наибольшая ширина 10 км, площадь 1080 км2) неглубоким (средняя глубина 4.2 м) водоемам с высоким коэффициентом условного водообмена (19.8 год−1) (Эдельштейн, 1998). Пробы планктона собирали в комплексной экспедиции Института биологии внутренних вод РАН 25–28 июля 2010 г. на 19 станциях водохранилища (рис. 1).
Рис. 1.
Карта-схема расположения станций в Чебоксарском водохранилище. 1 – р. Ока выше устья, 2 – устье р. Оки, 3 – ниже г. Городец, 4 – ниже г. Нижний Новгород*, 5 – ниже г. Нижний Новгород**, 6 – у г. Кстово*, 7 – у г. Кстово**, 8 – ниже с. Безводное*, 9 − ниже с. Безводное**, 10 – выше устья р. Керженец, 11 – у с. Лысково*, 12 – у с. Лысково**, 13 – устье р. Сура, 14 – у г. Васильсурск*, 15 – у г. Васильсурск**, 16 – устье р. Ветлуга, 17 – у г. Козьмодемьянск, 18 – y с. Ильинка, 19 – ниже г. Чебоксары; * – у левого берега, ** − у правого берега. Cтрелками указано направление течения р. Волги.
Количество вирусов, бактерий, гетеротрофных нанофлагеллят и детритных частиц учитывали методами эпифлуоресцентной микроскопии (Caron, 1983; Noble, Fuhrman, 1998; Porter, Feig, 1980) в интегрированных образцах воды, которые получали смешиванием проб, отобранных послойно с интервалом 1 м от поверхности до дна. Сразу после отбора материал фиксировали глутаральдегидом до конечной концентрации 2% и хранили в темноте при температуре 4°С. Удельную скорость роста бактерий определяли методом разбавления (Landry, Hassett, 1982), продукцию бактериопланктона – как произведение удельной скорости роста и биомассы. Содержание углерода в одной вирусной частице принимали равным 10–10 мкг С (Gonzalez, Suttle, 1993). Содержание органического углерода в сырой биомассе бактерий рассчитывали по уравнению, связывающему объем клетки и содержание углерода в клетке бактерии (Norland, 1993).
Bph, выраженную в единицах углерода, оценивали по содержанию Хл a (Reynolds, 2006): Bph = = 25 ∙ Хл a. Содержание Хл a определяли стандартным спектрофотометрическим методом (Jeffrey, Humphrey, 1975) в пробах воды, отобранных метровым пластиковым батометром Элгморка тотально от поверхности до дна.
Первичную продукцию фитопланктона анализировали радиоуглеродным методом (Романенко, Кузнецов, 1974). Скорость фотосинтеза измеряли в интегрированных (от поверхности до глубины утроенной прозрачности по диску Секки) и поверхностных (0.5 м) пробах воды. Интегральную (под м2) первичную продукцию (∑Pph, мг С/(м2 сут)) рассчитывали по формуле (Романенко, Кузнецов, 1974):
где Pph – суточная величина фотосинтеза в интегрированной пробе воды, мг С/(м3 сут); 0.7 – коэффициент, характеризующий влияние ослабления света с глубиной на фотосинтез; L – величина утроенной прозрачности, м.Пробы зоопланктона (Rotifera, Cladocera, Copepoda) собирали с борта экспедиционного судна тотально от дна до поверхности воды малой сетью Джеди (диаметр входа 12 см, сито с диагональю ячеи 120 мкм). На участках с сильным течением фильтровали через сеть 100 л воды. Пробы фиксировали 4%-ным формалином, в лаборатории обработку материала проводили в камере Богорова под микроскопом StereoDiscovery V.12 (Carl Zeiss), методика оценки численности организмов принята в модификации Лазаревой (2010).
Содержание углерода в сыром веществе гетеротрофных нанофлагеллят принимали равным 22%, метазоопланктона – 5%, детритных частиц, заселенных бактериями, – 5% (Копылов, Косолапов, 2011).
Корреляционный анализ выполняли с использованием рангового коэффициента корреляции Спирмена с уровнем значимости 0.05. В качестве показателя вариации значений параметров рассчитывали ошибку среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Летом 2010 г. гидрофизические характеристики водной толщи водохранилища существенно отличались от таковых в те же сроки 2008 г. (табл. 1) по термическому режиму близкого к норме. Средняя температура поверхности воды была выше на 8.7°C; прозрачность на 33 см, цветность воды на 12 град и скорость течения – вдвое ниже по сравнению с летом 2008 г. (Лазарева и др., 2012). Максимальную скорость течения (>0.5 м/с) регистрировали на речном участке, что наблюдали и ранее (Mineeva et al., 2008). Придонный слой воды прогревался до 28°C, вызвав интенсивное выделение газов из донных отложений и дефицит растворенного кислорода в слое воды глубже 5 м (Лазарева и др., 2012).
Таблица 1.
Гидрофизические характеристики Чебоксарского водохранилища летом 2010 г.
| Показатель | Min‒max | Среднее |
|---|---|---|
| Глубина, м | 3–17 | 7.4 ± 0.9 |
| Температура поверхностного слоя воды, °С | 25.0–29.0 | 27.5 ± 0.2 |
| Температура придонного слоя воды, °С | 25.0–28.0 | 27.1 ± 0.2 |
| Прозрачность, см | 40–190 | 97 ± 8 |
| Цветность, град Pt-Co | 30–55 | 41 ± 1 |
| Скорость течения, м/с | 0–0.5 | 0.2 ± 0.04 |
Примечание. Здесь и в табл. 2 и 3 приведены средние значения ± стандартная ошибка.
В конце июля 2010 г. содержание Хл a было высоким (>30 мкг/л) на всей акватории водохранилища при максимальных значениях (101 мкг/л) в устье р. Оки (ст. 2) и минимальных (<20 мкг/л) в нижней озеровидной части водохранилища (ст. 17, 19). В предыдущие годы концентрация Хл a по всей акватории варьировала в пределах 14.6−18.8 мкг/л (Mineeva et al., 2008).
Рph в поверхностном слое изменялась от 67 мг C/(м3 сут) в воде, поступавшей из Горьковского водохранилища (ст. 3), до 5296 мг C/(м3 сут) на участке ниже устья р. Суры (ст. 14) и достигала в среднем 1350 ± 272 мг C/(м3 сут). Средняя величина Ррн в слое тройной прозрачности оказалась соизмеримой c таковой в поверхностном горизонте (табл. 2).
Таблица 2.
Содержание Хл а, интенсивность фотосинтеза в слое тройной прозрачности (Pph) и интегральная первичная продукция (∑Pph) в Чебоксарском водохранилище летом 2010 г.
| Показатель | Min‒max | Среднее |
|---|---|---|
| Хл а в слое 0–2 м, мкг/л | 6.7–101 | 51.0 ± 5.9 |
| Хл а в слое 0 м–дно, мкг/л | 6.8–101 | 41.6 ± 5.6 |
| Pph, мг С/(м3 сут) | 38–4746 | 1316 ± 255 |
| ∑Pph, мг С/(м2 сут) | 120–10 964 | 2591 ± 576 |
Количество Хл а в слое 0–2 м (ст. 3–19) положительно коррелировало с первичной продукцией фитопланктона в поверхностном слое 0–0.5 м (r = 0.30, p = 0.05) и в слое тройной прозрачности (r = 0.40, р = 0.05). Максимальные значения первичной продукции фитопланктона под м2 отмечены ниже устья р. Суры (ст. 14), минимальные – в нижнем бьефе Нижегородской ГЭС у г. Городец (ст. 3) (табл. 2).
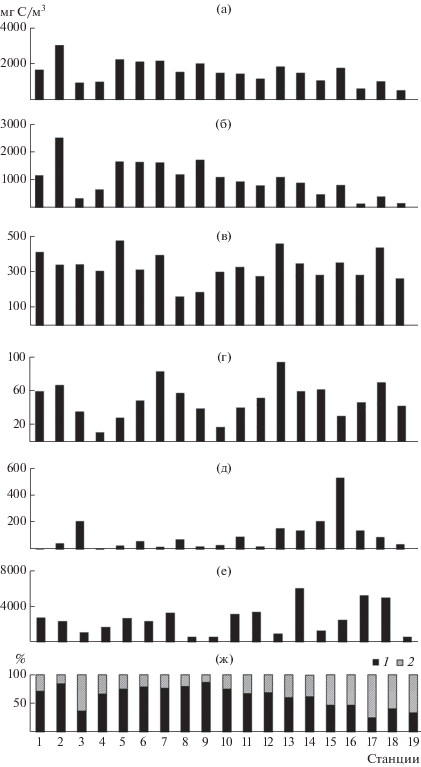
Численность и биомасса гидробионтов сильно варьировали по акватории водохранилища (табл. 3). Средние для столба воды минимальная и максимальная Вph различались в 15 раз, Вb − в 2.9 раз, Вhnf – в 7.8 раз, Вzoo − в 266 раз. При этом отмечена тенденция к снижению Вph и возрастанию Вzoo от верховьев водохранилища к плотине Чебоксарской ГЭС (рис. 2). Наиболее высокие величины Вph обнаружены в устье р. Оки, а Вzoo – в устье р. Ветлуги в озерной части водохранилища (ст. 16). Распределение Вb не зависело от вариаций Вph.
Таблица 3.
Численность (N), биомасса (В) компонентов планктонного сообщества и их вклад в Вtotal Чебоксарского водохранилища летом 2010 г.
| Компонент | N, экз./м3 | В, мг/м3 | В, мг С/м3 | Вtotal | ||||
|---|---|---|---|---|---|---|---|---|
| min–max | среднее | min–max | среднее | min–max | среднее | min–max | среднее | |
| Фитопланктон | – | – | 7–101 | 42 ± 6 | 170–2535 | 1040 ± 141 | 26.0–87.0 | 63.0 ± 4.0 |
| Бактериопланктон | (7.6−20.9) × 1012 | (15.3 ± 0.9) × 1012 | 709–2128 | 1424 ± 90 | 166–475 | 330 ± 19 | 9.0–49.0 | 25.0 ± 3.0 |
| Вириопланктон | (3.8–7.7) × 1013 | (5.5 ± 0.2) × 1013 | – | – | 4–8 | 6.0 ± 0.3 | 0.2–0.9 | 0.4 ± 0.04 |
| Гетеротрофные нанофлагелляты |
(1.9−11.9) × 109 | (6.3 ± 0.5) × 109 | 54–427 | 218 ± 23 | 12–94 | 48 ± 5 | 1.0–8.0 | 4.0 ± 0.5 |
| Зоопланктон | (18−335) × 103 | (101 ± 19) × 103 | 40–10 640 | 2089 ± 561 | 2–532 | 105 ± 28 | <1–30 | 8 ± 2 |
| Весь планктон | – | – | 810–13 296 | 3773 ± 560 | 543–2998 | 1531 ± 140 | – | – |
Рис. 2.
Общая биомасса планктона и его отдельных компонентов на участках Чебоксарского водохранилища летом 2010 г.: а – общая биомасса, б – фитопланктон, в – бактериопланктон, г – гетеротрофные нанофлагелляты, д – зоопланктон, е – детритные частицы размером 5–30 мкм, ж – вклад фитопланктона (1) и суммарной биомассы гетеротрофных организмов и вирусов (2).
В среднем для водохранилища вклад разных групп бактерий в формирование их суммарной биомассы – одиночные бактерии 86 ± 2% (диапазон 56–96%), агрегированные бактерии (ассоциированные с частицами детрита и находящиеся в составе микроколоний) 9 ± 1% (2–24%), нити 5 ± 1% (1−20%). Продукция бактериопланктона изменялась в пределах 119–574 (в среднем 258 ± 27) мг С/(м3 сут) или 476–5148 (в среднем 1853 ± 282) мг С/(м2 сут). Между продукцией бактериопланктона и фитопланктона в столбе воды под м2 отмечена положительная корреляция (r = 0.60, p = 0.05), более четко выраженная для речного участка водохранилища (r = 0.70, p = 0.05).
Численность и масса детритных частиц, содержащих бактерии размером 5–30 мкм, варьировали в широких пределах: (26–232) × 103, в среднем (97 ± 15) × 103 частиц/мл и 680−6067 (в среднем 2536 ± 367) мг С/м3 соответственно. Максимальные значения зарегистрированы в устьевой области р. Суры (ст. 13). На участке водохранилища ниже устья р. Оки количество детритных частиц у правого берега, вдоль которого распространяется окская вода, было, как правило, выше, чем в волжской воде у левого берега.
Выявлена достоверная положительная связь между Вb и Вhnf (r = 0.27, p = 0.05), более четко выраженная для одиночных бактерий (r = 0.34, p = = 0.05). Вznp варьировала от 1.7 до 434.0 мг С/м3 (в среднем 73.3 ± 2.3 мг С/м3) и достигала 36−85% (в среднем 64 ± 4%) Вzoo. Вznp отрицательно коррелировала с Bph (r = –0.31, p = 0.05), которую в июле формировали крупные колониальные водоросли, не доступные для прямого потребления фильтраторами и седиментаторами зоопланктона. Однако Вznp положительно коррелировала (r = 0.48, p = 0.05) с массой детритных частиц размером 5–20 мкм, доступных фильтраторам, а также с биомассой агрегированных бактерий в составе микроколоний, ассоциированных с детритными частицами (r = 0.43, p = = 0.05). Связь между Вznp и Вb была слабо положительной (r = 0.11, p = 0.05).
Распределение Вtotal по акватории водохранилища было также неравномерным, минимальное (в приплотинном участке) и максимальное (в устье р. Оки) значения различались в 5.5 раз (рис. 2, табл. 3). Вклад разных компонентов планктона в формирование Вtotal существенно варьировал по акватории, на большинстве исследованных станций основным компонентом сообщества являлся фитопланктон, доля бактериопланктона в Вtotal была в 2.5 раза ниже. Однако на разных участках водохранилища соотношение автотрофного и гетеротрофного компонентов планктона различалось. В волжской воде, поступающей из Горьковского водохранилища в Чебоксарское через плотину Нижегородской ГЭС (ст. 3), преобладали гетеротрофные организмы и вирусы, Вноv достигала 63% Вtotal (в том числе: Вb = 36%, Вhnf = 4%, Вzoo = 22%, Вv = <1%), вклад Вph в Вtotal был почти вдвое ниже (37%). В воде, поступающей в водохранилище из р. Оки (ст. 1 и 2), напротив, преобладали автотрофы, вклад Вph в Вtotal (в среднем 78%) превышал в 3.5 раза таковой Вhov (в среднем 22% Вtotal, в том числе: Вb = 18%, Вhnf = 3%, Вzoo = 1%, Вv = <1%).
На участке водохранилища от г. Нижний Новгород до устья р. Ветлуги (ст. 4–16) структура планктонного сообщества сходна с таковой в устьевой области р. Оки (ст. 1–2). Здесь доминировал фитопланктон (69 ± 3% Вtotal), доля Вноv была 31 ± 3% Вtotal (в том числе: Вb = 21 ± 2%, Вhnf = 3 ± 0.4%, Вzoo = = 7 ± 2%, Вv = <1%). Cтруктура планктонного сообщества существенно изменялась в нижней части озеровидного плеса (ст. 17–19). Преобладали гетеротрофные организмы и вирусы (66 ± 4% Вtotal, в том числе: Вb = 45 ± 2%, Вhnf = 7 ± 0.3%, Вzoo = = 13 ± 5%, Вv = 0.7 ± 0.1%), на Вph приходилось только 34 ± 4% Вtotal.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В период аномально высокого прогрева воды летом 2010 г. структурно-функциональные показатели планктона в Чебоксарском водохранилище были существенно выше, чем в предыдущие годы (июле–августе 2001 и 2008 гг.) с термическим режимом близким к норме (Копылов и др., 2012, 2013; Лазарева и др., 2012; Mineeva et al., 2008). Биомасса Вph увеличилась в 3.5–4.0 раза, первичная продукция в 2.5 раза, Вв в 2.1 раза, его продукция в 3.1 раза, Вhnf в 2.8 раза, Вzoo в 8–14 раз. Как результат, Вtotal глубоководных участков водохранилища достигла рекордной величины 3.0 г C/м3, а ее среднее значение для всего водоема (1.5 г C/м3) превысило зарегистрированные в других эвтрофных водохранилищах Верхней и Средней Волги: в Иваньковском и Горьковском в 1.6 и 1.8–2.2 раза cоответственно (рис. 3).
Рис. 3.
Общая биомасса планктона в эвтрофных водохранилищах Верхней и Средней Волги в летний период в разные годы. 1 − гетеротрофные организмы и вирусы, 2 − фитопланктон. Водохранилища: I – Иваньковское, II – Горьковское, III – Чебоксарское.
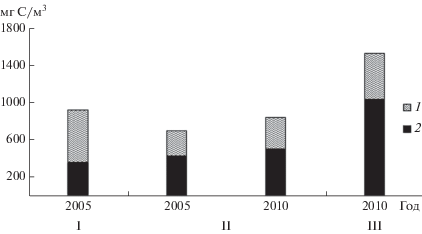
В Чебоксарском и Горьковском водохранилищах, в которых степень зарастания акватории высшими водными растениям невысока (Папченков, 2012), вклад гетеротрофных организмов в Вtotal (37−40%) существенно ниже, чем в Иваньковском водохранилище (60%), зарастающем сильнее других волжских водохранилищ (>29% площади) (Папченков, 2012). По-видимому, синтезируемое макрофитами первичное органическое вещество, служит важным источником питания для гетеротрофных организмов Иваньковского водохранилища.
Значительные вариации содержания Хл а и Врн по акватории Чебоксарского водохранилища позволили оценить вклад микробного сообщества (бактерии, простейшие, вирусы) в формирование общей биомассы планктонного сообщества (Вmc/Вtotal) при разных уровнях развития фитопланктона. В диапазоне изменения Вph 188–2535 мг С/м3, величина Вmc/Вtotal колебалась от 11 до 57%. Между Вph и Вmc обнаружена слабая положительная корреляция (r = 0.13, p = 0.05), а между Вph и Вмс/Вtotal− сильная отрицательная корреляция (r = –0.84, p = 0.05). Таким образом, в пределах одного водохранилища наблюдали закономерность, выявленную для водоемов разного трофического статуса – снижение доли микробного сообщества в Btotal при увеличении трофического уровня водных экосистем (Копылов, Косолапов, 2011).
Несмотря на низкую биомассу, вирусы играют важную роль в функционировании планктонного сообщества водохранилища. Летом 2010 г. смертность гетеротрофных бактерий в результате вирусного лизиса достигала 55%, в среднем для водохранилища – 23 ± 2% суточной продукции бактериопланктона (Копылов и др., 2013). В эвтрофных водоемах вирусы-цианофаги являются важным фактором гибели этих прокариотных организмов (Honjo et al., 2006; Tijdens et al., 2008). В Чебоксарском водохранилище обнаружено большое количество вирусов, прикрепленных к клеткам цианобактерий, возможно, и здесь в период “цветения” воды вирусы способствуют гибели цианобактерий.
Предполагают, что в умеренных широтах повышение температуры воды приводит к существенному увеличению Врн и “цветению” воды цианобактериями в загрязненных водоемах с большим количеством питательных веществ и в меньшей степени влияет на рост автотрофных организмов в относительно чистых водных экосистемах (Brookes, Carey, 2011). Среди волжских водохранилищ Чебоксарское испытывает наибольшую антропогенную нагрузку (Эдельштейн, 1998). По-видимому, сильное загрязнение оказалось одной из причин высокого обилия фитопланктона и массового развития цианобактерий в Чебоксарском водохранилище аномально жарким летом 2010 г.
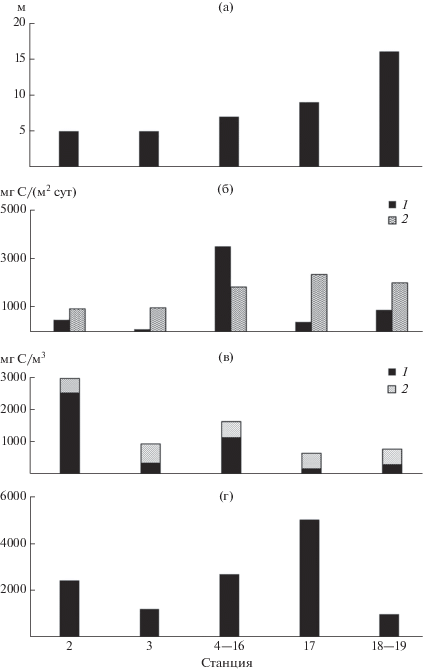
Наше исследование пришлось на окончание 40-суточного периода аномально высокого прогрева воды водохранилищ Верхней и Средней Волги. На большей акватории Чебоксарского водохранилища уровень “цветения” воды цианобактериями был очень высоким. В то же время, выявлены заметные различия структурно-функциональных характеристик планктона разных участков водоема (рис. 4). Водные массы, поступающие в водохранилище из р. Оки и через плотину Нижегородской ГЭС из Горьковского водохранилища, различались по Вtotal и соотношению автотрофного и гетеротрофного компонентов сообщества. Однако соотношение интегральной продукции фитопланктона и бактериопланктона показывает, что в окской и волжской воде гетеротрофные процессы преобладали над автотрофными. В окской воде высокая биомасса при относительно низкой первичной продукции автотрофов свидетельствовала об угнетенном состоянии фитопланктона. После слияния этих водных потоков на участке водохранилища ниже г. Нижний Новгород наблюдалось интенсивное развитие фитопланктона, в том числе цианобактерий, здесь автотрофные процессы преобладали над гетеротрофными. Врн превышала Bноv (рис. 4) и достигала на участке вблизи г. Кстово (ст. 6–9) 80–87% Вtotal. Причем численность (44 тыс. экз./м3) и Вzoo (0.8 г/м3) на этих станциях были сравнительно низкими (Лазарева и др., 2012). В направлении к плотине Чебоксарской ГЭС снижалась Врн и увеличивалась Вzoo.
Рис. 4.
Продукция и биомасса компонентов планктона Чебоксарского водохранилища на участках с различной глубиной: а – глубина; б – продукция фитопланктона (1) и бактериопланктона (2); в – биомасса фитопланктона (1), гетеротрофных организмов и вирусов (2); г – масса детритных частиц, содержащих бактерии.
Возможными причинами низкой концентрации зоопланктона на участках водохранилища с “цветением” воды могут быть значительное присутствие в составе фитопланктона крупных колониальных цианобактерий, которых мирный зоопланктон не потребляет, а также угнетающее влияние на зоопланктеров токсичных соединений, выделяемых возбудителями “цветения”. Известно (Briand et al., 2003; Chorus, Bartram, 1999), что цианобактерии способны синтезировать токсические вещества (цианотоксины), оказывающие негативное влияние на водоросли, водных беспозвоночных, рыб, млекопитающих и человека. В период исследования в Чебоксарском водохранилище обнаружено высокое содержание в воде цианотоксинов (>8 мкг/л), концентрация наиболее токсичного микроцистина превышала нормы, установленные Всемирной организацией здравоохранения (Корнева и др., 2012).
Средняя для речного участка Врн превышала Вb в 3.6 раза, а биомассу всего гетеротрофного компонента – в 2.4 раза. Однако скопление фитопланктона в поверхностных слоях воды приводит к ухудшению условий существования водорослей (снижению прозрачности воды, дефициту биогенных элементов) и, как результат, к отмиранию автотрофных организмов. В глубокой озерной части водохранилища, ниже г. Козьмодемьянск, структурно-функциональные характеристики планктонного сообщества были иными. Значительно уменьшалась Вph, что приводило к сокращению Вtotal в среднем в 2.3 раза по сравнению с речным участком. Средняя Вph оказалась ниже Вb в 1.3 раза, всего гетеротрофного компонента – в 1.8 раза. Рph стала меньше таковой бактериопланктона в 5.6 раз (рис. 4).
Таким образом, летом 2010 г. на разных участках Чебоксарского водохранилища наблюдали одновременно автотрофную и гетеротрофную стадии развития планктонного сообщества. При длине водохранилища 340 км и скорости передвижения водных масс на речном участке ~0.5 м/с, переход от автотрофной к гетеротрофной стадии планктонного сообщества занимал ~7 сут. Для сравнения, в умеренно эвтрофном Рыбинском водохранилище биомасса гетеротрофных организмов превышала Вph только осенью (Копылов, Косолапов, 2011). В Чебоксарском водохранилище в год с обычным термическим режимом средняя Вph на речном участке (250 ± 30 мг С/м3) была ниже, чем на озерном (318 ± 35 мг С/м3), соотношение речной/озерный составляло 0.8 (Лазарева и др., 2012). Напротив, жарким летом 2010 г. Вph была существенно выше на речном участке (1147 ± 116 мг С/м3), на озерном только 260 ± 81 мг С/м3, соотношение речной/озерный достигало 4.4. Данный факт свидетельствует, что в условиях аномально высокой температуры воды возникают важные для экосистемы различия в функционировании биотического компонента разных участков водохранилища.
Разница в содержании детритных частиц с прикрепленными бактериями между речным и озерным участками водохранилища указывает, что в глубоководном озерном участке, где скорость течения воды снижается, большое количество детритной массы из водной толщи оседает на дно. Согласно классификации Оксиюк и др. (1993), в 2010 г. количество фито- и бактериопланктона характеризовало качество воды значительной части акватории Чебоксарского водохранилища как “весьма грязная”.
Выводы. В Чебоксарском водохранилище летом 2010 г. повышение температуры воды до аномально высоких значений вызвало интенсивное развитие фитопланктона и сильное “цветение” воды цианобактериями. Средняя для водохранилища биомасса автотрофного и гетеротрофного компонентов планктона была значительно выше, чем в годы с обычным температурным режимом. Общая биомасса планктонного сообщества существенно превышала таковую предыдущих лет, а также отмеченную в 2010 г. в других эвтрофных водохранилищах Верхней и Средней Волги. Речной и озерный участки Чебоксарского водохранилища различались по уровню развития и структуре планктонного сообщества, соотношению продукционных и деструкционных процессов. На речном участке по биомассе фитопланктон доминировал над гетеротрофным компонентом планктонного сообщества, а первичная продукция фитопланктона превышала продукцию бактериопланктона. На озерном участке, напротив, суммарная биомасса гетеротрофных организмов и вирусов преобладала над биомассой фитопланктона, бактериальная продукция – над первичной продукцией фитопланктона. Как результат, функционирование планктонного сообщества при температуре воды, превышающей обычный летний прогрев почти на 9°C, привело к ухудшению качества воды в Чебоксарском водохранилище.
Список литературы
Второй оценочный доклад Росгидромета об изменениях климата и их последствиях на территории Российской Федерации. Общее резюме. 2014. Москва: Росгидромет.
Доклад об особенностях климата на территории Российской Федерации за 2010 г. 2011. Москва: Росгидромет.
Законнова А.В., Литвинов А.С. 2016. Многолетние изменения гидроклиматического режима Рыбинского водохранилища // Гидролого-гидрохимические исследования водоемов бассейна Волги. Ярославль: Филигрань. С. 16.
Копылов А.И., Косолапов Д.Б. 2011. Микробная “петля” в планктонных сообществах морских и пресноводных экосистемах. Ижевск: КнигоГрад.
Копылов А.И., Лазарева В.И., Минеева Н.М. и др. 2012. Влияние аномально высокой температуры воды на развитие планктонного сообщества водохранилищ Средней Волги летом 2010 г. // Докл. акад. наук. Т. 442. № 1. С. 133.
Копылов А.И., Стройнов Я.В., Заботкина Е.А. и др. 2013. Гетеротрофные микроорганизмы и вирусы в реке Оке и Чебоксарском водохранилище в аномально жаркое лето 2010 года // Известия РАН. Сер. биол. № 3. С. 377.
Корнева Л.Г., Соловьева В.В., Русских Я.В., Чернова Е.Н. 2012. Состояние фитопланктона и содержание цианотоксинов в Рыбинском, Горьковском и Чебоксарском водохранилищах в период аномально жаркого лета 2010 г. // Бассейн Волги в XXI веке: структура и функционирование экосистем водохранилищ: Матер. докл. Всерос. конф. Борок, 22–26 октября 2012 г. Ижевск: Издатель Пермяков. С. 138.
Лазарева В.И. 2010. Структура и динамика зоопланктона Рыбинского водохранилища. Москва: Товарищество науч. изданий КМК.
Лазарева В.И., Минеева Н.М., Жданова С.М. 2012. Пространственное распределение планктона в водохранилищах Верхней и Средней Волги в годы различными термическими условиями // Поволж. экол. журн. № 4. С. 394.
Оксиюк О.П., Жукинский В.Н., Брагинский Л.П. и др. 1993. Комплексная экологическая классификация качества поверхностных вод суши // Гидробиол. журн. Т. 29. № 4. С. 62.
Папченков В.Г. 2012. Динамика зарастания водохранилищ Волги // Бассейн Волги в XXI веке: структура и функционирование экосистем водохранилищ: Матер. докл. Всерос. конф. Борок, 22–26 октября 2012 г. Ижевск: Изд. Пермяков. С. 214.
Романенко В.И., Кузнецов С.И. 1974. Экология микроорганизмов пресных водоемов. Ленинград: Наука.
Эдельштейн К.К. 1998. Водохранилища России: экологические проблемы, пути их решения. Москва: ГЕОС.
Adrian R., O’Reilly C.M., Zagarese H. et al. 2009. Lakes as sentinels of climate change // Limnol., Oceanogr. V. 54. № 6 (part 2). P. 2283.
Briand J.-F., Jacquet S., Bernard C., Humbert J.-F. 2003. Health hazards for terrestrial vertebrates from toxic cyanobacteria in surface water ecosystems // Vet. Res. V. 34. P. 361.
Caron D.A. 1983. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy and comparison with other procedures // Appl. Environ. Microbiol. V. 46. № 2. P. 491.
Brookes J.D., Carey C.C. 2011. Resilience to Blooms // Science. V. 334. № 6052. P. 46.
Chorus I., Bartram J. 1999. Toxic Cyanobacteria in water: a guide to their public health consequences, monitoring and management. London: E and FN Spon.
Gonzalez J.M., Suttle C.A. 1993. Grazing by marine nanoflagellates on viruses and virus-sized particles: ingestion and digestion // Mar. Ecol. Progr. Ser. V. 94. P. 1.
Honjo M., Matzui K., Ueki M. et al. 2006. Diversity of virus-like agents killing Microcystis aeruginosa in a hyper-eutrophic pond // J. Plankton Res. V. 28. № 4. P. 407.
Jeffrey S.W., Humphrey G.F. 1975. New spectrophotometric equations for determining chloro-phylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanz. Bd 167. S. 191.
Landry M.R., Hassett R.P. 1982. Estimating the grazing impact of marine micro-zooplankton // Mar. Biol. V. 67. P. 283.
Mineeva N.A., Litvinov A.S., Stepanova I.S., Kochetkova Yu.M. 2008. Chlorophyll content and factors affecting its spartial distribution in the Middle Volga Reservoirs // Inland Water Biology. V. 1. № 1. P. 64. https://doi.org/10.1007/s12212-008-1010-5
Mooij W.M., Hülsmann S., De Senerpont L.N. et al. 2005. The impact of climate change on lakes in the Netherlands: a review // Aquat. Ecol. V. 39. P. 381.
Noble R.T., Fuhrman J.A. 1998. Use of SYBR Green for rapid epifluorescence count of marine viruses and bacteria // Aquat. Microb. Ecol. V. 14. P. 113.
Norland S. 1993. The relationship between biomass and volume of bacteria // Handbook of Methods in Aquatic Microbial Ecology. Boca Raton: Lewis Publ. P. 303.
O’Neil J.M., Davis T.W., Burford M.A., Gobler C.J. 2012. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change // Harmful Algae. V. 14. P. 313.
Paerll H.W., Huisman J. 2009. Climate change: a catalyst for global expansion of harmful cyanobacterial blooms // Environ. Microbiol. Rep. V. 1. P. 27.
Porter K.G., Feig Y.S. 1980. The use DAPI for identifying and counting of aquatic microflora // Limnol., Oceanogr. V. 25. № 5. P. 943.
Reynolds C.S. 2006. The Ecology of Phytoplankton. Cambridge: CUP.
Schindler D.W. 2009. Lakes as sentinels and integrators for the effects of climate change on watersheds, airsheds, and landscapes // Limnol., Oceanogr. V. 54. № 6 (part 2). P. 2349.
Sipkay Cs., Kiss K.T., Vadadi-Fülöp Cs., Hufnagel L. 2009. Trends in research on the possible effects of climate change concerning aquatic ecosystems with special emphasis on the modeling approach // Appl. Ecol. Environ. Res. V. 7. № 2. P. 171.
Tijdens M., Van de Waal D.B., Slovakova H. et al. 2008. Estimates of bacterial and phytoplankton mortality caused by viral lysis and microzooplankton grazing in shallow eutrophic lake // Freshwater Biol. V. 53. P. 1126.
The impact of climate change on European lakes. (Aquatic Ecology Series V. 4). 2010. Dordrecht: Springer.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


