Биология внутренних вод, 2021, № 1, стр. 12-22
Особенности поведенческих реакций черноморской мидии Mytilus galloprovicialis в естественных условиях обитания
В. В. Трусевич a, *, К. А. Кузьмин a, В. Ж. Мишуров a, В. Ю. Журавский a, Е. В. Вышкваркова a
a Институт природно-технических систем
Севастополь, Россия
* E-mail: trusev@list.ru
Поступила в редакцию 30.10.2019
После доработки 10.12.2019
Принята к публикации 02.07.2020
Аннотация
Впервые с использованием усовершенствованной модели разработанного нами комплекса автоматизированного биомониторинга водной среды исследованы фоновые характеристики поведенческих реакций черноморской мидии Mytilus galloprovicialis Lam, 1819 в естественных условиях обитания. Установлено, что в нормальных естественных условиях обитания во все сезоны года движение створок моллюсков подчинено ярко выраженному четкому солнечному суточному ритму: амплитуда раскрытия створок в ночное время максимальная, а в дневное время – минимальная. В суточном ритме активности черноморских мидий выделены две группы движений створок. Моллюски остро реагируют на резкие колебания физических факторов среды обитания мгновенным закрытием створок на непродолжительное время, что является проявлением защитных рефлексов. В поведенческих реакциях на аномальные резкие понижения температуры и длительное воздействие высокой температуры воды наблюдается развитие признаков, характерных для стрессовой ситуации.
ВВЕДЕНИЕ
В современных условиях интенсивно прогрессирующего загрязнения водной среды с возрастающей частотой техногенных аварий, сопровождающихся быстрым развитием негативных последствий для крупных регионов, стала очевидной настоятельная необходимость разработки автоматизированных методов и средств непрерывного оперативного обнаружения поллютантов любого происхождения и оценки степени их опасности для водных экосистем и человека.
Объективная оценка состояния водных экосистем невозможна без использования биологических методов экологического мониторинга. В настоящее время в ряде стран Европы для контроля вод во всех сферах современного водопользования широко и успешно используются биоэлектронные системы Musselmonitor и Driessenamonitor. Их действие основано на регистрации поведенческих реакций двустворчатых моллюсков (морских и пресноводных), т.е. способности их закрывать створки на продолжительное время или изменять ритмику движений при воздействии неблагоприятных факторов (Kramer, Foekema, 2001). Эти так называемые системы раннего реагирования (BEWS – Biological Early Warning Systems), успешно используемые в ведущих странах мира, в отличие от физико-химических методов мониторинга, позволяют в реальном времени непрерывно получать интегральную токсикологическую характеристику среды и оценивать качество воды, как среды обитания гидробионтов (Borcherding, 2006; Kramer, Foekema, 2001).
Поведенческие реакции моллюсков (интегральная реакция животных на изменения факторов окружающей среды) ярко и достоверно отражают общий уровень жизнедеятельности организма при проведении биотестирования (Kramer, Foekema, 2001). Величина раскрытия створок, особенности ритмики их движений характеризуют фильтрационную активность двустворчатых моллюсков, следовательно и уровень их жизнедеятельности в нормальной и токсической средах (Riisgard et al., 2011; Robson, de Leaniz, 2010).
Ранее нами разработан комплекс автоматического биомониторинга водной среды для проведения исследований в Черном море, являющийся аналогом системы Musselmonitor (Трусевич и др., 2010, 2015). Необходимым условием успешного функционирования такой системы является исследование фоновых характеристик поведенческих реакций аборигенных видов моллюсков в нормальных условиях естественной среды обитания. Долговременные наблюдения за поведенческими реакциями черноморской мидии в естественных условиях обитания отсутствуют.
Цель работы – изучить особенности движения створок черноморской мидии Mytilus galloprovicialis Lam, 1819 в естественных условиях обитания, а также адаптивные поведенческие реакции в условиях колебаний ряда определяющих физических факторов среды.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для исследования поведенческих реакций M. galloprovicialis был использован разработанный авторами экспериментальный образец комплекса автоматической регистрации движений створок моллюсков. Комплекс предназначен для проведения исследований в натурных условиях водоемов с глубиной погружения до 30 м (Трусевич и др., 2010, 2015). Созданная аппаратура комплекса и пакет управляющих компьютерных программ позволяют в режиме реального времени автоматически регистрировать одновременно динамику движений створок 16 мидий, температуру и уровень освещенности в водной среде, а также проводить первичную статистическую обработку данных, автоматически формировать сигнал тревоги, сохранять и передавать информацию в online-р-ежиме. Дискретность записи может устанавливаться в масштабе времени от 0.1 с до 1 мин. О-тносительная погрешность измерений – ≤1%.
С помощью разработанного комплекса впервые были зарегистрированы фоновые характеристики поведенческих реакций 16 черноморских мидий в естественных условиях обитания за трехлетний период (2012–2014 гг.) во все сезоны года. Непрерывные наблюдения в каждом сезоне велись 1–2 мес. Наблюдения проводили в окрестностях г. Севастополь с наиболее чистой по гидрохимическим показателям водой (Рябушко и др., 2002) (рис. 1). Полученные ряды данных анализировали с помощью кластерного и спектрального анализов. Перед проведением расчетов в рядах исходных данных (величина раскрытия створок мидий) был выделен и удален тренд с использованием метода наименьших квадратов.
Для работы использовали мидии длиной 55–60 мм, собранные в акватории бухты со стен волнолома на глубине 1.5–2.0 м. Перед экспериментом мидий выдерживали в аквариуме с проточной морской водой из района сбора моллюсков в течение двух суток. Моллюсков, которые за это время не прикрепились биссусом к стенкам аквариума, отбраковывали как животных с неудовлетворительным физиологическим состоянием.
В условиях in situ погружная часть модуля с прикрепленными мидиями опускалась на глубину 2.0–2.5 м с борта неработающей баржи, ошвартованной к молу у входа в бухту. Схема и способ крепления моллюсков в приборе представлены в работе В.В. Трусевич и др. (2015).
Помимо этого проводили лабораторные исследования в аквариуме объемом 100 л с непрерывным протоком воды, закачиваемой из зоны моря на удалении 50 м от берега с глубины 2 м, со скоростью 6 л/мин. В лабораторных условиях исследовали реакции моллюсков на изменение интенсивности освещения (затенение, быстро упавшая тень на экспериментальный аквариум, включение и выключения света), а также на механические воздействия (вибрации от работы насосов в экспериментальных аквариумах и непосредственной близости к ним, резкие звуки, легкие постукивания по аквариуму, использование электроинструментов, удары молотками по корпусу при проведении ремонтных работ на судне).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
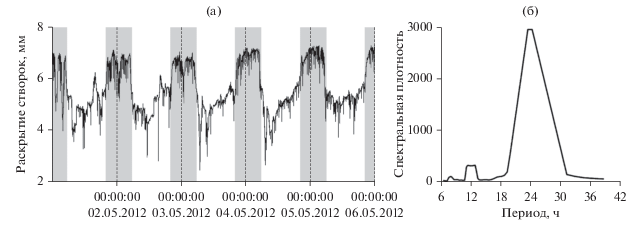
Исследования показали, что на протяжении всего периода наблюдений движения створок мидий подчинены ярко выраженному четкому солнечному суточному ритму – с максимальным раскрытием створок в ночное время и минимальным – в дневное (рис. 2а). Анализ периодограммы показал наличие статистически значимого (p < 0.001) пика с периодом 24 ч (рис. 2б).
Рис. 2.
Движения створок 16 мидий, подчиненное солнечному суточному ритму: а – средняя величина раскрытия створок (серые участки соответствуют ночному времени для периода 01.05–05.05.2015 г.); б – периодограмма ритма моллюсков.
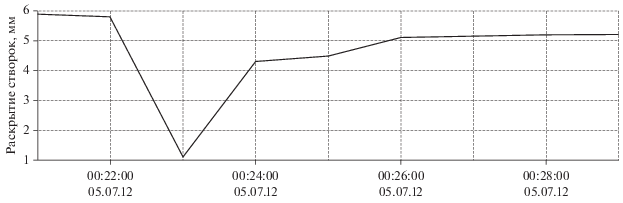
Переход от ночной части суточного ритма к дневной и обратно происходит в точном соответствии с восходом и заходом солнца в данный период года и осуществляется в течение 20–30 мин по мере развития и угасания гражданских сумерек (рис. 3).
Рис. 3.
Величина раскрытия створок мидий (тонкая серая линия) при переходе от ночной части суточного ритма к дневной и обратно. Жирная черная линия – скользящее среднее; тонкая черная линия – освещенность 02.07.2012 г.
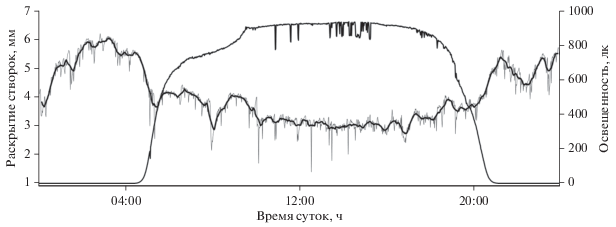
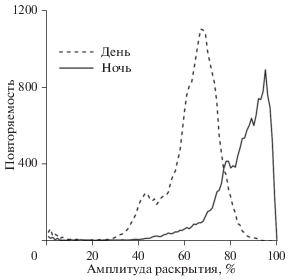
Один из важнейших показателей перехода от ночного режима к дневному – амплитуда раскрытия створок. По результатам наших наблюдений, средняя величина раскрытия створок у группы мидий для ночного периода суточного цикла колеблется в пределах 6–8 мм (6.38 ± 0.61), для дневного – 4–6 мм (4.67 ± 0.54), у некоторых моллюсков максимальная величина раскрытия может достигать 10–12 мм. Амплитуда раскрытия створок у мидий – величина индивидуальная и колеблется в значительных пределах, что может быть обусловлено как физиологическим состоянием моллюсков, так и колебаниями определяющих факторов среды (Newell et al., 2001; Robson, de Leaniz, 2010). Наиболее часто встречающаяся амплитуда раскрытия створок (осредненная для 16 мидий) варьируется на уровне близком к максимально возможному для дневного и ночного времени суток: днем в пределах 60–70% и ночью ‒ 90–100% от максимального раскрытия створок (рис. 4).
В суточном ритме черноморских мидий можно выделить две группы движений (рис. 5). Первая группа – длинные аддукции (амплитудой 4–8 мм), представляющие собой кратковременные быстрые схлопывания створок, обеспечивающие, в основном, процессы выведения из организма продуктов метаболизма и псевдофекалий, и короткие аддукции (амплитудой 1–2 мм), которые, очевидно, принимают участие в выведении жидких продуктов метаболизма и фекалий. Вторая группа – медленные, очень короткие, неглубокие колебания, занимающие основную часть дневного периода, участвующие в процессах фильтрации и дыхания (Barnes, 1955). Медленные колебания присутствуют и в ночном периоде в виде коротких временных отрезков между схлопываниями.
Рис. 5.
Основные типы движений створок моллюсков на протяжении суточного цикла 15.05.2013 г.: 1 – длинные аддукции, 2 – короткие аддукции, 3 – медленный ритм.
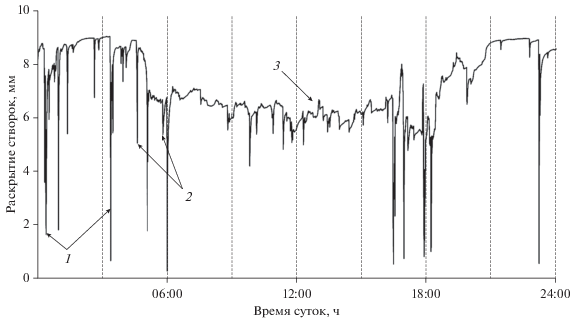
В ночное время мидии несинхронно в индивидуальном режиме совершают длинные аддукции (схлопывания) гораздо чаще (от 1 раза в 2–3 ч до нескольких раз в течение часа), чем в дневное (1–2 раза за весь дневной период) (рис. 5), что свидетельствует о большей активности питания мидий, как и большинства других морских моллюсков, в ночной период (Comeau et al., 2018; Riisgard et al., 2011; Robson, de Leaniz, 2010). Промежутки времени между схлопываниями у мидий, по нашим данным, могут существенно варьировать от нескольких часов до нескольких минут, что обусловлено, в первую очередь, вариациями концентрации и структуры пищевых и минеральных компонентов в составе взвеси в водной среде, а также колебаниями лимитирующих факторов окружающей среды (Newell et al., 2001; Saurel et al., 2007; Robson, de Leaniz, 2010; Riisgard et al., 2011; Tran et al., 2011; Comeau et al., 2018).
В нормальных условиях обитания у всех мидий продолжительность схлопываний составляет от 4–5 до >10 мин (рис. 6). Расстояние, которое проходит створка у отдельных моллюсков существенно различается и колеблется от 1–3 мм (короткие аддукции) до 5–8 мм (длинные аддукции). В длинных аддукциях начальная фаза (сведение створок), осуществляемая мускулами-аддукторами, достигает 40–60 с, в то время как фаза расслабления, осуществляемая за счет действия силы упругости лигамента, длится 4–7 мин. При этом, начальная быстрая фаза расслабления, составляющая ~80% всего пути движения створок, длится 1–1.5 мин, в то время как окончательная фаза возвращения створки в исходное состояние может продолжаться 3–5 мин. При ухудшении условий обитания мидий продолжительность этой фазы расслабления может существенно увеличиваться. Продолжительность коротких аддукций не превышает 2–3 мин (рис. 6). Литературные данные об их функциональной роли не встречаются.
Исследования показали, что моллюски остро реагируют на многие резкие изменения физических факторов окружающей среды. Например, резкие изменения светового потока (резко упавшая тень на аквариум, момент выключения света) и механические воздействия (легкие постукивания по аквариуму, резкие звуки и т.п.) вызывают у моллюсков мгновенное (через 2–3 с) синхронное закрывание створок на непродолжительное время (от 30–40 с до 2‒3 мин), в зависимости от интенсивности воздействия (рис. 7), что, очевидно, является проявлением защитных рефлексов (Гнюбкин, 2015; Barnes, 1955; Curtis et al., 2000).
Рис. 7.
Реакция мидий на постукивания по аквариуму (а) и кратковременное выключение света (б). Стрелками отмечены моменты постукиваний (~ через 30 с) и момент выключения света.
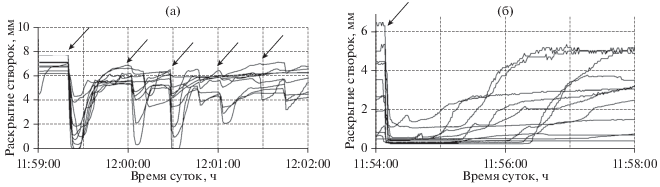
При частом повторении таких неповреждающих монотонных воздействий величина реакции мидий быстро снижается и уже через 4–5 повторений она исчезает (рис. 7а, 7б). Это четко проявляется при помещении в аквариум или размещении рядом с ним вибрирующего насоса. Через 15–20 мин у мидий полностью восстанавливается нормальный ритм движения створок. Такие кратковременные синхронные реакции моллюсков почти не отражаются на общей суточной ритмике и при настройке автоматизированных систем мониторинга водной среды должны исключаться управляющими компьютерными программами как ложные сигналы.
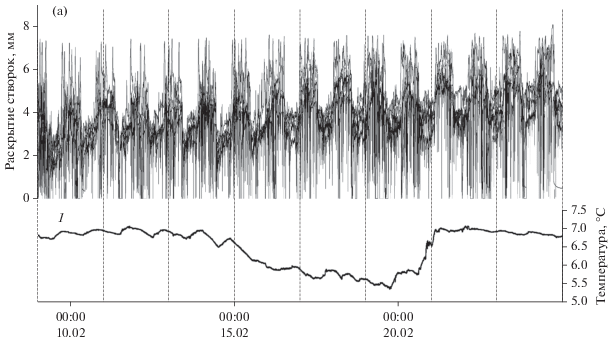
Температура воды – один из важнейших факторов среды, определяющих особенности метаболизма у экзотермных и тем самым обусловливающих границы их распространения (Anestis et al., 2007; Somero, 2002; de Zwaan, Wijsman, 1976). В Черном море в условиях марихозяйств в зимний период при низкой температуре воды и наиболее низком уровне фитопланктона в море, отмечают низкий уровень активности моллюсков (Холодов и др., 2010). В то же время, многолетние наблюдения за поведением мидий не обнаружили выраженных сезонных проявлений изменения суточного ритма движения створок даже в зимнее время. Напротив, на протяжении зимнего периода, несмотря на низкую температуру воды (7–9°С), в феврале в отдельные дни снижавшуюся до 4–5°С, у мидий сохраняется четкая суточная ритмика движений створок, что указывает на активное питание моллюсков (рис. 8).
Рис. 8.
Суммарный график движения створок 16 мидий в феврале 2013 г. Здесь и на рис. 9 и 10 1 – соответствующая температура воды в море.
В летний период в Черном море в отдельные годы наблюдается аномально высокое повышение температуры воды, достигающее 27.5°С. Такая высокая температура (>26°С) сохраняется продолжительное время, ~2 мес. (в июле–августе). С началом этого периода мидии периодически, несинхронно, с увеличивающейся частотой и продолжительностью находятся в закрытом состоянии. Продолжительность нахождения моллюсков в закрытом состоянии быстро нарастает по мере увеличения периода аномальной температуры воды, и это сопровождается постепенным разрушением суточного ритма (рис. 9). При этом происходит быстрое уменьшение амплитуды раскрытия створок. В укорачивающиеся моменты активности мидии, вместо правильно чередующихся аддукций, совершают беспорядочные кратковременные открывания створок (рис. 9б), которые скорее напоминают “обратную аддукцию” (flapping activity) по определению Кертиса и др. (Curtis et al., 2000). Это является явным признаком развития стрессовой ситуации и свидетельствует о нарушении процессов фильтрации, дыхания и питания.
Рис. 9.
График движения створок мидий в условиях аномально высокой температуры воды в летний период (26–31.07.2012 г.): а – среднее для 16 мидий; б – для одиночной мидии.
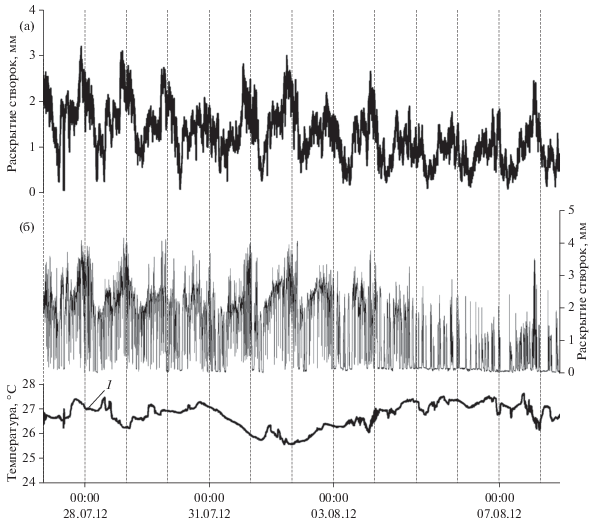
С возвращением температуры воды к 22–23°С, при изменениях направления течений в бухте в этот период, суточная ритмика движения створок на протяжении полусуток восстанавливается.
Нами установлено, что резкое понижение температуры воды в летний период на 7, 10 и даже 14°С в течение 4–6 ч (краткосрочные локальные апвеллинги, часто возникающее при ветровых сгонно-нагонных течениях у берегов Крыма), также вызывало изменение характера ритмики движений створок у большинства участвующих в эксперименте мидий (рис. 10). Мидии реагировали несинхронно чередованием частого резкого закрывания створок на 20–30 мин с последующим кратковременными раскрытиями и схлопываниями, быстрым уменьшением амплитуды раскрытия створок. Такой характер поведения моллюсков свидетельствует о стрессовой реакции и обычно отмечается многими исследователями при ухудшении условий среды обитания (Connor, Robles, 2015; Curtis et al., 2000; Lesser et al., 2010; Riisgard et al., 2011). С повышением температуры до 20°С мидии возвращались к нормальной ритмике движений уже через 3–5 ч. Следует отметить, что в случаях, когда такие резкие понижения температуры и последующие повышения температуры в течение суток, наблюдаемые в бухте при ветровых сгонных течениях, повторялись в небольших временных интервалах (через сутки–двое или даже нескольких суток) мидии на эти новые понижения температуры почти не реагировали. Очевидно, запускающим моментом закрывания створок служат не столько сами изменения температуры, сколько скорость изменений параметров среды (Hopkins, 1931). В наших лабораторных экспериментах быстрое изменение температуры воды в аквариумах на 3–5°С в сторону повышения или понижения вызывало резкое (за 3–5 мин) синхронное захлопывание створок всех 16 моллюсков, сохранявшееся на протяжении 20–30 мин, что, по-видимому, является проявлением признаков защитной реакции (Трусевич и др., 2015).
Рис. 10.
Изменение ритмики движений створок мидий при резком понижении температуры воды в летний период (22.08–23.08.2012 г.).
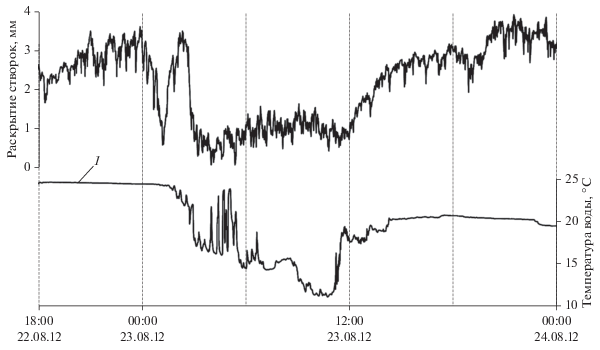
Такие резкие изменения температуры воды в море, хотя и связаны с определенным сезоном года, скорее следует отнести к разряду температурных аномалий. Кратковременные реакции мидий на такие аномальные всплески параметров окружающей среды – форма защитных рефлексов и должны учитываться при разработке управляющих компьютерных программ в системах автоматизированного мониторинга водной среды как ложные сигналы, не связанные с изменением химизма воды.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Суточная ритмика в активности систем и органов – одна из важнейших характеристик функционального состояния организма. Ее наличие свидетельствует об удовлетворительном функциональном состоянии животного, а нарушение или отсутствие – о возможном развитии патологических процессов (Connor, Robles, 2015; Curtis et al., 2000; Mat et al., 2014). Большинство исследователей отмечают у моллюсков наличие циркадианной (околосуточной) ритмики в движении створок. В ряде исследований показана генетически обусловленная циркадианная ритмика активности двустворчатых моллюсков (Anestis et al., 2007; Gracey, Connor, 2016; Kim et al., 2003; Mat et al., 2014; Naylor, 2010). Взаимосвязь момента активации ритмической деятельности створок полярных мидий с периодом развития гражданских сумерек отмечена в их поведенческих реакциях в условиях смены полярного дня и ночи Траном (Tran et al., 2016). Вместе с тем, в числе факторов, обусловливающих характер ритмики моллюсков, все большую роль отводят физиологической составляющей, т.е. изменению суточного ритма моллюсков в соответствии с изменениями условий питания, дыхания и характеристиками метаболических процессов, связанных с колебаниями параметров среды обитания. К определяющим факторам относят в первую очередь наличие кислорода и пищи (Mat et al., 2014; Newell et al., 2001; Robson, de Leaniz, 2010). Так, при длительном лабораторном содержании моллюсков с искусственно задаваемыми ритмами подачи пищи и освещения, отличающимися от природных, суточный ритм постепенно разрушается и угасает (Newell et al., 2001; Riisgard et al., 2011; Robson, de Leaniz, 2010). По возвращении таких моллюсков в естественную среду обитания утраченный ритм движения створок быстро восстанавливается (Robson, de Leaniz, 2010; Saurel et al., 2007).
Для существования моллюсков литорали и даже сублиторали в районах океанических побережий чередование приливов и отливов, сопровождающихся резкими ритмичными колебаниями гидрофизических и гидрохимических параметров воды, а также фитопланктона, оказывается более важным фактором, чем смена дня и ночи (Mat et al., 2014; Tran et al., 2011).
Очевидно, “истинный” ритм может маскироваться эффектами колебаний факторов среды, что является прямым ответом организмов на флуктуации экологический обстановки в среде обитания (Mat et al., 2014; Ortmann, Grieshaber, 2003; Riisgard et al., 2011; Robson, de Leaniz, 2010; Saurel et al., 2007). Животные приспосабливают свою генетически обусловленную схему поведения, связанную со временем суток и условиями освещения. Восход–заход солнца служит запускающим моментом для цепи физиологических приспособительных механизмов (Naylor, 2010; Saurel et al., 2007; Tran et al., 2011).
По нашим наблюдениям, для черноморских мидий, не подверженных воздействию приливов и отливов, наиболее значимым остается суточный (солнечный) ритм, а вариации поведения связаны с колебаниями характеристик воды в море. Как показали наши исследования, в нормальных условиях естественной среды обитания створки мидий находятся в открытом состоянии в среднем до 92–95% времени суток, что согласуется с величинами, приведенными для мидий и устриц в работах других исследователей (Comeau et al., 2018; Kramer, Foekema, 2001; Saurel et al., 2007; Tran et al., 2016).
В исследованиях, посвященных изучению питания моллюсков, выявлена некоторая корреляция между скоростью фильтрации, концентрацией фитопланктона и уровнем раскрытия створок моллюсков. Содержание двустворчатых моллюсков на диете низких водорослевых концентраций приводит к быстрому уменьшению амплитуды раскрытия створок и в дальнейшем к их полному смыканию. И, напротив, максимальный уровень открытия створок мидий наблюдается в условиях высокого уровня содержания фитопланктона (Newell et al., 2001; Riisgard et al., 2011; Robson, de Leaniz, 2010). В естественных условиях обитания Mytilus edulis L., 1758 установлены вариации интенсивности питания и поведенческих реакций в соответствии с сезонными колебаниями продукции фитопланктона и температуры воды (Connor, Robles, 2015; Kramer, Foekema, 2001; Lesser et al., 2010). Таким образом, наблюдаемые амплитуды раскрытия и частота аддукций створок в месте проведения наших наблюдений свидетельствуют о наличии оптимальных условий питания для мидий, что позволяет им поддерживать четкую суточную ритмику движений створок на протяжении всего года, что свидетельствует об их хорошем функциональном состоянии.
Влияние температуры воды и ее изменений на моллюсков в естественной среде обитания описано многими авторами. Исследуемые нами моллюски при низкой температуре воды в Черном море своей ритмики не меняли. Очевидно, что не сама низкая температура, а уровень наличия фитопланктона определяет интенсивность питания моллюсков, что проявляется в величинах раскрытия створок и поддержании суточной ритмики (Saurel et al., 2007; Tran et al., 2016). Этот вывод поддерживается еще и тем фактом, что в период февраль–март в Черном море наблюдается зимне-весенний максимум развития фитопланктона, и у моллюсков отмечается начало интенсивного формирования половых продуктов и связанная с этим необходимость усиленного питания (Холодов и др., 2010).
Снижение активности и даже массовой гибели мидий регулярно отмечают в летний период в Средиземном море при повышении температуры воды до 27–28°С (Anestis et al., 2007). Известно, что мидии по своему происхождению относятся к бореальным формам и температуры >24°С для них – экстремальны. При повышении температуры поверхностного слоя моря до 28–29°C 30–55% мидий в течение 10 сут умирают. Подобно M. galloprovincialis, для M. edulis верхний температурный максимум толерантности находится между 26 и 28°C (Anestis et al., 2007; Kramer, Foekema, 2001; Lesser et al., 2010).
В этом температурном диапазоне в тканях мидий наблюдается весь спектр биохимических изменений метаболизма, характерных для температурного стресса: в тканях отмечается накопление белков теплового шока – Hs70, Hs90 (Gracey, Connor, 2016; Li et al., 2007); активация пируваткиназы, а также других ферментов гликолиза (гексакиназы и альдолазы) (Anestis et al., 2007); блокируются процессы окислительного фосфорилирования и соответственно дыхания (Anestis et al., 2007; Gracey, Connor, 2016; Kramer, Foekema, 2001; Lesser et al., 2010; Somero, 2002); наблюдается нарушение функционирования ресничного эпителия, фильтрующего и пищеварительного аппарата моллюсков, сопровождающееся частичной или полной его деградацией (Anestis et al., 2007; Gonzalez, Yevich, 1976); прекращается производство биссуса (Холодов и др., 2010; Martella, 1974). Снижение интенсивности питания и дыхания на фоне развития возрастающих энерготрат на процессы адаптации к высоким температурам резко снижает энергетический баланс тканей моллюсков, уже сильно истощенных предшествующим нерестом (Lesser et al., 2010). Ограниченные возможности компенсации возросших энерготрат на метаболические процессы адаптации усугубляет особенно низкий уровень фитопланктона в море, характерный для этого периода (Холодов и др., 2010; Anestis et al., 2007; Kramer, Foekema, 2001). Весь комплекс перечисленных причин, приводящих к истощению энергетических ресурсов тканей моллюсков, вызывает массовую так называемую “летнюю” смертность моллюсков, часто наблюдаемую в марихозяйствах по культивированию моллюсков (Anestis et al., 2007; Gonzalez, Yevich, 1976; Kramer, Foekema, 2001). Вместе с тем за весь трехлетний период проведенных исследований не было отмечено “летней” смертности экспериментальных моллюсков. Это, по-видимому, объясняется тем, что температурная аномалия не превышала критических уровней слагающих факторов.
Способность к восстановлению функционирования после изменения качества среды обеспечивает моллюскам сохранение относительно стабильного уровня функциональной активности всего организма и является проявлением их адаптивных возможностей. По мнению ряда авторов (Newell et al., 2001; Riisgard et al., 2011; Saurel et al., 2007; Somero, 2002), переходы мидий даже на продолжительное время в состояние “покоя” – часть нормального поведения моллюсков, и длительные периоды закрытия створок проходят без ущерба для организма моллюсков. Это явление объясняется особенностями организации метаболизма моллюсков, проявляющееся в способности снижать уровень обмена до 10% от нормы, используя анаэробные пути производства энергии, что позволяет им экономить энергию и сравнительно легко переносить неблагоприятный период, находясь длительное время с закрытыми створками (Newell et al., 2001; Somero, 2002).
Выводы. Впервые исследованы особенности поведенческих реакций черноморской мидии в естественных условиях обитания. Установлено, что движения створок мидий Черного моря, не подверженных воздействию приливов и отливов, в нормальных условиях обитания подчинены ярко выраженному четкому суточному (солнечному) ритму, с максимальным раскрытием створок в ночное время и минимальным – в дневное. Переход от ночной части суточного ритма к дневной и обратно у моллюсков осуществляется на протяжении развития и угасания гражданских сумерек. Важнейшими показателями благополучия водной среды и адаптивных возможностей моллюсков являются способность их поддерживать нормальный суточный ритм. Моллюски остро реагируют на резкие колебания факторов среды обитания мгновенным закрыванием (захлопыванием) створок на непродолжительное время, что является проявлением защитных рефлексов. При монотонном повторении неповреждающих воздействий величина реакций моллюсков быстро снижается и даже угасает. В суточной ритмике движения и амплитудах раскрытия створок черноморской мидии не были отмечены сезонные различия. Резкие кратковременные понижения температуры воды на 6–10°С от сезонной нормы вызывают у моллюсков защитные рефлексы. Продолжительное воздействие аномально высоких температур (26–28°С) в летний период является для черноморской мидии тяжелой стрессовой ситуацией. С возвращением температуры к норме суточный ритм восстанавливается в течение нескольких часов. Отмеченные поведенческие реакции моллюсков на резкие колебания температуры и других факторов среды должны учитываться при проведении экспериментальных работ и при формировании управляющих компьютерных программ в системах автоматизированного биосенсорного мониторинга водной среды.
Список литературы
Гнюбкин В.Ф. 2015. Модель движения створок раковины черноморской мидии Mytilus galloprovincialis Lamarck, 1819 (Bivalvia: Mytilidae) // Биология моря. Т. 41. № 1. С. 36–45.
Трусевич В.В., Гайский П.В., Кузьмин К.А. 2010. Автоматизированный биомониторинг водной среды с использованием реакций двустворчатых моллюсков // Морской гидрофизический журнал. Вып. 3. С. 75–83.
Трусевич В.В., Гайский П.В., Кузьмин К.А., Мишуров В.Ж. 2015. Биомаркеры поведенческих реакций черноморской мидии для автоматизированного мониторинга водной среды // Системы контроля окружающей среды. Вып. 1(21). С. 13–18.
Рябушко В.И., Козинцев А.Ф., Макарчук Т.Л., Шинкаренко В.К. 2002. Содержание тяжелых металлов в мидии Mytilus galloprovincialis из бухты Казачья Черного моря // Морські біотехнічні системи. Вип. 2. С. 215–221.
Холодов В.И., Пиркова А.В., Ладыгина Л.В. 2010. Выращивание мидий и устриц в Черном море. Севастополь: ИнБЮМ. 424 с.
Anestis A., Lazou A., Portner H.O., Michaelidis B. 2007. Behavioral, metabolic, and molecular stress responses of marine bivalve Mytilus galloprovincialis during long-term acclimation at increasing ambient temperature // Am. J. Physiol. Regul. Integr. Comp. Physiol. V. 293. P. R911–R921. https://doi.org/10.1152/ajpregu.00124.2007
Barnes G.E. 1955. The behaviour of Anodonta cygnea L., and its neurophysiological basis // J. Experimental Biol. V. 32. P. 158–174.
Borcherding J. 2006. Ten years of practical experience with the Dreissena-Monitor, a biological early warning system for continuous water quality monitoring // Hydrobiologia. V. 556. P. 417–426. https://doi.org/10.1007/s10750-005-1203-4
Comeau L.A., Babarro J.M.F., Longa A., Padin X.A. 2018. Valve-gaping behavior of raft-cultivated mussels in the Ría de Arousa, Spain // Aquaculture Reports. V. 9. P. 68–73. https://doi.org/10.1016/j.aqrep.2017.12.005
Connor K.M., Robles C.D. 2015. Within-site variation of growth rates and terminal sizes in Mytilus californianus along wave exposure and tidal gradients // Biology Bulletin. V. 228. P. 39–51.
Curtis T.M., Williamson R., Depledge M.H. 2000. Simultaneous, long-term monitoring of valve and cardiac activity in the blue mussel Mytilus edulis exposed to copper // Marine Biol. V. 136. P. 837–846.
Gonzalez J.G., Yevich P. 1976. Responses of an estuarine population of the blue mussel Mytilus edulis to heated water from a steam generating plant // Marine Biol. V. 34. № 2. P. 177–189. https://doi.org/10.1007/BF00390760
Gracey A.Y., Connor K. 2016. Transcriptional and metabolomic characterization of spontaneous metabolic cycles in Mytilus californianus under subtidal conditions // Marine Genomics. V. 30. P. 35–41. https://doi.org/10.1016/j.margen.2016.07.004
Hopkins A.E., Galtsoff P.S., McMillin H.C. 1931. Effects of pulp mill pollution on oysters [U.S.] // Bureau of Fisheries. № 6. V. 47. P. 125–186.
Kim W.-S., Huh H.-T., Je J.-G., Han K.-N. 2003. Evidence of two-clock control of endogenous rhythmin the Washington clam, Saxidomus purpuratus // Marine Biology. V. 142. P. 305–309.
Kramer K.J.M., Foekema E.M. 2001. The “Musselmonitor®” as Biological Early Warning System // Biomonitors and Biomarkers as Indicators of Environmental Change 2. Environmental Science Research. V. 56. P. 59–87.
Lesser M.P., Bailey M., Merselis D., Morrison J.R. 2010. Physiological response of the blue mussel Mytilus edulis to differences in food and temperature in the Gulf of Maine // Comparative Biochemistry and Physiology. V. 156. P. 541–551.
Li Y., Qin J.G., Abbott C.A., Li X., Benkendorff K. 2007. Synergistic impacts of heat shock and spawning on the physiology and immune health of Crassostrea gigas: an explanation for summer mortality in Pacific oysters // American J. Regulatory, Integrative and Comparative Physiology. V. 293. № 6. P. 2353–2362.
Martella T. 1974. Some factors influencing the byssus readproduction in Mytilus edulis (Mollusca: Bivalvia) Linnaeus, 1758 // Water, Air and Soil Pollution. V. 3. P. 171–177.
Mat A.M., Massabuau J.-C., Ciret P., Tran D. 2014. Looking for the clock mechanism responsible for circatidal behavior in the oyster Crassostrea gigas // Marine Biology. V. 161. № 1. P. 89–99.
Naylor E. 2010. Chronobiology of marine organisms. Cambridge, UK: Cambridge University Press. 242 p.
Newell C.R., Wildish D.J., MacDonald B.A. 2001. The effects of velocity and seston concentration on the exhalant siphon area, valve gape and filtration rate of the mussel Mytilus edulis // J. Experimental Marine Biol. Ecol. V. 262. P. 91–111.
Ortmann C., Grieshaber M. 2003. Energy metabolism and valve closure behaviour in the Asian clam Corbicula fluminea // J. Experimental Biol. V. 206. P. 4167–4178.
Riisgard H.U., Egede P.P., SaavedraI B. 2011. Feeding Behaviour of the Mussel, Mytilus edulis: New Observations, with a Minireview of Current Knowledge // J. Marine Biol. V. 2011. ID 312459.
Robson A., de Leaniz C.G. 2010. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light // Hydrobiologia. V. 655. P. 197–204. https://doi.org/10.1007/s10750-010-0449-7
Saurel C., Gascoigne J.C., Palmer M.R., Kaiser M.J. 2007. In situ mussel feeding behavior in relation to multiple environmental factors: Regulation through food concentration and tidal conditions // Am. Soc. Limnol. Oceanography. V. 52(5). P. 1919–1929.
Somero G.N. 2002. Thermal Physiology and Vertical Zonation of Intertidal Animals: Optima, Limits, and Costs of Living Integrative and Comparative // Biology. V. 42. № 4. P. 780–789.
Tran D., Nadau A., Durrieu G. et al. 2011. Field Chronobiology of a Molluscan Bivalve: How the Moon and Sun Cycles Interact to Drive Oyster Activity Rhythms // Chronobiol. Int. V. 28(4). P. 307–317.
Tran D., Sow M., Camus L. et al. 2016. In the darkness of the polar night, scallops keep on a steady rhythm // Sci. Reports. V. 6. 32435. https://doi.org/10.1038/srep32435
de Zwaan A., Wijsman T.C.M. 1976. A. Review: Anaerobic metabolism in Bivalvia (Mollusca) // Characteristics of anaerobic metabolism. V. 56B. P. 313–324.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод