Биология внутренних вод, 2021, № 2, стр. 124-132
Относительная масса глоточных зубов плотвы Rutilus rutilus: связь с биологическими показателями рыб и наследуемыми признаками
Н. И. Комова *
Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: komova@ibiw.ru
Поступила в редакцию 28.11.2019
После доработки 30.09.2020
Принята к публикации 02.10.2020
Аннотация
Проанализированы масса глоточных зубов (глоточных костей с расположенными на них зубами) и ее доля в массе тела у плотвы Rutilus rutilus (L., 1758) Рыбинского водохранилища с разным типом питания. Установлено, что доля массы глоточных зубов достоверно возрастает при увеличении длины тела рыб с 170 до 200 мм, массы тела – с 90 до 200 г и возраста – с 5 до 7 лет. Этот показатель у исследованных особей не зависит от числа зубов на глоточных костях. Абсолютная и относительная массы глоточных зубов не связаны с генетически обусловленными признаками – числом позвонков в позвоночнике и его отделах. Вместе с тем рыбы с большой относительной массой глоточных зубов характеризуются более высоким фенетическим разнообразием по числу фенотипов позвоночника.
ВВЕДЕНИЕ
Морфология глоточных зубов у рыб многообразна (Nakajima, 1987; Hulsey et al., 2008; Kramer et al., 2012 и др.). Как показано для карповых (Tao et al., 2019), видовое разнообразие является следствием пластичности и разнородности глоточного зубного ряда, что способствует адаптивной радиации. В свою очередь, наблюдается и внутривидовая вариация (Касьянов и др., 1981; Hjelm et al., 2003; Hung et al., 2015). Специализация глоточных зубов для захвата и переработки пищевых объектов играет важнейшую роль в трофической адаптации у рыб (Sibbing, 1991; Vandewalle et al., 1994; Wainwright, 2005; Clark, Summers, 2007; Berkovitz, Shellis, 2017).
Плотва Rutilus rutilus (L., 1758) широко распространена в европейских пресноводных экосистемах. Для нее характерен один ряд зубов на глоточных костях, чаще всего число зубов 10–12, в большинстве случаев на левой кости по шесть зубов, а на правой по пять, но встречаются и другие варианты (Изюмов, 1981; Komova, 2018 и др.). Для этого показателя характерно изменение в онтогенезе вследствие возрастной смены пищевых объектов. В Рыбинском водохранилище после вселения и распространения дрейссены (Dreissena polymorpha Pallas) плотва начала питаться этим высококалорийным кормом, что привело к увеличению ее упитанности, темпа роста (Поддубный, 1966; Комова, Изюмов, 2012; Герасимов и др., 2015) и плодовитости (Володин, 1963).
Цель работы – оценить связь относительной массы глоточных зубов с биологическими показателями (длиной, массой тела, возрастом), а также наследуемыми признаками (числом позвонков в отделах позвоночника).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Плотву отлавливали сетями в Волжском плесе Рыбинского водохранилища в 2007, 2008, 2010 – 2013 гг. У рыб измеряли длину тела от кончика рыла до конца чешуйного покрова, взвешивали после извлечения гонад и внутренностей (масса тела, г). После полного биологического анализа рыб отваривали, отделяли и очищали позвоночник и глоточные зубы (глоточные кости с расположенными на них зубами) и затем высушивали. Глоточные зубы взвешивали с точностью до 1 мг. При обработке материала отмечено, что у особей, близких по длине и массе тела, глоточные зубы различаются по массе и, напротив, у рыб разных размеров могут быть близки по массе. Так, две самки длиной 258 мм, массой 272 и 275 г имели зубы 0.608 и 0.952 г соответственно, а самки длиной 252 и 268 мм, массой 241 и 340 г имели зубы 1.005 и 1.011 г соответственно. Поэтому в работе использовали не только массу, для более корректного анализа проводили сравнения по Иглз (‰), который рассчитывали, как долю массы глоточных зубов (г) от массы тела (г). Для морфологической характеристики использовали формулу глоточных зубов (5–5, 6–5 и 6–6) и, соответственно, число зубов на глоточных дужках (10, 11 и 12), Va, Vi, Vc и Vt, а также основные фенотипы позвоночника (Касьянов, Изюмов, 1997). Возраст рыб определяли по чешуе и клейтрум (cleithrum), дополнительно использовали лобные кости (frontale). Для оценки результатов проводили однофакторный дисперсионный анализ (ANOVA), достоверность различий оценивали с помощью LSD-теста, уровень значимости p < 0.05. Всего исследовано 785 экз. плотвы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведенный анализ корреляционной зависимости (уровень значимости p < 0.05) между признаками всех обследованных рыб показал, что масса глоточных зубов у самок и самцов наиболее тесно связана с массой и длиной тела (коэффициенты корреляции r = 0.91–0.96), меньше – с возрастом рыб (r = 0.86–0.88). В отличие от массы, Иглз связан лишь с возрастом у самцов (r = 0.43–0.60). Корреляция с числом позвонков отсутствует во всех случаях (r = 0.001–0.096).
В Рыбинском водохранилище плотва начинает питаться дрейссеной при длине 140–180 мм. В 1990-х годах среди особей 180–220 мм встречались рыбы с разным типом питания, в этой группе, по сравнению с другими размерными группами, отмечена наибольшая частота встречаемости всеядной плотвы; среди особей 220–260 мм доля моллюскоядных рыб значительно превышала таковую предыдущей размерной группы, рыбы >260 мм были в основном моллюскоядные (Касьянов, Изюмов, 1997). Мы провели сравнение Иглз, разделив обследованных рыб на группы: растительноядные (длина тела 130–140 мм), условно растительноядные (длина тела 141–180 мм), со смешанным питанием (181–220 мм), моллюскоядные (221–270 мм) и наиболее крупные самки (271–320 мм).
Средняя масса глоточных зубов в значительной степени возрастает с увеличением длины тела, величины Иглз также несколько растут, однако их статистически достоверный рост наблюдается лишь при сравнении групп 141–180 и 181–220 мм и у самцов, и у самок (табл. 1). Достоверное повышение Иглз выявлено и между группами рыб с массой тела 40–100 и 170–300 г, возрастными группами 4–5 и 7–9 лет у особей обоих полов. Необходимо отметить значительное перекрывание предельных индивидуальных значений массы глоточных зубов и их индексов между размерно-массовыми и возрастными группами плотвы.
Таблица 1.
Масса тела, масса глоточных зубов и Иглз плотвы разных размерных групп
| Размерная группа, мм | Масса тела, г | Масса глоточных зубов, мг | Иглз, ‰ | n |
|---|---|---|---|---|
| Самки | ||||
| 130–140 | 38.20 ± 1.47* | $\frac{{91.18 \pm 5.70{\text{*}}}}{{76 - 105}}$ | $\frac{{2.38 \pm 0.07}}{{2.13 - 2.55}}$ | 5 |
| 141–180 | 62.46 ± 1.60* | $\frac{{150.42 \pm 4.38{\text{*}}}}{{86 - 36}}$ | $\frac{{2.42 \pm 0.04{\text{*}}}}{{1.79 - 3.72}}$ | 75 |
| 181–220 | 141.20 ± 2.90* | $\frac{{393.93 \pm 10.75{\text{*}}}}{{216 - 608}}$ | $\frac{{2.79 \pm 0.05{\text{*}}}}{{2.01 - 4.11}}$ | 76 |
| 221–270 | 246.39 ± 1.86* | $\frac{{696.45 \pm 7.82{\text{*}}}}{{364 - 1194}}$ | $\frac{{2.83 \pm 0.02}}{{1.64 - 4.66}}$ | 399 |
| 271–320 | 373.55 ± 6.59* | $\frac{{1095.45 \pm 24.24{\text{*}}}}{{776 - 1507}}$ | $\frac{{2.95 \pm 0.06}}{{2.11 - 3.95}}$ | 49 |
| Самцы | ||||
| 130–140 | 41.66 ± 1.55* | $\frac{{74.92 \pm 5.23{\text{*}}}}{{58 - 90}}$ | $\frac{{1.80 \pm 0.12}}{{1.51 - 2.09}}$ | 5 |
| 141–180 | 68.80 ± 2.10* | $\frac{{127.04 \pm 5.69{\text{*}}}}{{68 - 237}}$ | $\frac{{1.82 \pm 0.04{\text{*}}}}{{1.34 - 2.62}}$ | 49 |
| 181–220 | 137.41 ± 3.12* | $\frac{{296.37 \pm 8.58{\text{*}}}}{{136 - 523}}$ | $\frac{{2.15 \pm 0.03{\text{*}}}}{{1.31 - 2.78}}$ | 72 |
| 221–270 | 247.50 ± 5.25* | $\frac{{551.60 \pm 16.13{\text{*}}}}{{339 - 911}}$ | $\frac{{2.23 \pm 0.04}}{{1.74 - 3.14}}$ | 55 |
Для всей выборки не обнаружена достоверная связь (при p < 0.05) Иглз с количеством зубов на глоточных костях (r = 0.10 для самок, r = 0.08 для самцов). Индивидуальные значения индексов для групп с разным количеством зубов находятся в широких пределах. У мелких и средних самок (141–180 и 181–220 мм) с 10 зубами (формула 5–5) средние значения Иглз немного больше, чем у самок с 11 зубами (формула 6–5), у крупных, напротив, меньше, для группы 221–270 мм различия статистически достоверны (рис. 1). У самцов соотношение между этими группами аналогично таковому у самок.
Рис. 1.
Средние значения и их ошибка индексов глоточных зубов формул 5–5, 6–5 и 6–6 у плотвы разных размерных групп: а – самки, б – самцы. * Статистически достоверные различия между соседними столбцами.

Ранее Изюмов и Касьянов (1995) установили, что Va и Vt у потомства связаны только с таковыми у самок, а Vi – только с таковым у самцов, поэтому мы рассчитали Иглз у особей с разными позвоночными фенами отдельно у самок и самцов (табл. 2). Оказалось, что с увеличением числа позвонков достоверных различий между группами рыб по средним значениям количества зубов на глоточных дужках, их массе, а также по Иглз, нет. Следует отметить лишь некоторый рост средних значений Иглз с увеличением числа Va у самок и тенденцию к этому числа Vi у самцов.
Таблица 2.
Показатели глоточных зубов у плотвы с разным числом позвонков
| Позвонки | Число позвонков, шт. | Число глоточных зубов, шт. | Масса глоточных зубов, мг | Иглз, ‰ | n |
|---|---|---|---|---|---|
| Cамки | |||||
| Va | 15 | 10.85 ± 0.09 | 568.58 ± 77.02 | 2.59 ± 0.11 | 20 |
| 16 | 10.90 ± 0.02 | 533.60 ± 15.61 | 2.71 ± 0.03 | 278 | |
| 17 | 10.88 ± 0.03 | 528.73 ± 22.16 | 2.72 ± 0.04 | 118 | |
| Vt | 40 | 10.86 ± 0.06 | 528.84 ± 42.74 | 2.74 ± 0.07 | 36 |
| 41 | 10.92 ± 0.02 | 530.15 ± 16.36 | 2.70 ± 0.03 | 261 | |
| 42 | 10.84 ± 0.04 | 541.90 ± 23.46 | 2.70 ± 0.04 | 116 | |
| Cамцы | |||||
| Vi | 2 | 10.90 ± 0.04 | 319.33 ± 21.99 | 2.13 ± 0.05 | 49 |
| 3 | 10.90 ± 0.03 | 305.32 ± 17.84 | 2.04 ± 0.03 | 108 | |
| 4 | 10.79 ± 0.11 | 374.61 ± 53.48 | 2.22 ± 0.09 | 14 | |
Примечание. Обозначения, как в табл. 1.
У рыб обоих полов различия средних значений Иглз между группами мелких рыб (130–140 и 141–180 мм), а также между более крупными (181–220, 221–270 мм и выше) статистически недостоверны (табл. 1). Поэтому, объединив эти группы, мы проанализировали по два размерных класса для самок и самцов: с длиной тела 130–180 и 181–320 мм.
Согласно положению статистики, что в пределах интервала x ± 0.67σ (где x – средняя арифметическая для данной группы, σ – стандартное отклонение) лежит ~50% вариант вариационного ряда, в каждом из двух размерных классов самок и самцов были выделены группы с разными Иглз следующим образом. Иглз, имеющие величину выше x + 0.67σ, условно определили, как высокие Иглз, ниже x – 0.67σ – как низкие, находящиеся в пределах x ± 0.67σ, – как средние. Расчет числа позвонков в отделах позвоночника групп рыб с разной величиной Иглз показал следующее (табл. 3). Достоверные различия отмечены только для Vc и Vt, причем у крупных самок происходит снижение среднего числа позвонков с увеличением индекса, а у мелких самцов, напротив, увеличение – от особей группы со средними Иглз к группе с высокими.
Таблица 3.
Число (x ± mx) позвонков у плотвы с разным значением Иглз
| Размерный класс, мм | Группа Иглз | Иглз, ‰ | Va | Vi | Vc | Vt | n |
|---|---|---|---|---|---|---|---|
| Самки | |||||||
| 130–180 | Н | 1.74–2.18 | 16.22 ± 0.13 | 2.83 ± 0.12 | 15.06 ± 0.10 | 41.11 ± 0.11 | 18 |
| Ср | 2.19–2.63 | 16.22 ± 0.08 | 2.78 ± 0.08 | 15.13 ± 0.09 | 41.13 ± 0.08 | 46 | |
| В | 2.64–3.08 | 16.08 ± 0.14 | 2.92 ± 0.18 | 15.15 ± 0.10 | 41.15 ± 0.19 | 13 | |
| 181–320 | Н | 1.92–2.52 | 16.26 ± 0.04 | 2.76 ± 0.04 | 15.31 ± 0.05* | 41.33 ± 0.05* | 140 |
| Ср | 2.53–3.13 | 16.28 ± 0.04 | 2.81 ± 0.03 | 15.10 ± 0.04* | 41.19 ± 0.04* | 263 | |
| В | 3.14–3.74 | 16.32 ± 0.08 | 2.77 ± 0.06 | 15.07 ± 0.06 | 41.16 ± 0.08 | 90 | |
| Самцы | |||||||
| 130–180 | Н | 1.23–1.62 | 16.17 ± 0.15 | 2.72 ± 0.16 | 15.17 ± 0.17 | 41.06 ± 0.17 | 18 |
| Ср | 1.63–2.02 | 15.96 ± 012 | 2.83 ± 0.12 | 15.04 ± 0.08* | 40.78 ± 0.14* | 23 | |
| В | 2.03–2.41 | 16.09 ± 0.28 | 2.73 ± 0.19 | 15.45 ± 0.16* | 41.27 ± 0.19* | 11 | |
| 181–320 | Н | 1.58–1.98 | 16.35 ± 0.10 | 2.79 ± 0.08 | 15.06 ± 0.10 | 41.21 ± 0.10 | 34 |
| Ср | 1.99–2.38 | 16.27 ± 0.07 | 2.70 ± 0.08 | 15.12 ± 0.09 | 41.10 ± 0.08 | 60 | |
| В | 2.39–2.79 | 16.21 ± 0.17 | 2.86 ± 0.15 | 15.21 ± 0.13 | 41.28 ± 0.20 | 29 | |
Примечание. Н – низкий Иглз, Ср – средний Иглз, В – высокий Иглз. Жирным шрифтом отмечены статистически достоверные различия (p < 0.05). Остальные обозначения как в табл. 1.
Изучение изменчивости фенотипов по частоте встречаемости различных комбинаций числа позвонков в отделах позвоночника показало увеличение разнообразия у рыб обоих полов от низких Иглз к особям с высокими Иглз (табл. 4). Если, сохраняя зафиксированное нами для обследованных рыб соотношение число рыб/число фенотипов, пересчитать для каждой группы число фенотипов при 100 экз. рыб в них, то получим для самок с низкими, средними и высокими Иглз число фенотипов у мелких рыб 39, 26 и 54 соответственно, у крупных – 11, 8 и 19, для мелких самцов – 56, 43 и 73, а также 26, 25 и 66 соответственно. При этом у групп со средним Иглз оказалось минимальное число фенотипов, с высокими – максимальное в обоих размерных классах у самок и самцов. Доля семи основных фенотипов уменьшается в ряду от рыб с низким Иглз к рыбам с высоким Иглз у мелких самок и крупных самцов. Однако у крупных самок и мелких самцов с высоким Иглз этот показатель был немного выше по сравнению с имеющими средний Иглз. Наиболее часто во всех группах встречается фенотип 16–3–15. Его частота ниже у особей с высоким Иглз, чем с низким (за исключением мелких самцов). Наименее встречаемый фенотип среди cеми основных – 17–3–14, у рыб длиной 130–180 мм он отмечен лишь у самок со средним Иглз, у самцов не зафиксирован.
Таблица 4.
Частота встречаемости (в долях от 1) основных позвонковых фенотипов у плотвы в группах с низким (Н), средним (Ср) и высоким (В) Иглз
| Фенотип | Размерный класс | |||||
|---|---|---|---|---|---|---|
| 130–180 мм | 181–320 мм | |||||
| Н | Ср | В | Н | Ср | В | |
| Самки | ||||||
| 16–3–14 | 0.056 | 0.043 | – | 0.036 | 0.053 | 0.044 |
| 16–3–15 | 0.500 | 0.457 | 0.462 | 0.393 | 0.373 | 0.389 |
| 16–3–16 | 0.056 | 0.109 | 0.077 | 0.179 | 0.087 | 0.067 |
| 17–2–15 | 0.167 | 0.109 | 0.077 | 0.107 | 0.114 | 0.133 |
| 17–2–16 | – | 0.087 | 0.077 | 0.107 | 0.065 | 0.111 |
| 17–3–14 | – | 0.043 | – | – | 0.042 | 0.033 |
| 17–3–15 | 0.111 | 0.022 | – | 0.050 | 0.091 | 0.067 |
| Всего фенотипов, шт. | 7 | 12 | 7 | 15 | 21 | 17 |
| Доля 7 основных фенотипов, % | 88.89 | 86.96 | 69.23 | 87.14 | 82.51 | 84.44 |
| n | 18 | 46 | 13 | 140 | 263 | 90 |
| Самцы | ||||||
| 16–3–14 | 0.167 | 0.043 | – | 0.088 | 0.050 | 0.034 |
| 16–3–15 | 0.167 | 0.348 | 0.273 | 0.441 | 0.317 | 0.207 |
| 16–3–16 | 0.167 | 0.043 | 0.091 | 0.088 | 0.083 | 0.069 |
| 17–2–15 | 0.167 | 0.043 | 0.182 | 0.118 | 0.117 | 0.034 |
| 17–2–16 | – | – | 0.091 | 0.088 | 0.050 | 0.103 |
| 17–3–14 | – | – | – | 0.059 | 0.100 | – |
| 17–3–15 | 0.056 | 0.087 | – | 0.059 | 0.033 | 0.069 |
| Всего фенотипов, шт. | 10 | 10 | 8 | 9 | 15 | 19 |
| Доля 7 основных фенотипов, % | 72.22 | 56.52 | 63.64 | 94.12 | 75.00 | 51.72 |
| n | 18 | 23 | 11 | 34 | 60 | 29 |
Примечание. “–” – отсутствие рыб с данным фенотипом. Остальные обозначения, как в табл. 1 и 3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
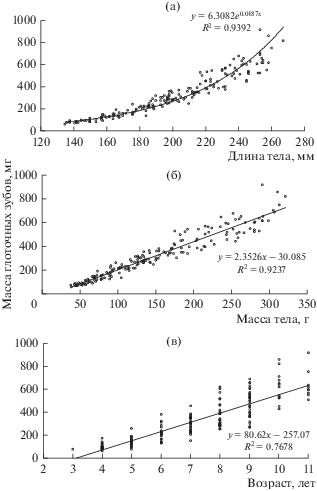
Масса глоточных зубов в значительной степени обусловлена размерами плотвы, корреляция с массой тела, длиной и возрастом тесная и положительная, однако изменения с ростом биологических показателей происходят неравномерно. Выявлено заметное увеличение массы глоточных зубов при повышении длины тела с 170 до 200 мм, массы тела – с 90 до 200 г и возраста – с 5 до 7 лет. Связь индивидуальных значений массы глоточных зубов с длиной тела лучше всего отражают уравнения экспоненциальной регрессии, а связь с массой тела и возрастом – линейной регрессии (рис. 2, 3).
Рис. 2.
Изменение массы глоточных зубов у самок плотвы разной длины (а), массы тела (б) и возраста (в).

Рис. 3.
Изменение массы глоточных зубов у самцов плотвы разной длины (а), массы тела (б) и возраста (в).
Увеличение массы глоточных зубов с размерами рыб отмечено у черного амура Mylopharyngodon piceus Richardson, также оказалось, что у особей, питавшихся мягкой пищей, их масса достигала лишь 50.7% массы зубов рыб того же размера, питавшихся твердой пищей (Hung et al., 2015). Морфологические изменения пищевого аппарата и даже формы тела, связанные с изменениями функциональной морфологии в онтогенезе, когда при размерах >200 мм происходит переход на питание бентосными макробеспозвоночными, описаны для плотвы из шведского оз. Касшё (Kassjo) (Hjelm et al., 2003). Согласно данным этих авторов, изменения массы глоточных зубов взаимосвязаны с изменением питания и особенностями физиологического обмена рыб в онтогенезе. Для исключения фактора обусловленности массы глоточных зубов от размерно-массовых характеристик особей, в настоящей работе нами был использован Иглз. Его корреляция с размерно-массовыми характеристиками и возрастом оказалась средней у самцов и слабой у самок.
Nagelkerke, Sibbing (1996) сравнили эффективность питания дрейссеной леща (Abramis brama L.), густеры (Blicca bjoerkna L.) и плотвы. Зафиксировано, что отношение массы глоточной кости к массе тела наибольшее у плотвы, это способствует раздавливанию раковин моллюсков. Максимальные и оптимальные размеры добычи тоже были самыми высокими у плотвы, для которой характерны и высокие индивидуальные значения эффективности питания. Потребление дрейссены приводит к увеличению упитанности и темпа роста. В частности, отмечено повышение темпа роста плотвы в оз. Плещеево после вселения и распространения Dreissena polymorpha (Касьянов, Изюмов, 1995). Анализ генетической дифференцировки моллюскоядной и растительноядной плотвы озера наряду с данными остеометрии глоточных зубов позволил сделать вывод скорее об экологической, но не генетической, обусловленности различий между этими экологическими формами (Кодухова, Карабанов, 2017).
Показано, что у моллюскоядной плотвы выше частота глоточных зубов формулы 6–5 и ниже – 5–5 (Изюмов, 1981; Касьянов и др., 1981). Предположение о том, что с увеличением количества зубов на глоточных костях может возрасти их общая масса, не подтвердилось. Оказалось, что только у крупных рыб (221–270 мм) обоих полов средние значения Иглз особей, имеющих 11 зубов (формула 6–5), статистически достоверно выше, чем у особей с 10 зубами (формула 5–5), тогда как у мелких и средних рыб нет достоверных различий по этому показателю (рис. 1).
На примере некоторых видов рыб установлено, что полиморфизм глоточных зубов обусловлен в основном генетическими факторами, но зависит и от экологических (Nzau Matondo et al., 2008; Pasco-Viel et al., 2014; Hulsey et al., 2017). Отмечено влияние тиреоидных гормонов и температуры в период развития икры на варьирование формулы глоточных зубов африканского усача Barbus intermedius complex sensu Banister (1973) (Shkil et al., 2010). У плотвы действие этих гормонов привело к появлению формул 5–4 и 4–4 (Bolotovskiy, Levin, 2011), а электромагнитного поля – формулы 7–5 (Chebotareva et al., 2009). Число позвонков у рыб также в основном наследуется потомством (Кирпичников, 1987; Изюмов, Касьянов, 1995). По этой причине число позвонков и формулу глоточных зубов наряду молекулярным статусом видов используют в филогенетических исследованиях (Roudbar et al., 2016). Однако воздействие на ранних стадиях онтогенеза некоторых факторов окружающей среды, токсикантов или гормонов, может вызвать не только аномалии позвонков, но и изменение их числа (Chebotareva, 2009; Bolotovskiy, Levin, 2018).
В результате изучения связи между этими в значительной степени наследуемыми признаками обнаружено, что на уровне всей выборки отсутствует корреляция массы глоточных зубов и их индексов с числом позвонков. У рыб с разным числом позвонков в отделах и в целом позвоночнике нет статистически достоверных различий по массе глоточных зубов и Иглз (табл. 2). Сравнение рыб двух размерных классов с разными Иглз по Va и Vt у самок, Vi – у самцов не показало четкой связи, почти все различия между средними значениями статистически недостоверны (табл. 3). Для самок и самцов с высоким Иглз характерна наибольшая изменчивость, т.е. у них обнаружено максимальное число позвонковых фенотипов, для рыб со средним Иглз – наименьшая (табл. 4). Не удалось выявить какой-либо корреляции величин Иглз и частот встречаемости наиболее массового во всех группах фенотипа 16–3–15. Полученные результаты не позволяют говорить о существовании четкой связи между Иглз и числом позвонков, а также – Иглз и разнообразием фенотипов.
Проведенная нами ранее (Komova, 2016) оценка изменений уровня плодовитости самок плотвы показала статистически достоверные приросты индивидуальной абсолютной плодовитости и относительной плодовитости от четырехлетних особей к шестилетним, затем – к особям 9–10 лет. Установлено также значительное увеличение диаметра и массы икринок у крупных самок по сравнению с мелкими. Существенный рост индивидуальной абсолютной плодовитости у самок тех же возрастов и у рыб длиной 200–220 мм описан В.М. Володиным (1963) для плотвы Рыбинского водохранилища. Увеличение индивидуальной абсолютной плодовитости у шестилетних рыб (по сравнению с пятилетними) отмечено у плотвы Запорожского водохранилища и каспийской воблы (Rutilus rutilus caspicus L.) из заливов р. Терек (Шихшабеков и др., 2013). Анализ наличия связи генеративных показателей с относительной массой глоточных зубов у самок плотвы свидетельствовал о той же направленности прироста величин Иглз, как и плодовитости, – от молодых, впервые созревающих самок к рыбам среднего возраста (Комова, Комова, 2018). Отмечено, что описанная тенденция роста плодовитости вызвана не повышением Иглз, а увеличением размеров самок, т.е. прирост плодовитости не зависит напрямую от величины глоточных зубов, а обусловлен интенсификацией генеративного обмена от впервые созревших рыб к более крупным особям среднего возраста, имеющим наиболее высокий его уровень.
Таким образом, с одной стороны, более мощные глоточные зубы у рыб, достигших определенной длины, позволяют им потреблять более калорийный корм, с другой, это приводит к улучшению роста, и, соответственно, увеличению глоточных зубов, усилению жиронакопления и генеративного обмена.
Выводы. На уровне всей выборки масса глоточных зубов плотвы положительно коррелирует с массой тела, длиной и возрастом, для Иглз связь с этими показателями средняя у самцов и слабая у самок. Значения Иглз у рыб обоих полов статистически достоверно возрастают при увеличении длины тела с 170 до 200 мм, массы тела – с 90 до 150 г и возраста – с 5 до 7 лет, когда плотва переходит на питание более калорийной пищей (моллюском дрейссеной) и возрастает темп роста. Относительная масса глоточных зубов у исследованных рыб не зависит от числа зубов. У крупных рыб (>220 мм) средние значения Иглз особей, имеющих 11 зубов (формула 6–5), статистически достоверно выше, чем у особей с 10 зубами (формула 5–5). У мелких и средних особей достоверных различий Иглз между группами особей с разными формулами зубов не наблюдается. Масса глоточных зубов и Иглз не связаны с генетически обусловленными признаками: числом позвонков в позвоночнике и его отделах. Вместе с тем, у рыб с высоким Иглз обнаружено максимальное число позвонковых фенотипов, что свидетельствует о более высокой фенотипической изменчивости этой группы.
Список литературы
Володин В.М. 1963. Плодовитость плотвы Rutilus rutilus (L.) в Рыбинском водохранилище // Вопр. ихтиол. Т. 3. Вып. 2(27). С. 266.
Герасимов Ю.В., Столбунов И.А., Лёвин Б.А. и др. 2015. Плотва // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ярославль: Филигрань. С. 263.
Изюмов Ю.Г. 1981. Экологические морфы плотвы Rutilus rutilus L. в Рыбинском водохранилище // Биология внутренних вод: Информ. бюл. Ленинград: Наука. № 50. С. 65.
Изюмов Ю.Г., Касьянов А.Н. 1995. О наследственной обусловленности числа позвонков у плотвы Rutilus rutilus // Вопр. ихтиол. Т. 35. № 5. С. 594.
Кирпичников В.С. 1987. Генетика и селекция рыб. Ленинград: Наука.
Касьянов А.Н., Изюмов Ю.Г. 1995. К изучению роста и морфологии плотвы Rutilus rutilus (L.) оз. Плещеево в связи с вселением дрейссены // Вопр. ихтиол. Т. 35. № 4. С. 546.
Касьянов А.Н., Изюмов Ю.Г. 1997. Изменчивость плотвы Rutilus rutilus (L.) в Рыбинском водохранилище // Современное состояние рыбных запасов Рыбинского водохранилища. Ярославль: Ин-т биол. внутр. вод РАН. С. 132.
Касьянов А.Н., Яковлев В.Н., Изюмов Ю.Г., Жгарева Н.Н. 1981. Изменчивость глоточных зубов плотвы Rutilus rutilus (L.) в зависимости от типа питания // Вопр. ихтиол. Т. 21. № 4. С. 595.
Кодухова Ю.В., Карабанов Д.П. 2017. Морфологические изменения в популяции плотвы (Rutilus rutilus, Cyprinidae) озера Плещеево в результате вселения моллюска Dreissena polymorpha (Bivalvia) // Зоол. журн. Т. 96. № 9. С. 1069. https://doi.org/10.7868/S0044513417090100
Комова Н.И., Изюмов Ю.Г. 2012. Линейный рост плотвы Rutilus rutilus (L.) Волжского плеса Рыбинского водохранилища // Ярославл. пед. вестник, III (Естественные науки). № 2. С. 70.
Комова Н.И., Комова А.В. 2018. О возможной связи плодовитости с массой глоточных зубов у плотвы Rutilus rutilus (L., 1758) (Cyprinidae, Cypriniformes) // Тр. Инст. биол. внутр. вод. Вып. 84(87). С. 85. https://doi.org/10.24411/0320-3557-2018-10021
Поддубный А.Г. 1966. Об адаптивном ответе популяции плотвы на изменение условий обитания // Тр. Инст. биол. внутр. вод. Вып. 10(13). Москва: Наука. С. 131.
Шихшабеков М.М., Рабазанов Н.И., Федоненко Е.В. и др. 2013. Особенности воспроизводства рыб рода Rutilus в водоемах южных широт // Биол. вестник Мелитопольского гос. пед. ун-та им. Б. Хмельницкого. № 3(3). С. 203. https://doi.org/10.7905/bbmspu.v0i3(6).544
Berkovitz B., Shellis P. 2017. Chapter 4. Osteichthyes // The teeth of non-mammalian vertebrates. Amsterdam: Academic Press. P. 43. https://doi.org/10.1016/B978-0-12-802850-6.00004-7
Bolotovskiy A.A., Levin B.A. 2011. Effect of thyroid hormones on the development of pharyngeal dentition in roach Rutilus rutilus (Cyprinidae, Cypriniformes) // J. Ichthyol. V. 51. P. 474. https://doi.org/10.1134/S0032945211040035
Bolotovskiy A.A., Levin B.A. 2018. Effects of thyroid hormones on vertebral numbers in two cyprinid fish species: Rutilus rutilus (Linnaeus, 1758) and Abramis brama (Linnaeus, 1758) // J. Appl. Ichthyol. V. 34. P. 449. https://doi.org/10.1111/jai.13659
Chebotareva Yu.V. 2009. Anomalies in the backbone structure in roach (Rutilus rutilus) (Cyprinidae, Cypriniformes) underyearlings following toxic impacts during early developmental stages // J. Ichthyol. V. 49. P. 96. https://doi.org/10.1134/S0032945209010123
Chebotareva Yu.V., Izyumov Yu.G., Krylov V.V. 2009. The effect of an alternating electromagnetic field upon early development in roach Rutilus rutilus (L.) (Cyprinidae, Cypriniformes) // J. Ichthyol. V. 49. P. 409. https://doi.org/10.1134/S0032945209050075
Clark A.J., Summers A.P. 2007. Morphology and kinematics of feeding in hagfish: possible functional advantages of jaws // J. Exp. Biol. V. 210. P. 3897. https://doi.org/10.1242/jeb.006940
Hjelm J., van de Weerd G.H., Sibbing F.A. 2003. Functional link between foraging performance, functional morphology, and diet shift in roach (Rutilus rutilus) // Can. J. Fish. Aquat. Sci. V. 60. P. 700. https://doi.org/10.1139/F03-058
Hulsey C.D., Roberts R.J., Lin A.S.P. et al. 2008. Convergence in a mechanically complex phenotype: detecting structural adaptations for crushing in cichlid fish // Evolution. V. 62. Is.7. P. 1587. https://doi.org/10.1111/j.1558-5646.2008.00384.x
Hulsey C.D., Machado-Schiaffino G., Keicher L. et al. 2017. The integrated genomic architecture and evolution of dental divergence in East African Cichlid Fishes (Haplochromis chilotes × H. nyererei) // G3: Genes, Genomes, Genetics. V. 7. Is. 9. P. 3195. https://doi.org/10.1534/g3.117.300083
Hung N.M., Ryan T.M., Stauffer J.R., Madsen H. 2015. Does hardness of food affect the development of pharyngeal teeth of the black carp, Mylopharyngodon piceus (Pisces: Cyprinidae)? // Biological Control. V. 80. P. 156. https://doi.org/10.1016/j.biocontrol.2014.10.001
Komova N.I. 2016. Comparative analysis of generative parameters of the Roach Rutilus rutilus (L., 1758) in the Volga reach of the Rybinsk Reservoir // Inl. Water Biol. V. 9. № 3. P. 289. https://doi.org/10.1134/S1995082916030093
Komova N.I. 2018. Morphological variability of roach Rutilus rutilus (L.) from the Volga Reach of Rybinsk Reservoir // Inl. Water Biol. V. 11. № 3. P. 371. https://doi.org/10.1134/S1995082918030069
Kramer A., Kovačić M., Patzner R.A. 2012. Dentition of eight species of Mediterranean Sea Gobiidae: do dentition characters of gobies reflect phylogenetic relationships? // J. Fish Biology. V. 80. Is. 1. P. 29. https://doi.org/10.1111/j.1095-8649.2011.03137.x
Nagelkerke L.A.J., Sibbing F.A. 1996. Efficiency of feeding on zebra mussel (Dreissena polymorpha) by common bream (Abramis brama), white bream (Blicca bjoerkna), and roach (Rutilus rutilus): the effects of morphology and behavior // Can. J. Fish. Aquat. Sci. V. 53. № 12. P. 2847. https://doi.org/10.1139/f96-229
Nakajima T. 1987. Development of pharyngeal dentition in the cobitid fishes, Misgurnus anguillicaudatus and Cobitis biwae, with a consideration of evolution of cypriniform dentitions // Copeia. V. 1987. № 1. P. 208. https://doi.org/10.2307/1446055
Nzau Matondo B., Ovidio M., Poncin P. et al. 2008. Morphological recognition artificial F1 hybrids between three common European cyprinid species: Rutilus rutilus, Blicca bjoerkna and Abramis brama // Acta Zool. Sin. V. 54. № 1. P. 144.
Pasco-Viel E., Yang L., Veran M. et al. 2014. Stability versus diversity of the dentition during evolutionary radiation in cyprinine fish // Proceedings of the Royal Society // Biological Sciences. V. 281: 20132688. P. 1. https://doi.org/10.1098/rspb.2013.2688
Roudbar A.J., Eagderi S., Esmaeili H.R. et al. 2016. A molecular approach to the genus Alburnoides using COI sequences data set and the description of a new species, A. damghani, from the Damghan River system (the Dasht-e Kavir Basin, Iran) (Actinopterygii, Cyprinidae) // ZooKeys. V. 579. P. 157. https://doi.org/10.3897/zookeys.579.7665
Shkil F., Levin B., Abdissa B., Smirnov S.V. 2010. Variability in the number of tooth rows in the pharyngeal dentition of Barbus intermedius (Teleostei; Cyprinidae): Genetic, hormonal and environmental factors // J. Appl. Ichthyol. V. 26. P. 315. https://doi.org/10.1111/j.1439-0426.2010.01428.x
Sibbing F.A. 1991. Food capture and oral processing // Cyprinid Fishes. Fish and Fisheries Series. V. 3. Dordrecht: Springer. P. 377. https://doi.org/10.1007/978-94-011-3092-9_13
Tao W., Yang L., Mayden R.L., He S. 2019. Phylogenetic relationships of Cypriniformes and plasticity of pharyngeal teeth in the adaptive radiation of cyprinids // Sci. China Life Sci. V. 62. № 4. P. 553. https://doi.org/10.1007/s11427-019-9480-3
Vandewalle P., Huyssene A., Aerts P., Veraes W. 1994. The pharyngeal apparatus in teleost feeding // Biomechanics of Feeding in Vertebrates. Berlin: Springer. P. 59.
Wainwright P.C. 2005. Functional morphology of the pharyngeal jaw apparatus // Fish Physiology: Fish Biomechanics. V. 23. P. 77. https://doi.org/10.1016/S1546-5098(05)23003-0
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


