Биология внутренних вод, 2021, № 2, стр. 208-216
Влияние фенола на активность и температурные характеристики пептидаз личинок хирономид при различных значениях рН
В. В. Кузьмина a, *, Е. Ю. Чорная b, В. А. Шептицкий b
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Ярославская обл., Некоузский р-н, Россия
b Приднестровский государственный университет им. Т.Г. Шевченко
Тирасполь, Молдова
* E-mail: vkuzmina@ibiw.ru
Поступила в редакцию 27.11.2019
После доработки 26.03.2020
Принята к публикации 06.10.2020
Аннотация
Исследовано влияние фенола (0.5 ммоль/л) на активность и температурную зависимость казеин- и гемоглобинлитических пептидаз, функционирующих во всем организме личинок хирономид Chironomus sp. в интервале температур 0–70°С при различных значениях рН (3.0, 5.0 и 7.4). Температурный оптимум исследованных пептидаз тканей личинок хирономид соответствует 40°С. В присутствии Ф активность казеинлитических пептидаз увеличивается, наиболее значительно при 20°С и рН 5.0 (в 3.3 раза), активность гемоглобинлитических пептидаз – при рН 3.0 (в 3.5 раза). Эффект при обеих температурах последовательно снижается от рН 3.0 до рН 7.4. В присутствии фенола форма кривых температурной зависимости и величина температурного коэффициента Q10 наиболее заметно изменяется в зоне высоких температур. Значения энергии активации пептидаз, гидролизующих казеин и гемоглобин, в зоне низких и высоких температур различны. В присутствии фенола значения энергии активации казеинлитических пептидаз при рН 7.4 увеличиваются, при рН 5.0 – уменьшаются в зоне высоких температур, гемоглобинлитических пептидаз – в большинстве случаев уменьшаются. Обсуждаются механизмы влияния фенола на активность пептидаз и процессы пищеварения рыб-бентофагов, потребляющих личинок хирономид.
ВВЕДЕНИЕ
Известно, что личинки хирономид, будучи объектами питания различных гидробионтов, играют важную роль в функционировании трофических сетей в водных экосистемах (Гусаков, 2007; Zelli et al., 2008; Рыбы…, 2015). При этом лишь на первой стадии развития они входят в состав зоопланктона, на трех последующих стадиях развития – в состав детрита (Pinder, 1986; Гусаков, 2007; Wardiatno, Krisanti, 2013). При этом наиболее важную роль личинки хирономид играют в питании рыб-бентофагов, многие из которых не имеют желудка (Иванова и др., 1978; Wardiatno, Krisanti, 2013; Рыбы…, 2015). Следовательно, у большей части рыб-бентофагов процессы пищеварения происходят в кишечнике при участии ферментов, синтезируемых поджелудочной железой и энтероцитами, осуществляющими полостное и мембранное пищеварение (Уголев, Кузьмина, 1993).
Вместе с тем в процессах деградации объектов питания значительную роль может играть и механизм индуцированного аутолиза (Уголев, 1985). В реализации индуцированного аутолиза участвуют две группы внутриклеточных ферментов (цитозольные и лизосомальные) различных тканей. Наиболее важны лизосомальные ферменты, способные разрушать почти все биополимеры тканей животных (Высоцкая, Немова, 2008). Оптимум рН большинства лизосомальных ферментов, как правило, лежит в пределах 3.0–6.0, реже – при нейтральных значениях рН (Высоцкая, Немова, 2008). Вскоре после описания индуцированного аутолиза была доказана возможность его участия в пищеварении рыб (Уголев, Кузьмина, 1993; Кузьмина, 2000). Наиболее важную роль механизм индуцированного аутолиза играет в процессах пищеварения, происходящих при низких значениях рН в желудке рыб (Кузьмина, 2000). Роль этого механизма в процессах аутодеградации объектов питания у безжелудочных рыб подробно не исследована, однако и у них может осуществляться индуцированный аутолиз при нейтральных и низких значениях рН. Действительно, в результате перетирания жертвы глоточными зубами, а также снижении концентрации кислорода в организме жертвы при ее попадании в верхние отделы кишечника в тканях усиливаются процессы гликолиза, вызывающие закисление интрацеллюлярной среды (Кузьмина, 2018). И первое, и второе создает условия для высвобождения ферментов из лизосом и реализации индуцированного аутолиза в тканях жертвы.
Поскольку большинство видов рыб являются зоофагами (Рыбы…, 2015), в тканях которых преобладают белки, наибольшее внимание уделяется ферментам, гидролизующим белковые компоненты пищи (Кузьмина, 2018). Вместе активность пептидаз (протеиназ) ранее изучали преимущественно у морских представителей типа членистоногих, Arthropoda в частности у десятиногих раков Decapoda (Dendinger, 1987; Glass, Stark, 1994; Boetius, Felbeck, 1995; Diaz-Tenorio et al., 2006; Navarrete del Toro et al., 2006; Sriket et al., 2011). Сведения о температурных характеристиках пептидаз, функционирующих в организме объектов питания молоди всех видов рыб и взрослых бентофагов, обитающих в пресноводных водоемах, фрагментарны (Кузьмина, 1999; Скворцова и др., 2016). Однако в последние десятилетия показано, что различные антропогенные факторы, включая Ф и его производные, оказывают существенное влияние на активность пищеварительных гидролаз рыб (Кузьмина, 2018).
Известно, что Ф, образующийся в процессе метаболизма водных организмов, а также в процессе биохимического разложения и трансформации органических веществ, происходящих в воде и донных отложениях, не представляет угрозу для экосистем (Michałowicz, Duda, 2007; Ali et al., 2011). Однако при попадании в воду отходов промышленного производства, особенно предприятий нефте- и сланцеперерабатывающей, коксо- и целлюлозно-бумажной, деревообрабатывающей, металлургической, а также анилинокрасочной промышленности, Ф и его производные становятся опасными для гидробионтов (Лукьяненко, 1983; Флеров, 1989; Michałowicz, Duda, 2007; Gad, Saad, 2008; Mai et al., 2012; Singh, Chandra, 2019).
Ф вызывает дисфункцию центральной нервной системы (Матей, 1970; Лукьяненко, 1983; Флеров, 1989), в значительной мере из-за блокирования ионных каналов (Michałowicz, Duda, 2007). Кроме того, он вызывает некроз кожи, повреждает жабры, почки, мышцы, глаза и иммунную систему. Также Ф и его производные оказывают негативное влияние на активность пептидаз кишечника у большинства исследованных видов рыб (Тарлева и др., 2018). Сведения о влиянии Ф на активность и характеристики ферментов объектов питания рыб крайне скудны. Наибольший интерес представляют личинки хирономид, играющих в пищевых сетях водных экосистем одновременно роль консумента и жертвы (Гусаков, 2007; Рыбы…, 2015). Известно, что Ф модифицирует активность и температурные характеристики пептидаз личинок хирономид при нейтральных значениях рН (Кузьмина и др., 2017). Однако процессы индуцированного аутолиза проходят при кислых значениях рН (Уголев, 1985; Кузьмина, 2000). Сведения о влиянии Ф на активность и температурные характеристики пептидаз целого организма личинок хирономид при разных значениях рН в доступной литературе отсутствуют.
Цель работы – получить сведения о влиянии Ф на активность и температурные характеристики пептидаз, функционирующих во всем организме личинок хирономид, при различных значениях рН в условиях in vitro.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования – личинки хирономид Chironomus sp. Средняя масса одной личинки 7.5 ± 0.5 мг. Для определения активности и характеристик пептидаз использован метод смешанных проб (Егорова и др., 1974). В качестве ферментативно активных препаратов использовали гомогенаты предварительно измельченных и тщательно перемешанных десятков личинок. Все операции проводили на холоде. Аликвоты образцов (0.5–1.0 г) гомогенизировали в стеклянном гомогенизаторе с небольшим количеством раствора Рингера для холоднокровных животных (103 мМ NaCl, 1.9 мМ KCl, 0.45 мМ CaCl2, рН 3.0, 5.0 или 7.4) при температуре 2–4°С. Для этого стеклянный гомогенизатор помещали в стакан со льдом. Гомогенат далее разбавляли раствором Рингера до конечного разведения 1 : 99 (масса/объем).
Температурную зависимость определяли в диапазоне температур 0–70°С (шаг – 10°С).
Для оценки влияния Ф (фирма “Вектон”, г. Санкт-Петербург) на активность пептидаз в целом организме личинок хирономид 0.25 мл гомогената и 0.25 мл Ф в начальной концентрации 0.5 ммоль/л (47.1 мг/л) предварительно инкубировали в течение 1 ч при постоянном перемешивании. После прединкубации концентрация Ф была 0.25 ммоль/л или 23.5 мг/л. Затем в пробирки добавляли 0.5 мл 1%-ного субстрата (казеина или гемоглобина, рН 3.0, 5.0 или 7.4), приготовленного в растворе Рингера. В первом случае определяли казеинлитическую активность, во втором – гемоглобинлитическую. Смесь инкубировали еще 30 мин в специальных термостатируемых камерах при постоянном перемешивании. Все операции проводили при температуре 20°С. Активность пептидаз оценивали по увеличению концентрации тирозина с использованием реагента Фолина-Чиокалтеу (Anson, 1938). Ферментативную активность определяли в пяти биохимических повторностях (n = 5). Об уровне активности ферментов судили по увеличению продуктов реакции с учетом фона (количество тирозина в исходном гомогенате) в расчете на 1 г влажной ткани за 1 мин инкубации субстрата и ферментативно активного препарата, мкмоль/(г мин). Интенсивность окраски оценивали с помощью фотоколориметра (КФК-2) при длине волны 670 нм. Кроме того, рассчитывали температурные коэффициенты (Q10), а также значения энергии активации (Еакт), которые определяли при помощи графического метода Аррениуса и формуле:
Еакт = 2.3 × 1.987T2T1(lg V2 − lg V1)/(T2 − T1),
где 2.3 – модуль перехода десятичного в натуральный логарифм, 1.987 – газовая постоянная, Т – температура, °К (°К =°С + 273), V – скорость реакции.
Результаты обработки статистических данных представлены в виде средних значений и их ошибок (M ± m). Значимость различий между показателями оценивали с использованием критерия Стьюдента для малых выборок при р ≤ 0.05 − р < 0.001.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние фенола на активность и температурную зависимость пептидаз личинок хирономид по казеину при разных значениях рН. Активность казеинлитических пептидаз всех тканей контрольных особей личинок хирономид при температуре 20°С и рН 7.4 выше, чем при рН 5.0 в 2.2 раза, при 40°С – в 1.4 раза (табл. 1). В присутствии Ф активность казеинлитических пептидаз в указанных условиях увеличивается, наиболее значительно при 20°С и рН 5.0. Изучение активности пептидаз в широком диапазоне температур позволило выявить различия в форме кривых температурной зависимости казеинлитических пептидаз, функционирующих в отсутствие и в присутствии Ф при разных значениях рН (рис. 1).
Таблица 1.
Влияние фенола на активность казеинлитических и гемоглобинлитических пептидаз при различных значениях температуры и рН
| Субстрат | рН | Ферментативная активность, мкмоль/(г мин) при | |
|---|---|---|---|
| 20°С | 40°С | ||
| Казеин | 5.0 | $\frac{{0.37 \pm 0.02}}{{1.21 \pm 0.17{\text{**}}\left( {3.3} \right)}}$ | $\frac{{1.17 \pm 0.06}}{{2.35 \pm 0.21{\text{**}}\left( {2.0} \right)}}$ |
| 7.4 | $\frac{{0.81 \pm 0.14}}{{0.94 \pm 0.20\left( {1.2} \right)}}$ | $\frac{{1.65 \pm 0.13}}{{3.72 \pm 0.21{\text{**}}\left( {2.3} \right)}}$ | |
| Гемоглобин | 3.0 | $\frac{{0.64 \pm 0.09}}{{2.27 \pm 0.35{\text{**}}\left( {3.5} \right)}}$ | $\frac{{1.22 \pm 0.17}}{{2.82 \pm 0.49\left( {2.3} \right)}}$ |
| 5.0 | $\frac{{1.03 \pm 0.35}}{{2.08 \pm 0.22\left( {2.0} \right)}}$ | $\frac{{1.42 \pm 0.24}}{{2.78 \pm 0.11{\text{*}}\left( {2.0} \right)}}$ | |
| 7.4 | $\frac{{0.74 \pm 0.19}}{{1.37 \pm 0.08{\text{*}}\left( {1.9} \right)}}$ | $\frac{{3.10 \pm 0.53}}{{4.08 \pm 0.22\left( {1.3} \right)}}$ | |
Примечание. Здесь и в табл. 2, 3 над чертой – в отсутствие фенола, под чертой – в присутствии фенола, в скобках – степень увеличения ферментативной активности (раз). * р ≤ 0.05 достоверные различия между опытом и контролем. ** р < 0.001.
Рис. 1.
Влияние фенола на температурную зависимость казеинлитических пептидаз у личинок хирономид при рН 7.4 (а, б) и рН 5.0 (в, г): a, в – активность ферментов, мкмоль/(г мин), б, г − относительная активность ферментов, % максимальной активности. 1 − отсутствие фенола (контроль), 2 − наличие фенола (опыт).
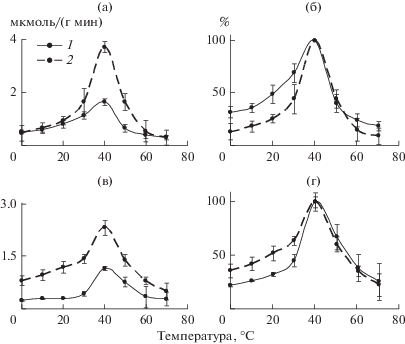
Сравнение полученных данных указывает на значительное влияние рН на характер температурной зависимости пептидаз, функционирующих в присутствии Ф. Особо следует отметить достоверное (р ≤ 0.01–0.001) увеличение активности казеинлитических пептидаз при рН 5.0 почти во всем диапазоне температур, тогда как при рН 7.4 уровень ферментативной активности заметно повышается только в зоне температур 30–50°С (достоверно при 40 и 50°С, р ≤ 0.001 и р ≤ 0.01 соответственно). В диапазоне жизнедеятельности личинок хирономид (10–30°С), а также в зоне 60–70°С значения активности казеинлитических пептидаз чрезвычайно близки. Относительная активность пептидаз в зоне 0–30°С в присутствии Ф при рН 5.0 выше, при рН 7.4 – ниже, чем в контроле.
Влияние фенола на активность и температурную зависимость пептидаз личинок хирономид по гемоглобину при разных значениях рН. Максимальная активность гемоглобинлитических пептидаз всех тканей контрольных особей личинок хирономид при температуре 20°С отмечена при рН 5.0, при температуре 40°С – при рН 7.4 (табл. 1). В присутствии Ф активность гемоглобинлитических пептидаз достоверно (р ≤ 0.05–р ≤ 0.001) повышается. При этом эффект при обеих температурах последовательно снижается от рН 3.0 до рН 7.4. Исследование активности гемоглобинлитических пептидаз в широком диапазоне температур в отсутствие и в присутствии Ф также выявило различия в форме кривых температурной зависимости (рис. 2). Относительная активность гемоглобинлитических пептидаз, как правило, недостоверно увеличивается, особенно при рН 5.0.
Рис. 2.
Влияние фенола на температурную зависимость гемоглобинлитических пептидаз у личинок хирономид при рН 7.4 (а, б), рН 5.0 (в, г) и рН 3.0 (д, е): a, в, д – активность ферментов, б, г, е – относительная активность ферментов. Остальные обозначения, как на рис. 1.

Влияние фенола на температурные коэффициенты (Q10) активности пептидаз личинок хирономид. Данные о температурных коэффициентах активности пептидаз личинок хирономид в широком диапазоне температур свидетельствуют, что в большинстве случаев они <2.0, а в зоне постмаксимальных температур <1.0 (табл. 2). В диапазоне жизнедеятельности личинок хирономид в присутствии Ф значения Q10 активности казеинлитических пептидаз при рН 5.0 и гемоглобинлитических пептидаз при рН 3.0 снижаются, при более высоких значениях рН изменяются разнонаправленно.
Таблица 2.
Влияние фенола на значения Q10 пептидаз, функционирующих в целом организме личинок хирономид в исследованном диапазоне температур
| Субстрат | Q10 | ||||||
|---|---|---|---|---|---|---|---|
| 0–10°С | 10–20°С | 20–30°С | 30–40°С | 40–50°С | 50–60°С | 60–70°С | |
| рН 3.0 | |||||||
| Гемоглобин | $\frac{{1.1}}{{1.1}}$ | $\frac{{1.2}}{{1.4}}$ | $\frac{{1.6}}{{1.4}}$ | $\frac{{2.1}}{{1.6}}$ | $\frac{{0.4}}{{0.6}}$ | $\frac{{0.5}}{{0.6}}$ | $\frac{{0.7}}{{0.8}}$ |
| pH 5.0 | |||||||
| Казеин | $\frac{{1.2}}{{1.2}}$ | $\frac{{1.2}}{{1.2}}$ | $\frac{{1.4}}{{1.2}}$ | $\frac{{2.2}}{{1.6}}$ | $\frac{{0.6}}{{0.6}}$ | $\frac{{0.4}}{{0.6}}$ | $\frac{{0.8}}{{0.6}}$ |
| Гемоглобин | $\frac{{2.0}}{{1.6}}$ | $\frac{{1.6}}{{1.7}}$ | $\frac{{1.5}}{{1.5}}$ | $\frac{{1.4}}{{1.2}}$ | $\frac{{0.6}}{{0.8}}$ | $\frac{{0.4}}{{0.6}}$ | $\frac{{0.2}}{{0.3}}$ |
| pH 7.4 | |||||||
| Казеин | $\frac{{1.1}}{{1.4}}$ | $\frac{{1.4}}{{1.4}}$ | $\frac{{1.4}}{{1.8}}$ | $\frac{{1.4}}{{2.3}}$ | $\frac{{0.4}}{{0.4}}$ | $\frac{{0.6}}{{0.3}}$ | $\frac{{0.7}}{{0.6}}$ |
| Гемоглобин | $\frac{{1.7}}{{1.3}}$ | $\frac{{1.4}}{{1.5}}$ | $\frac{{1.9}}{{1.5}}$ | $\frac{{2.2}}{{2.0}}$ | $\frac{{0.4}}{{0.6}}$ | $\frac{{0.4}}{{0.4}}$ | $\frac{{0.4}}{{0.2}}$ |
Влияние фенола на энергию активации пептидаз личинок хирономид. Данные, касающиеся Еакт пептидаз, функционирующих в тканях личинок хирономид в интервале температур их жизнедеятельности (0–30°С), указывают на зависимость величины показателя от используемого субстрата, рН и наличия Ф (табл. 3). Прежде всего, важно отметить наличие изгиба на графике Аррениуса во всех вариантах эксперимента при 20°С. В контроле значения Еакт пептидаз, гидролизующих казеин, в диапазоне 0–20°С при рН 5.0 и рН 7.4 в 3.4 и 1.9 раза ниже, чем в зоне более высоких температур, особенно в первом случае. Следовательно, эффективность процесса гидролиза белков казеинлитическими пептидазами в зоне низких температур выше, чем в зоне высоких. В присутствии Ф значения Еакт в этих зонах различаются: в низкотемпературной зоне при рН 5.0 не изменяются, в высокотемпературной зоне уменьшаются в 1.7 раза, при рН 7.4 значения Еакт в обеих температурных зонах увеличиваются в 1.6 и 1.9 раза соответственно.
Таблица 3.
Влияние фенола на значения энергии активации пептидаз, функционирующих у личинок хирономид в диапазоне температур их жизнедеятельности
| Субстрат | Энергия активации, ккал/моль | |
|---|---|---|
| до точки перегиба | после точки перегиба | |
| pH 3.0 | ||
| Гемоглобин | $\frac{{2.4}}{{3.5}}$ | $\frac{{11.5}}{{7.8}}$ |
| pH 5.0 | ||
| Казеин | $\frac{{3.1}}{{3.1}}$ | $\frac{{10.5}}{{6.1}}$ |
| Гемоглобин | $\frac{{9.5}}{{8.2}}$ | $\frac{{6.3}}{{4.8}}$ |
| pH 7.4 | ||
| Казеин | $\frac{{3.5}}{{5.5}}$ | $\frac{{6.5}}{{12.6}}$ |
| Гемоглобин | $\frac{{6.8}}{{5.1}}$ | $\frac{{13.2}}{{10.1}}$ |
Значения Еакт пептидаз, гидролизующих гемоглобин, при рН 3.0 в диапазоне 0–20°С в 4.5 раза ниже, чем в зоне более высоких температур, при рН 7.4 – в 1.9 раза. При рН 5.0, напротив, значения Еакт в диапазоне 0–20°С выше, чем в зоне более высоких температур. В присутствии Ф значения Еакт в указанных диапазонах температур в большинстве случаев уменьшаются в 1.2 или 1.3 раза. Лишь при рН 3.0 наблюдается увеличение показателя в первом случае и снижение во втором – в 1.5 раза.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Прежде всего, следует отметить, что у позвоночных при рН 7.4 в гомогенатах слизистой оболочки кишечника преобладает активность эндопептидаз (трипсина, химотрипсина и эластазы), а также экзопептидаз (карбоксипептидаз, аминопептидаз и различных дипептидаз). При рН 3.0 и 5.0 доминирует активность различных катепсинов (Кузьмина, 2018). Активность пищеварительных пептидаз наиболее детально изучена у морских членистоногих. В частности, активность трипсиноподобных и химотрипсиноподобных ферментов выявлена у целого ряда десятиногих раков (Dendinger, 1987; Kim et al., 1994; Van Wormhoudt et al., 1995; Navarrete del Toro et al., 2006). Имеются сведения о наличии у ракообразных лейцинаминопептидазы и карбоксипептидаз A и B (Dendinger, 1987; Boetius, Felbeck, 1995; Glass, Stark, 1994). Следует отметить, что у гигантской пресноводной креветки Macrobrachium rosenbergii De Man, 1879 при рН 7.0 в мышечном экстракте обнаружена активность кальпаинов и катепсина L, тогда как в экстракте гепатопанкреаса – главным образом, трипсина и химотрипсина (Sriket et al., 2011). В тканях пресноводной креветки M. nipponese De Haan, 1849 выявлена кДНК, кодирующая катепсин L (Zhao et al., 2013), катепсин B (Stephens et al., 2012; Li et al., 2013) и катепсин С (Qiu et al., 2008). Эти данные позволяют предположить, что личинки хирономид также обладают широким спектром пептидаз. При этом высокая активность гемоглобинлитических пептидаз, а также доминирование в организме личинок хирономид фракции растворимых белков, соответствующей фракции гемоглобина (Кузьмина, 2018), свидетельствуют об их важной роли в процессах индуцированного аутолиза.
Данные, касающиеся активности казеин- и гемоглобинлитических пептидаз, функционирующих в тканях личинок хирономид, а также величины оптимума температуры при нейтральных значениях рН близки полученным ранее (Скворцова и др., 2016). Диапазон значений температурного оптимума различных пептидаз у ракообразных достаточно широк. Максимальные значения (70°С) характерны для казеинлитической пептидазы гепатопанкреаса креветки Fenneropenaeus chinensis (Osbeck, 1765) (Oh et al., 2000) и трипсина у рака Procambarus clarkii (Girard, 1852) (Kim et al., 1994), минимальные (50°С) – у личинок хаоборуса Chaoborus sp. (Кузьмина, 1999). Значения температурного оптимума химотрипсина ниже, чем трипсина. Максимальные значения (50–55°С) отмечены у камчатского краба Paralithodes camtschaticus (Tilesius, 1815) (Мухин, Новиков, 1999) и крабов-плавунцов Callinectes bellicosus (Stimpson, 1859) и C. arcuatus Ordway, 1863 (Diaz-Tenorio et al., 2006), минимальные (40°С) – у антарктической креветки Chorismus antarcticus (Pfeffer, 1887) (Dittrich, 1990). По-видимому, относительно низкий уровень (40°С) температурного оптимума пептидаз в тканях личинок хирономид в наших опытах в значительной мере обусловлен их обитанием в бореальной зоне.
Также важно отметить, что активность пептидаз у личинок хирономид при использовании обоих субстратов в присутствии Ф увеличивается и при 20°С, и при 40°С. При 20°С наибольшее увеличение активности казеинлитических пептидаз отмечено при рН 5.0, гемоглобинлитических – при рН 3.0 (зоне действия катепсинов). Действительно, из гепатопанкреаса креветки Penaeus vannamei Boone, 1931 (Litopenaeus vannamei) изолирован L-подобный катепсин с оптимумом рН 5.1 (Le Boulay et al., 1996). У обыкновенного омара Homarus gammarus L. один пик выявлен при рН 5.8–6.0, другой – при рН 2.5–3.0 (Navarrete del Toro et al., 2006). Известно, что в зоне рН 2.5–4.0 функционируют катепсины D, E и A, в зоне 5.0–6.0 – катепсины B и L, в зоне 7.0–8.0 – катепсин С (по: Кузьмина, 2018).
Зарегистрирован различный характер изменения формы кривых температурной зависимости пептидаз личинок хирономид при разных значениях рН в присутствии Ф. Казеинлитическая активность пептидаз личинок хирономид под влиянием Ф при рН 7.4 значительно увеличивается лишь при оптимальной температуре и в меньшей степени при 30 и 50°С. При рН 5.0 активность пептидаз под влиянием Ф увеличивается фактически во всем диапазоне исследованных температур. Однако относительная активность пептидаз при нейтральных значениях рН под влиянием Ф снижается, особенно в зоне температур жизнедеятельности личинок хирономид. При рН 5.0, напротив, в указанной зоне относительная активность пептидаз в опыте повышается по сравнению с контролем. Активность гемоглобинлитических пептидаз под влиянием Ф увеличивается при всех значениях рН: при рН 3.0 – в диапазоне 0–60°С, при рН 5.0 – 10–70°С (особенно в зоне постмаксимальных температур), при рН 7.4 – 0–70°С. Относительная активность пептидаз под влиянием Ф при всех значениях рН увеличивается в меньшей степени по сравнению с таковой казеинлитических пептидаз, особенно при рН 5.0. Важно отметить, что значительные различия между опытом и контролем при разных значениях рН отмечены в различных температурных зонах. Разный характер влияния Ф на казеинлитические катепсины и эндопептидазы, подобные трипсину, может свидетельствовать о значительном различии их структур, в то время как отсутствие существенных различий в эффектах Ф на гемоглобинлитические пептидазы позволяет предположить их сходство.
Изучение динамики значений Q10 подтвердило их резкое уменьшение в зоне постмаксимальных температур в результате денатурации белковых глобул ферментов. Однако устойчивое и ярко выраженное влияние Ф на этот показатель не обнаружено. Значительно интереснее оказались результаты изучения влияния Ф на Еакт пептидаз, гидролизующих казеин и гемоглобин в тканях личинок хирономид. Зарегистрирован излом на графике Аррениуса при 20°С, что согласуется с ранее полученными результатами (Кузьмина, 1999). При этом в большинстве случаев в зоне более низких температур значения Еакт ниже, чем в зоне более высоких температур. Данные, полученные при нейтральных значениях рН в этой зоне несколько ниже величин показателя трипсиноподобных протеиназ у краба-отшельника Clibanarius striolatus и у коричневого краба Cancer pagurus L. – 7.64 и 5.92 ккал/моль соответственно (Dittrich, 1992). Следовательно, эффективность процесса гидролиза белков казеинлитическими пептидазами личинок хирономид выше, чем у ракообразных. Важно, что под влиянием Ф значения Еакт казеинлитических пептидаз при рН 5.0 не изменяются или значительно уменьшаются, при рН 7.4 – увеличиваются. Вместе с тем, для процессов индуцированного аутолиза большее значение имеет уменьшение под влиянием Ф величин Еакт гемоглобнлитических пептидаз, поскольку их активность у личинок хирономид выше, а зона действия рН шире по сравнению с казеинлитическими пептидазами.
Эффекты Ф можно объяснить с позиций аллостерической регуляции активности ферментов. Аллостерическое регулирование наблюдается, когда регулятор (модификатор), не будучи стерическим аналогом субстрата данного фермента, может связываться с ним в центре, пространственно не совпадающем с активным центром, что вызывает изменение конфигурации и, как следствие, активности фермента (Jacob, Monod, 1961; Monod et al., 1965). Эпителий кишечника личинок хирономид покрыт микроворсинками (Kaufman et al., 1986), при этом важно отметить, что некоторые мембранные ферменты являются амфипатическими: гидрофильная часть молекулы выполняет каталитические функции, гидрофобная − якорные (Louvard et al., 1975). Кроме того, предполагается, что гидрофобная часть может участвовать в поддержании оптимальной конформации фермента и регуляции свойств гидрофильной части фермента (Уголев, Кузьмина, 1993). По-видимому, Ф влияет на регуляторные сайты не только пептидаз пищеварительного тракта, но и пептидаз других органов и тканей хирономид.
Выводы. Влияние Ф на активность пептидаз, функционирующих в тканях личинок хирономид Chironomus sp., в значительной степени зависит от структуры субстрата, температуры и рН. Температурный оптимум исследованных пептидаз тканей личинок хирономид соответствует 40°С. В присутствии Ф активность казеинлитических пептидаз увеличивается, наиболее значительно при 20°С и рН 5.0 (в 3.3 раза), активность гемоглобинлитических пептидаз – при рН 3.0 (в 3.5 раз). Эффект при обеих температурах последовательно снижается от рН 3.0 до рН 7.4. Форма кривых температурной зависимости и величина температурного коэффициента Q10 в присутствии Ф наиболее заметно изменяется в зоне высоких температур. Значения Еакт пептидаз, гидролизующих казеин и гемоглобин, в зоне низких и высоких температур различны. В присутствии Ф значения Еакт казеинлитических пептидаз при рН 7.4 увеличиваются, при рН 5.0 – уменьшаются в зоне высоких температур, гемоглобинлитических пептидаз – в большинстве случаев уменьшаются. Полученные данные свидетельствуют о значительном влиянии Ф не только на активность, но и на рН-зависимые температурные характеристики пептидаз, функционирующих в организме личинок хирономид.
Список литературы
Высоцкая Р.У., Немова Н.Н. 2008. Лизосомы и лизосомальные ферменты рыб. Москва: Наука.
Гусаков В.А. 2007. Мейобентос Рыбинского водохранилища. Москва: Товарищество научных изданий КМК.
Егорова В.В., Иезуитова Н.Н., Тимофеева Н.М. и др. 1974. Некоторые температурные характеристики и температурные адаптации ферментов, обеспечивающих мембранное пищеварение у пойкилотермных и гомойотермных животных // Журн. эвол. биохим. физиол. Т. 10. № 3. С. 223.
Иванова М.Н., Половкова С.Н., Кияшко В.И., Баканов А.И. 1978. Питание и пищевые взаимоотношения рыб в водохранилищах Волжского каскада // Теоретические аспекты рыбохозяйственных исследований водохранилищ. Ленинград: Наука. С. 55.
Кузьмина В.В. 1999. Влияние температуры на пищеварительные гидролазы беспозвоночных животных // Ж. эволюц. биохим. физиол. Т. 35. № 1. С. 15.
Кузьмина В.В. 2000. Вклад индуцированного аутолиза в процессы пищеварения вторичных консументов на примере гидробионтов // Докл. РАН. Т. 373. № 1. С. 132.
Кузьмина В.В. 2018. Процессы пищеварения у рыб. Новые факты и гипотезы Ярославль: Филигрань.
Кузьмина В.В., Чорная Е.Ю., Куливацкая Е.А., Шептицкий В.А. 2017. Влияние фенола на температурные характеристики пептидаз личинок хирономид – потенциальных объектов питания рыб-бентофагов // Пробл. биол. продукт. жив. № 4. С. 48.
Лукьяненко В.И. 1983. Общая ихтиотоксикология. Москва: Легк. и пищ. пром-сть.
Матей В.Е. 1970. Влияние субтоксических концентраций фенола на условнорефлекторную деятельность гуппи // Гидробиол. ж. Т. 6. № 3. С. 100.
Мухин В.А., Новиков В.Ю. 1999. Выделение, очистка и характеристика комплекса протеиназ из гепатопанкреаса камчатского краба Paralithodes camtschatica // Тез. докл. XX науч.-техн. конф. профес.-препод. состава МГТУ. Мурманск: Мурманск. гос. техн. ун-т. С. 354.
Рыбы Рыбинского водохранилища: популяционная динамика и экология. 2015. Ярославль: Филигрань.
Скворцова Е.Г., Егорова А.А., Кузьмина В.В. 2016. Влияние температуры и кислотности среды на активность пептидаз у личинок хирономид – потенциальных объектов питания рыб-бентофагов // Пробл. биол. продукт. жив. № 4. С. 46.
Тарлева А.Ф., Шептицкий В.А., Кузьмина В.В. 2018. Реакция различных систем организма рыб на фенол и его производные (обзор) // Пробл. биол. продукт. жив. № 4. С. 27.
Уголев А.М. 1985. Эволюция пищеварения и принципы эволюции функций. Ленинград: Наука.
Уголев А.М., Кузьмина В.В. 1993. Пищеварительные процессы и адаптации у рыб. Санкт-Петербург: Гидрометеоиздат.
Флеров Б.А. 1989. Эколого-физиологические аспекты токсикологии пресноводных животных. Санкт-Петербург: Наука.
Ali S.M., Sabac S.Z., Fayez M. et al. 2011. The influence of agro-industrial effluents on River Nile pollution // J. Adv. Res. V. 2. P. 850.
Anson M. 1938. The estimation of pepsin, trypsin, papain and cathepsin with hemoglobin // J. Gen. Physiol. V. 22. P. 79.
Boetius A., Felbeck H. 1995. Digestive enzymes in marine invertebrates from hydrothermal vents and other reducing environments // Mar. Biol. Berlin; Heidelberg. V. 122. № 1. P. 105.
Dendinger J.E. 1987. Digestive proteases in the midgut gland of the Atlantic blue crab, Callinectes sapidus // Comp. Biochem. Physiol. V. 88B. № 2. P. 503. https://doi.org/10.1016/0305-0491(87)90334-8
Diaz-Tenorio L.M., Garcia-Carreňo F.L., Ángeles Navarrete del Toro M. 2006. Characterization and comparison of digestive proteinases of the Cortez swimming crab, Callinectes bellicosus, and the arched swimming crab, Callinectes arcuatus // Invertebrate Biol. V. 125. № 2. P. 125.
Dittrich B. 1990. Temperature dependence of the activities of trypsin-like proteases in decapod crustaceans from different habitats // Naturwissenschaften. Bd 77. S. 491. https://doi.org/10.25687/1996-6733.prodanimbiol.2018.3.27-44
Dittrich B. 1992. Comparative studies on the thermal properties of a trypsin-like protease in two hermit crabs // Helgoländer Meeresuntersuchunger: Helgoländer Meeresunters. V. 46. P. 45.
Gad N.S., Saad A.S. 2008. Effect of environmental pollutionby phenol on some physiological parameters of Oreochromis niloticus // Global Veterin. V. 2. P. 312.
Glass H.J., Stark J.R. 1994. Protein digestion in the European lobster, Homarus gammarus (L.) // Compar. Biochem. Physiol. V. 108B. № 2. P. 225.
Jacob F., Monod J. 1961. On the regulation of gene activity // Cold spring Harbor Symp. Quant. Biol. V. 26. P. 193.
Kaufman M.G., Pankratz H.S., Klug M.J. 1986. Bacteria Associated with the Ectoperitrophic Space in the Midgut of the Larva of the Midge Xylotopus par (Diptera: Chironomidae) // Appl. Environ. Microbiol. V. 51. № 3. P. 657.
Kim H.R., Meyers S.P., Pyeun J.H., Godber J.S. 1994. Enzymatic properties of anionic trypsins from the hepatopancreas of crayfish, Procambarus clarkia // Comp. Biochem. Physiol. V. 107B. P. 197.
Le Boulay C., Van Wormhoudt A., Sellos D. 1996. Cloning and expression of cathepsin L-like proteinases in the hepatopancreas of the shrimp Penaeus vannamei during the intermolt cycle // J. Comp. Physiol. V. 166. B. № 5. P. 310. https://doi.org/10.1007/BF02439917
Li X., Mengeng X., Kong J. et al. 2013. Molecular cloning and characterisation of a cathepsin B gene from Chinese shrimp Fenneropenaeus chinensis // Fish Shellfish Immunol. V. 35. № 5. P. 1604.
Louvard D., Maroux S., Vannier C., Desnuelle P. 1975. Topological studies on the hydrolases bound to the intestinal brush membrane. 1. Solubilization by papain and triton x-100 // Biochim. Biophys. Acta. V. 375. № 1. P. 236.
Mai I.D. 2012. Experimental exposure of African catfish Clarias gariepinus (Burchell, 1822) to phenol: Clinical evaluation, tissue alterations and residue assessment // J. Adv. Res. V. 3. P. 177.
Michałowicz J., Duda W. 2007. Phenols – Sources and Toxicity // Polish J. Environ. Stud. V. 16. № 3. P. 347.
Monod J., Wyman J., Changeux J.-P. 1965. On the nature of allosteric transitions: A plausible model // J. Mol. Biol. V. 12. № 1. P. 88.
Navarrete del Toro M.A., García-Carreño F.L., Díaz L.M. et al. 2006. Aspartic proteinases in the digestive tract of marine decapod crustaceans // J. Exp. Zool. V. 305A. P. 645. https://doi.org/10.1002/jez.a.318
Oh E.-S., Kim D.-S., Kim J.H., Kim H.-R. 2000. Enzymatic properties of a protease from the hepatopancreas of shrimp, Penaeus oriantalis // J. Food Biochem. V. 24. P. 251.
Pinder L.C.V. 1986. Biology of freshwater Chironomidae // Ann. Rev. Entomol. V. 31. P. 1.
Qiu L., Jians S., Huang J. et al. 2008. Molecular cloning and mRNA expression of cathepsin C gene in black tiger shrimp (Penaeus monodon) // Comp. Biochem. Physiol. V. 150A. № 3. P. 320.
Singh A.K., Chandra R. 2019. Pollutants released from the pulp paper industry. Aquatic toxicity and their health hazards // Aquat. Toxicol. V. 211. P. 202.
Sriket C., Benjakul S., Vissessangual W. 2010. Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn (Macrobrachium rosenbergii) // J. Sci. Food Agric. V. 91. № 1. P. 52.
Stephens A.I., Rojo L., Araujo-Bernal S. et al. 2012. Cathepsin B from the white shrimp Litopenaeus vannamei: cDNA sequence analysis, tissue-specific expression and biological activity // Comp. Biochem. Physiol. V. 161B. № 1. P. 32.
Van Wormhoudt A., Sellos D., Donval A. et al. 1995. Chymotrypsin gene expression during the intermolt cycle in the shrimp Penaeus vannamei (Crustacea; Decapoda) // Experientia. V. 51. № 2. P. 159. https://doi.org/10.1007/bf01929362
Wardiatno Y., Krisanti M. The Vertical Dynamics of Larval Chironomids on Artificial Substrates in Lake Lido (Bogor, Indonesia) // Tropic. Life Sci. Res. 2013. V. 24. № 2. P. 13.
Zhao W., Chen L., Zhang F. et al. 2013. Molecular characterization of cathepsin L cDNA and its expression during oogenesis and embryogenesis in the oriental river prawn Macrobrachium nipponese (Palaemonidae) // Gen. Mol. Res. V. 12. № 4. P. 5215.
Zilli F.L., Montalto L., Paggi A., Merchese C. 2008. Biometry and life cycle of Chironomus calligraphus Goeldi 1905 (Diptera, Chironomidae) in laboratory conditions // Associacion Interciencia. V. 33. № 10. P. 767.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


