Биология внутренних вод, 2021, № 2, стр. 198-207
Физиологический механизм выживания динофитовых водорослей в условиях биогенного лимитирования
Л. В. Стельмах a, *, И. М. Мансурова a
a Федеральный исследовательский центр “Институт биологии южных морей
им. А.О. Ковалевского Российской академии наук”
Севастополь, Россия
* E-mail: lustelm@mail.ru
Поступила в редакцию 06.08.2020
После доработки 17.09.2020
Принята к публикации 23.10.2020
Аннотация
На примере культур трех массовых видов динофитовых водорослей Черного моря Prorocentrum cordatum, P. micans и Gyrodinium fissum исследован физиологический механизм их длительного выживания в условиях биогенного лимитирования. Перенос клеток Prorocentrum cordatum и Gyrodinium fissum, имеющих максимальный внутриклеточный пул биогенных веществ, в морскую воду, обедненную по биогенным веществам, вызвал снижение их удельной скорости роста и содержания хлорофилла а в расчете на клетку. За счет внутриклеточного пула питательных веществ Prorocentrum cordatum осуществил 3.3 клеточных деления за 9 сут, а Gyrodinium fissum – 2.3 клеточных деления за 4 сут. После исчерпания внутриклеточных запасов биогенных веществ в культуре G. fissum в течение 16 сут отмечено прекращение прироста клеток и дальнейшее снижение удельного содержания хлорофилла а, а также эффективности работы фотосистемы-2. В культуре Prorocentrum micans, находившейся в условиях наиболее жесткого биогенного лимитирования, в течение всего эксперимента, длившегося 20 сут, на фоне почти постоянной численности клеток наблюдалось чередование низких положительных и отрицательных значений удельной скорости роста, а также низкое содержание хлорофилла а в расчете на клетку. Однако эффективность работы фотосистемы-2 сохранялась на достаточно высоком уровне (0.27–0.41) и большую часть времени превышала контрольные значения. Выявлена высокая степень гетерогенности функциональной активности клеток и отмирание некоторой их части у данного вида в условиях биогенного стресса. Вероятно, выживание P. micans обеспечивали питательные вещества, поступавшие в воду в результате отмирания наименее жизнеспособной части ее клеток и служившие источником органических веществ для физиологически активных клеток микроводорослей.
ВВЕДЕНИЕ
Динофитовые водоросли считаются одним из важнейших компонентов фитопланктона. В море они создают существенную, а иногда основную долю первичной продукции и биомассы фитопланктона и служат источником пищи для представителей высших трофических уровней (Anderson et al., 2008; Thompson et al., 2008). “Цветения” воды, вызванные интенсивным развитием некоторых видов динофлагеллят, часто представляют серьезную опасность для гидробионтов и человека, поскольку в процессе “цветений” они продуцируют целый ряд токсичных веществ (Yang et al., 2011).
За последнее столетие в результате изменений климата температура морской воды в глобальном масштабе повысилась на ~1°C (Häder, Gao, 2015), что привело к усилению термического расслоения вод и ослаблению восходящего потока биогенных веществ (Behrenfeld et al., 2006). С середины 1990-х годов в изменении температуры поверхностного слоя глубоководной части Черного моря также отмечен положительный тренд (Oguz, Glibert, 2007). В результате усиления температурной стратификации черноморских вод в теплый период года поступление биогенных веществ из глубин в зону фотосинтеза постепенно снижается (Mikaelyan et al., 2018; Pakhomova et al., 2014), а их содержание в поверхностном слое моря часто падает до аналитического нуля (Stelmakh, Gorbunova, 2019). В связи с этим динофитовые водоросли, как и представители других таксономических групп фитопланктона, должны быть приспособлены к выживанию в условиях биогенного лимитирования. В качестве методологической основы для выявления механизмов адаптации фитопланктона к недостатку минеральных питательных веществ следует рассматривать эксперименты на культурах отдельных видов морских микроводорослей.
Цель работы – исследовать механизм выживания динофитовых водорослей Черного моря в условиях дефицита биогенных веществ в воде и в клетках.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования были три вида альгологически чистых культур динофитовых водорослей: Prorocentrum cordatum (Ostenfeld) J.D. Dodge, P. micans Ehrenberg и Gyrodinium fissum (Levander) Kofoid & Swezy, выделенных из планктона Черного моря и содержащихся в коллекции отдела экологической физиологии водорослей Федерального исследовательского центра “Института биологии южных морей” (рис. 1а–1в). Эти виды относятся к массовым представителям фитопланктона Черного моря и хорошо развиваются в условиях культуры. Исходный средний объем клеток Prorocentrum cordatum 1000 ± 150 мкм3, P. micans – 5200 ± ± 1300 мкм3, Gyrodinium fissum – 18 900 ± 3100 мкм3.
Рис 1.
Клетки водорослей Prorocentrum micans (а), P. cordatum (б) и Gyrodinium fissum (в) под световым микроскопом и флуоресценция клеток Prorocentrum micans, культивируемых в условиях биогенного лимитирования (г, д) и при высоком содержании биогенных веществ в среде (e). Увеличение ×400.

До начала эксперимента каждую культуру адаптировали в течение нескольких суток к непрерывному свету, интенсивность которого была 70–80 мкЭ/(м-2 · с), что соответствует световому насыщению по росту для исследуемых видов водорослей (Мансурова, 2013). Контрольные и опытные колбы с водорослями объемом 250 мл, помещенные на световую решетку, освещали снизу, используя светодиоды. Освещенность измеряли с помощью люксметра Ю-116, коэффициент перехода от освещенности в люксах к интенсивности света – 1000 лк = 17 мкЭ/(м–2 · с) (Парсонс и др., 1982). Температура воды была 22–23°С – оптимальная для динофитовых водорослей (Стельмах и др., 2014).
Культуры G. fissum и Prorocentrum cordatum были адаптированы к световым условиям эксперимента в течение 3–8 сут и находились в экспоненциальной фазе роста. Культура P. micans была адаптирована к непрерывному свету в течение 12 сут. К концу этого периода она находилась в стадии стационарного роста, о чем свидетельствовало отсутствие прироста клеток водорослей в течение последних пяти суток адаптации. Затем водоросли каждого вида переносили в стерильную морскую воду без дополнительных добавок биогенных веществ (опыт) и в морскую воду с добавлением питательной среды f/2 (контроль), где конечная концентрация нитратов достигала 800 мкМ, фосфатов – 36 мкМ (Guillard, Rither, 1962). Исходное содержание нитратов и фосфатов в морской воде, использованной в работе, было ≤0.05 мкМ.
В ходе экспериментов из колб с культурами микроводорослей ежесуточно отбирали аликвоты для оценки численности клеток, их объема, концентрации Хл а, Fv/Fm, а также интенсивности красной автофлуоресценции Хл а.
Для определения концентрации Хл а из колб с водорослями отбирали аликвоты объемом 2–14 мл в трех повторностях и осаждали на мембранные фильтры Sartorius c диаметром пор 0.8 мкм. Фильтры помещали в 90%-ный водный раствор ацетона. Пигменты экстрагировали в течение 12 ч при температуре 8°С. Концентрацию Хл а определяли флуориметрическим методом с использованием лабораторного флуориметра, калибровку которого осуществляли по чистому Хл а (Protocols for JGOFS, 1996). Относительная ошибка определений не превышала 10%.
Содержание углерода в клетках динофитовых водорослей рассчитывали на основе их объема по уравнению, представленному в работе (Menden-Deuer, Lessard, 2000). Линейные размеры клеток определяли с помощью светового микроскопа ZEISS Primo Star в 20 повторностях при общем увеличении системы ×100. Объем клеток вычисляли по методике (Брянцева и др., 2005), основываясь на принципах геометрического подобия. Учет численности клеток проводили в счетной камере Горяева в трех повторностях. Коэффициент вариации среднего значения был, как правило, в пределах 2–15%.
Удельную суточную скорость роста культур рассчитывали по приросту численности клеток в пробах по уравнению:
µ = ln(Nt – N0),
где µ – удельная скорость роста водорослей, сут–1, N0 и Nt – исходная численность клеток и их количество через сутки.
Для регистрации красной автофлуоресценции Хл а клеток P. micans в темном поле применяли световой микроскоп Микромед 3ЛЮМ, дополнительно оснащенный флуоресцентным блоком с ртутной лампой мощностью 100 Вт и фотокамерой Toup Cam UCMOS 14000 KPA. Световой диапазон возбуждения флуоресценции в клетках водорослей был 500–550 нм, что обеспечивалось зеленым светофильтром. Его использование для возбуждения красной автофлуоресценции Хл а у динофитовых водорослей обосновано в работе (Стельмах, Мансурова, 2019). Наблюдение красного свечения объекта (в отраженном свете) после прохождения через запирающий светофильтр (590 нм) проводили в области 590–700 нм. Цветовые и яркостные характеристики светящихся клеток P. micans определяли с помощью программы Adobe Photoshop, которую ранее применяли при измерении цветовых характеристик зоопланктона Черного моря (Литвинюк, 2015). Каждую клетку водорослей анализировали отдельно. Всю светящуюся область клетки выделяли с помощью инструмента Lasso Tool, усредняли ее яркостные и цветовые характеристики, затем их измеряли. Усреднение выполняли с помощью фильтра “Среднее размытие” (меню Filter–Blur–Average), измерение яркостных и цветовых характеристик – инструментом “Пипетка” (Eyedropper Tool). Количественную оценку интенсивности свечения оценивали с использованием показателя B (яркость) в модели HSB (H – цветовой тон, S – насыщенность, B – яркость) данной программы. Он измеряется в процентах и может служить количественным показателем интенсивности флуоресценции отдельных клеток микроводорослей. В каждой пробе для определения интенсивности свечения отдельных клеток анализировали от 50 до 70 кл.
Оценку Fv/Fm микроводорослей осуществляли на двухвспышечном флуориметре, принцип работы и устройство которого разработаны на кафедре биофизики биологического факультета Московского государственного университета (Погосян и др., 2009). Измерения проводили после 30 мин адаптации водорослей к темноте, чтобы все реакционные центры фотосистемы-2 перешли в открытое состояние. Во флуориметре реализован метод измерения начального уровня переменной флуоресценции (F0) при помощи коротких зондирующих вспышек и ее максимального уровня (Fm) при насыщающей вспышке. По измеренным показателям рассчитывали переменную флуоресценцию Fv = Fm – F0 и Fv/Fm. Относительная погрешность определений величины Fv/Fm не превышала 5%.
Статистическая обработка данных и построение графиков выполнены в программе Excel 2013 для Windows.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
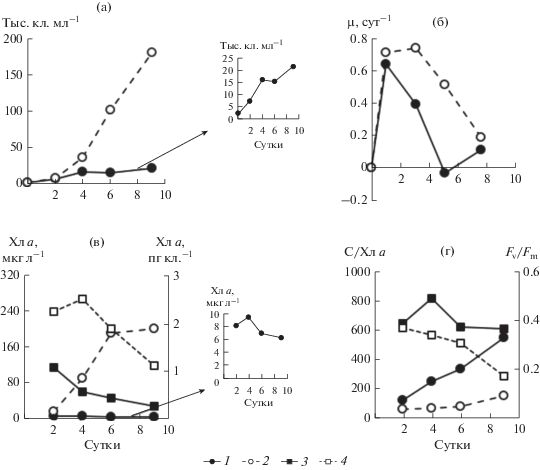
Эксперимент на культуре Prorocentrum cordatum. У клеток, находившихся в экспоненциальной фазе роста, а затем перенесенных в морскую воду и свежую питательную среду, в обоих случаях наблюдали рост на протяжении всего 9-суточного эксперимента (рис. 2а). Однако конечная концентрация клеток в опыте была в 9 раз ниже, чем в контроле, из-за существенных различий в удельной скорости роста (рис. 2б). Расчеты показали, что за 9 сут в среде, обедненной по биогенным веществам, культура P. cordatum осуществила 3.3 клеточных делений. При этом абсолютное содержание Хл а изменялось слабо, тогда как удельное (в расчете на клетку) снизилось к концу эксперимента в 3.7 раза (рис. 2в). В контроле содержание Хл а в единице объема культуры на 9-е сут увеличилось на порядок относительно исходного значения, а его внутриклеточная концентрация уменьшилась вдвое. В результате чего увеличение отношения между органическим углеродом и Хл а (C/Хл а) в культуре в условиях биогенного лимитирования произошло в 4 раза, а при высоком содержании биогенных веществ в среде лишь в 2.4 раза (рис. 2г). Существенного изменения Fv/Fm в опыте не выявлено (рис. 2г), величина Fv/Fm составила в среднем 0.41 ± 0.06. В контроле в течение всего эксперимента наблюдали постепенное снижение этого параметра от 0.40 до <0.20.
Рис. 2.
Динамика численности клеток (а), µ (б), концентрации Хл а (в), отношения С/Хл а и Fv/Fm (г) в культуре Prorocentrum cordatum. а, б: 1 – опыт, 2 – контроль; в – абсолютная концентрация Хл а (мкг л–1) в опыте (1 ) и контроле (2 ), нормированная на клетку (пг кл.–1) в опыте (3 ) и контроле (4 ); г – отношение С/Хл а в опыте (1 ) и контроле (2 ), Fv/Fm в опыте (3 ) и контроле (4 ).
Эксперимент на культуре Gyrodinium fissum. У клеток, находившихся в экспоненциальной фазе роста, а затем помещенных в морскую воду без дополнительных добавок питательных веществ, прирост был в течение первых четырех суток. К концу этого периода они достигли численности 8800 кл. мл–1, что превысило начальное значение в 5 раз (рис. 3а). Прирост численности водорослей (рис. 3б) позволил получить µ, которая в это время была равна 0.50 сут–1. Всего за четверо суток клетки культуры G. fissum совершили 2.3 деления. В дальнейшем отмечено чередование периодов слабого роста и отмирания клеток. Это обеспечило поддержание их численности примерно на постоянном уровне до 20 сут, т.е. до конца эксперимента. В контроле на питательной среде f/2 отмечен прирост численности клеток G. fissum в течение 16 сут, что обусловлено более высокими значениями µ этого вида по сравнению с опытом. В результате максимальная численность водорослей была в 5 раз выше опытной.
Рис. 3.
Динамика численности клеток (а), µ (б), концентрации Хл а (в), отношения С/Хл а и Fv/Fm (г) в культуре Gyrodinium fissum; а, б: 1 – опыт, 2 – контроль; в – абсолютная концентрация Хл а в опыте (1 ) и контроле (2 ), нормированная на клетку в опыте (3 ) и контроле (4 ); г – отношение С/Хл а в опыте (1 ) и контроле (2 ), Fv/Fmв опыте (3 ) и контроле (4 ).
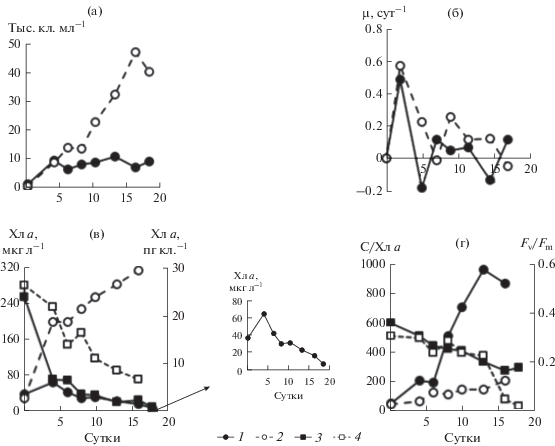
Концентрация Хл а в единице объема культуры в опыте в первые 4 сут возрастала одновременно с численностью клеток, при этом его удельное содержание в расчете на клетку снизилось в 3.6 раза (рис. 3в). В последующий период эти показатели снижались. В контроле в течение всего периода эксперимента абсолютное содержание Хл а возрастало, тогда как удельное снижалось. Однако скорость этого снижения была существенно ниже относительно опыта.
За весь период исследований в культуре G. fissum, содержавшейся в условиях крайнего недостатка биогенных веществ в воде, отношение С/Хл а увеличилось с 50 до 900–1000, при высоком содержании биогенов не превышало 200 (рис. 3г). Величина Fv/Fm в опыте постепенно снизилась почти вдвое от начального значения (0.36). В контроле в первые две недели Fv/Fm не опускалась ниже 0.20, затем произошло ее резкое снижение до значений, близких к нулю (рис. 3г).
Эксперимент на культуре Prorocentrum micans. Культура этого вида, достигшая поздней стационарной фазы роста в период адаптации, при ее переносе в морскую воду существенно не прирастала (рис. 4а), поскольку µ, как правило, была близка к нулю (рис. 4б). Только на 10 сут отмечен небольшой прирост клеток за счет увеличения µ до 0.20 сут–1. В дальнейшем µ снизилась до отрицательных значений, а общая численность клеток упала до исходной величины. В целом, в течение 20 сут средняя численность клеток в культуре P. micans была 5800 ± 900 кл. мл–1. В контроле численность клеток увеличивалась на протяжении первых десяти суток, достигнув максимальной численности 38 500 кл. мл–1, после чего увеличение численности клеток в культуре не выявлено, что вызвано снижением удельной скорости роста почти до нуля. В дальнейшем численность клеток оставалась на одном уровне.
Рис. 4.
Динамика численности клеток (а), µ (б), концентрации хлорофилла а (в), удельного содержания Хл а и Fv/Fm (г) в культуре Prorocentrum micans. а, б: 1 – опыт, 2 – контроль; в – абсолютная концентрация хлорофилла а в опыте (1 ) и контроле (2 ), г – удельное содержание хлорофилла а в опыте (1 ) и контроле (2 ), Fv/Fm в опыте (3 ) и контроле (4 ).
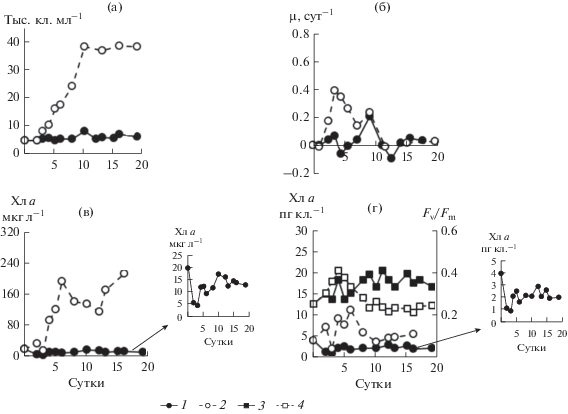
При содержании P. micans в морской воде, обедненной по биогенным веществам, в 1-е и 2-е сутки эксперимента концентрация Хл а в расчете на единицу объема культуры резко снизилась. В дальнейшем однонаправленных изменений этого параметрa не выявлено: периоды увеличения чередовались с периодами снижения (рис. 4в). Подобные изменения наблюдали и для величины Fv/Fm (рис. 4г), которая в течение 20 сут находилась в пределах 0.27–0.41. Удельное содержание Хл а в контроле нарастало до 6 сут, затем по мере прироста накопительной культуры постепенно снижалось. Значения Fv/Fm сначала возрастали, достигнув максимума (0.41) на 4-е сут, затем плавно снижались до 0.20 к середине эксперимента, в дальнейшем изменений не выявлено.
Исходная интенсивность или яркость свечения клеток (B) культуры P. micans, находившейся в поздней стационарной фазе роста, была в среднем 9% (рис. 5а). В ходе эксперимента этот показатель изменялся в несколько раз. На морской воде, обедненной по биогенным веществам, его максимальные значения выявлены на 2-е и 16-е сут (18 и 11% соответственно), минимальные значения (6–7%) – с 4-х по 8-е сут и в конце эксперимента. В целом, яркость клеток в морской воде для всего периода исследований составила в среднем 9 (±3)%. Коэффициент вариации этого параметра на протяжении всего опыта был относительно высоким (55–100%) и в среднем достигал 77 (±13)% (рис. 5б). Это свидетельствует о высокой степени неоднородности интенсивности флуоресценции клеток водорослей данного вида, и, следовательно, наличии в культуре одновременно клеток и с высокой, и с низкой жизнеспособностью. В контроле интенсивность свечения клеток водорослей в целом была значительно выше, чем в опыте (рис. 1г–1е). В течение первых трех–четырех суток она нарастала от 10 до 33%, а коэффициент вариации среднего значения этого параметра снижался с 60 до 20%. Это может отражать высокую скорость восстановления жизнеспособности клеток данной суспензии на питательной среде после длительного голодания. В стационарной фазе роста контрольной культуры яркость клеток снижалась, коэффициент вариации ее среднего значения возрастал. Для всего периода наблюдений яркость клеток в контроле была в среднем 20 (±9)%, коэффициент вариации яркости – 38 (±13)%.
Рис. 5.
Динамика яркости клеток (а), коэффициента вариации средних значений яркости клеток – K (б) и доли несветящихся клеток (в) в культуре Prorocentrum micans на морской воде (1 ) и на питательной среде (2 ). На рис. 5а приведена стандартная ошибка средней величины.
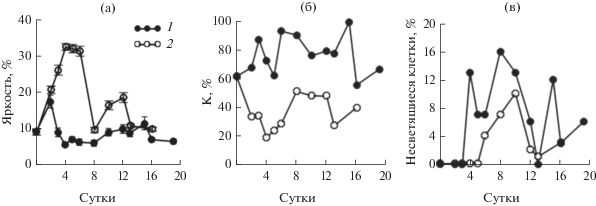
В ходе эксперимента доля клеток P. micans, несветящихся в темном поле микроскопа, но видимых в светлом поле, была непостоянна и на обедненной по биогенным веществам морской воде, и на питательной среде. В условиях биогенного лимитирования периоды увеличения процента несветящихся клеток в культуре чередовались с периодами его снижения. На питательной среде динамика доли несветящихся клеток P. micans характеризовалась одновершинной кривой с максимумом на 10-е сут, в период завершения экспоненциального роста культуры. Среднее значение этого показателя в опыте было 6 (±6)%, в контроле – в 3 раза ниже.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что к основным факторам, регулирующим рост микроводорослей, относятся свет, температура и биогенные вещества. Если значение какого-либо из этих факторов отклоняется от оптимального, рост водорослей замедляется, а в случае приближения его к границам толерантности, рост водорослей прекращается. При достаточном количестве биогенных веществ в среде и оптимальных световых и температурных условиях скорость роста водорослей достигает максимальных значений. В накопительных культурах этот процесс наблюдается в экспоненциальной фазе, когда рост водорослей осуществляется за счет поступления в их клетки минеральных питательных веществ из внешней среды. В процессе целого ряда ферментативных реакций они используются для синтеза органических компонентов клеток водорослей. Однако даже при достижении максимальной скорости роста водорослей процесс транспорта биогенных веществ из среды в клетку через ее плазматическую мембрану продолжается (Baek et al., 2008). Это свидетельствует о способности морских планктонных водорослей, динофитовых в том числе, накапливать внутри клеток, например, в вакуолях, определенный запас питательных веществ, что следует рассматривать как стратегию выживания водорослей при неблагоприятных по биогенным веществам условиях (Baek et al., 2008; Aldridge et al., 2014). В проведенных нами экспериментах показано, что динофитовые водоросли P. cordatum и Gyrodinium fissum, предварительно культивировавшиеся в условиях высокого содержания биогенных веществ в среде, при их переносе в обедненную морскую воду, продолжали свой рост в течение нескольких суток. В отсутствие внешних источников минеральных форм азота и фосфора он осуществлялся, вероятно, за счет внутриклеточного запаса питательных веществ. В процессе роста водорослей благодаря внутриклеточным резервам в первую очередь потребляются так называемые легко усваиваемые питательные вещества – неорганические формы азота и фосфора, затем – трудно утилизируемые органические вещества (аминокислоты, нуклеиновые кислоты, некоторые белки и органические формы фосфора) (Bronk et al., 2007; Girault et al., 2013; Palabhanvi et al., 2014). После этого вегетативный рост водорослей прекращается. Количество питательных веществ внутри клеток, вероятно, у разных видов неодинаково, поскольку Prorocentrum cordatum смог осуществить 3.3 клеточных деления, тогда как Gyrodinium fissum – чуть более 2 раз. При таких условиях значения µ у исследуемых видов были в несколько раз ниже их максимальных значений, полученных при оптимальных условиях среды (Мансурова, 2013). Замедление роста водорослей следует рассматривать как один из механизмов или способов их выживания и сохранения функциональной активности в течение нескольких суток без дополнительных внешних источников азота и фосфора. Процесс ослабления роста в культуре Prorocentrum cordatum сопровождался снижением удельного содержания Хл а в клетках, тогда как Fv/Fm была почти неизменной и достигала 0.40–0.50, что характерно для черноморских видов динофитовых водорослей, не испытывающих лимитирование по биогенным веществам (Akimov, Solomonova, 2019). По-видимому, к концу девятисуточного эксперимента в клетках P. cordatum внутриклеточный пул биогенных веществ был использован не полностью. В более длительном эксперименте с культурой Gyrodinium fissum после исчерпания внутриклеточных запасов питательных веществ на фоне прекращения прироста клеток отмечено не только снижение внутриклеточного содержания Хл а, но и понижение Fv/Fm, значения которой к 20 сут были 0.18–0.19. Сопоставляя наши данные с литературными (Aldridge et al., 2014) для динофитовых водорослей Neoceratium hexacanthum (Gourret) F. Gomez, D. Moreira & P. Lopez-Garcia и N. candelabrum (Ehrenberg) F. Gómez, D. Moreira & P. López-Garcia, можно предположить, что при таких значениях Fv/Fm возможно полное восстановление функциональной активности водорослей при появлении внешнего источника биогенных веществ. Следует отметить, что в “голодной” культуре Prorocentrum micans на 20 сут эксперимента величина Fv/Fm была в 1.5 раза выше, чем у Gyrodinium fissum, что может свидетельствовать о высокой степени ее выживаемости в условиях дефицита биогенных веществ.
Для выявления возможных причин длительного сохранения жизнеспособности динофитовых водорослей при наиболее жестком лимитировании минеральными питательными веществами нами были проведены исследования динамики функциональной активности культуры Р. micans и ее отдельных клеток в этих условиях. Исчерпание внутриклеточных запасов биогенных веществ у этого вида и их крайне низкое содержание в воде позволяет заключить, что водоросли находились в условиях биогенного стресса в течение всего эксперимента. В качестве показателя функциональной активности отдельных клеток водорослей была использована интенсивность красной автофлуоресценции Хл а. На фоне прекращения прироста численности клеток Р. micans на обедненной по нитратам и фосфатам черноморской воде интенсивность флуоресценции отдельных клеток была неодинакова. В течение 20 сут в суспензии водорослей присутствовали жизнеспособные клетки с относительно высокой интенсивностью флуоресценции, слабо светящиеся клетки, а также несветящиеся клетки (нежизнеспособные). Количество последних в опыте периодически возрастало, что сопровождалось некоторым увеличением содержания Хл а в расчете на клетку, Fv/Fm и µ. По-видимому, отмирающие клетки водорослей, разрушаясь и выделяя во внешнюю среду органические вещества, служили источником питательных веществ для наиболее жизнеспособных клеток Р. micans и способствовали их жизнедеятельности. Вероятно, бактерии, присутствующие в экспериментальных колбах с культурой, улучшают усвоение органических веществ клетками этого вида, что подверждается результатами исследований на других видах динофитовых водорослей (Bronk et al., 2007; Girault et al., 2013).
Помимо описанных выше физиологических механизмов выживания в условиях дефицита минеральных питательных веществ, динофитовые водоросли используют в море и другие механизмы. Среди них – вертикальные миграции, сигналом для усиления которых является дефицит биогенных веществ в воде (Jephson, Carlsson, 2009), фаготрофия, т.е. питание бактериями, а также другими видами водорослей и простейшими (Schnepf, Elbrächter, 1992; Legrand et al., 1998), поглощение растворенных в воде органических соединений фосфора и азота (Richardson, Fogg, 1982).
Данные (Аldridge et al., 2014) и полученные нами позволяют заключить, что для успешного восстановления динофитовых водорослей после биогенного стресса необходимо, чтобы их клетки периодически (не реже, чем через 20 сут) получали доступ к внешнему источнику минеральных форм биогенных веществ. Он может быть обеспечен за счет их восходящего потока в результате усиления ветровой активности и ослабления термического расслоения водной толщи, апвеллингов, либо при усилении активности циклонических круговоротов и иных динамических процессов (Karl, 1999). Если условия среды для динофитовых водорослей выходят за пределы толерантной зоны, единственный долгосрочный механизм их выживания – образование цист или энцистмент. Они годами могут сохранять свою жизнеспособность, а при благоприятных условиях давать вегетативные клетки (Chen et al., 2015).
Выводы. Исследован физиологический механизм выживания культур трех массовых видов динофитовых водорослей Черного моря P. cordatum, P. micans и G. fissum в условиях биогенного лимитирования. Он основан на процессах снижения скорости роста водорослей, эффективности работы фотосинтетического аппарата и относительного содержания Хл а в клетках до уровней, при которых возможно полное восстановление физиологических функций в оптимальных условиях. В обедненной по биогенным веществам черноморской воде в культурах Prorocentrum cordatum и Gyrodinium fissum, у которых внутриклеточный пул биогенных веществ был насыщен, выявлено постепенное замедление роста, понижение удельного содержания Хл а в расчете на клетку, а также снижение у G. fissum Fv/Fm. Внутриклеточный резерв питательных веществ позволил этим видам водорослей осуществить 2.3–3.3 клеточных деления. После его исчерпания у G. fissum и P. micans прирост клеток прекращался, а удельное содержание Хл а продолжало снижаться. При этом Fv/Fm у Gyrodinium fissum снизилась к концу эксперимента до 0.20, тогда как у Prorocentrum micans была почти в 1.5 раза выше. На примере культуры P. micans показано, что длительное пребывание динофитовых водорослей в условиях наиболее жесткого биогенного лимитирования приводит к повышению гетерогенности функционального состояния клеток и их частичному отмиранию. Выживание наиболее жизнеспособных клеток в условиях биогенного стресса обеспечивается, вероятно, поступлением органических вещества во внешнюю среду из отмирающих клеток. Для полного восстановления функциональной активности динофитовых водорослей необходим внешний источник минеральных форм питательных веществ, который должен появляться не реже одного раза в 20 сут.
Список литературы
Брянцева Ю.В., Лях А.М., Сергеева А.В. 2005. Расчет объемов и площадей поверхности одноклеточных водорослей Черного моря. Севастополь: Изд-во ин-та биологии южных морей.
Литвинюк Д.А. 2015. Морской зоопланктон и методические проблемы его изучения: Дис. … канд. биол. наук. Москва. 147 с.
Мансурова И.М. 2013. Влияние света на удельную скорость роста динофитовых водорослей Черного моря // Морской экол. журн. Т. 12. № 4. С. 73. https://doi.org/10.33624/2311-0147-2019-1(19)-46-56
Парсонс Т.Р., Такахаши М., Харгрей В. 1982. Биологическая океанография. Москва: Легк. и пищ. пром-сть. (Parsons T.R., Takahashi M., Hargrave B. 1977. Biological oceanographic processes. Oxford: Pergamon Press).
Погосян С.И., Гальчук С.В., Казимирко Ю.В. и др. 2009. Применение флуориметра “МЕГА-25” для определения количества фитопланктона и оценки состояния его фотосинтетического аппарата // Вода: химия и экология. № 6(12). С. 34.
Стельмах Л.В., Мансурова И.М., Акимов А.И. 2014. Культуры динофитовых водорослей Черного моря: экспериментальные исследования и практическое значение // Экосистемы, их оптимизация и охрана. № 11. С. 260. https://doi.org/10.33624/2311-0147-2019-1(19)-46-56
Akimov A.I., Solomonova E.S. 2019.Characteristics of growth and fluorescence of certain types of algae during acclimation to different temperatures under culture conditions // Oceanology. V. 59. Iss. 3. P. 316. https://doi.org/10.1134/S0001437019030019
Aldridge D., Purdie D.A., Zubkov M.V. 2014. Growth and survival of Neoceratium hexacanthum and Neoceratium candelabrum under simulated nutrient-depleted conditions // J. Plankton Res. V. 36. Iss. 2. P. 439. https://doi.org/10.1093/plankt/fbt098
Anderson C.R., Siegel D.A., Brzezinski M.A., Guillocheau N. 2008. Controls on temporal patterns in phytoplankton community structure in the Santa Barbara Channel, California // J. Geophys. Res.: Oceans. V. 113. Iss. C04038. https://doi.org/10.1029/2007JC004321
Baek S.H., Shimode S., Han M.-S., Kikuchi T. 2008.Growth of dinoflagellates Ceratium furca and Ceratium fusus in Sagami Bay, Japan: The role of nutrients // Harmful Algae. V. 7. Iss. 6. P. 729.
https://doi.org/10.1016/j.hal.2008.02.007
Behrenfeld J.M., Worthington K., Sherrell M.R. et al. 2006. Controls on tropical Pacific productivity revealed through nutrient stress diagnostics // Nature. V. 442. Iss. 7106. P. 1025. https://doi.org/10.1038/nature05083
Bronk D.A., See J.H., Bradley P., Killberg L. 2007. DON as a source of bioavailable nitrogen for phytoplankton // Biogeosciences. V. 4. P. 283. https://doi.org/10.5194/bg-4-283-2007
Chen T., Liu Y., Song S. et al. 2015. The effects of major environmental factors and nutrient limitation on growth and encystment of planktonic dinoflagellate Akashiwo sanguinea // Harmful Algae. V. 46. P. 62. https://doi.org/10.1016/j.hal.2015.05.006
Girault M., Arakawa H., Hashihama F. 2013. Phosphorus stress of microphytoplankton community in the western subtropical North Pacific // J. Plankton Res. V. 35. Iss. 1. P. 146. https://doi.org/10.1093/plankt/fbs076
Guillard R.R.L., Ryther J.H. 1962. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve // Can. J. Microbiol. V. 8. P. 229.
Häder D.-P., Gao K. 2015. Interactions of anthropogenic stress factors on marine phytoplankton // Front. Environ. Sci. V. 3. Article 14. P. 1. https://doi.org/10.3389/fenvs.2015.00014
Jephson T., Carlsson P. 2009. Species- and stratification-dependent diel vertical migration behaviour of three dinoflagellate species in a laboratory study // J. Plankton Res. V. 31. Iss. 11. P. 1353. https://doi.org/10.1093/plankt/fbp078
Karl D.M. 1999. A sea of change: biogeochemical variability in the North Pacific Subtropical Gyre // Ecosystems. V. 2. P. 181. https://doi.org/10.1007/s100219900068
Legrand C., Graneli E., Carlsson P. 1998. Induced phagotrophy in the photosynthetic dinoflagellate Heterocapsa triquetra // Aquat. Microb. Ecol. V. 15. Iss. 1. P. 65. https://doi.org/10.3354/ame015065
Menden-Deuer S., Lessard E.J. 2000. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol., Oceanogr. V. 45. Iss. 3. P. 569. https://doi.org/10.4319/lo.2000.45.3.0569
Mikaelyan A.S., Kubryakov A.A., Silkin V.A. et al. 2018. Regional climate and patterns of phytoplankton annual succession in the open waters of the Black Sea // Deep-Sea Res., Part I. V. 142. P. 44. https://doi.org/10.1016/j.dsr.2018.08.001
Oguz T., Glibert D. 2007. Abrupt transitions of the top-down controlled Black Sea pelagic ecosystem during 1960–2000: Evidence for regime-shifts under strong fishery exploitation and nutrient enrichment modulated by climate-induced variations // Deep Sea Res., Part I. V. 54. Iss. 2. P. 220. https://doi.org/10.1016/j.dsr.2006.09.010
Pakhomova S., Vinogradova E., Yakushev E. et al. 2014. Interannual variability of the Black Sea proper oxygen and nutrients regime: The role of climatic and anthropogenic forcing // Estuarine, Coastal Shelf Sci. V. 140. P. 134. https://doi.org/10.1016/j.ecss.2013.10.006
Palabhanvi B., Kumar V., Muthuraj M., Das D. 2014. Preferential utilization of intracellular nutrients supports microalgal growth under nutrient starvation: Multi-nutrient mechanistic model and experimental validation // Bioresour. Technol. V. 173. P. 245. https://doi.org/10.1016/j.biortech.2014.09.095
Protocols for the Joint Global Ocean Flux Study (JGOFS) Core Measurements. JGOFS Report Nr. 19, vi+170 pp. Reprint of the IOC Manuals and Guides No. 29, UNESCO 1994. 1996. http://hdl.handle.net/11329/220
Richardson K., Fogg G.E. 1982. The role of dissolved organic material in the nutrition and survival of marine dinoflagellates // Phycologia. V. 21. Iss. 1. P. 17. https://doi.org/10.2216/i0031-8884-21-1-17.1
Schnepf E., Elbrächter M. 1992. Nutritional strategies in dinoflagellates: a review with emphasis on cell biological aspects // Eu. J. Protistology. V. 28. Iss. 1. P. 3. https://doi.org/10.1016/S0932-4739(11)80315-9
Stelmakh L., Gorbunova T. 2019. Effect of phytoplankton adaptation on the distribution of its biomass and chlorophyll a concentration in the surface layer of the Black Sea // Oceanol. Hydrobiol. Stud. V. 48. Iss. 4. P. 404. https://doi.org/10.2478/ohs-2019-0035
Thompson P.A., Bonham P.I., Swadling K.M. 2008. Phytoplankton blooms in the Huon Estuary, Tasmania: top-down or bottom-up control? // J. Plankton Res. V. 30. № 7. P. 735. https://doi.org/10.1093/plankt/fbn044
Yang I., Beszteri S., Tillmann U. et al. 2011. Growth-and nutrient-dependent gene expression in the toxigenic marine dinoflagellate Alexandrium minutum// Harmful Algae. V. 12. P. 55. https://doi.org/10.1016/j.hal.2011.08.012
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


