Биология внутренних вод, 2021, № 2, стр. 191-197
Новые сведения о темном горбыле Sciaena umbra (Sciaenidae) у черноморских берегов Крыма по результатам подводных наблюдений в режиме апноэ
И. Ю. Тамойкин a, О. Н. Кулешова b, *, В. С. Кулешов a
a Межрегиональная общественная организация “Ассоциация подводной деятельности Крыма и Севастополя”
Севастополь, Россия
b Федеральный исследовательский центр, Институт биологии южных морей
им. А.О. Ковалевского Российской академии наук
Севастополь, Россия
* E-mail: v_olgo4ka@inbox.ru
Поступила в редакцию 02.08.2019
После доработки 02.03.2020
Принята к публикации 04.09.2020
Аннотация
Визуальные наблюдения членов Межрегиональной общественной организации “Ассоциация подводной деятельности Крыма и Севастополя” в 2015–2016 гг. позволили получить количественные характеристики темного горбыля (Sciaena umbra L., 1758) у черноморских берегов Крыма. Использована методика оценки его численности при визуальных наблюдениях без применения дыхательных аппаратов. Осуществлено 290 наблюдений средней продолжительностью каждого ~4 ч. Исследовано 64 экз. вида, из них у взрослых особей длина (SL) – 31.4 ± 0.9 см; масса тела – 830 ± 65 г, у молоди длина (SL) – 13.5 ± 0.2 см; масса – 78 ± 4 г. Для вида не выявлено угрожаемого состояния: плотность распределения достигала 2000–3100 экз./км2. Стаи на 70% представлены взрослыми рыбами возрастом до четырех лет и массой ≤1000 г, особи с массой >1500 г – малочисленны. Молодь обычно образует отдельные скопления.
ВВЕДЕНИЕ
Темный горбыль Sciaena umbra L., 1758 – характерный вид черноморских прибрежных сообществ твердых и смешанных грунтов. У черноморских берегов Турции в районе Синоп – Самсун вид отмечают в качестве обычного (But et al., 2013), но для страны в целом S. umbra относят к охраняемым (Öztürk et al., 2013). Его распространение вдоль северных берегов Черного моря по данным А.Н. Световидова (1964) повсеместно, но неравномерно. Это же подтверждают и более поздние исследования. Так, вид обычен в водах около горного массива Карадаг (восточный Крым) (Салехова и др., 1987), у м. Мартьян (южный Крым) и других участков побережья п-ова (Гордина, 1976; Болтачев, 2003; Болтачев и др., 2014; Болтачев, Карпова, 2017), выявлен в акватории у г. Севастополя (юго-западный Крым) (Овен и др., 1993), где отмечено стабильное присутствие его икры, молоди и взрослых особей (Салехова и др., 2007). В сетных уловах в северо-восточной части Черного моря его встречаемость достигает 75% (Куманцов и др., 2013). Вид находят даже в пещерах (п-ов Тарханкут, западный Крым) (Ковтун, Пронин, 2011). Таким образом, как указывается в работе с анализом данных промыслового лова (Надолинский, 2014), темный горбыль распространен вдоль всех берегов Черного моря, чаще встречаясь в его восточной части.
Во всех указанных выше публикациях для оценки численности и распределения темного горбыля использовали данные сетных учетных съемок или промысловой статистики. Но особенности поведения этого вида не позволяют получить достоверные сведения только по результатам сетных обловов (Лапшин, Герасимов, 2008; Лапшин, 2009). При исследовании этологической организации в популяциях темного горбыля посредством подводных визуальных наблюдений отмечали присущий ему скрытый образ жизни с использованием убежищ, крайнюю осторожность и относительно низкую подвижность (Мочек, 1987). Для получения репрезентативных данных о численности темного горбыля разработана методика оценки его численности при визуальных наблюдениях с использованием дыхательных аппаратов и без них (ныряние на задержке дыхания – апноэ) (Пашков, Круглов, 1984; Гетьман, 2007, 2012, 2017). По результатам подобных наблюдений установлено, что темный горбыль обычен для акватории м. Сарыч – м. Айя (южный Крым) (Пашков, 2001), а также вдоль побережья от пос. Новый Свет до г. Феодосия, но очень редок у м. Опук (восточный Крым) (Шаганов, 2009). Из всех этих работ следует вывод: у берегов Крыма темный горбыль встречается везде, где имеются типичные для него местообитания – твердые и смешанные грунты (Плотников и др., 2003; Тамойкин, 2016).
Цель работы – уточнить информацию по распределению, численности и сезонным особенностям поведения S. umbra у черноморского побережья Крыма с помощью подводных наблюдений без использования дыхательных аппаратов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Данные собирали в 2015–2016 гг. на трех выделенных участках акватории от с. Андреевка на юго-западе Крыма до пос. Орджоникидзе на востоке (рис. 1). Результаты визуальных подводных апноэ-наблюдений авторов, подводных охотников и фридайверов Межрегиональной общественной организации “Ассоциация подводной деятельности Крыма и Севастополя” (www.apdks.ru) фиксировали в специально разработанных анкетах, учитывающих встречаемость 28 морских видов.
Рис. 1.
Карта зон сбора материала в прибрежных экотопах черноморского побережья: 1 – р-н м. Толстый–бух. Ласпи (г. Севастополь); 2 – южный берег Крыма; 3 – р-н Судак–Феодосия.
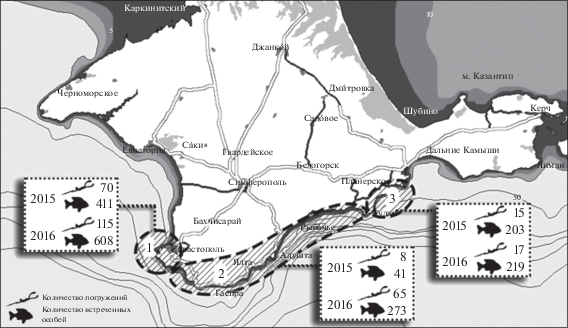
Погружения проходили преимущественно в весенне-летне-осенний период в светлое время суток в прибрежных акваториях над твердыми или смешанными грунтами на глубинах до 30 м при температуре воды >11–12°С, когда темный горбыль активен. Время наблюдений за одно погружение было ≤4 мин на глубинах ≤10 м и от 40 с до 3 мин на глубинах 10–32 м при общей длительности нахождения ныряльщиков в море от 1 ч 30 мин до 7 ч 55 мин (в среднем – 4 ч 06 мин). В среднем, наблюдатель обследовал площадь ~0.1 км2: участок береговой линии протяженностью ~500 м с удалением от берега до ~200 м – в зависимости от расположения границы, где заканчиваются твердые или смешанные грунты, над которыми обычно встречается темный горбыль. Для обработки отобрано 290 анкет. Всего за два года на акватории участка 1 сделано 185 наблюдений, участка 2 – 83 и участка 3 – 32 (рис. 1).
Режим апноэ в подводных исследованиях успешно применяли и ранее (Boltachev et al., 2016) В нашем случае важны его преимущества при наблюдении за видом, ведущим скрытный и осторожный образ жизни (Барди, 2009; Тамойкин, 2016). При поиске рыб в акватории ныряльщики использовали различные траектории обследования (рис. 2). Регистрацию рыб проводили в основном в объеме полусферы с радиусом 5–15 м от точки наблюдения на дне (что обусловлено видимостью под водой у берегов Крыма), а также при перемещении по акватории. Численность и распределение рыб оценивали по количеству встреченных особей на маршруте в пересчете на единицу площади.
Рис. 2.
Маршрутные схемы движения ныряльщика-апноиста в акватории: а – зигзагообразное движение, б – полосами перпендикулярно берегу, в – полосами параллельно берегу, г – радиальное.

У особей, добытых подводными охотниками, измеряли ТL и SL с точностью 0.1 см и массу тела с точностью 1 г. Всего выловлено 64 особи разного размера. Характеристики водной среды фиксировали по наручным водолазным компьютерам. Температуру воды измеряли с точностью 1°С, глубину – 0.1 м; время погружения – 1 с, общего пребывания в воде – 5 мин.
Анкеты в электронном или бумажном виде сдавали в “Ассоциацию подводной деятельности Крыма и Севастополя” и затем передавали авторам для анализа.
Статистический анализ полученных данных, включающий оценку зависимостей между размерными, весовыми и возрастными характеристиками, а также встречаемости горбыля от абиотических компонентов среды, проводили с использованием программных пакетов Statistica 10 и MS Office Excel.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристики размерно-возрастной структуры и численности в стаях. В выборке из бух. Александровская (г. Севастополь), которая включала 22 впервые созревающих особи темного горбыля в возрасте 1–2 года, ТL в среднем была 18.8 ± 0.2 см (от 17 до 21 см), SL – 13.5 ± 0.2 см (от 12 до 18 см), а масса – 78 ± 4 г (от 58 до 140 г) при соотношении самцов и самок 1/1.75. Данные по возрасту получены при помощи специалистов отдела паразитологии Института биологии южных морей им. А.О. Ковалевского РАН.
Всего на разных участках добыто 42 взрослые особи со следующими характеристиками: ТL – 37.1 ± 0.9 см (34–57 см); SL – 31.4 ± 0.9 см (29–52 см); масса – 830 ± 65 г (300–2350 г).
Наиболее крупной особью была самка темного горбыля, пойманная в 2015 г. у м. Меганом на глубине 5 м при температуре воды 19°C (масса – 2350 г, ТL – 49.5 см, SL – 44 см). После завершения исследований у г. Севастополя добыто несколько более крупных рыб массой 2950 г (2017 г.), 4030 г (2018 г.), 2580 г (2019 г.) и 3010 г (2020 г.).
У молоди и взрослых особей S. umbra выявлена высоко достоверная логарифмическая зависимость массы от длины особи (рис. 3, 4). При этом у взрослых рыб длина хвостового плавника (Lхn) почти не менялась с увеличением массы (рис. 4).
Рис. 3.
Логарифмическая зависимость массы от длины особи S. umbra из бух. Александровская (г. Севастополь). 1 – ТL, 2 – логарифмическая ТL.

Рис. 4.
Размерные и массовые характеристики половозрелых особей S. umbra из трех макромасштабных районов Черноморской прибрежной зоны Крыма: 1 – ТL, 2 – SL, 3 – Lхn (длина хвостового плавника), 4–6 – расчетные данные по формулам (1)–(3) соответственно.

В стае горбыля численностью >10 экз. (за исключением образования временных конгломератов перед зимними миграциями или во время летних явлений сгона теплых вод с большой акватории) наблюдали следующее соотношение взрослых рыб разного возраста. На одну взрослую особь возрастом >4 лет и массой >1000 г приходилось 5–7 взрослых особей возрастом ≤3–4 лет и массой 400–1000 г. В стаях численностью до 30 экз. доля взрослых рыб возрастом ≤3–4 лет и размером (SL) >20 см была 50–70%, возрастом >4 лет и массой >1000 г – 30–50%, самых крупных, с массой >1500 г – ≤10%. Повсеместно отмечена невысокая численность крупных особей массой >1500 г и возрастом >4 лет.
Плотность и встречаемость. Максимальная плотность горбыля достигала 3100 экз./км2 поверхности исследуемой акватории. В остальных случаях плотность колебалась в пределах 2000–3000 экз./км2.
В ходе анализа совокупности собранных сведений о количестве встреченных особей S. umbra за каждое отдельное погружение, получены следующие статистические характеристики: среднее – 5.803 экз./погружение (стандартное отклонение – 8.741, стандартная ошибка среднего – 0.512, доверительный интервал стандартного отклонения – 8.058–9.487). При наличии предпочитаемых этим видом местообитаний вероятность встречи 4–6 экз. горбыля за одно погружение достигала 95%.
Особенности распределения. Встречаемость горбыля резко убывала в воде с температурой <11–12°C и возрастала в теплой воде с температурой >22°С. При падении температуры воды <11–12°С рыбы обычно переставали питаться и часто образовывали большие скопления в скальных убежищах. При летних сгонно-нагонных явлениях, когда холодная вода стремительно подходила к берегу, большая часть местных стай сначала предпринимала активные миграции в сторону теплых водных масс. Если это было невозможно, стаи переставали кормиться и объединялись с другими группами в крупные скопления, временно залегая в убежищах до потепления, и иногда погибали. Однако были отмечены случаи, когда при температуре воды 9–10°C горбыль вел активный образ жизни, что может объясняться внезапным появлением легкодоступного корма, температурным скачком или другими факторами. Наиболее устойчивы к внезапному перепаду температур крупные особи. Установлено также фактически полное отсутствие горбыля вблизи уреза воды на мелководье в светлое время суток.
Зависимость встречаемости горбыля от абиотических компонентов среды проанализирована по двум факторам – глубине и температуре воды. Согласно результатам корреляционного анализа совокупных данных 2015 и 2016 гг. за все сезоны, кроме зимнего, число встреченных особей S. umbra не зависит от глубины (коэффициент корреляции Пирсона r = 0.16; p < 0.05; доверительный интервал: 95%; t-Стьюдента = 2.809 >tкр = 1.968) и температуры (r = –0.03; p > 0.05; доверительный интервал: 95%; t-Стьюдента = 0.653 <tкр = 1.968).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Почти все работы по изучению темного горбыля в северной части Черного моря с использованием дыхательных аппаратов и техник апноэ не содержат оценок численности или плотности вида, в лучшем случае указано лишь количество встреч или пойманных особей на единицу длины сетей (Пашков, Круглов, 1994; Пашков, 2001; Шаганов, 2009; Мальцев и др., 2017). Так, в 1993–1996 гг. для сумеречно-ночного времени в прибрежной зоне северо-восточной части Черного моря отмечены достаточно высокие показатели уловов вида для твердых и смешанных грунтов (0.08 и 0.04 экз./10 м сетей соответственно) (Плотников и др., 2003). По результатам подводных наблюдений в 2007–2014 гг., численность S. umbra была 3–15 экз. на ~0.01 км2 обследованных участков от м. Тарханкут на западе до м. Сарыч на юге Крыма (Гетьман, 2007, 2012, 2017). К сожалению, эти данные не выдерживают критики из-за ошибок методического характера (Тамойкин, 2016).
Характеристика размерно-возрастной структуры и численности в стаях. S. umbra по происхождению является средиземноморским видом. В условиях более теплого Средиземного моря ТL ювенальных особей 13–29 см, масса >60 г, возраст ≤3 лет; время первого нереста соответствует 3–4 годам при ТL самцов ~25 см, самок ~30 см. У Балеарских о-ов наиболее крупные особи-самки имеют ТL 47.2 см и возраст 16 лет, у о. Мальта – 47.6 см и 26 лет соответственно, у побережья Туниса – 53.9 см и 21 год, у о. Корсика – 49.7 см и 31 год. В стаях превалируют особи 3–4 лет и массой ≥500 г. Соотношение полов примерно 1 : 1, но самцы почти всегда мельче самок, последние по мере старения проявляют лучшую выживаемость, сохраняя высокую фертильность. Чрезвычайно быстрый прирост (0.5–19 см/год) наблюдается в первые три года, после 10 лет рост почти прекращается (La Mesa et al., 2008; Grau et al., 2009; Moran et al., 2017).
В Мраморном море у темного горбыля половозрелость наступает при ТL >17 см. При продолжительности жизни >20 лет ТL достигает 50 см (максимальная – 70 см). Зарегистрировано преобладание 4-летних рыб в группах (Artüz, 2006).
В Черном море в прибрежных водах Турции у 50% фертильных особей S. umbra минимальная ТL у самцов достигает 19.5 см, у самок – 22 см, однако, половое созревание начинается при ТL ~15 см; максимальная ТL (72 см) зафиксирована у особей с массой тела 4700 г в возрасте 18 лет (Engin, Seyhan, 2009).
По данным А.Н. Световидова (1964), у темного горбыля в северной части Черного моря обычна ТL 25–45 см при максимуме 70 см и предельной массе 3–4 кг. В работе В.П. Надолинского (2004) по анализу многолетних данных промысловых ловов для взрослых особей вида указывали размеры SL 19–30 см при массе 300–500 г. Уточнить эти характеристики при искусственном выращивании пока не удалось (Астахов и др., 2006).
Полученные нами данные в целом соответствуют вышеприведенным: половозрелость темного горбыля у берегов Крыма наступает при ТL ≥22 см, SL ≥19 см, массе ≥300 г и возрасте >2 лет. У взрослых особей возрастом >4 лет ТL >34 см, SL >29 см, масса >800 г. Стаи в основном представлены взрослыми особями 3–4 лет жизни; крупные особи массой >1500 г немногочисленны; максимальные размеры несколько ниже таковых в средиземноморских и прибосфорских черноморских районах. Расхождения могут объясняться более суровыми условиями обитания S. umbra в прибрежных водах Крыма и, как следствие, более быстрым созреванием при меньших скоростях роста и увеличения массы тела.
Особенности распределения и сезонного поведения. Во всех исследованных районах плотность расселения вида носит сходный характер. Представители вида могут встречаться поодиночке, малочисленными группами и стаями численностью до нескольких десятков рыб в течение теплого сезона, часто образуя большие (до сотен особей) скопления в нерестовый период и перед зимовкой. Даже в небольших группах обычно представлены оба пола, самки крупнее самцов. По нашим наблюдениям, молодь темного горбыля образует преимущественно отдельные стаи, чаще – в мелководных зонах, особенно в бухтах, почти не смешивается со взрослыми особями, присоединяясь к последним по мере достижения половой зрелости или формируя новые стаи в незанятых видом нишах. Нерестовое поведение у S. umbra в крымских водах наблюдалось с июня по август и совпадало с устойчивым прогревом воды ≥18°С, наибольшая нерестовая активность зафиксирована при температуре >22°С.
Упоминаемое в литературе появление темного горбыля у берегов лишь с апреля–мая до ноября связано со снижением активности, сбиванием в стаи и залеганием в убежищах при низких температурах и вызвано особенностями жизнедеятельности этого средиземноморского по происхождению вида в более холодных черноморских водах.
Выявлено, что для нормального существования S. umbra обязательно наличие на разных глубинах темных убежищ с разветвленными и емкими пещерами, ходами и нишами. Также он использует скалы, нагромождения обломочных пород и объекты искусственного происхождения, удобные для всех возрастных групп. Вид временно может присутствовать в толще воды и над мягкими грунтами далеко от убежищ (за десятки и сотни метров), применять укрытия небольшой емкости, подходить к урезу воды при наличии достаточных глубин с убежищами. Особенности горизонтальных и вертикальных перемещений темного горбыля носят бентопелагический характер.
В исследованных районах S. umbra с достаточно высокой плотностью встречается почти на любой акватории с подходящими ландшафтами, но при невысокой численности крупных особей. В Средиземном море особи крупных размеров чрезвычайно редки из-за прессинга со стороны подводной охоты и других видов рыболовства и сохраняются исключительно в охраняемых акваториях (Moran et al., 2017). У берегов Крыма наиболее крупных особей наблюдали и добывали вне охраняемых акваторий. При сравнимой плотности основным различием поведения темного горбыля в охраняемых и неохраняемых районах можно назвать более спокойное восприятие опасности (ныряльщика) в охраняемой зоне, что связано с фактором меньшей степени беспокойства со стороны человека.
Выводы. У берегов Крыма от с. Андреевка на юго-западе Крымского п-ва до пос. Орджоникидзе на востоке состояние S. umbra не оценивается как угрожаемое. Плотность особей темного горбыля на соответствующих ландшафтах исследованных акваторий достигает 2000–3100 экз./км2. Время нереста темного горбыля начинается при температуре воды >18°С. Время первого нереста наступает при достижении ТL ≥22 см, SL ≥19 см, массе ≥300 г и возрасте >2 лет. Стаи на 50–70% представлены взрослыми особями возрастом ≤4 лет и массой ≤1000 г, повсеместно крупные экземпляры массой >1500 г малочисленны. Молодь преимущественно не смешивается с взрослыми особями, образуя отдельные скопления.
Список литературы
Астахов Д.А., Попонов С.Ю., Попонова В.Р. 2006. Некоторые аспекты длительного содержания морских рыб в искусственных условиях. 17. Семейство Sciaenidae (Actinopterygii, Perciformes) // Научные исследования в зоологических парках. Вып. 20. С. 12.
Барди М. 2009. Учебник подводной охоты на задержке дыхания. Москва: Изд-во Олимпия.
Болтачев А.Р. 2003. Ихтиофауна черноморского побережья Крыма. Таксономическое разнообразие // Современное состояние биоразнообразия прибрежных вод Крыма (черноморский сектор). Севастополь: ЭКОСИ-Гидрофизика. С. 363.
Болтачев А.Р., Карпова Е.П. 2017. Морские рыбы Крымского полуострова. Симферополь: Изд-во Бизнес-Информ.
Болтачев А.Р., Карпова Е.П., Данилюк Е.М. 2014. Список видов рыб природного заповедника “Мыс Мартьян” // Научные записки природного заповедника “Мыс Мартьян”. Вып. 57. С. 113.
Гетьман Т.П. 2007. Визуальные подводные наблюдения при оценке качественно-количественных показателей ихтиоцена // Экология моря. Отдельный вып. 74. С. 13.
Гетьман Т.П. 2012. Особенности распространения и распределения темного горбыля Sciaena umbra в прибрежной акватории Крыма (Черное море) // Биоразнообразие и устойчивое развитие: Матер. II Междунар. конф. (Симферополь, 12–16 сентября 2012 г.), Симферополь. С. 163.
Гетьман Т.П. 2017. Ихтиоцены прибрежной акватории бухты Круглая (Севастополь, Черное море) // Вісник Харківського національного університету імені В.Н. Каразіна. Серія “Біологія”. Вип. 29. С. 126.
Гордина А.Д. 1976. Распределение и сезонные изменения численности взрослых рыб в зарослевых биоценозах Черного моря // Биол. моря. Вып. 39. С. 78.
Ковтун О.А., Пронин К.К. 2011. Морфолого-биологическая характеристика подводной пещеры Тарзанка (полуостров Тарханкут, Малый Атлеш) // Спелеология и карстология. № 6. С. 53.
Куманцов М.И., Кузнецова Е.Н., Лапшин О.М. 2013. Комплексный подход к организации рыболовства на Черном море // Труды ВНИИ рыбного хоз-ва и океанографии. Т. 150. С. 92.
Лапшин О.М. 2009. Теория, методология и практика учетных рыболовных систем: Автореф. дис. … докт. техн. наук: 05.18.17. Москва. 48 с.
Лапшин О.М., Герасимов Ю.В. 2008. Особенности поведения промысловых рыб в зоне действия учетного ставного невода // Известия Тихоокеанского филиала Всероссийского научно-исследовательского института рыбного хозяйства и океанографии. Т. 155. С. 300.
Мальцев В.И., Шаганов В.В., Василец В.Е. 2017. Современное состояние ихтиокомплекса Карадагского природного заповедника // Труды Карадагской научной станции – природного заповедника РАН. № 2(4). С. 42.
Мочек А.Д. 1987. Этологическая организация прибрежных сообществ морских рыб. Москва: Изд-во “Наука”.
Надолинский В.П. 2004. Структура и оценка запасов водных биоресурсов в северо-восточной части Черного моря: Дис. … канд. биол. наук: 03.00.32. Ростов-на-Дону. 171 с.
Овен Л.С., Гордина А.Д., Миронов О.Г. и др. 1993. Ихтиофауна черноморских бухт в условиях антропогенного воздействия. Киев: Наук. думка.
Пашков А.Н. 2001. Ихтиофауна прибрежного шельфа Черного моря в полигалинных акваториях: Автореф. дис. … канд. биол. наук: 03.00.10. Москва.
Пашков А.Н., Круглов М.В. 1994. К методике оценки плотности распределения придонных рыб в мелководной части черноморского шельфа // Актуальные вопросы экологии и охраны природы степных экосистем и сопредельных территорий. С. 318.
Плотников Г.К., Пашков А.Н., Стрельников В.В. 2003. Состав, структура и количественные показатели придонных ихтиоценозов прибрежного шельфа северо-восточной части Черного моря // Известия ВУЗов. Северо-Кавказский регион. Сер. Естественные науки. № 3. С. 66.
Салехова Л.П., Гордина А.Д., Климова Т.Н. 2007. Ихтиофауна прибрежных вод Юго-западного Крыма в 2003–2004 гг. // Вопр. ихтиол. Т. 47. Вып. 2. С. 173.
Салехова Л.П., Костенко Н.С., Богачик Т.А., Минибаева О.Н. 1987. Состав ихтиофауны в районе Карадагского государственного заповедника (Черное море) // Вопр. ихтиол. Т. 27. Вып. 6. С. 898.
Световидов А.Н. 1964. Рыбы Черного моря. Москва: Изд-во “Наука”.
Тамойкин И.Ю. 2016. Методологические аспекты применения подводных наблюдений в ихтиологических исследованиях у черноморских берегов Крыма // Актуальные проблемы современной науки и пути их решения: Матер. XXIII Междунар. конф. (Москва, 26–27 февраля 2016 г.). Москва: Евразийский Союз Ученых. Биологические науки. Ч. 3. № 2(23). С. 133.
Шаганов В.В. 2009. Предварительный обзор ихтиофауны черноморского побережья Юго-восточного Крыма // Сборник научных трудов: Карадаг-2009. С. 262–273.
Artüz M.L. 2006. Abundance and growth observations of Sciaena umbra Linnaeus, 1758 in Sea of Marmara // Hidrobiologica. 1a. P. 124.
Boltachev A., Karpova E., Tamoykin I. 2016. Species composition and feature of spread of Porgies (Actinopterygii: Sparidae) in the Black Sea // FABA 2016: International Symposium on Fisheries and Aquatic Sciences Abstract Book 3–5 November 2016. Antalya/TURKEY. P. 17.
But L., Sezgin M., Sahih F. et al. 2013. Sinopsity fishery of the Black Sea // Marine Science. V. 3(3). P. 55. https://doi.org/10.5923/j.ms.20130303.01
Engin S., Seyhan K. 2009. Age, growth, sexual maturity and food composition of Sciaena umbra in the south-eastern Black Sea, Turkey // J. Appl. Ichthyol. V. 25. P. 96. https://doi.org/10.1111/j.1439-0426.2008.01173.x
Grau A., Linde M., Grau A.M. 2009. Reproductive biology of the vulnerable species Sciaena umbra Linnaeus, 1758 (Pisces: Sciaenidae) // Sci. Mar. V. 73(1). P. 67. https://doi.org/10.3989/scimar.2009.73n1067
La Mesa M., Colella S., Giannetti G., Arneri F. 2008. Age and growth of brown meager Sciaena umbra (Sciaenidae) in the Adriatic Sea // Aquat. Living Resour. V. 21. P. 153. https://doi.org/10.1051/alr:2008029
Moran F., Marschal C., Dominici J.-M., Harmelin-Vivien M.A. 2017. 31-year-old brown meagre female poached in the Scandola marine reserve in Corsica, France // Cybium: Int. Journal Ichthyol. V. 41(1). P. 79.
Öztürk B., Oral M., Topaloglu B. et al. 2013. Red data book Black Sea // Istanbul: Turkish Marine Research Foundation. P. 212
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


