Биология внутренних вод, 2021, № 4, стр. 332-342
Состав и морфология чешуйчатых золотистых водорослей левобережных волжских притоков
П. В. Кулизин a, *, Е. С. Гусев b, Е. Л. Воденеева a, c, А. Г. Охапкин a
a Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
c Нижегородский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
Нижний Новгород, Россия
* E-mail: KulizinPavel@yandex.ru
Поступила в редакцию 05.10.2020
После доработки 20.10.2020
Принята к публикации 23.11.2020
Аннотация
По результатам электронно-микроскопического исследования проб фитопланктона двух крупных левобережных притоков Чебоксарского водохранилища обнаружено 30 видов чешуйчатых золотистых водорослей из класса Chrysophyceae, в том числе три новых для флоры России и один потенциально новый для науки. Приведены сведения по численности и биомассе фитопланктона с указанием роли золотистых водорослей. Отмечено доминирование чешуйчатых золотистых водорослей в весенних и раннелетних альгоценозах р. Керженец.
ВВЕДЕНИЕ
Золотистые водоросли – широко распространенная группа пресноводных фитофлагеллат, относимых к линии Stramenopiles или Heterokontophyta, играющая важную роль в функционировании пресноводных экосистем, особенно в водоемах средней и низкой продуктивности (Kristiansen, 1995; Гусев и др. 2020). Для строения их талломов отмечено большое разнообразие структурных типов, включающих виды без твердых клеточных покровов, с образованиями в виде целлюлозных домиков, а также виды, имеющие специализированные кремнеземные образования (чешуйки), покрывающие клетки (Волошко, 2017б).
В ранних работах по фитопланктону р. Волги (Павлинова, 1930; Есырева, 1935, 1945; Коршиков, 1939) приводятся списки видов водорослей, в которых отмечены Mallomonas spp., Synura uvella Ehrenberg emend. Korschikov, S. echinulata Korschikov, S. petersenii Korshikov.
Зарегулирование стока р. Волги и создание каскада водохранилищ стимулировали исследования фитопланктона и золотистых водорослей в его составе. В последних обобщающих сводках по альгофлоре водоемов бассейна р. Волги приведены сведения о 43 таксонах чешуйчатых золотистых водорослей из рода Mallomonas (Gusev et al., 2019), 18 видах рода Synura, четырех видах Spiniferomonas, четырех видах Paraphysomonas, пяти видах Chrysosphaerella (Балонов, 1976; Корнева, 2015).
Разнообразие фитопланктона р. Волги формируется, в том числе и воздействием системы боковой приточности – небольшими по протяженности реками, которые в значительной степени определяют ее гидрологический и гидрохимический режимы, оказывают заметное влияние на структуру биоты (Охапкин, 1997; Воденеева, 2006). В имеющихся немногочисленных данных о составе золотистых водорослей некоторых волжских притоков (р. Керженец) в составе планктона указываются Mallomonas acaroides var. striatula Asmund, M. caudata Ivanov emend. Krieger, M. eoa Takahaschi in Asmund et Takahaschi, M. tonsurata Teiling emend. Krieger, Synura uvella Ehrenberg emend. Korschikov, S. petersenii Korschikov, S. petersenii var. glabra (Korschikov) Huber-Pestalozzi и S. spinosa Korschikov (Балонов, Кузьмин, 1975; Балонов, 1976). Сведений о чешуйчатых золотистых водорослях р. Ветлуга крайне недостаточно. По результатам исследования фитопланктона этой реки, проведенного в 70-х гг. XX в., обнаружены Mallomonas akrokomos Ruttner in Pascher, Mallomonas caudata, Mallomonas sp. и Synura verrucosa Pascher (Есырева, Юлова, 1968; Охапкин, 1997), однако, идентификация видов была проведена только с использованием световой микроскопии и требует электронно-микроскопического подтверждения.
Несмотря на большое количество литературных сведений по составу и структуре фитопланктона водоемов и водотоков бассейна р. Волги, специальных таксономических работ по идентификации чешуйчатых золотистых водорослей с применением электронной микроскопии и молекулярно-генетических методов немного (Корнева, 2006; Гусев и др., 2017; Gusev et al., 2019). Электронная микроскопия и ультраструктура чешуек уже давно используются при изучении таксономии рассматриваемой группы организмов. Несколько родов описаны и изучены исключительно с использованием ЭМ (методы СЭМ и ТЭМ). Применение новых подходов показало значимость небольших на первый взгляд различий в ультраструктуре чешуек и возможность их использования в оценке эволюционных взаимосвязей (Škaloud et al., 2013a; Гусев и др., 2016).
Цель работы – анализ видового состава чешуйчатых золотистых водорослей с использованием современных подходов (электронная микроскопия) в определении этой группы.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
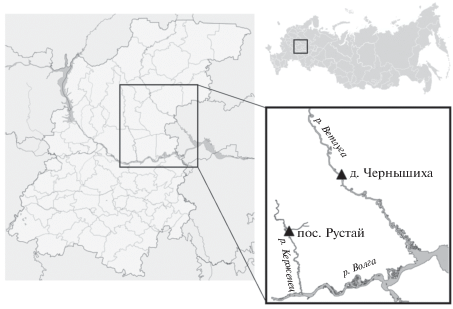
Исследованные водотоки по морфологическим показателям (площадь водосбора, длина) относятся к категории средних (р. Керженец) и больших (р. Ветлуга) рек. Они являются типично равнинными, с выраженным весенним половодьем и преобладанием снегового типа питания. Протекая по равнинной местности с преобладанием лесов, озер и болот они имеют сильно извилистые и неглубокие русла, небольшие продольные уклоны, небольшие скорости течения и хорошо разработанные долины с пологими склонами, незаметно переходящими в окружающую местность. Водораздельное пространство двух исследованных рек представляет собой довольно ровную поверхность, что сильно затрудняет четкое проведение границы водосборных площадей этих водотоков (Панфилов, 1974).
Сток левобережных притоков Средней Волги формируется в подзоне южной тайги с залесенным и заболоченным водосбором. Это оказывает существенное влияние на формирование химического состава поверхностных вод и отражается на характере и величинах минерализации, содержании биогенных элементов, органических веществ гумусового происхождения (гуминовые и фульвокислоты) и определяет повышенную цветность вод, величину pH и уменьшает содержание ионов HCO3 по сравнению с р. Волгой (табл. 1).
Таблица 1.
Основные гидрологические и гидрохимические показатели исследованных водотоков
| Показатель | р. Керженец | р. Ветлуга |
|---|---|---|
| Площадь водосбора, км2 | 16 400 | 39 400 |
| Длина реки, км | 290 | 889 |
| Скорость течения, м/с | 0.1–0.3 | 0.3–0.5 |
| pH | 6.1–7.53* | 7.6–8.1 |
| Цветность, град | 98* | – |
| Сумма ионов, млг/л | 100.7* | 133 |
| Удельная электропроводность, мкСм/см | 121.9* | 197.5 |
| Робщ, мкг/л | 55* | 30 |
Для изучения состава чешуйчатых золотистых водорослей использовали пробы фитопланктона, отобранные в период открытой воды. На р. Керженец пробы отбирали в течение вегетационного периода (май–октябрь) 2017 г. на станции близ пос. Рустай (56°49′79.12″ с.ш., 44°79′42.40″ в.д.), на р. Ветлуга – на станции около д. Чернышиха (56°85′73.18″ с.ш., 45°43′74.22″ в.д.) осенью (октябрь 2019 г.) (рис. 1). Также анализировали архивные материалы авторов по сезонной динамике фитопланктона в 2014 и 2016 гг.
В период исследования измеряли темпреатуру, pH и электропроводность воды (табл. 1).
Пробы для количественного учета отбирали зачерпыванием поверхностного слоя воды емкостью объемом 0.5 л и фиксировали йодно-формалиновым фиксатором. Далее пробы сгущали методом фильтрации через мембранные фильтры “Владипор” мембраны типа МФАС-М с диаметром диска 35 мм и размером пор порядка 2 мкм и доводили объем до 5 мл.
Для изучения чешуек золотистых водорослей пробы отмывали от йодно-формалинового фиксатора, 4–5 мин прожигали в серной кислоте с бихроматом калия, отмывали с помощью дистиллированной воды. Осадок помещали на сетки, покрытые формваровой пленкой (EMS FF200-Cu-50, Electron Microscopy Sciences). Пробы просматривали с использованием трансмиссионного электронного микроскопа JEM-1011 в Центре коллективного пользования электронной микроскопии Института биологии внутренних вод им. И.Д. Папанина РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В фитопланктоне исследуемых водотоков обнаружено 30 видов из класса Chrysophyceae, порядков Synurales и Paraphysomonadales. Из них 19 видов принадлежат роду Mallomonas, 9 – Synura, один – Chrysosphaerella и один – Lepidochromonas. В р. Керженец зафиксированы все найденные нами таксоны родов Mallomonas, Synura, Chrysosphaerella, Lepidochromonas, в р. Ветлуга отмечено только два вида рода Synura.
Ниже приводится список обнаруженных видов с краткой характеристикой морфологии чешуек и их распространения. Виды иллюстрированы оригинальными фотографиями чешуек, полученными с использованием трансмиссионного микроскопа.
Mallomonas akrokomos Ruttner (рис. 2а). Обнаружен в р. Керженец впервые. Имеет широкое распространение. Отмечен в водоемах севера России (Волошко, 2017б), в Верхней Волге (Балонов, 1976).
Рис. 2.
Чешуйки таксонов рода Mallomonas: а – M. akrokomos; б–г – M. annulata; д – M. alata; е – M. allorgei; ж – M. calceolus; з – M. сaudata; и – M. сostata; к – M. сrassisquama var. crassisquama; л – M. heterospina; м–о – M. jubata, п – M. mangofera; р – M. multiunca; c, т – M. munda, у, ф – M. papillosa var. papillosa.
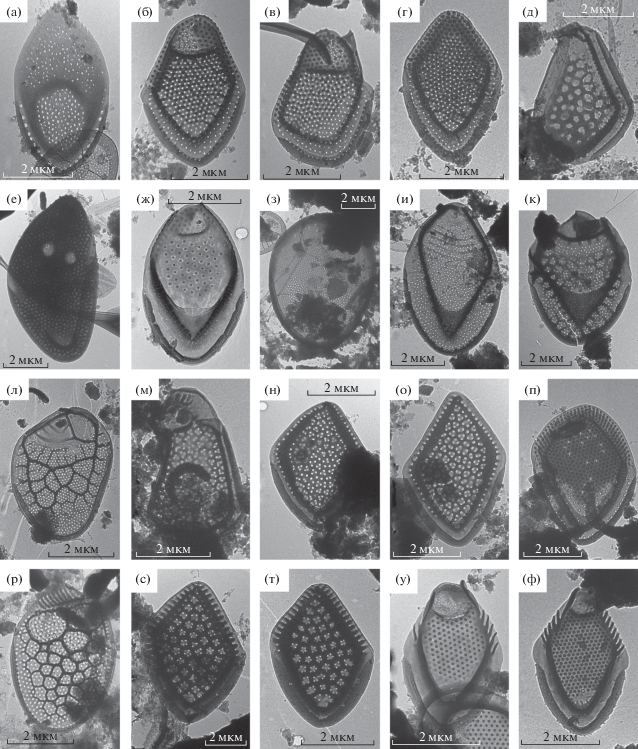
M. annulata (Bradley) Harris 1967 (рис. 2б–2г). Найден в р. Керженец впервые. Широко распространен в Европе, Центральной и Южной Америке, Азии, Австралии (Kristiansen, Preisig, 2007). На территории России отмечен в р. Волге (Балонов, 1976) и в водоемах Севера России (Волошко, 2017б).
M. alata Asmund, Cronberg et Dürrschmidt (рис. 2д). Отмечен в р. Керженец впервые. Широко распространенный вид (Kristiansen, Preisig, 2007). Встречается в Европейских странах, России (Волошко, 2017б).
M. allorgei (Deflande) Conrad (рис. 2е). Зарегистрирован впервые в р. Керженец. Широко распространен, встречается в водоемах Европы, Северной, Центральной и Южной Америки, Африке и Австралии (Kristiansen, Preisig, 2007). На территории России отмечен в водоемах Севера России (Волошко, 2017б).
M. calceolus Bradley (рис. 2ж). Обнаружен в р. Керженец впервые. Широко распространенный вид (Kristiansen, Preisig, 2007). На территории России отмечен в Карелии (Балонов, 1979), Невской губе, Вологодской обл. и водоемах Большеземельской тундры (Волошко, 2017б; Siver et al., 2005).
M. сaudata Ivanov emend. Krieger (рис. 2з). Ранее отмечен в планктоне р. Керженец и волжских водохранилищ (Балонов, Кузьмин, 1975). Один из самых широко распространенных видов, космополит (Kristiansen, 2005), олигосапробионт (Watson, Satchwill, 2003). Кроме водохранилищ Волжского каскада обнаружен в крупных волжских притоках (Шоша, Созь, Ока, Кама) (Балонов, Кузьмин, 1975).
M. сostata Dürrschmidt (рис. 2и). Обнаружен в р. Керженец впервые. Широко распространен. Встречается в водоемах Европы, Северной Америке, Азии, Австралии и в водоемах Севера России (Большеземельская и Воркутинская тундры) (Siver et al., 2005; Волошко, 2017б). Ацидофил, в водоемах с низкой минерализацией.
M. crassisquama (Asmund) Fott var. crassisquama (рис. 2к). Впервые зарегистрирован в р. Керженец. Широко распространен, особенно в умеренных широтах (Kristiansen, Preisig, 2007). Отмечен в водоемах Севера России (Волошко, 2017б).
M. heterospina Lund (рис. 2л). Найден впервые в р. Керженец. Широко распространен (Kristiansen, Preisig, 2007). Отмечен в планктоне Рыбинского водохранилища (Балонов, Кузьмин, 1975) и в водоемах Севера России (Волошко, 2017б).
M. jubata Němcová, Kreidlová, Pusztai & Neustupa (рис. 2м–2о). Недавно описанный вид, выделен из группы M. pumilio (Němcová et al., 2013). Первая находка на территории России. Отмечен в р. Керженец. Чешуйки вида характеризуются рядом морфологических признаков. Апикальные чешуйки, образующие воротник, ассиметричные, удлиненные с выраженным куполом (рис. 2м). Срединные чешуйки ромбические без купола (рис. 2н, 2о). Ретикулум щита состоит из ячей неправильной формы и содержит от одной до трех пор. Размеры чешуек в популяции из р. Керженец варьируют от 3.9 до 4.7 мкм в длину, 2.6 до 3.1 мкм в ширину. Распространен в странах Европы (Франция, Греция) в небольших прудах, бассейнах, сфагновых болотах. Встречается при pH 4.6–7.2 (Němcová et al., 2013).
M. mangofera Harris et Bradley (рис. 2п). Обнаружен в р. Керженец впервые. Вид описан из водоемов Великобритании (Harris, Bradley, 1960), встречается в других районах Европы (Němcová et al., 2012; Škaloud et al., 2013b). Считается, что вид имеет космополитное распространение (Kristiansen, Preisig, 2007), однако, исследования последних лет показали, что обнаруженный морфотип характерен для европейской территории, а морфотипы из других регионов (Южная Америка, тропическая Азия и Африка) представляют собой другие виды (Gusev et al., 2019). В России ранее отмечен только на Северо-Западе Европейской части (Сафронова, 2014).
M. multiunca Asmund (рис. 2р). Обнаружен в р. Керженец впервые. Широко распространенный вид. Отмечен в водоемах Севера России (Волошко, 2017б), водохранилищах Волжского каскада (Балонов, Кузьмин, 1975), в Европе, Северной и Центральной Америке, Азии (Kristiansen, Preisig, 2007).
M. munda (Asmund, Cronberg & Dürrschmidt) Němcová (рис. 2с, 2т). Обнаружен в р. Керженец впервые. Изначально чешуйки такого типа описаны как M. pumilio var. munda Asmund, Cronberg & Dürrschmidt (Dürrschmidt, 1982). Проведенная геометрическая морфометрия позволила повысить ранг разновидности до вида, выделив его из группы M. pumilio (Němcová et al., 2013). Биполярный вид (Kristiansen, Preisig, 2007). В России отмечен в водоемах большеземельской тундры (Siver et al., 2005), в карстовых озерах Центральной России (Gusev, 2013) и небольших водоемах Ленинградской обл. (Сафронова, 2014).
M. papillosa Harris et Bradley var. papillosa (рис. 2у, 2ф) обнаружен в р. Керженец впервые. Космополитный вид (Kristiansen, Preisig, 2007). Найден в р. Волга (Балонов, 1976), водоемах Севера России (Волошко, 2017б).
M. punctifera Korschikov var. punctifera (рис. 3а, 3б). Обнаружен в р. Керженец впервые. Широко распространенный вид, обычен в северных и умеренных широтах (Kristiansen, Preisig, 2007). Отмечен в планктоне Волжских водохранилищ (Балонов, Кузьмин 1975), в водоемах Севера России (Волошко, 2017б).
Рис. 3.
Чешуйки таксонов рода Mallomonas, Synura, Chrysosphaerella и Lepidochromonas: а, б – Mаllomonas punctifera var. punctifera; в, г – M. retifera; д – M. striata var. striata; е – Mallomonas sp., ж – M. tonsurata, з–к – Synura echinulata, л, м – S. multidentata, н – S. punctulosa, о – S. spinosa f. spinosa, п – S. spinosa f. longispina, р, с – Synura uvella, т, у – Chrysosphaerella brevispina, ф – Lepidochromonas poteriophora.
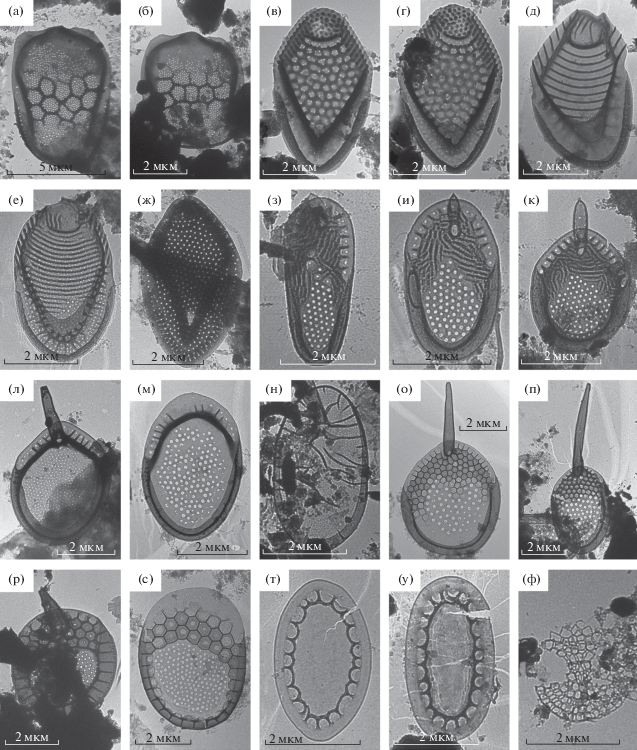
M. retifera Dürrschmidt (рис. 3в, 3г). Впервые отмечен на территории России в р. Керженец. Чешуйки трехсторонние, немного ассиметричные, длина 4.7–4.8 мкм, ширина 2.1–2.9 мкм. Купол с рассеянными папиллами. V-образное ребро с выраженным капюшоном. Переднее субмаргинальное ребро толстое. Задняя кромка широкая, гладкая, передняя – узкая с рядами папилл. Встречается на территории Европы (Pichrtova et al., 2007; Němcová et al., 2012), Южной Америки (Dürrschmidt, 1982), Восточной Азии (Kristiansen, Preisig, 2007). Редкий вид.
M. striata Asmund var. striata (рис. 3д). Обнаружен в р. Керженец. Широко распространенный вид, отмечен в планктоне волжских водохранилищ, в крупных волжских притоках (Шоша, Созь, Ока, Керженец, Кама) (Балонов, Кузьмин, 1975).
Mallomonas sp. (рис. 3е). Обнаружен в р. Керженец. Найденная чешуйка не подходит по описанию к ранее известным видам. Относится к секции Striatae Asmund & Kristiansen. Чешуйки эллиптические, 4.6 мкм длиной, 2.8 мкм шириной. Купол чешуйки почти округлый, с продольными ребрами. На щите расположено 18 дугообразно изогнутых поперечных ребер. V-образное ребро широко закругленное с хорошо выраженным капюшоном. В углу V-образного ребра расположено несколько крупных пор. Антериальная кромка с ребрами. Новый для науки вид, требующий для описания более подробного изучения.
M. tonsurata Teiling emend. Krieger (рис. 3ж). Обнаружен в р. Керженец. Ранее отмечен в планктоне р. Керженец (Балонов, Кузьмин, 1975). Космополит, встречался в Волжских водохранилищ, дельте р. Волги, отмечен на территории севера Европейской России (Балонов, Кузьмин, 1975; Волошко, 2017б).
Chrysosphaerella brevispina Korschikov (рис. 3т, 3у). Вид зарегистрирован в р. Керженец. Имеет широкое распространение (космополит), обычен в планктоне пресных вод: реках, озерах, водохранилищах, сфагновых болотах (Снитько и др., 2016; Волошко, 2017б).
Lepidochromonas poteriophora (Moestrup & Kristiansen) Kapustin & Guiry (syn. Paraphysomonas poteriophora Moestrup & Kristiansen, Clathromonas poteriophora Scoble & Cavalier-Smith) (рис. 3ф). Впервые обнаружен на территории России в р. Керженец. Характеризуется сетчатыми чешуйками, округлыми в основании, образующими выступ (вырост), расширяющийся на конце (Thomsen et al., 1981). Найден лишь в пяти европейских местообитаниях в Дании (Thomsen et al., 1981), Германии, Великобритании (Finlay, Clarke, 1999) и Чехии (Škaloud et al., 2013b). Проведенная в 2014 г. ревизия рода Paraphysomonas с использованием молекулярно-генетических методов (Scoble, Cavalier-Smith, 2014) показала значимость ряда признаков (форма базальной пластинки, длина и форма шипа, корончатой чешуйки и др.) при идентификации его видов. В результате выделен новый род – Clathromonas Scoble & Cavalier-Smith, представители которого характеризовались чешуйками с сетчатой структурой. Однако, этот род является незаконным (ст. 52.1 Международного кодекса номенклатуры водорослей, грибов и растений), поскольку включает тип рода Lepidochromonas Kristiansen – L. diademifera (E. Takah.) Kristiansen. Авторы работы (Kapustin, Guiry, 2019) восстановили забытый род Lepidochromonas и перенесли в него виды рода Clathromonas.
Synura echinulata Korschikov (рис. 3з–3к). Обнаружена в р. Керженец впервые. Широко распространенный вид. Ранее найдена в бассейне Верхней Волги (Балонов, Кузьмин, 1974), в водоемах севера России (Волошко, 2017б), в малых реках антропогенно преобразованных ландшафтов (Гусев и др., 2017). Характерна для пресных водоемов разного типа с pH от нейтральной до слабокислой.
S. multidentata (Balonov et Kuzmin) Péterfi et Momeu (рис. 3л, 3м). Найдена в р. Керженец впервые. Вид приурочен к водоемам умеренных широт. Встречается в Европе и Северной Америки. На территории России отмечен в Верхней Волге (как разновидность S. echinulata f. mulidentata Balonov et Kuzmin), водоемах Вологодской обл. (Балонов, 1980), на Чукотском п-ове и в бассейне р. Колымы (Кузьмин, 1985).
S. punctulosa Balonov (рис. 3н). Обнаружена в р. Керженец впервые. Встречается редко, в умеренных широтах. Отмечена на территории Европы и Азии. В России зарегистрирована в бассейнах Верхней Волги (Балонов, 1976) и Нижнего Енисея (Бессудова 2016).
S. spinosa Korshikov f. spinosa (рис. 3о). Ранее обнаружена в р. Керженец (Балонов, Кузьмин, 1974). В р. Ветлуга зарегистрирована впервые. Космополит. Отмечена в большинстве работ, посвященных исследованиям чешуйчатых золотистых водорослей (Балонов, 1976; Балонов, 1979; Балонов, Кузьмин, 1986; Siver et al., 2005; Voloshko, 2010; Safronova, Voloshko, 2013; Волошко, 2017б; Гусев и др., 2017).
S. spinosa f. longispina Petersen et Hansen (рис. 3п). Обнаружена в р. Керженец впервые. Широко распространена, но встречается нечасто. В России разновидность указана для бассейна р. Волги (Балонов, Кузьмин, 1974; Балонов, 1976), водоемов севера Европейской России (Волошко, 2017б) и Полярного Урала (Voloshko, 2010). Имеются находки данной формы в малых реках городской зоны (Гусев и др., 2017).
S. uvella Ehrenberg emend. Korschikov (рис. 3р, 3с). В планктоне р. Керженец была отмечена ранее (Балонов, Кузьмин, 1974). Космополит. Найдена в водоемах Волжского бассейна (Балонов, 1976), Севера Европейской России (Voloshko, Gavrilova, 2001; Safronova, Voloshko, 2013), Полярного Урала (Voloshko, 2010), в карстовых озерах Владимирской обл. (Gusev, 2013) и в малой реке г. Нижний Новгород (Гусев и др., 2017).
Особую сложность вызывает идентификация представителей рода Synura из секции Peterseniae, поскольку определение проводят по размерам чешуек и их структурных элементов (табл. 2, рис. 3).
Таблица 2.
Размеры передних чешуек и их структурных элементов у таксонов рода Synura (секция Peterseniae)
| Показатель | S. petersenii | S. conopea | S. glabra |
|---|---|---|---|
| Длина чешуйки, мкм | 3.9–4.8 | 3.2–4.0 | 3.4–3.8 |
| Ширина чешуйки, мкм | 1.6–2.7 | 1.7–1.9 | 2.3–2.5 |
| Диаметр отверстия базальной пластинки в апикальной части, мкм | 0.25–0.38 | 0.25–0.37 | 0.16–0.37 |
| Диаметр пор базальной пластинки, нм | 30–55 | 30–60 | 30–45 |
| Диаметр пор медиального гребня, нм | 35–60 | 90–130 | 41–75 |
| Количество поперечных ребер | 21–31 | 23–27 | 19–23 |
| Отношение длины чешуйки к ширине чешуйки | 1.5–2.2 | 1.8–2.1 | 1.4–1.6 |
| Отношение ширины чешуйки к ширине медиального гребня | 2.8–3.7 | 2.4–2.7 | 3.1–3.9 |
S. conopea Kynčlova et Škaloud (рис. 4а, 4б; табл. 2). Обнаружена в р. Керженец впервые. Ранее вид отмечен в малых городских водотоках г. Нижний Новгород (Гусев и др., 2017). Найден в водоемах Европы и Южной Америки (Škaloud et al., 2012).
Рис. 4.
Чешуйки таксонов рода Synura секции Peterseniae: а, б – S. conopea, в–д – S. glabra, е–к – S. petersenii.

S. glabra Korshikov em. Škaloud et Kynčlova in Škaloud (рис. 4в–4д, табл. 2). Обнаружена в р. Керженец. Ранее отмечена как разновидность S. petersenii var. glabra (Балонов, Кузьмин, 1974). Широко распространенный вид (Балонов, Кузьмин, 1974; Балонов, 1976; Кузьмин, Кузьмина 1987; Voloshko, 2010; Волошко, 2017б; Гусев и др., 2017). Обнаружена в водоемах разного типа.
S. petersenii Korshikov (рис. 4е–4к; табл. 2). Обнаружена во всех исследованных водотоках (в реках Керженец и Ветлуга). Ранее зарегистрирована в планктоне р. Керженец (Балонов, Кузьмин, 1974). Вид широко распространен (Škaloud et al., 2012; Boo et al., 2010). Идентификация на основе структуры чешуек не позволяет сделать однозначный вывод о таксономической принадлежности, поскольку возможна путаница с другими ранее описанными видами комплекса S. petersenii. Молекулярно-генетический анализ на основе штаммов коллекции водорослей Института биологии внутренних вод РАН (Гусев и др., 2016) подтвердил наличие данного вида на территории европейской части России.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на более чем столетнее изучение фитопланктона водоемов и водотоков Нижегородского региона, специализированные исследования золотистых водорослей с применением электронной микроскопии были начаты только с 1970-х гг. (Балонов, 1976) и продолжились далее на примере небольших рек г. Нижний Новгород (Гусев и др., 2017; Gusev et al., 2019). Списки альгофлоры, приводимые в работах А.Г. Охапкина и Е.Л. Воденеевой, содержат сведения о составе золотистых водорослей левобережных волжских притоков (Охапкин, 1997; Воденеева, 2006), однако, эти находки не были подтверждены электронно-микроскопическими исследованиями и требовали уточнения.
Золотистые водоросли являются важным компонентом альгоценозов в общей численности и биомассе фитопланктона изученных водотоков. Как правило, сезонная динамика фитопланктона изученных водотоков характеризуется тремя подъемами биомассы: весной, летом и осенью. Весеннее и осеннее развитие фитопланктона обеспечено диатомовыми и золотистыми водорослями, летнее – зелеными, диатомовыми, нередко при участии золотистых и сине-зеленых водорослей.
Средние многолетние численность и биомасса фитопланктона в р. Керженец за вегетационные периоды 2014–2016 гг. достоверно не различались, колебались от 1.95 ± 0.78 до 4.79 ± 0.29 млн кл./л и от 1.39 ± 0.24 до 2.07 ± 0.68 г/м3 и соответствовали таковым мезотрофных вод. Численность фитопланктона в р. Ветлуга варьировала от 4.34 ± 0.76 до 6.6 ± 1.3 млн кл./л, биомасса – от 0.74 ± 0.11 до 1.51 ± 0.42 г/м3. Развитие золотистых водорослей в изученных реках было неодинаковым в разные периоды гидрологического цикла, максимальные показатели зарегистрированы весной. В р. Ветлуге обилие золотистых водорослей достигало 33% общей численности (0.33 млн кл./л) и 28% общей биомассы фитопланктона (0.11 г/м3). Среди них преобладали представители родов Dinobryon (D. divergens O.E. Imhof, D. sociale (Ehrenberg) Ehrenberg), Chrysococcus (C. biporus Skuja), доля чешуйчатых золотистых водорослей в формировании численности и биомассы альгоценозов незначительна (<5%). Более существенным был вклад чешуйчатых золотистых водорослей в формировании планктона р. Керженец. В 2017 г. в весенних и раннелетних альгоценозах отмечено доминирование видов из родов Mallomonas spp. и Synura spp., численность и биомасса которых достигали 0.15–0.19 млн кл./л и 0.12–0.16 г/м3 соответственно.
Несмотря на низкие показатели развития чешуйчатых золотистых водорослей в исследованных водотоках, состав их оказался относительно богатым (30 видов из 4 родов). Среди них Mallomonas jubata, Mallomonas retifera и Lepidochromonas poteriophora впервые отмечены на территории России. Большинство видов в исследуемых реках обнаружены впервые. Анализ географического распространения показал, что большая часть выявленных таксонов относятся к космополитным и широко распространенным видам. Для ряда видов характерен биполярный ареал (Mallomonas jubata, M. munda, M. retifera), некоторые таксоны отмечены в северных и умеренных широтах (M.allorgei, M. multinuca, M. punctifera, Synura multidentata).
Высокое таксономическое разнообразие данной группы хорошо согласуется с результатами других исследований в регионе (Гусев и др., 2017; Gusev et al., 2019). Вероятно, на это влияет уникальное расположение изученных водотоков в зоне бореально-неморального экотона, бореальная часть которого характеризуется преобладанием лесов, озер и болот. Несмотря на высокое видовое богатство, чешуйчатые золотистые водоросли занимают лидирующее положение лишь в весенних альгоценозах р. Керженец.
Большинство найденных видов отмечены в р. Керженец, характеризующейся олигоацидными водами с повышенным значением цветности вод. В ряде работ (Ilmavirta, 1988; Корнева, 2006; Волошко, 2017a) отмечено, что основным фактором, формирующим состав флоры золотистых водорослей озерных экосистем, cлужит pH воды, а их представленность в альгоценозах определяется совокупностью показателей, – pH, уровень трофии, цветность воды и концентрация общего азота. Существенное влияние на состав флоры золотистых водорослей оказывает наличие рек с заболоченным водосбором. Исследования, проводимые ранее на примере рек г. Нижний Новгород, вытекающих из болот, показали высокое разнообразие в них чешуйчатых золотистых водорослей (Гусев и др., 2017; Gusev et al., 2019).
Выводы. Видовой состав чешуйчатых золотистых водорослей двух левобережных притоков р. Волги богат и включает 30 видовых и внутривидовых таксонов из родов Mallomonas, Synura, Chrysosphaerella и Lepidochromonas из четырех семейств с преобладанием видов рода Mallomonas. Богатство видового состава изученной группы хризофит несомненно связано с формирующимся в водотоках набором и разнообразием факторов среды, поддерживающих их высокое видовое богатство (варьирование значений рН, характерных для олигоацидно-нейтральных вод, высокие показатели цветности и трофии вод, биотопическая неоднородность речных систем). Большинство видов имеет широкое географическое распространение, для трех из них характерен биполярный ареал, три вида (Mallomonas jubata, Mallomonas retifera и Lepidochromonas poteriophora) впервые обнаружены на территории России, один – потенциально новый для науки. Показатели количественного развития изученной группы водорослей в отличии от их видового богатства оказались незначительными, однако максимальные численность и биомасса, наблюдавшиеся в весенних альгоценозах р. Керженец, достигали 48 и 43% общих показателей соответственно.
Список литературы
Балонов И.М., Кузьмина А.Е. 1986. Золотистые водоросли. Гидрохимические и гидробиологические исследования Хантайского водохранилища // Тр. Лимн. инст. СО АН СССР. Новосибирск: Наука. С. 59.
Балонов И.М. 1976. Виды сем. Synuraceae Lemm. (Chrysophyta) Волги и ее бассейна // Биология внутренних вод: Информ. бюл. Ленинград: Наука. № 29. С. 16.
Балонов И.М. 1979. Золотистые водоросли сем. Synuraceae Lemm. водоемов Карелии // Тр. Инст. биол. внутр. вод АН СССР. Вып. 42(45). С. 3.
Балонов И.М. 1980. Золотистые водоросли водоемов Вологодской области // Биология внутренних вод: Информ. бюл. Ленинград: Наука. № 45. С. 31.
Балонов И.М., Кузьмин Г.В. 1975. Электронно-микроскопическое изучение видов рода Mallomonas Petry (Chrysophyta) из водохранилищ Волжского каскада. I. Series Planae Harris et Bradley // Бот. журн. Т. 60. № 9. С. 1142.
Бессудова А.Ю. 2016. Чешуйчатые золотистые водоросли бассейна Нижнего Енисея и заливов Карского моря с элементами аутэкологии. Иркутск: Изд-во Института географии им. В. Б. Сочавы СО РАН.
Воденеева Е.Л. 2006. Состав и структура фитопланктона гумозно-ацидных водоемов (на примере водных объектов заповедника “Керженский”): Дис. … канд. биол. наук. Нижний Новгород.
Волошко Л.Н. 2017a. Золотистые водоросли Севера России: экологические условия обитания // Астраханский вестник экологического образования. № 4(42). С. 45.
Волошко Л.Н. 2017б. Золотистые водоросли водоемов Севера России. Санкт-Петербург: Реноме.
Гусев Е.С. 2016. К флоре чешуйчатых золотистых водорослей озера Фролиха (северное Забайкалье) // Тр. Инст. биол. внутр. вод РАН. № 76(79). С. 25.
Гусев Е.С., Капустин Д.А., Мартыненко Н.А. 2016. Морфологическое и молекулярно-генетическое изучение видов рода Synura Ehrenb. (Chrysophyceae) из коллекции ИБВВ РАН. Молекулярная генетика гидробионтов // Тр. Инст. биол. внутр. вод РАН. № 73(76). С. 5.
Гусев Е.С., Перминова О.С., Старцева Н.А., Охапкин А.Г. 2017. Род Synura (Synurales, Synurophyceae) в малых городских реках Нижнего Новгорода // Новости сист. низш. раст. № 51. С. 57. https://doi.org/10.31111/nsnr/2017.51.57
Гусев Е.С., Гусаков В.А., Гусева Е.Е. и др. 2020. Флора золотистых водорослей (Chrysophyceae: Synurales, Paraphysomonadales) дельты р. Меконг // Биол. внутр. вод. № 4. С. 325.https://doi.org/10.31857/S0320965220030080
Есырева В.И. 1935. Фитопланктон Волги по наблюдениям 1931 года против г. Горького // Учен. зап. Горьковск. ун-та. № 4. Горький: Изд-во Горьковск. ун-та. С. 83.
Есырева В.И. 1945. Флора водорослей р. Волги от Рыбинска до г. Горького // Тр. Бот. сада Московск. гос. ун-та. Кн. 5. Вып. 82. С. 10.
Есырева В.И., Юлова Г.А. 1968. Некоторые данные о водорослях р. Ветлуги по наблюдениям 1966 года // Ученые записки. Вып. 90. Горький: Изд-во Горьковск. ун-та. С. 118.
Корнева Л.Г. 2006. Таксономический состав и экология золотистых водорослей (Chrysophyta) в слабоминерализованных лесных озерах Вологодской области // Биология внутренних вод. № 2. С. 3.
Корнева Л.Г. 2015. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской печатный дом.
Коршиков А.А. 1939. Материалы к познанию водорослей Горьковской области. Фитопланктон р. Оки в августе 1932 года // Учен. зап. Горьков. ун-та. Вып. 9. Горький: Изд-во Горьковск. ун-та. С. 101.
Кузьмин Г.В. 1985. Видовой состав фитопланктона водоемов зоны затопления Колымской ГЭС. Магадан: Ин-т биол. проблем Севера ДВНЦ АН СССР.
Кузьмин Г.В., Кузьмина В.А. 1987. Панцирные представители золотистых водорослей из Магаданской обл. // Новости сист. низш. раст. Т. 23. С. 40.
Охапкин А.Г. 1997. Структура и сукцессия фитопланктона при зарегулировании речного стока (на примере р. Волги и ее притоков): Дис. … докт. биол. наук. Санкт-Петербург. 280 с.
Павлинова Р.М. 1930. Биологическое обследование р. Волги в районе от г. Городца до Собчинского затона в 1926–1927 гг. // Труды Ин-та сооружений Центр. комитета водоохранения. № 11. С. 3.
Панфилов В.Д. 1974. Воды // Природа Горьковской области. Горький: Волго-Вятское кн. изд-во. С. 146.
Сафронова Т.В. 2014. Сезонные изменения состава золотистых водорослей (Chrysophyceae, Synurophyceae) в прудах Ботанического сада БИН РАН (Санкт-Петербург) // Бот. журн. Т. 99. № 4. С. 443.
Снитько Л.В., Снитько В.П., Блинов И.А., Волошко Л.Н. 2016. Золотистые водоросли (Chrysophyceae, Synurophyceae) в водоемах Восточных предгорий Южного и Среднего Урала // Бот. журн. Т. 101. № 12. С. 1361.
Boo S.M., Kim H.S., Shin W. et al. 2010. Complex phylogeographic patterns in the freshwater alga Synura provide new insights into ubiquity vs endemism in microbial Eukaryotes // Mol. Ecol. V. 19. № 19. P. 4328. https://doi.org/10.1111/j.1365-294X.2010.04813.x
Dürrschmidt M. 1982. Studies on the Chrysophyceae from South Chilean inland waters by means of scanning and transmission electron microscopy II // Algol. Studies. V. 31. (Arch. Hidrobiol. Suppl. 63). P. 121.
Finlay B.J., Clarke K.J. 1999. Apparent global ubiquity of species in the protist genus Paraphysomonas // Protist. 150. P. 419.
Gusev E.S. 2013. Silica-scaled chrysophytes from karst lakes in Central Russia // Nova Hedwigia. Beih. V. 142. P. 17.
Gusev E.S., Perminova O.S., Guseva E.E., Startseva N.A. 2019. The genus Mallomonas in small urban rivers in Nizhniy Novgorod (Russia) // Nova Hedwigia. Beiheft. V. 148. P. 77. https://doi.org/10.1127/nova-suppl/2019/091
Harris K., Bradley D.E. 1960. A taxonomic study of Mallomonas // J. Gen. Microbiol. V. 22. P. 750.
Ilmavirta V. 1988. Phytoflagellates and their ecology in Finnish broun-water lakes. Flagellates in freshwater ecosystems // Microbiol. Sci. Dev. Hydrobiol. V. 45. P. 255.
Kapustin D.A., Guiry M.D. 2019. Reinstatement of Lepidochromonas Kristiansen (Lepidochromonadaceae fam. nov., Chrysophyceae) // Phytotaxa. V. 413(1). P. 049. https://doi.org/10.11646/phytotaxa.413.1.5
Kristiansen J. 1995. History of chrysophyte research // Chrysophyte algae. Distribution, phylogeny and development. New York: Cambridge University Press. P. 1.
Kristiansen J. 2005. Golden algae. A biology of chrysophytes. Koenigstein: Koenigstein: A.R.G. Gantner.
Kristiansen J., Preisig H.R. 2007. Freshwater Flora of Central Europe // Chrysophyte and haptophyte algae. Part 2: Synurophyceae. Süsswasserflora von Mitteleuropa. Berlin: Springer. V. 1/2. 252 p.
Němcová Y., Kreidlová J., Kosová A., Neustupa J. 2012. Lakes and pools of Aquitaine region (France) – a biodiversity hotspot of Synurales in Europe // Nova Hedwigia. Beiheft. V. 95(1–2). P. 1.
Němcová Y., Kreidlová J., Pusztai M., Neustupa J. 2013. Mallomonas pumilio group (Chrysophyceae/Stramenopiles) – a revision based on the scale/scale-case morphology and analysis of scale shape // Nova Hedwigia. Beiheft. V. 142. P. 27.
Pichrtova M., Rezacova-Skaloudova M., Skaloud P. 2007. Silica-scaled chrysophytes of the Czech-Moravian Highlands // Fottea. V. 7(1). P. 43.
Safronova T.V., Voloshko L.N. 2013. Silica-scaled chrysophytes in the waterbodies of protected areas of the North-West of Russia // Nova Hedwigia. Beiheft. V. 142. P. 97.
Scoble J.M., Cavalier-Smith T. 2014. Scale evolution in Paraphysomonadida (Chrysophyceae): Sequence phylogeny and revised taxonomy of Paraphysomonas, new genus Clathromonas, and 25 new species // Protistologica. 50. P. 551. https://doi.org/10.1016/j.ejop.2014.08.001
Siver P.A., Voloshko L. N., Gavrilova O.V., Getsen M. V. 2005. The scaled chrysophyte flora of the Bolshezemelskaya tundra (Russia) // Nova Hedwigia. Beiheft. V. 128. P. 125.
Škaloud P., Kynčlová A., Benada O. et al. 2012. Toward a revision of the genus Synura, section Petersenianae (Synurophyceae, Heterokontophyta): morphological characterization of six pseudo-cryptic species // Phycologia. V. 51. P. 303.
Škaloud P., Kristiansen J., Škaloudova M. 2013a. Developments in the taxonomy of silica-scaled – from morphological and ultrastructural to molecular approaches // Nord. J. Bot. V. 31. P. 385.
Škaloud P., Škaloudová M., Pichrtová M. et al. 2013b. www.chrysophytes.eu – a database on distribution and ecology of silica-scaled chrysophytes in Europe // Nova Hedwigia. Beih. 142. P. 141.
Thomsen H.A., Zimmermann B., Moestrup Ø., Kristiansen J. 1981. Some new freshwater species of Paraphysomonas (Chrysophyceae) // Nord. J. Bot. V. 1. P. 559. https://doi.org/10.1111/j.1756-1051.1981.tb00724.x
Voloshko L.N., Gavrilova O.V. 2001. A checklist of silica-scaled chrysophytes in Russia with an emphasis on the fl ora of Lake Ladoga // Nova Hedwigia. Beiheft. V. 122. P. 147.
Voloshko L. N. 2010. The chrysophycean algae from glacial lakes of Polar Ural (Russia) // Nova Hedwigia. Beiheft. V. 136. P. 191.
Watson S.B., Satchwill T., Dixon E., McCauley E. 2001. Under-ice blooms and source-water odour in a nutrient-poor reservoir: biological, ecological and applied perspectives // Freshwater Biol. V. 46. P. 1553.
Watson S.B., Satchwill T. 2003. Chrysophyte odour production: the impact of resources at the call and population levels // Phycologia. V. 42. P. 393.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод